Method Article
نموذج فأر للضعف الإدراكي الوعائي والخرف على أساس تضيق الشريان السباتي المشترك الثنائي غير المتماثل الموجه بالإبرة
In This Article
Summary
يقترح استخدام طريقة الإبرة لتضيق الشريان السباتي المشترك الثنائي غير المتماثل لإنشاء نموذج فأر لضعف إدراك الأوعية الدموية والخرف. ينتج عنه نتائج طويلة المدى مقارنة بالنماذج التي تم إنشاؤها سابقا ومتوافق مع التصوير بالرنين المغناطيسي الحي. يوفر التمثيل المرئي الذي يوضح الإجراء إرشادات لإتقان الجراحة.
Abstract
ينتج ضعف الإدراك الوعائي والخرف (VCID) عن إصابات الدماغ الوعائية. نظرا لارتفاع معدل الإصابة بمرض VCID ، والذي من المتوقع أن يستمر في الارتفاع مع تقدم السكان في العمر ، فمن الأهمية بمكان إنشاء نموذج حيواني قوي للمرض. تقدم هذه الورقة طريقة جديدة لإنشاء نموذج فأر من VCID يعتمد على تضيق الشريان السباتي المشترك الثنائي غير المتماثل ، والذي يحاكي نقص التروية الدماغية المزمنة البشرية الناجمة عن تصلب الشرايين السباتية.
باختصار ، يتم ربط الشرايين السباتية الشائعة (CCAs) بإبر قياس مختلفة (32 جم ل CCA الأيمن و 34 جم ل CCA الأيسر) باستخدام 7-0 خيوط حريرية متبوعة بإزالة الإبرة الفورية. تسبب حلقات الخياطة المتبقية انخفاضا مستمرا في تدفق الدم وضعف إدراكي طويل الأمد مرتبط بإصابة المادة البيضاء ، والاحتشاء الدقيق ، والداء الدبقي التفاعلي ، وبالتالي تحاكي عن كثب التسبب في VCID. الأهم من ذلك ، في نموذج الإبرة هذا ، لا تعود التمثيلات السريرية بمرور الوقت ، مما يوفر ضعفا إدراكيا موثوقا به على المدى الطويل. علاوة على ذلك ، كان معدل البقاء على قيد الحياة بعد 24 أسبوعا من الجراحة 81.6٪ ، وهو أعلى مقارنة بالنماذج الأخرى الراسخة من VCID بمستوى مماثل من انخفاض تدفق الدم.
تشمل المزايا الإضافية تكلفة المواد المنخفضة والتوافق مع التصوير بالرنين المغناطيسي لمراقبة إصابة الدماغ في الحية حيث لا يتم زرع أي معدن. التحدي الرئيسي في استخدام نموذج الإبرة ل VCID هو متطلبات تطوير مهارات جراحية متقدمة نظرا لأن CCAs للفأر يقل قطرها عن 0.6 مم وهي هشة للغاية. وبالتالي ، فإن التمثيل البصري عالي الجودة للجراحة سيساعد الباحثين على إتقان هذه التقنية وتعزيز فهمنا ل VCID ، مما قد يؤدي إلى تطوير طرق علاجية جديدة لتقليل التدهور المعرفي المدمر المرتبط ب VCID.
Introduction
يعد الضعف الإدراكي الوعائي والخرف (VCID) السبب الرئيسي الثاني للتدهور المعرفي. على الرغم من التقدم الذي لا يمكن إنكاره الذي تم إحرازه نحو فهم التسبب في VCID وعوامل الخطر الخاصة به ، إلا أن آلية كيفية مساهمة الخلل الوظيفي العصبي الوعائي في تدهور القدرة المعرفية لا تزال غامضة. تم إنشاء عدد من نماذج القوارض ذات التعقيد المختلف للحث على نقص التروية الدماغية لتقليد التمثيلات السريرية ل VCIDالبشري 1. تعتمد بعض هذه النماذج على إنشاء نقص تروية دماغية عابرة. ومع ذلك ، يتم إنشاء معظمها عن طريق إحداث نقص التروية الدماغية المزمنة ، وهي الآلية الرئيسية التي تؤدي إلى VCID في المرضى من البشر2.
يمكن إدخال نقص التروية الدماغية المزمنة إما باستخدام انسداد الشريان السباتي الثنائي (BCAO) ، والذي يسبب نتائج شديدة ، ولكنها مميتة في كثير من الأحيان ، أو تضيق الشريان السباتي الثنائي (BCAS). عادة ما يتم إجراء BCAS باستخدام إحدى طريقتين: عن طريق وضع ملفات دقيقة متطابقة حول كل من CCAs ، مما يؤدي إلى تضيق متماثل3. أو عن طريق زرع مضيق أميرويد وملف دقيق حول CCAs الأيمن والأيسر ، على التوالي ، مما يتسبب في انسداد تدريجي و ~ 50٪ انخفاض تدفق الدم على CCAs الأيمن والأيسر ، في المقابل4. تتمثل عيوب كلتا الطريقتين في ارتفاع معدل الوفيات إذا كان التضيق شديدا جدا أو إذا كان CCA مسدودا وعدم التوافق مع فحص التصوير بالرنين المغناطيسي للحيوانات الحية بسبب وجود معدن في الجسم. كما تم إنشاء عدد قليل من نماذج الفئران الجينية1،5،6،7،8. تشمل الخيارات الإضافية اعتلال الشرايين الوراثي الدماغي السائد مع الاحتشاء تحت القشري ونماذج فأر اعتلال بيضاء الدماغ9،10. ومع ذلك ، لا يحاكي أي من النماذج المقترحة النطاق الكامل للضرر الإقفاري الذي يتم تقديمه في المرضى من البشر ، وبالتالي يستمر البحث عن نماذج VCID المحدثة.
تقدم هذه الورقة طريقة جراحية جديدة لإحداث تضيق الشريان السباتي المشترك الثنائي غير المتماثل (ABCS) في الفئران ، حيث يتم إجراء تضيق CCA باستخدام خيوط الحرير ويتم التحكم فيه عن طريق ربط CCAs بإبر بأقطار مختلفة متبوعة بإزالة الإبرةالفورية 11. نتيجة لذلك ، يتم ترك حلقات خياطة بأقطار دقيقة بشكل دائم على CCAs لضمان التضيق المزمن. تتمثل فائدة استخدام ABCS على طريقة متماثلة في أن نقص التروية المعتدل على اليمين يضمن بقاء أفضل بينما يضمن نقص التروية الأكثر وضوحا على اليسار تمثيلات عصبية ومرضية طويلة الأمد. يتميز نموذج الإبرة هذا بالعديد من المزايا مقارنة بنماذج BCAS التقليدية11 مثل النتائج المستمرة ، وانخفاض معدل الوفيات ، والتكلفة المنخفضة للغاية ، والمرونة ، وإمكانية استخدام مناهج تحليلية خاصة.
لتوضيح هذه المزايا ، تسبب ثلاثة روابط جزءا من تضيق CCA بدلا من تضيق النقطة المحورية ، مما يؤدي إلى نقص التروية المستمر ، وإصابة المادة البيضاء ، والتدهور المعرفي في ~ 90٪ من الفئران. كان معدل وفيات الفئران الإبرية ~ 17٪ ، أقل من معدل وفيات المقيد الأمروئيدي / النموذج4 ، والذي يحتوي على ~ 30٪ وفيات على مدى 16 أسبوعا بناء على تجربتنا. عادة ما يكلف كل نموذج BCAS حوالي 100 دولار بسبب الملفات الدقيقة باهظة الثمن أو قيود الأميرويد ، بينما يكلف نموذج الإبرة حوالي 1 دولار فقط لكل ماوس. علاوة على ذلك ، يمكن تعديل مقياس الإبر اعتمادا على المتطلبات الخاصة بالبحث لتقييد تدفق الدم على كلا الجانبين. في التباين المقدم في الورقة الحالية ، يحاكي نموذج الإبرة الفيزيولوجيا المرضية لتضيق الشريان السباتي الشديد ، الناجم عن التضيق الدائم من جانب واحد دون انسداد ، وهو التمثيل الأكثر شيوعا للمرض في العيادة11. علاوة على ذلك ، فإن قيود الأميرويد والملفات الدقيقة المستخدمة في نماذج BCAS التقليدية مصنوعة من المعدن ، والتي يمكن أن تسبب قطع أثرية مهمة إذا تم إجراء التصوير بالرنين المغناطيسي في الجسم الحي ، على الرغم من أن المعدن لا يتم زرعه في الدماغ ولكن في الصدر. قد يكون من الصعب التنبؤ بالضبط بكيفية تأثير وجود المعدن على التصوير.
بشكل عام ، عادة ما يكون التصوير بالرنين المغناطيسي في الجسم الحي الذي يتم إجراؤه بعد زرع الملف الدقيق هو تصوير تشريحي بسيط ، وغير مناسب للتحليل الكمي للإهانات المتعددة ، وهو أمر مرغوب فيه للغاية لأبحاث VCID. في المقابل ، يستخدم نموذج الإبرة المقدم هنا خيوط الحرير فقط وهو متوافق تماما مع أي نوع من التصوير بالرنين المغناطيسي في الجسم الحي. هذا مهم لسببين: (1) التصوير بالرنين المغناطيسي حساس للغاية لآفات الدماغ الصغيرة ، أو النزيف الدقيق ، أو التنوين الجانبي السطحي12 ، وبالتالي فهو مفضل على طرق التحليل الأخرى ، مثل التصوير المقطعي المحوسب (2) في الجسم الحي يجب تفضيل التصوير بالرنين المغناطيسي على التصوير بالرنين المغناطيسي خارج الجسم الحي ، حيث يمكن أن تستفيد أبحاث VCID بلا شك من تتبع ديناميكيات تطور / التئام الآفة ، خاصة استجابة للعلاجات الجديدة المقترحة. بالإضافة إلى ذلك ، يمكن إجراء الوظيفة (fMRI) في نموذج الإبرة لتوفير رؤى مهمة حول سلامة اقتران الأوعية الدموية العصبية استجابة لنقص التروية الدماغية. وبالتالي ، فإن إمكانية استخدام التصوير بالرنين المغناطيسي في الجسم الحي تفتح طريقا لتحليل متعمق للعلاقة المعقدة بين حجم وموقع الآفات والوظيفة المعرفية ، بالإضافة إلى اقتران الأوعية الدموية العصبية ، خاصة في دراسات الديناميكا الدوائية.
Protocol
تمت الموافقة على جميع البروتوكولات الحيوانية من قبل اللجنة المؤسسية لرعاية واستخدامها في جامعة بيتسبرغ وتم تنفيذها وفقا لدليل المعاهد الوطنية للصحة لرعاية واستخدام المختبر. يجب الحفاظ على التقنيات المعقمة في جميع جراحات البقاء على قيد الحياة. تم استخدام ذكور الفئران C57BL / 6J البالغة من العمر اثني عشر أسبوعا بوزن الجسم 25-30 جم في التجارب المعروضة.
1. تحضير المواد ومساحة العمل
- تحضير شظايا الإبرة (~ 4 مم ، 32 جم ل CCA الأيمن و 34 جم ل CCA الأيسر). قم بتخفيف الطرف الحاد للإبر قليلا عن طريق النقر بعناية على الطرف الحاد على سطح صلب وفصل الإبر بعناية عن القطع البلاستيكية باستخدام حامل إبرة. قطع 7-0 خيوط حريرية إلى قطع بطول 1-2 سم.
- تعقيم الأدوات الجراحية وشظايا الإبرة والخيوط بالتعقيم أو أي طريقة أخرى مناسبة.
2. إجراء الجراحة
- قم بوزن الفأر وتحفيز التخدير عن طريق وضع الفأر لمدة 2-3 دقائق في غرفة جيدة التهوية مع 3٪ إيزوفلوران في خليط من 25٪ O2 و 72٪ N2O.
- ضع الفأر (الجانب البطني لأعلى) على وسادة تدفئة مغطاة بورقة جراحية معقمة للحفاظ على درجة حرارة ثابتة للجسم (37 درجة مئوية) وتأمين قناع للوجه للتهوية بنسبة 1٪ إيزوفلوران في خليط من 25٪ O2 و 74٪ N2O. قم بتأمين أطراف الفأر بشريط لاصق.
- احلق الفراء على الرقبة باستخدام ماكينة حلاقة كهربائية. نظف الشعر الناعم بشريط لاصق أو مكنسة كهربائية للوحة المفاتيح.
- تطهير موقع الجراحة بمحلول البيتادين (10٪ يود). قم بإزالة اليود من الجلد بنسبة 70٪ من الإيثانول. كرر العدوى 3 مرات. تأكد من أن مستوى التخدير مناسب من خلال عدم الاستجابة لقرصة إصبع القدم القوية (منعكس الدواسة).
- ثنى منطقة الجراحة. بعد ذلك ، قم بعمل شق عمودي في خط الوسط على طول القصبة الهوائية وافصل الغدد الدرقية الثنائية باستخدام ملقط صغير. اسحب الجلد والأنسجة بعيدا باستخدام ضاغطات الجلد الصغيرة المعقمة.
- تحت المجهر ، استخدم ملاقط بزاوية لكشف وتشريح أحد CCAs بعناية من العصب المبهم والغمد. استخدم الماء المعقم أو المحلول الملحي المخزن بالفوسفات (PBS) لترطيب موقع الشق إذا كان CCA يميل إلى الالتصاق بالملقط. ضع حقنة بلاستيكية صغيرة تحت الرقبة لدعم الموقف إذا لزم الأمر.
ملاحظة: توخي الحذر الشديد حتى لا تمزق CCA. - قم بربط ثلاث شظايا من خياطة الحرير المقطوعة مسبقا (مقاس 7-0) تحت CCA (على بعد 1 مم) باستخدام ملاقط بزاوية.
- قم بصياغة عقدة مزدوجة فضفاضة جدا حول CCA على أحد شظايا الخياطة.
ملاحظة: قد يساعد ترطيب موقع الجراحة والخيوط بالماء المعقم أو PBS في صياغة عقدة. - ضع جزءا من الإبرة (32 جم ل CCA الأيمن و 34 جم ل CCA الأيسر) بالتوازي مع CCA ، داخل العقدة السائبة (الشكل 1 أ). شد العقدة الأساسية بعناية حول كل من الإبرة و CCA حتى لا يتم ملاحظة تدفق الدم وتثبيتها بعقدة ثانوية. اسحب الإبرة على الفور لاستعادة تدفق الدم الجزئي وتقليم أطراف الخياطة.
ملاحظة: يجب أن يكون الجراح حذرا جدا في تقليم نهايات الخيط بعد اكتمال العقد. قد يؤدي القطع بالقرب من العقدة إلى فك العقدة. بالإضافة إلى ذلك ، من الأهمية بمكان مراقبة CCA بعد إزالة الإبرة للتأكد من أن تدفق الدم لا يزال ممكنا في اتجاه مجرى العقدة. إذا بدا CCA شاحبا جدا بعد إزالة الإبرة ، فهذا يعني أن CCA مضغوط. - كرر الخطوات 2.8-2.9 لخيوط الخياطة 2و 3 على نفس CCA ، على بعد حوالي 1 مم عن بعضها البعض (الشكل 1 ب).
- كرر الخطوات 2.6-2.10 مع CCA المعاكس باستخدام جزء إبرة 32 G.
- افحص بعناية ما إذا كان كلا التقييمين القطريين المجمعين مربوطين بكفاءة: تأكد من أن جميع أشرطة الخياطة الثلاثة معقودة بإحكام في مكانها ولكنها ليست ضيقة جدا بحيث تمنع تدفق الدم تماما (تأكد من أن الجمعيات القطرية الشاملة ليست شاحبة في اتجاه مجرى العقد). تأكد من أن أشرطة الخياطة الثلاثة على كل CCA تبعد حوالي 1 مم عن بعضها البعض.
- أغلق الجلد باستخدام خيوط أحادية الشعيرات المعقمة.
- بعد الجراحة مباشرة ، قم بحقن 100-150 ميكرولتر من الكيتوبروفين (1 مجم / مل من المخزون ؛ 5 مجم / كجم من وزن الجسم) داخل الصفاق لتخفيف آلام ما بعد الجراحة. كرر هذا الحقن بعد 24 ساعة و 48 ساعة من الجراحة.
- ضع الفأر على بطانية حرارة منزلية عند 37 درجة مئوية للمراقبة المستمرة لمدة ساعتين قبل إعادة إلى منشأة.
ملاحظة: بالنسبة للإجراء الوهمي ، يجب حذف الخطوات 2.7-2.12.
3. التحقق من صحة النموذج
ملاحظة: تم تحليل إصابة الدماغ باستخدام التصوير بالرنين المغناطيسي في الجسم الحي وتم التحقق منها بشكل أكبر من خلال تلطيخ Luxol Fast Blue (LFB) والاختبارات السلوكية.
- تصوير نضح الدم الدماغي.
- تخدير الفأر باستخدام 1-1.5٪ إيزوفلوران. تعقيم موقع الجراحة بمحلول البيتادين (10٪ يود). ثم قم بإزالة اليود من الجلد بنسبة 70٪ من الإيثانول.
- قم بتأمين جمجمة في إطار تجسيمي. قم بعمل شق لمعي في خط الوسط في فروة الرأس من العظم الأمامي إلى القذالي لكشف الجمجمة وتنظيف سطح الجمجمة بمحلول ملحي معقم.
- ضع كاميرا جهاز مشحونة مقترنة بمقدار 10 سم فوق الجمجمة باستخدام نظام بقع ليزر ثنائي الأبعاد. ضع حامل مسبار فوق موقع استئصال التدوين وقم بتثبيته بإحكام.
- التقط صور نضح الدم قبل 5 دقائق من الجراحة وبعد إطلاق الإبرة مباشرة أو بعد 7 و 14 و 21 و 28 و 35 و 42 يوما بعد الجراحة.
- أغلق الجلد باستخدام خيوط أحادية الشعيرات المعقمة. حقن 100-150 ميكرولتر من الكيتوبروفين (1 مجم / مل مخزون ؛ 5 مجم / كجم من وزن الجسم) داخل الصفاق لتخفيف آلام ما بعد الجراحة. كرر هذا الحقن 24 ساعة و 48 ساعة.
- في الجسم الحي الرنين المغناطيسي
- قم بتخدير الفئران باستخدام 1-1.5٪ من الأيزوفلوران ، مع مراقبة التنفس باستمرار والحفاظ على درجة الحرارة عند 37 درجة مئوية بالهواء الدافئ أثناء الحصول على الصورة.
- قم بإجراء التصوير بالرنين المغناطيسي في الجسم الحي باستخدام ماسح ضوئي 9.4T وملف Tx مقاس 86 مم ومصفوفة استقبال دماغ الماوس ذات 4 قنوات ، وتشغيل البرنامج المرتبط. بعد تحديد المواقع والمسح التجريبي ، احصل على صور مرجحة T2 (T2WI) باستخدام تسلسل الاستحواذ السريع مع تحسين الاسترخاء (RARE) ، مع المعلمات التالية: وقت الصدى / وقت التكرار (TE / TR) = 40 / 4,000 مللي ثانية ، المتوسطات = 8,256 × 256 مصفوفة ، 16 شريحة بسمك شريحة 0.5 مم ، عامل نادر = 4 ، ومجال رؤية (FOV) 20 × 20 مم.
- اجمع بيانات تصوير موتر الانتشار (DTI) باستخدام تسلسل تصوير مستوي الصدى (EPI) -DTI باستخدام نفس الهندسة والمعلمات مثل T2WI مع الاستثناءات التالية: TR / TE = 2,300/22 مللي ثانية ، مصفوفة الاستحواذ = 128 × 128 ، مقطعان ، 5 صور A0 ، و 30 صورة انتشار غير خطية ، Δ / δ = 10/3 مللي ثانية ، وقيمة b = 1,000 ثانية / مم2.
- قم بتحليل بيانات DTI باستخدام برنامج DSI Studio (http://dsistudio.labsolver.org/) ، بحثا عن الاختلافات في المعلمات العددية للانتشار (تباين الخواص الجزئية (FA) ، متوسط الانتشار (MD) ، الانتشار المحوري (AD) والانتشار الشعاعي (RD)). ارسم مناطق الاهتمام (ROIs) للجسم الثفني (CC) ، والكبسولة الخارجية (EC) ، والكبسولة الداخلية (IC) ، وفيمبريا ، والمجمع الأمامي (AC) ، والحزامية (Cing) ، والحصين (فرس النهر) ، والقشرة (C) ، والمخطط (Str) من نصفي الكرة الأرضية.
- تلطيخ Luxol Fast Blue (LFB)
- تحضير أقسام الدماغ: قم بإصلاح الدماغ بنسبة 4٪ PFA لمدة 24 ساعة ثم اغمر الدماغ في 30٪ سكروز حتى يغرق الدماغ. قم بتضمين الدماغ في مركب OCT على الثلج الجاف. قطع شريحة دماغ إكليلية بسمك 20 ميكرومتر على ميكروتوم منزلق. قم بتخزين شرائح الدماغ في محلول تخزين (30٪ جلسرين / 30٪ إيثيلين جلايكول في PBS).
- اغمر أقسام الدماغ في LFB (محلول كحول 0.1٪) ، واحتفظ بها عند 56 درجة مئوية طوال الليل ، واغسلها بالماء المقطر.
- احتضان أقسام الدماغ في 0.05٪ كربونات الليثيوم وتجفيفها من خلال الكحوليات المتدرجة.
- تلطخ الأقسام ب 0.5٪ كريسيل بنفسجي لمدة 5 دقائق ، مع تمييز 70٪ من الإيثانول.
- قم بتركيب أقسام الدماغ الملطخة بوسط تصاعد.
- تقييم الوظيفة المعرفية باستخدام اختبار متاهة موريس المائية المعدل
- املأ خزانا دائريا بالماء (25 درجةمئوية ، عمق 33 سم) واغمر مربعا ~ 10 × 10 سم2 منصة زجاج شبكي 1.2 سم تحت مستوى الماء ، 31 سم من الحافة الشمالية أو الشرقية أو الجنوبية أو الغربية للبركة.
ملاحظة: يجب أن تظل هذه المنصة في نفس المكان طوال مدة الاختبار. - قم بتشغيل كاميرا فيديو مثبتة في السقف. ضع فأرا في الخزان (لا تسقط عند مستوى الماء) ، في مواجهة الحائط وابدأ إما من الشمال الشرقي أو الجنوب الشرقي أو الجنوب الغربي أو الشمال الغربي. اسمح للماوس بالسباحة لمدة أقصاها 90 ثانية للعثور على منصة مغمورة.
- اسمح للماوس بالبقاء على النظام الأساسي المغمور لمدة 30 ثانية إذا تم العثور على النظام الأساسي. إذا لم يتم العثور على النظام الأساسي ، فضع الماوس هناك لمدة 30 ثانية.
- دع الماوس يرتاح لمدة 5 دقائق وكرر تجربة السباحة (الخطوات 3.4.2 - 3.4.3) 2x.
- جفف الماوس بقطعة قماش وأعده إلى قفصه تحت لمبة تدفئة.
- كرر ثلاث تجارب سباحة كل يوم لمدة 5 أيام متتالية.
- باستخدام لقطات الفيديو ، احسب زمن الوصول للهروب (كم من الوقت يستغرق العثور على النظام الأساسي في كل تجربة).
- في اليوم الأخير من الاختبار ، قم بإزالة النظام الأساسي وسجل الوقت الذي يقضيه الماوس في الربع ، حيث كان النظام الأساسي موجودا مسبقا.
- املأ خزانا دائريا بالماء (25 درجةمئوية ، عمق 33 سم) واغمر مربعا ~ 10 × 10 سم2 منصة زجاج شبكي 1.2 سم تحت مستوى الماء ، 31 سم من الحافة الشمالية أو الشرقية أو الجنوبية أو الغربية للبركة.
النتائج
نقص التروية الدماغية غير المتماثلة على المدى الطويل
تم قياس تدفق الدم CCA قبل وبعد تحرير الإبرة مباشرة من الربط الأخير (الثالث) ، كما هو موضحسابقا 11. انخفض تدفق الدم بنسبة ~ 70٪ في CCA الأيسر و ~ 50٪ في CCA الأيمن. تمت مراقبة نضح الدم الدماغي ديناميكيا باستخدام بقع ليزر ثنائية الأبعاد. تسببت الجراحة في نقص التروية الدماغية في نصفي الكرة الأرضية ، مع تأثر نصف الكرة الأيسر بشدة (الشكل 2). يتم الحفاظ على نقص التروية الدماغية لمدة 24 أسبوعا على الأقل بعد الجراحة11.
انخفاض معدل الوفيات
كان معدل البقاء على قيد الحياة للفئران الذكور على مدى 6 أسابيع 81.6٪ (الشكل 3) ؛ كانت الفئران أكثر عرضة للوفاة في الأسبوع الأول بعد الجراحة.
الكشف عن التصوير بالرنين المغناطيسي في الجسم الحي لإصابات الدماغ
كشفت الصور المرجحة T2 عن مناطق منخفضة أو مفرطة الكثافة في الحصين (فرس النهر) ، والكبسولة الخارجية (EC) ، والكبسولة الداخلية (IC) ، والجسم الثفني (CC) ، والمخطط (Str) في الفئران التي خضعت لجراحة ABCS ، مما يشير إلى إصابة الدماغ (الشكل 4 أ). لوحظ تلف هيكلي في خرائط الألوان المشفرة اتجاهيا (DEC) ل DTI لفئران ABCS عند مقارنتها بالوهم (الشكل 4 ب).
أظهرت التحليلات الكمية أن الفئران ABCS أظهرت تباين الخواص الجزئي (FA) أقل بكثير في فرس النهر الأيسر ، IC ، الميل الأمامي (AC) ، الحزامية (Cg) و Fimbria (Fi) عند مقارنتها بالوهم (P < 0.05 مقابل الوهم) ، مما يشير إلى اختراق البنية المجهرية للمادة البيضاء في نصف الكرة الأيسر (أعلى اللوحة اليسرى ، الشكل 4C). كما تم تقليل FA في Cg و Fi الأيمن في الفئران ABCS (P < 0.05 مقابل الوهم). كان FA في IC و Fi الأيسر أقل بكثير من الأيمن في فئران ABCS (P < 0.05 ، اليسار مقابل اليمين).
وبالمثل ، تم عرض الانتشار المحوري (AD) أقل بكثير في EC الأيسر و IC و Str و Fi في الفئران ABCS مقارنة بالزائف ، مما يشير إلى إصابة محورية (اللوحة اليمنى العلوية ، الشكل 4C (ص < 0.05 مقابل الوهم)). أظهر Str الأيسر فقط انخفاض متوسط الانتشار (MD) في الفئران ABCS مقارنة بالوسام (اللوحة اليسرى السفلية ، الشكل 4C). لوحظ اختلاف الانتشار الشعاعي (RD) في CC الأيسر و Str و Fi في فئران ABCS (أسفل اللوحة اليمنى ، الشكل 4C) ، مما يشير إلى الالتهاب وزيادة الخلوية في هذه المناطق13.
إصابة الدماغ غير المتماثلة في نصفي الكرة الأرضية والتلف في مناطق المادة البيضاء في نصف الكرة الأيسر
بالإضافة إلى ذلك ، تم تحليل إصابة الدماغ باستخدام تلطيخ LFB باستخدام الإجراء الموصوف سابقا14 (الشكل 5). أظهرت الصور ذات الطاقة المنخفضة تلطيخا أزرق أفتح في EC و Str ، مما يشير إلى إزالة الميالين في هذه المناطق. أظهرت الصور عالية الوضوح أن الفئران الزائفة أظهرت محاور جيدة التنظيم وذات النخاع مع الخلايا قليلة التغصن الخطية الموجهة في EC. ومع ذلك ، اختفت المحاور ولوحظت خلايا منتشترة ملطخة باللون الأزرق في EC في فئران ABCS. أظهرت الفئران الشامية هياكل حزمة من الألياف العميقة الملطخة باللون الأزرق والمنظمة جيدا في Str. ومع ذلك ، كانت حزم الألياف ملطخة أخف وزنا وأصغر ، وتعرضت سلامتها للخطر. تم تفريغ بعض حزم الألياف في فئران ABCS. تم تشويه حزم الألياف ، وتم تكثيف المصفوفة بين الحزم بشكل كبير في التيار المتردد في فئران ABCS. باختصار ، تسبب جراحة ABCS إزالة الميالين المحوري وتلفه. يحدث تلف المادة البيضاء بشكل رئيسي في نصف الكرة الأيسر.
ضعف التعلم والذاكرة
أدت جراحة ABCS بالإبرة إلى إعاقة كبيرة في التعلم ، كما يتضح من زيادة الوقت للعثور على منصة مغمورة (زمن الوصول للهروب) أثناء اختبار متاهة المياه موريس (الشكل 6). استمرت هذه الإعاقة لمدة 24 أسبوعا على الأقل بعد الجراحة. تأثرت الذاكرة أيضا بشكل كبير ، كما يتضح من انخفاض الوقت الذي يقضيه في الربع المستهدف بعد إزالة النظام الأساسي.
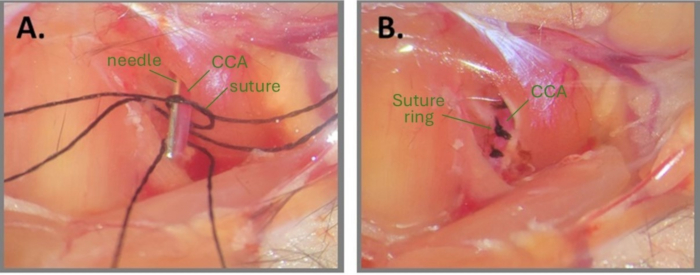
الشكل 1: خطوات جراحة الإبرة لإنشاء ABCS. (أ) يتم كشف CCA الأيسر ، ويتم ربط ثلاث خيوط حريرية تحت CCA. تتم صياغة عقدة فضفاضة على أحد شظايا الخيط ويتم وضع الإبرة بالتوازي مع CCA. (ب) يتم وضع ثلاث حلقات خياطة على بعد 1 مم تقريبا. الاختصارات: ABCS = تضيق الشريان السباتي المشترك الثنائي غير المتماثل. CCA = الشريان السباتي المشترك. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: نقص التروية الدماغية غير المتماثلة المستمر في نموذج ABCS بالإبرة. المراقبة الديناميكية لتدفق الدم في الدماغ بعد الجراحة. يمكن ملاحظة نقص التروية الدماغية المستمر في نصفي الكرة الأرضية ، كونها أكثر عمقا على اليسار. تشير العلامات النجمية السوداء إلى مناطق نقص التروية. اختصار: ABCS = تضيق الشريان السباتي المشترك الثنائي غير المتماثل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: معدل البقاء على قيد الحياة بعد جراحة ABCS بالإبرة. أسفرت الجراحة عن معدل بقاء 81.6٪ على مدى 6 أسابيع. حدثت الوفاة بشكل رئيسي خلال الأسبوع الأول بعد الجراحة. اختصار: ABCS = تضيق الشريان السباتي المشترك الثنائي غير المتماثل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
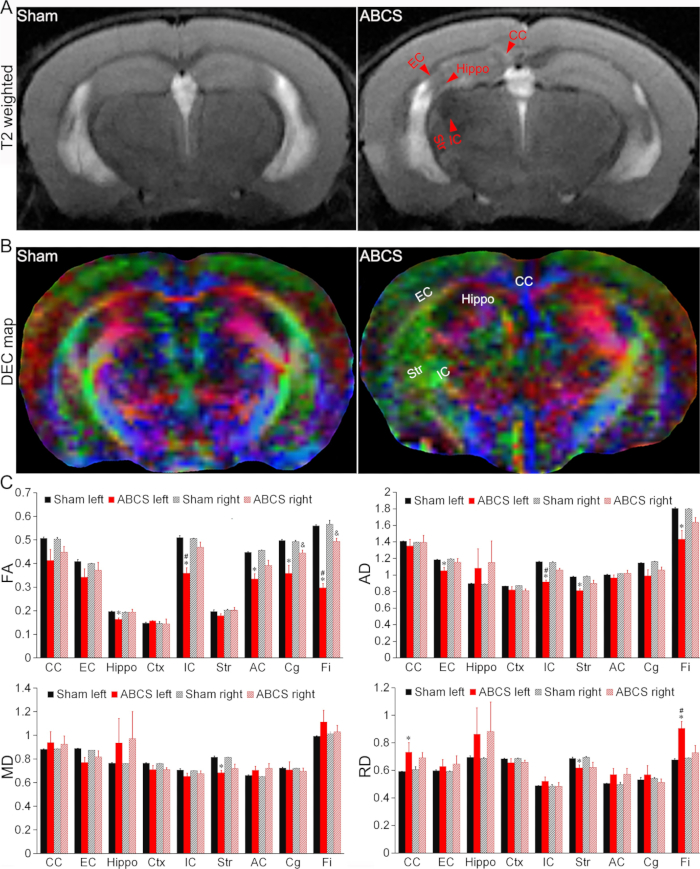
الشكل 4: الكشف عن التصوير بالرنين المغناطيسي في الجسم الحي لإصابة الدماغ في نموذج ABCS بالإبرة. (أ) صور ممثلة T2 مرجحة من الفئران الزائفة و ABCS. تشير رؤوس الأسهم الحمراء إلى مناطق منخفضة أو مفرطة الكثافة. (ب) خريطة DEC التمثيلية ل in vivo DTI بعد أسبوعين من جراحة ABCS بالإبرة. تشير الألوان إلى اتجاه المحور الرئيسي للانتشار (أحمر = يسار / يمين ، أخضر = ظهري / بطني ، وأزرق = منجل / ذيلي). (ج) التحليل الكمي في الفئران الوهمية و ABCS (ANOVA أحادي الاتجاه). * يمثل p < 0.05 ABCS مقابل الوهمية (نصف الكرة الأيسر). # يمثل p < 0.05 يسار مقابل يمين. & يمثل p < 0.05 ABCS مقابل الوهم (نصف الكرة الأيمن). يتم تقديم البيانات كمتوسط ± SEM. ن = 4 للزائف ، ن = 4 لفئران ABCS. الاختصارات: ABCS = تضيق الشريان السباتي المشترك الثنائي غير المتماثل. فرس النهر = الحصين. EC = كبسولة خارجية. IC = كبسولة داخلية ؛ CC = الجسم الثفني ؛ Str = المخطط. DEC = لون مشفر اتجاهيا ؛ DTI = تصوير موتر الانتشار ؛ FA = تباين الخواص الجزئي ؛ MD = متوسط الانتشار. AD = الانتشار المحوري. RD = الانتشار الشعاعي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
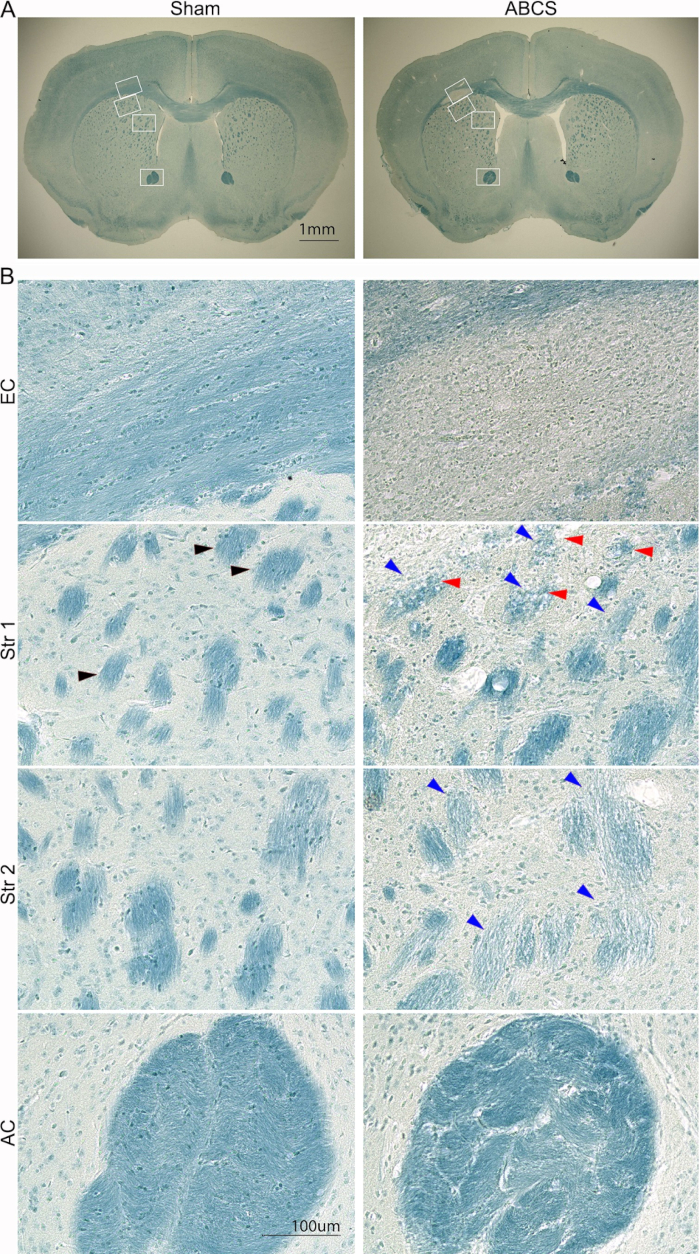
الشكل 5: تلطيخ LFB التمثيلي لشرائح الدماغ بعد 6 أسابيع من جراحة ABCS بالإبرة. (أ) صور منخفضة الطاقة لتلطيخ LFB من الفئران الزائفة و ABCS. تشير المربعات البيضاء إلى الموقع المقابل للصور عالية الوضوح في B. (B) صور عالية الدقة (200x) من EC (اللوحة العلوية) وموقعي Str 1 و 2 (اللوحة الوسطى) والتيار المتردد (اللوحة السفلية). يظهر رأس السهم الأسود حزمة ألياف عادية. تشير رؤوس الأسهم الزرقاء إلى حزمة ألياف تالفة. تشير رؤوس الأسهم الحمراء إلى الألياف المفرغة بالمكنسة الكهربائية. أشرطة المقياس = 1 مم (A) ، 100 ميكرومتر (B). الاختصارات: ABCS = تضيق الشريان السباتي المشترك الثنائي غير المتماثل. LFB = Luxol سريع أزرق ؛ EC = كبسولة خارجية. Str = المخطط. AC = المفوض الأمامي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
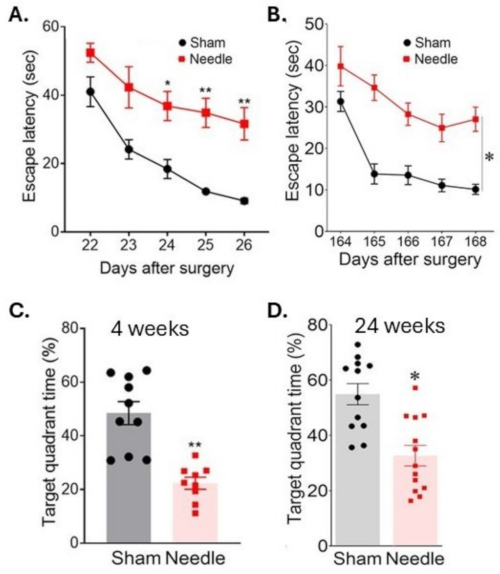
الشكل 6: التعلم المكاني وتقييم الذاكرة في اختبار المتاهة المائية. تم تقييم التعلم المكاني (أ) 3 أسابيع و (ب) 24 أسبوعا بعد الجراحة عن طريق قياس الوقت اللازم لتحديد موقع المنصة في أيام متتالية. تم تقييم الذاكرة (C) بعد 4 أسابيع و (D) بعد 24 أسبوعا من الجراحة عن طريق قياس الوقت الذي يقضيه في الربع المستهدف بعد إزالة المنصة. أدت الجراحة إلى اضطراب طويل الأمد في الوظائف المعرفية. تم التعبير عن البيانات كمتوسط ± SEM ، * ص < 0.05 إبرة مقابل وهمية. ** ص < 0.01 مقابل الخدف. ثنائي الاتجاه ANOVA و Neuman-Keuls post hoc. ن = 10 للوسادة ، ن = 10 لمجموعات الإبر. تم تعديل هذا الرقم من Weng et al.11. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تم وصف عدة طرق لتحريض VCID باستخدام تضيق CCA غير المتماثل ، وكلها تشترك في خطوة جراحية مهمة وحاسمة لعزل CCA من العصب المبهم وغمد وتعرض CCA لجعله في متناول التضيق. بينما نقدم إرشادات بصرية عالية الجودة حول التعرض الجراحي ل CCAs قبل الربط ، نود أيضا توجيه الباحثين لمشاهدة مقاطع فيديو إضافية حول عزل CCA المتوفرة عبر الإنترنت في سياق جراحات الفئران والفئرانالأخرى 15،16،17،18. يجب توخي الحذر الشديد حتى لا تضغط أو تمزق CCA لأنه الشريان الرئيسي الذي يمد الدماغ بالدم المؤكسج.
خطوة أخرى مهمة في الجراحة تحتاج إلى إتقانها هي صياغة عقدة فضفاضة وشدها حول CCA بإبرة متبوعة بإزالة الإبرة. نوصي بشدة بممارسة هذه الخطوة بالإبرة وحدها قبل محاولة إجراؤها في فأرة مخدرة. سيسمح ذلك بإتقان حركات الملقط الدقيقة وإتقان التلاعب بالخيوط دون التعرض لخطر إيذاء الماوس. يجب تأمين العقدة جيدا دون أن تتفتت أثناء إزالة الإبرة ، وهي محكمة بما يكفي لتثبيت الإبرة ولكنها فضفاضة بما يكفي لتمكين انزلاق الإبرة بعيدا عن الخيط المعقود باستخدام الملقط.
الأهم من ذلك ، وجدنا أن ربط واحد لكل CCA لا يكفي لتقليل تدفق الدم بشكل موثوق والحفاظ على نقص التروية الدماغية على المدى الطويل11. قد يكون أحد التفسيرات المحتملة هو أن الربط الفردي يسبب تضيقا نقطيا ، والذي من المحتمل أن يتسبب في زيادة موضعية في الضغط ، مما يؤدي إلى زيادة سرعة تدفق الدم للتعويض عن انخفاض تدفق الدم. نوصي بإجراء ثلاث عمليات ربط ~ 1 مم بصرف النظر عن بعضها البعض لإنشاء جزء من التضيق. فائدة إضافية لاستخدام ثلاثة روابط هي أن العقد تعمل كآلية تدقيق في حالة انفصال إحدى العقدة أثناء إزالة الإبرة الإضافية. في الواقع ، فإن جزء من التضيق الناجم عن ثلاثة روابط منفصلة لنفس CCA يزيد من تناسق النموذج ، مما يؤدي إلى نقص التروية الدماغية المستمر في حوالي 90٪ من الفئران. علاوة على ذلك ، يحاكي تضيق الشظايا تضيق CCA الناجم عن تصلب الشرايين لدى المرضى البشريين بشكل أكثر دقة مقارنة بتضيق النقطة المحورية ، مما يزيد من الأهمية السريرية لنموذج الإبرة.
نوصي بشدة بالإزالة الفورية للإبرة بعد الانتهاء من الربط الأول للتأكد من استعادة تدفق الدم CCA جزئيا ، وعندها فقط الانتقال إلى الربط الثاني والثالث بالتتابع. لا ينصح بإنهاء جميع عمليات الربط الثلاثة بالإبرة داخل جميع العقد الثلاث ، لأن هذا من شأنه أن يزيد بشكل كبير من وقت الانسداد الكامل لتدفق الدم. عادة ، لا نوصي بأكثر من 1 دقيقة من انسداد CCA الكامل قبل إزالة الإبرة. تستند هذه التوصية إلى التقرير الذي يفيد بأن الفئران لم تظهر أي علامات على أي ضعف وظيفي بعد 3 جلسات من 60 ثانية من انسداد كلا التقييمين القطريينالقطريين 19. في نموذجنا ، يعمل الجراح على CCA واحد في كل مرة ، وهو أكثر تسامحا من انسداد كلا الاحتجاز المشترك في وقت واحد ، لكننا ما زلنا نوصي باتباع هذا الجدول الزمني لاستبعاد أي قطع أثرية ناتجة عن الانسداد المطول بدلا من نقص التروية المزمن على كلا الجانبين.
في حين أن نموذج الإبرة هذا يسمح بضبط أقطار الغرز المعقدة باستخدام إبر بأقطار مختلفة (بناء على وزن الجسم أو المتطلبات المحددة لتقييد تدفق الدم) ، في تجربتنا ، كان لدى الفئران معدلات بقاء أعلى عندما كان نقص التروية في نصف الكرة الأيمن معتدلا وليس شديدا. من ناحية أخرى ، أدى نقص التروية الشديد المستمر في نصف الكرة الأيسر إلى نتائج مرضية وعصبية طويلة الأمد. وبالتالي ، نوصي بإجراء ربط غير متماثل باستخدام إبرة أكثر سمكا لربط CCA الأيمن (مما يتسبب في نقص تروية معتدلة في نصف الكرة الأيمن) وإبرة أرق لربط CCA الأيسر (مما يسبب نقص التروية الحاد في نصف الكرة الأيسر).
أخيرا ، يجب أن يدرك الباحثون أن سلالات الفئران المختلفة قد تنتج نتائج مختلفة عن الإهانة الإقفارية أو المؤلمة ، ويرجع ذلك أساسا إلى الاختلافات في تشريح الأوعية الدموية الدماغية20،21. نظرا لأن العديد من الدراسات في الوقت الحاضر تتطلب توليد فئران معدلة وراثيا جديدة ، يجب النظر بعناية في إجهاد الخلفية إذا كانت جراحة BCAO مطلوبة في أي مرحلة من مراحل التصميم التجريبي. على سبيل المثال ، تعد كل من سلالات C57BL / 6 و SV129 خيارا شائعا للخلفية لتوليد معدلة وراثيا لأبحاث السكتة الدماغية21. ومع ذلك ، فقد تم توثيق أن الفئران C57BL / 6 أكثر حساسية لنقص التروية مقارنة بالسلالات الأخرى التي تم اختبارها ، بما في ذلك الفئران SV12920،21. في الواقع ، هناك أدلة على أن تأثير سلالة الفئران يمكن أن يكون أكثر أهمية من تأثير التقنية المستخدمة للحث على VCID21. وبالتالي ، يصبح من المهم للغاية الحفاظ على خلفيات الفئران متسقة في جميع التجارب التي تنطوي على إحداث إصابة إقفارية في القوارض. الأهم من ذلك ، يمكن للباحثين تقييم كفاءة نتيجة الجراحة في الحية باستخدام أنظمة التسجيل العصبية22 بدرجة 0.5 كمعيار للشمول. يمكن تأكيد إصابة الدماغ بشكل أكبر باستخدام التلوين المناعي Iba1 وهو حساس جدا لتلف الدماغ حتى بعد الإهانة البؤرية الطفيفة.
باختصار ، من المهم أن تتذكر أن VCI هو مصطلح معقد يوحد العديد من التمثيلات والأسباب السريرية تحت نفس المظلة. لذلك ، يجب على الباحثين دائما أن يضعوا في اعتبارهم النموذج الذي يجب اختياره بناء على جوانب VCI التي يرغبون في دراستها. لا يمكن أبدا أن يكون هناك نموذج عالمي واحد لجميع مظاهر VCI. تحد نماذج تضيق CCA بشدة من تدفق الدم من الشرايين الرئيسية ، وبالتالي تحاكي المرضى الذين يعانون من تضيق تصلب الشرايين. تعد طريقة الإبرة الجديدة لإنشاء BCAS غير متماثل في الفئران C57BL / 6J طريقة موثوقة لتقليد VCID التي توفر العديد من المزايا مقارنة بالطرق التي تم الإبلاغ عنها سابقا (خاصة المرونة العالية ، ومعدل الوفيات المنخفض ، والنتائج طويلة المدى ، والحد الأدنى من التكلفة ، ومراقبة التصوير بالرنين المغناطيسي الحية). نظرا لمزاياها مقارنة بالنماذج الأخرى ، يمكن استخدامها لتعزيز معرفتنا بتطور VCID بالإضافة إلى العمل كأساس لفحص العوامل العلاجية المحتملة لعلاج أو إبطاء تطور VCID. على غرار الطرق الأخرى المبلغ عنها ل BCAS ، يتطلب نموذج الإبرة مهارات جراحية متقدمة يمكن إتقانها بمرور الوقت ، باستخدام هذا العرض المرئي كدليل.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم هذا المشروع من قبل منح المعاهد الوطنية للصحة / NINDS RF1NS117509 (G. Cao) ومنح مراجعة الاستحقاق VA BX003923 و BX006454 (G. Cao).
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD | 309659 | IP injection of ketoprofen |
| 2.5 mm blunt retractor tips | Kent Scientific Corporation | SURGI-5016-2 | 2 needed |
| Andis Ion T-Blade Pet Trimmer | Andis | BTF3 | To shave fur |
| Betadine Solution | Avrio Health L.P. | NDC 67618-150-17 | |
| Braided silk suture, 5-0 | Teleflex Medical | 106-S | For suturing skin |
| Braided silk suture, 7-0 | Teleflex Medical | 103-S | For ligating CCAs |
| Camera | Med Associates, Inc | VID-CAM-MONO-7 | For model validation |
| cover glass | Fisherbrand | 12-541-012 | For model validation |
| cresyl violet | Thermo Scientific | C581-25 | For model validation |
| Dispensing Tip, Needle, Flex, 34 Gauge, 1/4" OAL | Jensen Global | JG34-0.25HPX | For the left CCA |
| DSIStudio | https://dsi-studio.labsolver.org; for DTI data analysis | ||
| Dumont Tweezers; Pattern #1 | Roboz Surgical Instrument Co | RS-4960 | 2 needed |
| Dumont Tweezers; Pattern #5, 45 Degree Angle | Roboz Surgical Instrument Co | RS-5058 | 2 needed |
| Ethanol | Fisher Scientific | 64-17-5 | Dilute to 70% |
| ethylene glycol | Thermo Scientific | E178-4 | For model validation |
| Eye Needle, Size #4; 3/8 Circle, Cutting Edge, 11 mm Chord Length | Roboz Surgical Instrument Co | RS-7981-4 | For suturing skin |
| E-Z Anesthesia Classic System | E-Z systems | EZ-7000 | |
| glycerol | Thermo Scientific | AAA16205AP | For model validation |
| Homeothermic Monitoring System | Harvard Bioscience | K 022258 | |
| Imaging system EVOS FL Auto | Life Technologies | AMAFD2000 | For model validation |
| Isoflurane | Covetrus | 11695-6777-2 | |
| Ketoprofen | Zoetis | 5487 | |
| Leica M320 F12 clinic and surgery microscope | Leica | M320 F12 | |
| Lidocaine and Prilocaine Cream, USP 2.5%/2.5% | Padagis | NDC 0574-2042-30 | Generic to EMLA cream |
| lithium carbonate | Thermo Scientific | L119-500 | For model validation |
| Luxol fast blue | Thermo Scientific | AC212170250 | For model validation |
| microscope slides | Fisherbrand | 12-550-403 | For model validation |
| Microtome | Leica | SM2010R | For model validation |
| Morris Water Maze with the hidden platform | Maze Engineers | https://maze.conductscience.com/portfolio/morris-water-maze/ | |
| M-Prove Portable Balance | Sartorius | AY711 | Scales for weiging the mouse |
| MRI with ParaVision 6.0.1 | Bruker | AV3HD 9.4T | For model validation |
| Multi gas flow meter | Aalborg Instruments | GMR2-010334 | for low flow rate gas blending (N2O and O2) |
| Nano Ultra Fine Pen Needles - 32G 4mm | BD | 58320883 | For the right CCA |
| O.C.T. | Thermo Scientific | 23-730-571 | For model validation |
| Paraformaldehyde, 4% | Thermo Scientific | J61899.AK | For model validation |
| PBS | Thermo Scientific | BP399500 | For model validation |
| PeriCam PSI System with Aperiflux probe holder | Perimed Inc | PeriCam PSI HR | For model validation |
| permount | Thermo Scientific | SP15-100 | For model validation |
| Round Handle Forceps; Micro Suturing With Tying Platform; Curved | Roboz Surgical Instrument Co | RS-5264 | To help with cutting and suturing the skin |
| Small Animal Heat Lamp, 75 Watt | Morganville Scientific | HL0100 | For model validation |
| Small cotton-tipped applicators | Fisher Scientific | 23-400-118 | |
| Spring Scissors - 8mm Cutting Edge | Fine Science tools | 15024-10 | |
| Student Halsey Needle Holder | Fine Science tools | 91201-13 | 3 needed: 2 for holding skin retractors and 1 for suturing the skin |
| Sucrose | Thermo Scientific | A15583.36 | For model validation |
| Universal Camera Ceiling Mount | Med Associates, Inc | ENV-598 | For model validation |
| water bath | VWR | 89032-226 | For model validation |
References
- Tuo, Q. Z., Zou, J. J., Lei, P. Rodent models of vascular cognitive impairment. J Mol Neurosci. 71 (5), 1-12 (2021).
- Zhou, Z., et al. Deeper cerebral hypoperfusion leads to spatial cognitive impairment in mice. Stroke Vasc Neurol. 7 (6), 527-533 (2022).
- Shibata, M., Ohtani, R., Ihara, M., Tomimoto, H. White matter lesions and glial activation in a novel mouse model of chronic cerebral hypoperfusion. Stroke. 35 (11), 2598-2603 (2004).
- Hattori, Y., et al. A novel mouse model of subcortical infarcts with dementia. J Neurosci. 35 (9), 3915-3928 (2015).
- Janson, J., et al. Increased risk of type 2 diabetes in Alzheimer disease. Diabetes. 53 (2), 474-481 (2004).
- Herzig, M. C., et al. Abeta is targeted to the vasculature in a mouse model of hereditary cerebral hemorrhage with amyloidosis. Nat Neurosci. 7 (9), 954-960 (2004).
- Miao, J., et al. Cerebral microvascular amyloid beta protein deposition induces vascular degeneration and neuroinflammation in transgenic mice expressing human vasculotropic mutant amyloid beta precursor protein. Am J Pathol. 167 (2), 505-515 (2005).
- Moechars, D., et al. Early phenotypic changes in transgenic mice that overexpress different mutants of amyloid precursor protein in brain. J Biol Chem. 274 (10), 6483-6492 (1999).
- Wallays, G., et al. Notch3 Arg170Cys knock-in mice display pathologic and clinical features of the neurovascular disorder cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy. Arterioscler Thromb Vasc Biol. 31 (12), 2881-2888 (2011).
- Cognat, E., Cleophax, S., Domenga-Denier, V., Joutel, A. Early white matter changes in CADASIL: evidence of segmental intramyelinic oedema in a pre-clinical mouse model. Acta Neuropathol Commun. 2, 49(2014).
- Weng, Z., et al. A novel needle mouse model of vascular cognitive impairment and dementia. J Neurosci. 43 (44), 7351-7360 (2023).
- Biesbroek, J. M., Biessels, G. J. Diagnosing vascular cognitive impairment: Current challenges and future perspectives. Int J Stroke. 18 (1), 36-43 (2023).
- Winklewski, P. J., et al. Understanding the physiopathology behind axial and radial diffusivity changes-what do we know. Front Neurol. 9, 92(2018).
- Jing, Z., et al. Neuronal NAMPT is released after cerebral ischemia and protects against white matter injury. J Cereb Blood Flow Metab. 34 (10), 1613-1621 (2014).
- Yang, S. T., et al. Adult mouse venous hypertension model: common carotid artery to external jugular vein anastomosis. J Vis Exp. (95), e50472(2015).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387(2013).
- Lee, D., et al. A murine model of ischemic retinal injury induced by transient bilateral common carotid artery occlusion. J Vis Exp. (165), (2020).
- Schleimer, K., et al. Training a sophisticated microsurgical technique: interposition of external jugular vein graft in the common carotid artery in rats. J Vis Exp. (69), e4124(2012).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387(2013).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Wellons, J. C., et al. A comparison of strain-related susceptibility in two murine recovery models of global cerebral ischemia. Brain Res. 868 (1), 14-21 (2000).
- Cao, G., et al. In Vivo delivery of a Bcl-xL fusion protein containing the TAT protein transduction domain protects against ischemic brain injury and neuronal apoptosis. J Neurosci. 22 (13), 5423-5431 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved