Method Article
İğne Kılavuzluğunda Asimetrik Bilateral Ortak Karotis Arter Darlığına Dayalı Vasküler Kognitif Bozukluk ve Demans için Bir Fare Modeli
Bu Makalede
Özet
Asimetrik bilateral ortak karotis arter stenozunun iğne yöntemi, vasküler kognitif bozukluk ve demans için bir fare modeli oluşturmak için önerilmiştir. Daha önce kurulmuş modellere kıyasla daha uzun vadeli sonuçlarla sonuçlanır ve canlı MRG ile uyumludur. Prosedürü gösteren görsel temsil, ameliyatta ustalaşmak için rehberlik sağlar.
Özet
Vasküler bilişsel bozukluk ve demans (VCID), vasküler beyin hasarından kaynaklanır. Nüfus yaşlandıkça artmaya devam etmesi beklenen VCID'nin yüksek insidansı göz önüne alındığında, hastalık için sağlam bir hayvan modeli oluşturmak çok önemlidir. Bu makale, karotis aterosklerozunun neden olduğu insan kronik serebral hipoperfüzyonunu taklit eden asimetrik bilateral ortak karotis arter darlığına dayanan bir fare VCID modeli oluşturmak için yeni bir yöntem sunmaktadır.
Kısaca, ana karotis arterler (CCA'lar) 7-0 ipek sütürler kullanılarak farklı ölçülü iğnelere (sağ CCA için 32 G ve sol CCA için 34 G) bağlanır ve ardından hemen iğne çıkarılır. Kalan sütür halkaları, beyaz cevher hasarı, mikroenfarktüsler ve reaktif gliozis ile ilişkili kalıcı kan akışı azalmasına ve uzun süreli kognitif bozukluğa neden olur, böylece VCID patogenezini yakından taklit eder. Daha da önemlisi, bu iğne modelinde, klinik temsiller zamanla geri dönmez ve güvenilir uzun vadeli bilişsel bozukluk sağlar. Ayrıca, ameliyattan 24 hafta sonra hayatta kalma oranı %81.6 idi ve bu, benzer düzeyde kan akışı azalması olan diğer yerleşik VCID modellerine kıyasla daha yüksekti.
Ek avantajlar arasında düşük malzeme maliyeti ve metal implante edilmediği için canlı hayvanlarda beyin hasarını izlemek için MRI ile uyumluluk yer alır. VCID'nin iğne modelini kullanmadaki ana zorluk, fare CCA'larının çapı 0,6 mm'den küçük ve çok kırılgan olduğu için ileri cerrahi becerilerin geliştirilmesi gerekliliğidir. Ameliyatın yüksek kaliteli görsel temsili, bu nedenle, araştırmacıların bu tekniğe hakim olmalarına ve VCID anlayışımızı geliştirmelerine yardımcı olacak ve potansiyel olarak VCID ile ilişkili yıkıcı bilişsel gerilemeyi azaltmak için yeni terapötik modalitelerin geliştirilmesine yol açacaktır.
Giriş
Vasküler bilişsel bozukluk ve demans (VCID), bilişsel gerilemenin ikinci önde gelen nedenidir. VCID patogenezini ve risk faktörlerini anlamaya yönelik kaydedilen yadsınamaz ilerlemeye rağmen, nörovasküler disfonksiyonun bilişsel yeteneğin azalmasına nasıl katkıda bulunduğunun mekanizması belirsizliğini korumaktadır. İnsan VCID1'in klinik temsillerini taklit etmek için serebral iskemiyi indüklemek için çeşitli karmaşıklıklara sahip bir dizi kemirgen modeli oluşturulmuştur. Bu modellerden bazıları geçici serebral hipoperfüzyon oluşturmaya dayanmaktadır; bununla birlikte, çoğu, insan hastalarda VCID'ye yol açan ana mekanizma olan kronik serebral hipoperfüzyonun indüklenmesiyle üretilir2.
Kronik serebral hipoperfüzyon, ciddi ancak sıklıkla ölümcül sonuçlara neden olan bilateral karotis arter tıkanıklığı (BCAO) veya bilateral karotis arter darlığı (BCAS) kullanılarak uygulanabilir. BCAS genellikle iki yöntemden biri kullanılarak gerçekleştirilir: her iki CCA'nın etrafına aynı mikro bobinleri yerleştirerek simetrik stenoz3 ile sonuçlanır; veya sırasıyla sol ve sağ CCA'ların etrafına bir ameroid konstriktör ve bir mikro bobin implante ederek, sol ve sağ CCA'larda kademeli oklüzyona ve ~% 50 kan akışının azalmasına neden olur, buna bağlı olarak4. Her iki yöntemin de dezavantajları, darlığın çok şiddetli olması veya CCA'nın tıkalı olması durumunda yüksek mortalite oranı ve vücutta metal varlığı nedeniyle canlı hayvan MRG taraması ile uyumsuzluktur. Birkaç genetik fare modeli de kurulmuştur 1,5,6,7,8. Ek seçenekler arasında subkortikal enfarktüslü serebral otozomal dominant arteriyopati ve lökoensefalopati fare modelleri 9,10 bulunur. Bununla birlikte, önerilen modellerin hiçbiri insan hastalarda sunulan iskemik hasarın tamamını taklit etmemektedir ve bu nedenle güncellenmiş VCID modelleri için arayış devam etmektedir.
Bu yazıda, farelerde asimetrik bilateral ortak karotis arter darlığını (ABCS) indüklemek için yeni bir cerrahi yöntem sunulmaktadır, burada CCA darlığı ipek dikişler kullanılarak gerçekleştirilir ve CCA'ların çeşitli çaplardaki iğnelere bağlanması ve ardından hemen iğne çıkarılmasıyla kontrol edilir11. Sonuç olarak, kronik darlığı sağlamak için CCA'ların üzerine kalıcı olarak hassas çaplarda dikiş halkaları bırakılır. ABCS'yi simetrik bir yönteme göre kullanmanın yararı, sağda orta derecede hipoperfüzyonun daha iyi sağkalım sağlarken, solda daha belirgin hipoperfüzyonun uzun süreli nörolojik ve patolojik temsilleri garanti etmesidir. Bu iğne modeli, kalıcı sonuçlar, daha düşük mortalite, ultra düşük maliyet, esneklik ve özel analitik yaklaşımları kullanma imkanı gibi geleneksel BCAS modellerine11 göre çeşitli avantajlara sahiptir.
Bu avantajları detaylandırmak için, üç ligasyon, odak noktası darlığından ziyade CCA darlığının bir parçasına neden olur ve farelerin ~% 90'ında kalıcı hipoperfüzyona, beyaz cevher hasarına ve bilişsel gerilemeye yol açar. İğneli farelerin ölüm oranı ~% 17 idi, deneyimlerimize dayanarak 16 hafta boyunca ~% 30 ölüm oranına sahip olan Hattori'nin ameroid kısıtlayıcı / mikrobobin model4'ünden daha düşüktü. Pahalı mikro bobinler veya ameroid kısıtlayıcılar nedeniyle her BCAS modeli tipik olarak yaklaşık 100 ABD dolarına mal olurken, iğne modeli fare başına yalnızca yaklaşık 1 ABD dolarına mal olur. Ayrıca, iğnelerin ölçüsü, her iki taraftaki kan akışı kısıtlaması için araştırmaya özel gereksinimlere bağlı olarak değiştirilebilir. Bu yazıda sunulan varyasyonda, iğne modeli, klinik11'de hastalığın en sık temsili olan oklüzyon olmaksızın tek taraflı kalıcı darlığın neden olduğu ciddi karotis darlığının patofizyolojisini taklit etmektedir. Ayrıca, geleneksel BCAS modellerinde kullanılan ameroid sınırlayıcılar ve mikro bobinler metalden yapılmıştır, bu da in vivo MRG yapılırsa, metal beyne değil göğüste implante edilse bile önemli artefaktlara neden olabilir. Metalin varlığının görüntülemeyi tam olarak nasıl etkileyeceğini tahmin etmek zor olabilir.
Genel olarak, mikrobobin implantasyonundan sonra gerçekleştirilen in vivo MRG, genellikle basit anatomik görüntülemedir, VCID araştırması için oldukça arzu edilen çoklu hakaretlerin kantitatif analizi için uygun değildir. Buna karşılık, burada sunulan iğne modeli sadece ipek dikişler kullanır ve her türlü in vivo MRG ile tamamen uyumludur. Bu iki nedenden dolayı önemlidir: (1) MRG, küçük beyin lezyonlarına, mikro kanamalara veya yüzeysel sideroza karşı son derece hassastır12, bu nedenle BT taraması gibi diğer analiz yöntemlerine göre tercih edilir (2) in vivo MRG, ex vivo MRG'ye göre tercih edilmelidir, çünkü VCID araştırması lezyon ilerlemesi/iyileşmesinin dinamiklerini izlemekten şüphesiz fayda sağlayabilir, özellikle önerilen yeni tedavilere yanıt olarak. Ek olarak, serebral hipoperfüzyona yanıt olarak nörovasküler eşleşmenin bütünlüğüne ilişkin kritik bilgiler sağlamak için iğne modelinde fonksiyonel (fMRI) gerçekleştirilebilir. Bu nedenle, in vivo MRG kullanma olasılığı, özellikle farmakodinamik çalışmalarda, lezyonların boyutu ve yeri ile bilişsel işlev arasındaki karmaşık korelasyonun yanı sıra nörovasküler eşleşme için derinlemesine bir yol açar.
Protokol
Tüm hayvan protokolleri, Pittsburgh Üniversitesi'ndeki Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylandı ve Laboratuvar Hayvanlarının Bakımı ve Kullanımı için Ulusal Sağlık Enstitüleri Kılavuzu'na uygun olarak gerçekleştirildi. Tüm sağkalım ameliyatlarında steril teknikler sürdürülmelidir. Sunulan deneylerde vücut ağırlığı 25-30 g olan on iki haftalık erkek C57BL / 6J fareler kullanıldı.
1. Malzemelerin ve çalışma alanının hazırlanması
- İğne parçalarını hazırlayın (~ 4 mm uzunluğunda; sağ CCA için 32 G ve sol CCA için 34 G). Keskin ucu sert bir yüzeye dikkatlice vurarak iğnelerin keskin ucunu hafifçe köreltin ve bir iğne tutucu kullanarak iğneleri plastik parçalardan dikkatlice ayırın. 7-0 ipek dikişleri 1-2 cm uzunluğunda parçalar halinde önceden kesin.
- Cerrahi aletleri, iğne parçalarını ve dikişleri otoklavlama veya başka bir uygun yöntemle sterilize edin.
2. Ameliyatın yapılması
- Fareyi tartın ve fareyi %25O2 ve %72N2Okarışımında %3 izofluran ile havalandırılan bir odaya 2-3 dakika yerleştirerek anesteziye neden olun.
- Sabit bir vücut ısısını (37 ° C) korumak için fareyi (ventral tarafı yukarı bakacak şekilde) steril bir cerrahi tabaka ile kaplı bir ısıtma yastığına yerleştirin ve% 25O 2 ve% 74 N2O karışımında% 1 izofluran ile ventilasyon için bir yüz maskesi sabitleyin.
- Boyundaki kürkü elektrikli tıraş makinesiyle tıraş edin. İnce tüyleri yapışkan bant veya klavye süpürgesi ile temizleyin.
- Cerrahi bölgeyi Betadine Solüsyonu (% 10 iyot) ile dezenfekte edin. Cildi% 70 etanol ile deiyodize edin. Dinsenfeksiyonu 3 kez tekrarlayın. Sert bir ayak parmağı tutamına (pedal refleksi) yanıt verilmemesi nedeniyle anestezi seviyesinin yeterli olduğundan emin olun.
- Cerrahi bölgeyi örtün. Daha sonra soluk borusu boyunca dikey bir orta hat kesisi yapın ve mikro forseps ile iki taraflı tiroid bezlerini ayırın. Steril küçük cilt ekartörleri ile cildi ve dokuyu uzaklaştırın.
- Mikroskop altında, CCA'lardan birini vagus sinirinden ve kılıftan dikkatlice açığa çıkarmak ve künt bir şekilde incelemek için açılı cımbız kullanın. CCA forsepslere yapışma eğilimindeyse, insizyon bölgesini ıslatmak için steril su veya fosfat tamponlu salin (PBS) kullanın. Gerekirse duruşu desteklemek için boynun altına küçük bir plastik şırınga yerleştirin.
NOT: CCA'yı yırtmamaya ekstra özen gösterin. - Önceden kesilmiş üç ipek dikiş parçasını (7-0 numara) açılı cımbız kullanarak CCA'nın altına (1 mm aralıkla) geçirin.
- Sütür parçalarından birinde CCA'nın etrafına çok gevşek bir çift düğüm çizin.
NOT: Ameliyat bölgesini ve dikişleri steril su veya PBS ile ıslatmak düğüm atılmasına yardımcı olabilir. - Gevşek düğümün içine CCA'ya paralel bir iğne parçası (sağ CCA için 32 G ve sol CCA için 34 G) yerleştirin (Şekil 1A). Kan akışı gözlenmeyene kadar hem iğnenin hem de CCA'nın etrafındaki birincil düğümü dikkatlice sıkın ve ikincil bir düğümle sabitleyin. Kısmi kan akışını eski haline getirmek için iğneyi hemen dışarı çekin ve dikişin uçlarını kesin.
NOT: Cerrah, düğümler tamamlandıktan sonra dikiş uçlarını keserken çok dikkatli olmalıdır. Düğüme çok yakın kesmek, düğümün gevşemesine neden olabilir. Ek olarak, düğümün aşağısında kan akışının hala etkin olduğundan emin olmak için iğneyi çıkardıktan sonra CCA'yı gözlemlemek çok önemlidir. İğne çıkarıldıktan sonra CCA çok solgun görünüyorsa, CCA'nın aşırı sıkıştırıldığı anlamına gelir. - Aynı CCA üzerindeki 2. ve 3. dikiş dişleri için birbirinden yaklaşık 1 mm aralıklarla 2.8-2.9 adımlarını tekrarlayın (Şekil 1B).
- 32 G'lik bir iğne parçası kullanarak karşı CCA ile 2.6-2.10 adımlarını tekrarlayın.
- Her iki CCA'nın da verimli bir şekilde bağlanıp bağlanmadığını dikkatlice inceleyin: üç dikiş bandının da yerinde güvenli bir şekilde düğümlendiğini, ancak kan akışını tamamen engelleyecek kadar sıkı olmadığını doğrulayın (CCA'ların düğümlerin aşağısında soluk olmadığını kontrol edin). Her bir CCA'daki üç dikiş bandının birbirinden yaklaşık 1 mm aralıklı olduğunu kontrol edin.
- Steril monofilament dikişler kullanarak cildi kapatın.
- Ameliyattan hemen sonra, ameliyat sonrası ağrıyı hafifletmek için intraperitoneal olarak 100-150 μL ketoprofen (1 mg / mL stok; 5 mg / kg vücut ağırlığı) enjekte edin. Bu enjeksiyonu ameliyattan 24 saat ve 48 saat sonra tekrarlayın.
- Hayvanı hayvan tesisine geri göndermeden önce 2 saat boyunca sürekli izleme için fareyi 37 °C'de homeotermik bir battaniyenin üzerine yerleştirin.
NOT: Sahte prosedür için 2.7-2.12 adımları atlanmalıdır.
3. Modelin doğrulanması
NOT: Beyin hasarı in vivo MRG ile analiz edildi ve Luxol hızlı mavi (LFB) boyama ve davranış testleri ile daha fazla doğrulandı.
- Serebral kan perfüzyonunun görüntülenmesi.
- Fareyi% 1-1.5 izofluran kullanarak uyuşturun. Cerrahi bölgeyi Betadine Solüsyonu (% 10 iyot) ile sterilize edin. Daha sonra cildi %70 etanol ile iyoydan arındırın.
- Hayvanın kafatasını stereotaktik bir çerçeveye sabitleyin. Kafatasını ortaya çıkarmak için kafa derisinde frontalden oksipital kemiğe kadar orta hat saggital bir kesi yapın ve kafatası yüzeyini steril tuzlu su ile temizleyin.
- İki boyutlu bir lazer benek sistemi kullanarak kafatasının 10 cm yukarısına şarjlı bir cihaz kamerası yerleştirin. Kraniektomi bölgesinin üzerine bir prob tutucu yerleştirin ve sıkıca sabitleyin.
- Ameliyattan 5 dakika önce ve iğne serbest bırakıldıktan hemen sonra veya ameliyattan 7, 14, 21, 28, 35 ve 42 gün sonra kan perfüzyon görüntüleri alın.
- Steril monofilament dikişler kullanarak cildi kapatın. Ameliyat sonrası ağrıyı hafifletmek için intraperitoneal olarak 100-150 μL ketoprofen (1 mg / mL stok; 5 mg / kg vücut ağırlığı) enjekte edin. Bu enjeksiyonu 24 saat ve 48 saat tekrarlayın.
- İn vivo MRG
- Fareleri% 1-1.5 izofluran kullanarak uyuşturun, solunum sürekli izlenir ve görüntü elde edilirken sıcaklık 37 ° C'de tutulur.
- İlgili yazılımı çalıştıran bir 9.4T tarayıcı, 86 mm Tx bobin ve 4 kanallı fare beyni alıcı dizisi kullanarak in vivo MRI gerçekleştirin. Konumlandırma ve pilot taramaların ardından, aşağıdaki parametrelerle Gevşeme Geliştirme ile Hızlı Edinme (RARE) dizisi kullanarak T2 ağırlıklı görüntüler (T2WI) elde edin: Yankı Süresi/Tekrarlama Süresi (TE/TR) = 40/4.000 ms, ortalamalar = 8.256 × 256 matris, 0,5 mm dilim kalınlığına sahip 16 dilim, RARE faktörü = 4 ve 20 x 20 mm'lik bir görüş alanı (FOV).
- Aşağıdaki istisnalar dışında T2WI ile aynı geometri ve parametreleri kullanarak bir yankı düzlemsel görüntüleme (EPI)-DTI görüntüleme dizisi kullanarak Difüzyon Tensör Görüntüleme (DTI) verilerini toplayın: TR/TE = 2.300/22 ms, edinim matrisi = 128 x 128, 2 segment, 5 A0 görüntü ve 30 doğrusal olmayan difüzyon görüntüsü, Δ/δ = 10/3 ms ve bir b-değeri = 1.000 s/mm2.
- DSI Studio yazılımını (http://dsistudio.labsolver.org/) kullanarak DTI verilerini analiz edin, difüzyon skaler parametrelerindeki farklılıkları arayın (Fraksiyonel Anizotropi (FA), Ortalama Yayılma (MD), Eksenel Yayılma (AD) ve Radyal Yayılma (RD)). Korpus kallozum (CC), dış kapsül (EC), iç kapsül (IC), Fimbria, anterior komissür (AC), cingulum (Cing), hipokampus (su aygırı), Korteks (C) ve striatum (Str) için her iki hemisferden ilgi alanları (ROI'ler) çizin.
- Luxol hızlı mavi (LFB) boyama
- Beyin bölümlerini hazırlayın: beyni 24 saat boyunca %4 PFA ile sabitleyin ve ardından beyin batana kadar beyni %30 sükroz içine daldırın. Beyni kuru buz üzerindeki OCT bileşiğine gömün. Kayan bir mikrotom üzerinde 20 μm kalınlığında koronal beyin dilimi kesin. Beyin dilimlerini depolama solüsyonunda saklayın (PBS'de %30 gliserol / %30 etilen glikol).
- Beyin bölümlerini LFB'ye (% 0.1 alkol çözeltisi) daldırın, gece boyunca 56 ° C'de tutun ve damıtılmış suyla yıkayın.
- Beyin bölümlerini %0.05 lityum karbonat içinde inkübe edin ve dereceli alkoller yoluyla dehidre edin.
- Bölümleri% 70 etanol ile farklılaştırılmış% 0.5 kresil menekşe ile 5 dakika boyayın.
- Lekeli beyin bölümlerini montaj ortamı ile monte edin.
- Modifiye edilmiş Morris su labirenti testi ile bilişsel işlev değerlendirmesi
- Dairesel bir tankı suyla doldurun (25 oC, derinlik 33 cm) ve su seviyesinin 1,2 cm altına, havuzun kuzey, doğu, güney veya batı kenarından 31 cm uzaklıkta ~ 10 x10 cm 2 pleksiglas bir kare platformu suya batırın.
NOT: Bu platform, tüm test süresi boyunca aynı yerde kalmalıdır. - Tavana monte edilmiş bir video kamerayı açın. Tanka bir fare yerleştirin (su seviyesinde düşürmeyin), duvara bakacak ve kuzeydoğu, güneydoğu, güneybatı veya kuzeybatıdan başlayarak. Batık bir platform bulmak için farenin maksimum 90 saniye yüzmesine izin verin.
- Platform bulunursa, farenin batık platformda 30 saniye kalmasına izin verin. Platform bulunamazsa, fareyi 30 saniye boyunca oraya yerleştirin.
- Fareyi 5 dakika dinlendirin ve yüzme denemesini tekrarlayın (adım 3.4.2 - 3.4.3) 2x.
- Fareyi bir bez parçasıyla kurulayın ve bir ısıtma ampulünün altındaki kafesine geri koyun.
- Ardışık 5 gün boyunca her gün üç yüzme denemesini tekrarlayın.
- Video görüntülerini kullanarak, kaçmak için gereken gecikmeyi hesaplayın (her denemede platformu bulmanın ne kadar sürdüğünü).
- Testin son gününde, platformu kaldırın ve farenin daha önce platformun bulunduğu kadranda geçirdiği süreyi kaydedin.
- Dairesel bir tankı suyla doldurun (25 oC, derinlik 33 cm) ve su seviyesinin 1,2 cm altına, havuzun kuzey, doğu, güney veya batı kenarından 31 cm uzaklıkta ~ 10 x10 cm 2 pleksiglas bir kare platformu suya batırın.
Sonuçlar
Uzun süreli asimetrik serebral hipoperfüzyon
CCA kan akışı, daha önce tarif edildiği gibi, iğneyi son (üçüncü) ligasyondan serbest bırakmadan önce ve hemen sonra ölçüldü11. Kan akışı sol CCA'da ~% 70 ve sağ CCA'da ~% 50 oranında azaldı. Serebral kan perfüzyonu iki boyutlu lazer benek kullanılarak dinamik olarak izlendi. Ameliyat her iki hemisferde serebral hipoperfüzyona neden oldu ve sol hemisfer daha ciddi şekilde etkilendi (Şekil 2). Serebral hipoperfüzyon ameliyattan sonra en az 24 hafta sürdürülür11.
Daha düşük mortalite
6 hafta boyunca erkek fareler için hayatta kalma oranı% 81.6 idi (Şekil 3); Fareler ameliyattan sonraki ilk hafta ölüme daha yatkındı.
Beyin hasarının in vivo MRG tespiti
T2 ağırlıklı görüntüler, ABCS cerrahisine tabi tutulan farelerde hipokampus (Hippo), dış kapsül (EC), iç kapsül (IC), korpus kallozum (CC) ve striatumda (Str) hipo- veya hiperintens bölgeler ortaya çıkardı ve beyin hasarını gösterdi (Şekil 4A). ABCS farelerinin DTI'sinin yönlü olarak kodlanmış renk (DEC) haritalarında, sahte ile karşılaştırıldığında yapısal hasar gözlenmiştir (Şekil 4B).
Kantitatif analizler, ABCS farelerinin sol Hippo, IC, anterior komissür (AC), cingulum (Cg) ve Fimbria'da (Fi) sahte ile karşılaştırıldığında anlamlı derecede daha düşük fraksiyonel anizotropi (FA) gösterdiğini gösterdi (P < 0.05'e karşı sahte), sol yarımkürede beyaz cevher mikro yapısının tehlikeye girdiğini gösterir (sol üst panel, Şekil 4C). ABCS farelerinde sağ Cg ve Fi'de FA da azaldı (P < 0.05'e karşı sahte). Sol IC ve Fi'deki FA, ABCS farelerinde sağdan anlamlı derecede düşüktü (P < 0.05, sola karşı sağ).
Benzer şekilde, ABCS farelerinde sol EC, IC, Str ve Fi'de sahte ile karşılaştırıldığında önemli ölçüde daha düşük eksenel difüzyon (AD) sergilendi, bu da aksonal yaralanmayı düşündürdü (sağ üst panel, Şekil 4C (P < 0.05'e karşı sahte)). Sadece sol Str, ABCS farelerinde sahte ile karşılaştırıldığında ortalama difüzyon (MD) azalması gösterdi (sol alt panel, Şekil 4C). ABCS farelerinde sol CC, Str ve Fi'de radyal difüzyon (RD) farkı gözlendi (sağ alt panel, Şekil 4C), bu bölgelerde iltihaplanma ve artmış hücreselliği düşündürdü13.
İki hemisferde asimetrik beyin hasarı ve sol hemisferde beyaz cevher bölgelerinde hasar
Beyin hasarı ayrıca daha önce açıklanan prosedür kullanılarak LFB boyama ile analiz edildi14 (Şekil 5). Daha düşük güç görüntüleri, EC ve Str'de daha açık mavi lekelenme gösterdi ve bu bölgelerde demiyelinizasyonu düşündürdü. Yüksek çözünürlüklü görüntüler, sahte farelerin EC'de çizgisel yönelimli oligodendrositlerle iyi organize edilmiş ve miyelinli aksonlar sergilediğini gösterdi; bununla birlikte, aksonlar kayboldu ve ABCS farelerinde EC'de yaygın, mavi lekeli hücreler gözlendi. Sahte fareler, Str'de koyu mavi lekeli ve iyi organize edilmiş lif demeti yapıları gösterdi. Bununla birlikte, lif demetleri daha hafif ve daha küçük lekelendi ve bütünlükleri tehlikeye girdi; bazı lif demetleri ABCS farelerinde vakuollendi. Fiber demetleri bozuldu ve demetler arası matris, ABCS farelerinde AC'de önemli ölçüde kalınlaştı. Özetle, ABCS cerrahisi aksonal demiyelinizasyon ve hasara neden olur; Beyaz cevher hasarı esas olarak sol hemisferde meydana gelir.
Öğrenme ve hafıza işlev bozukluğu
İğne ABCS ameliyatı, bir Morris su labirenti testi sırasında batık bir platform bulmak için artan süre (kaçma gecikmesi) ile gösterildiği gibi, önemli öğrenme güçlüğü ile sonuçlandı (Şekil 6). Bu sakatlık ameliyattan sonra en az 24 hafta boyunca devam etti. Platform çıkarıldıktan sonra hedef kadranda geçirilen sürenin azalmasıyla gösterildiği gibi, bellek de önemli ölçüde etkilendi.
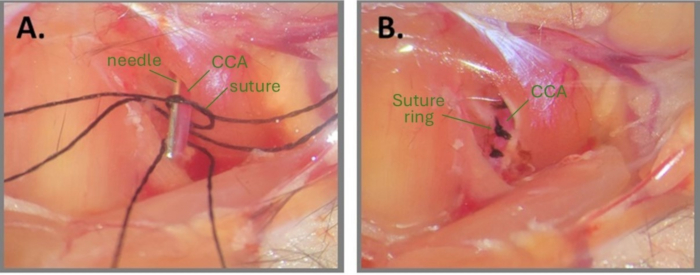
Şekil 1: ABCS oluşturmak için iğne cerrahisinin adımları. (A) Sol CCA açığa çıkar ve CCA'nın altına üç ipek sütür geçirilir. Sütür parçalarından birine gevşek bir düğüm atılır ve iğne CCA'ya paralel olarak konumlandırılır. (B) Üç dikiş halkası yaklaşık 1 mm aralıklarla yerleştirilmiştir. Kısaltmalar: ABCS = asimetrik bilateral ortak karotis arter darlığı; CCA = ortak karotis arter. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: İğne ABCS modelinde kalıcı asimetrik serebral hipoperfüzyon. Ameliyat sonrası beyin kan akışının dinamik olarak izlenmesi. Kalıcı serebral hipoperfüzyon her iki hemisferde de gözlenebilir, solda daha derindir. Siyah yıldızlar hipoperfüzyon bölgelerini gösterir. Kısaltma: ABCS = asimetrik bilateral ortak karotis arter darlığı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: İğne ABCS ameliyatı sonrası sağkalım oranı. Ameliyat, 6 hafta boyunca% 81.6'lık bir sağkalım oranı ile sonuçlandı; Ölüm esas olarak ameliyat sonrası ilk hafta içinde meydana geldi. Kısaltma: ABCS = asimetrik bilateral ortak karotis arter darlığı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
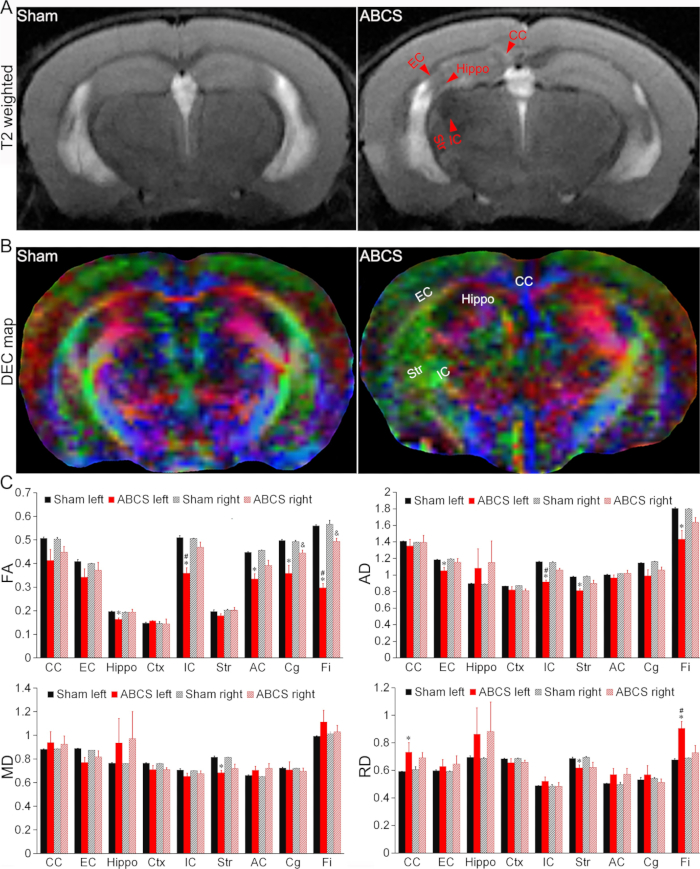
Şekil 4: İğne ABCS modelinde beyin hasarının in vivo MRG tespiti. (A) Sahte ve ABCS farelerinden temsili T2 ağırlıklı görüntüler. Kırmızı ok uçları hipo- veya hiperintens bölgeleri gösterir. (B) İğne ABCS ameliyatından 2 hafta sonra in vivo DTI'nin temsili DEC haritası. Renkler, ana difüzyon ekseninin yönlülüğünü gösterir (kırmızı = sol/sağ, yeşil = dorsal/ventral ve mavi = rostral/kaudal). (C) Sahte ve ABCS farelerinde kantitatif analiz (tek yönlü ANOVA). * p'yi temsil eder < 0.05 ABCS'ye karşı sahte (sol yarımküre). # p < 0.05 sola karşı sağa karşı temsil eder. &, p'yi temsil eder < 0.05 ABCS'ye karşı sahte (sağ yarımküre). Veriler ortalama ± SEM olarak sunulur; sahte için n = 4, ABCS fareleri için n = 4. Kısaltmalar: ABCS = asimetrik bilateral ortak karotis arter darlığı; Su aygırı = hipokampus; EC = dış kapsül; IC = iç kapsül; CC = korpus kallozum; Str = striatum; DEC = yönlü olarak kodlanmış renk; DTI = difüzyon tensör görüntüleme; FA = fraksiyonel anizotropi; MD = ortalama yayılım; AD = eksenel yayılım; RD = radyal yayılım. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
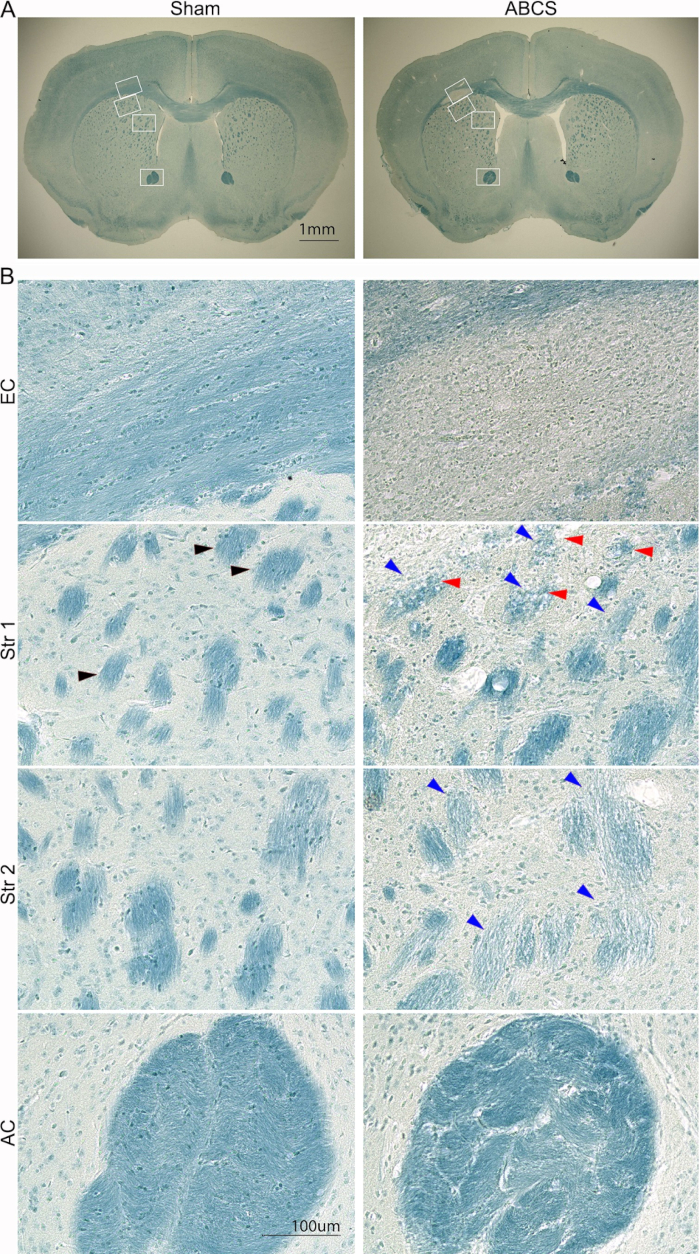
Şekil 5: İğne ABCS ameliyatından 6 hafta sonra beyin dilimlerinin temsili LFB boyaması. (A) Sahte ve ABCS farelerinden LFB lekelenmesinin düşük güçlü görüntüleri. Beyaz kutular, B'deki daha yüksek çözünürlüklü görüntülere karşılık gelen konumu belirtir. (B) EC (üst panel) ve Str konumları 1 ve 2 (orta panel) ve AC'den (alt panel) yüksek çözünürlüklü görüntüler (200x). Siyah ok ucu normal bir lif demetini gösterir. Mavi ok uçları hasarlı bir elyaf demetine işaret ediyor. Kırmızı ok uçları, vakumlanmış lifleri gösterir. Ölçek çubukları = 1 mm (A), 100 μm (B). Kısaltmalar: ABCS = asimetrik bilateral ortak karotis arter darlığı; LFB = Luxol hızlı mavi; EC = dış kapsül; Str = striatum; AC = ön komissür. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
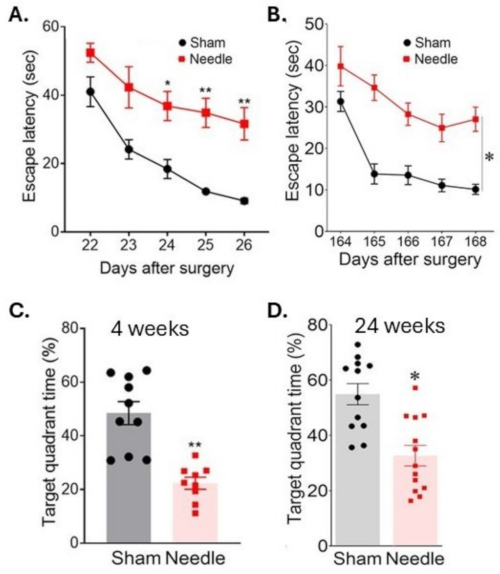
Şekil 6: Su labirenti testinde uzamsal öğrenme ve hafıza değerlendirmesi. Uzamsal öğrenme, (A) ameliyattan 3 hafta ve (B) ameliyattan 24 hafta sonra, ardışık günlerde platformu bulma süresi ölçülerek değerlendirildi. Hafıza, ameliyattan 4 hafta sonra (C) ve (D) 24 hafta sonra, platform çıkarıldıktan sonra hedef kadranda geçirilen süre ölçülerek değerlendirildi. Ameliyat, bilişsel işlevlerin uzun süreli bozulmasına neden oldu. Veriler ortalama ± SEM, *p < 0.05 iğneye karşı sahte; **p < 0.01'e karşı sahte; iki yönlü ANOVA ve Neuman-Keuls post hoc. SHAM için n = 10, iğne grupları için n = 10. Bu rakam Weng ve ark.11'den değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Asimetrik CCA stenozu kullanan çeşitli VCID indüksiyon yöntemleri tanımlanmıştır ve bunların tümü, CCA'nın vagus sinirinden ve kılıfından önemli ve kritik bir cerrahi adım izolasyonunu ve CCA'nın stenoz için erişilebilir hale getirilmesi için maruz kalmasını paylaşır. Ligasyondan önce CCA'ların cerrahi maruziyeti hakkında kaliteli görsel rehberlik sağlarken, araştırmacıları diğer fare ve sıçan ameliyatları bağlamında çevrimiçi olarak mevcut olan CCA izolasyonu hakkında ek videoları izlemeye yönlendirmek istiyoruz 15,16,17,18. Beyne oksijenli kan sağlayan ana arter olduğu için CCA'yı sıkıştırmamak veya yırtmamak için ekstra özen gösterilmelidir.
Ameliyatın ustalaşılması gereken bir diğer kritik adımı, gevşek bir düğüm hazırlamak ve iğne ile CCA çevresinde daha da sıkılaştırmak ve ardından iğnenin çıkarılmasıdır. Anestezi uygulanmış bir farede gerçekleştirmeye çalışmadan önce bu adımı yalnızca iğne ile uygulamanızı şiddetle tavsiye ederiz. Bu, hassas forseps hareketlerinde ustalaşmaya ve fareye zarar verme riski olmadan dikişlerle manipülasyonları mükemmelleştirmeye izin verecektir. İğnenin çıkarılması sırasında düğümün dağılmadan iyi bir şekilde sabitlenmesi, iğneyi tutacak kadar sıkı, ancak iğnenin forseps kullanılarak düğümlü dikişten uzaklaştırılmasını sağlayacak kadar gevşek olması gerekir.
Daha da önemlisi, her CCA'nın tek bir ligasyonunun kan akışını güvenilir bir şekilde azaltmak ve uzun süreli serebral hipoperfüzyonu sürdürmek için yeterli olmadığını bulduk11. Olası bir açıklama, tek bir ligasyonun, basınçta yerel bir artışa neden olması muhtemel olan ve kan akışının azalmasını telafi etmek için kan akış hızının artmasına yol açan nokta darlığına neden olması olabilir. Bir darlık parçası oluşturmak için birbirinden ~ 1 mm aralıklarla üç ligasyon yapmanızı öneririz. Üç ligasyon kullanmanın ek bir yararı, ek iğne çıkarma sırasında düğümlerden birinin gevşemesi durumunda düğümlerin bir prova mekanizması görevi görmesidir. Gerçekten de, aynı CCA'nın üç ayrı ligasyonunun neden olduğu bir stenoz parçası, model tutarlılığını arttırır ve farelerin yaklaşık% 90'ında kalıcı serebral hipoperfüzyona yol açar. Ayrıca, fragman darlığı, insan hastalarda aterosklerozun neden olduğu CCA darlığını odak noktası darlığına kıyasla daha kesin bir şekilde taklit eder ve böylece iğne modelinin klinik alaka düzeyini artırır.
CCA kan akışının kısmen geri kazanıldığından emin olmak için ilk ligasyonu bitirdikten sonra iğnenin derhal çıkarılmasını ve ancak bundan sonra sırayla ikinci ve üçüncü ligasyonlara geçilmesini şiddetle tavsiye ederiz. Her üç ligasyonun da iğne her üç düğümün içinde olacak şekilde bitirilmesi önerilmez, çünkü bu, kan akışının tamamen tıkanma süresini önemli ölçüde artıracaktır. Tipik olarak, iğneyi çıkarmadan önce 1 dakikadan fazla tam CCA oklüzyonu önermiyoruz. Bu öneri, farelerin her iki CCA'nın 60 saniye tıkanmasından 3 seans sonra herhangi bir fonksiyonel bozukluk belirtisi göstermediği raporuna dayanmaktadır19. Modelimizde, cerrah her seferinde bir CCA üzerinde çalışır, bu da her iki CCA'nın aynı anda tıkanmasından daha bağışlayıcıdır, ancak yine de her iki tarafta kronik hipoperfüzyon yerine uzun süreli oklüzyonun neden olduğu artefaktları dışlamak için bu zaman çizelgesini takip etmenizi öneririz.
Bu iğne modeli, çeşitli çaplarda iğneler kullanılarak (vücut ağırlığına veya kan akışı kısıtlamasının özel gereksinimlerine bağlı olarak) düğümlü sütürlerin çaplarının ayarlanmasına izin verirken, deneyimlerimize göre, sağ hemisferde hipoperfüzyon şiddetli olmaktan ziyade orta düzeyde olduğunda fareler daha yüksek sağkalım oranlarına sahipti. Öte yandan, sol hemisferde kalıcı şiddetli hipoperfüzyon uzun vadeli patolojik ve nörolojik sonuçlara neden oldu. Bu nedenle, sağ CCA'yı bağlamak için daha kalın bir iğne (sağ hemisferde orta derecede hipoperfüzyona neden olur) ve sol CCA'yı bağlamak için daha ince bir iğne (sol hemisferde ciddi hipoperfüzyona neden olur) kullanarak asimetrik bir ligasyon yapılmasını öneririz.
Son olarak, araştırmacılar, farklı fare suşlarının, esas olarak serebral vasküler anatomideki farklılıklar nedeniyle, iskemik veya travmatik hakaretten farklı sonuçlar üretebileceğinin farkında olmalıdır20,21. Günümüzde birçok çalışma yeni transgenik farelerin üretilmesini gerektirdiğinden, deneysel tasarımın herhangi bir aşamasında BCAO cerrahisi gerekiyorsa, arka plan suşu dikkatlice düşünülmelidir. Örneğin, hem C57BL / 6 hem de SV129 suşları, inme araştırması için transgenik hayvanlar üretmek için ortak bir arka plan seçimidir21. Bununla birlikte, C57BL / 6 farelerinin, SV129 fareleri de dahil olmak üzere test edilen diğer suşlara kıyasla iskemiye çok daha duyarlı olduğu iyi belgelenmiştir20,21. Aslında, murin suşunun etkisinin, VCID21'i indüklemek için kullanılan tekniğin etkisinden daha önemli olabileceğine dair kanıtlar vardır. Bu nedenle, kemirgenlerde iskemik beyin hasarına neden olmayı içeren tüm deneyler boyunca fare arka planlarını tutarlı tutmak kritik derecede önemli hale gelir. Daha da önemlisi, araştırmacılar, dahil etme kriteri olarak 0.5 puanla nörolojik skorlama sistemlerini22 kullanarak canlı hayvanlarda ameliyat sonucunun etkinliğini değerlendirebilirler. Beyin hasarı, küçük fokal hakaretten sonra bile beyin hasarına karşı çok hassas olan Iba1 immün boyama kullanılarak daha da doğrulanabilir.
Özetle, VCI'nin birçok klinik temsili ve nedeni aynı şemsiye altında birleştiren karmaşık bir terim olduğunu hatırlamak önemlidir. Bu nedenle, araştırmacılar, çalışmak istedikleri VCI yönlerine göre hangi modelin seçilmesi gerektiğini her zaman akıllarında tutmalıdır. Tüm VCI tezahürleri için asla tek bir evrensel model olamaz. CCA stenoz modelleri, ana arterlerden kan akışını ciddi şekilde sınırlar, böylece arteriosklerotik stenozlu hastaları taklit eder. C57BL / 6J farelerde asimetrik BCAS oluşturmak için yeni iğne yöntemi, daha önce bildirilen yöntemlere göre çeşitli avantajlar sunan VCID'yi taklit etmek için güvenilir bir yöntemdir (özellikle yüksek esneklik, düşük mortalite, uzun vadeli sonuçlar, minimum maliyet ve canlı MRG izleme). Diğer modellere göre avantajları nedeniyle, VCID ilerlemesi hakkındaki bilgimizi daha da ilerletmek için kullanılabilir ve ayrıca VCID'nin ilerlemesini iyileştirmek veya yavaşlatmak için potansiyel terapötik ajanların taranması için bir temel olarak kullanılabilir. BCAS'ın bildirilen diğer yöntemlerine benzer şekilde, iğne modeli, bu görsel gösteriyi bir kılavuz olarak kullanarak, zamanla ustalaşılabilecek ileri cerrahi beceriler gerektirir.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu proje, Ulusal Sağlık Enstitüleri / NINDS hibe RF1NS117509 (G. Cao) ve VA Merit Review hibeleri BX003923 ve BX006454 (G. Cao) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD | 309659 | IP injection of ketoprofen |
| 2.5 mm blunt retractor tips | Kent Scientific Corporation | SURGI-5016-2 | 2 needed |
| Andis Ion T-Blade Pet Trimmer | Andis | BTF3 | To shave fur |
| Betadine Solution | Avrio Health L.P. | NDC 67618-150-17 | |
| Braided silk suture, 5-0 | Teleflex Medical | 106-S | For suturing skin |
| Braided silk suture, 7-0 | Teleflex Medical | 103-S | For ligating CCAs |
| Camera | Med Associates, Inc | VID-CAM-MONO-7 | For model validation |
| cover glass | Fisherbrand | 12-541-012 | For model validation |
| cresyl violet | Thermo Scientific | C581-25 | For model validation |
| Dispensing Tip, Needle, Flex, 34 Gauge, 1/4" OAL | Jensen Global | JG34-0.25HPX | For the left CCA |
| DSIStudio | https://dsi-studio.labsolver.org; for DTI data analysis | ||
| Dumont Tweezers; Pattern #1 | Roboz Surgical Instrument Co | RS-4960 | 2 needed |
| Dumont Tweezers; Pattern #5, 45 Degree Angle | Roboz Surgical Instrument Co | RS-5058 | 2 needed |
| Ethanol | Fisher Scientific | 64-17-5 | Dilute to 70% |
| ethylene glycol | Thermo Scientific | E178-4 | For model validation |
| Eye Needle, Size #4; 3/8 Circle, Cutting Edge, 11 mm Chord Length | Roboz Surgical Instrument Co | RS-7981-4 | For suturing skin |
| E-Z Anesthesia Classic System | E-Z systems | EZ-7000 | |
| glycerol | Thermo Scientific | AAA16205AP | For model validation |
| Homeothermic Monitoring System | Harvard Bioscience | K 022258 | |
| Imaging system EVOS FL Auto | Life Technologies | AMAFD2000 | For model validation |
| Isoflurane | Covetrus | 11695-6777-2 | |
| Ketoprofen | Zoetis | 5487 | |
| Leica M320 F12 clinic and surgery microscope | Leica | M320 F12 | |
| Lidocaine and Prilocaine Cream, USP 2.5%/2.5% | Padagis | NDC 0574-2042-30 | Generic to EMLA cream |
| lithium carbonate | Thermo Scientific | L119-500 | For model validation |
| Luxol fast blue | Thermo Scientific | AC212170250 | For model validation |
| microscope slides | Fisherbrand | 12-550-403 | For model validation |
| Microtome | Leica | SM2010R | For model validation |
| Morris Water Maze with the hidden platform | Maze Engineers | https://maze.conductscience.com/portfolio/morris-water-maze/ | |
| M-Prove Portable Balance | Sartorius | AY711 | Scales for weiging the mouse |
| MRI with ParaVision 6.0.1 | Bruker | AV3HD 9.4T | For model validation |
| Multi gas flow meter | Aalborg Instruments | GMR2-010334 | for low flow rate gas blending (N2O and O2) |
| Nano Ultra Fine Pen Needles - 32G 4mm | BD | 58320883 | For the right CCA |
| O.C.T. | Thermo Scientific | 23-730-571 | For model validation |
| Paraformaldehyde, 4% | Thermo Scientific | J61899.AK | For model validation |
| PBS | Thermo Scientific | BP399500 | For model validation |
| PeriCam PSI System with Aperiflux probe holder | Perimed Inc | PeriCam PSI HR | For model validation |
| permount | Thermo Scientific | SP15-100 | For model validation |
| Round Handle Forceps; Micro Suturing With Tying Platform; Curved | Roboz Surgical Instrument Co | RS-5264 | To help with cutting and suturing the skin |
| Small Animal Heat Lamp, 75 Watt | Morganville Scientific | HL0100 | For model validation |
| Small cotton-tipped applicators | Fisher Scientific | 23-400-118 | |
| Spring Scissors - 8mm Cutting Edge | Fine Science tools | 15024-10 | |
| Student Halsey Needle Holder | Fine Science tools | 91201-13 | 3 needed: 2 for holding skin retractors and 1 for suturing the skin |
| Sucrose | Thermo Scientific | A15583.36 | For model validation |
| Universal Camera Ceiling Mount | Med Associates, Inc | ENV-598 | For model validation |
| water bath | VWR | 89032-226 | For model validation |
Referanslar
- Tuo, Q. Z., Zou, J. J., Lei, P. Rodent models of vascular cognitive impairment. J Mol Neurosci. 71 (5), 1-12 (2021).
- Zhou, Z., et al. Deeper cerebral hypoperfusion leads to spatial cognitive impairment in mice. Stroke Vasc Neurol. 7 (6), 527-533 (2022).
- Shibata, M., Ohtani, R., Ihara, M., Tomimoto, H. White matter lesions and glial activation in a novel mouse model of chronic cerebral hypoperfusion. Stroke. 35 (11), 2598-2603 (2004).
- Hattori, Y., et al. A novel mouse model of subcortical infarcts with dementia. J Neurosci. 35 (9), 3915-3928 (2015).
- Janson, J., et al. Increased risk of type 2 diabetes in Alzheimer disease. Diabetes. 53 (2), 474-481 (2004).
- Herzig, M. C., et al. Abeta is targeted to the vasculature in a mouse model of hereditary cerebral hemorrhage with amyloidosis. Nat Neurosci. 7 (9), 954-960 (2004).
- Miao, J., et al. Cerebral microvascular amyloid beta protein deposition induces vascular degeneration and neuroinflammation in transgenic mice expressing human vasculotropic mutant amyloid beta precursor protein. Am J Pathol. 167 (2), 505-515 (2005).
- Moechars, D., et al. Early phenotypic changes in transgenic mice that overexpress different mutants of amyloid precursor protein in brain. J Biol Chem. 274 (10), 6483-6492 (1999).
- Wallays, G., et al. Notch3 Arg170Cys knock-in mice display pathologic and clinical features of the neurovascular disorder cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy. Arterioscler Thromb Vasc Biol. 31 (12), 2881-2888 (2011).
- Cognat, E., Cleophax, S., Domenga-Denier, V., Joutel, A. Early white matter changes in CADASIL: evidence of segmental intramyelinic oedema in a pre-clinical mouse model. Acta Neuropathol Commun. 2, 49(2014).
- Weng, Z., et al. A novel needle mouse model of vascular cognitive impairment and dementia. J Neurosci. 43 (44), 7351-7360 (2023).
- Biesbroek, J. M., Biessels, G. J. Diagnosing vascular cognitive impairment: Current challenges and future perspectives. Int J Stroke. 18 (1), 36-43 (2023).
- Winklewski, P. J., et al. Understanding the physiopathology behind axial and radial diffusivity changes-what do we know. Front Neurol. 9, 92(2018).
- Jing, Z., et al. Neuronal NAMPT is released after cerebral ischemia and protects against white matter injury. J Cereb Blood Flow Metab. 34 (10), 1613-1621 (2014).
- Yang, S. T., et al. Adult mouse venous hypertension model: common carotid artery to external jugular vein anastomosis. J Vis Exp. (95), e50472(2015).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387(2013).
- Lee, D., et al. A murine model of ischemic retinal injury induced by transient bilateral common carotid artery occlusion. J Vis Exp. (165), (2020).
- Schleimer, K., et al. Training a sophisticated microsurgical technique: interposition of external jugular vein graft in the common carotid artery in rats. J Vis Exp. (69), e4124(2012).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387(2013).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Wellons, J. C., et al. A comparison of strain-related susceptibility in two murine recovery models of global cerebral ischemia. Brain Res. 868 (1), 14-21 (2000).
- Cao, G., et al. In Vivo delivery of a Bcl-xL fusion protein containing the TAT protein transduction domain protects against ischemic brain injury and neuronal apoptosis. J Neurosci. 22 (13), 5423-5431 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır