Method Article
Un modèle murin de déficience cognitive vasculaire et de démence basé sur la sténose bilatérale asymétrique de l’artère carotide commune guidée par aiguille
Dans cet article
Résumé
La méthode de l’aiguille de la sténose asymétrique bilatérale de l’artère carotide commune est proposée pour créer un modèle murin de déficience cognitive vasculaire et de démence. Elle donne des résultats à plus long terme par rapport aux modèles précédemment établis et est compatible avec l’IRM en direct. La représentation visuelle démontrant la procédure fournit des conseils pour maîtriser la chirurgie.
Résumé
Les troubles cognitifs vasculaires et la démence (VCID) résultent d’une lésion cérébrale vasculaire. Compte tenu de la forte incidence du VCID, qui devrait continuer à augmenter à mesure que la population vieillit, il est essentiel d’établir un modèle animal robuste pour la maladie. Cet article présente une nouvelle méthode de création d’un modèle murin de VCID basée sur une sténose bilatérale asymétrique de l’artère carotide commune, qui imite l’hypoperfusion cérébrale chronique humaine causée par l’athérosclérose carotidienne.
En bref, les artères carotides communes (ACC) sont ligaturées à des aiguilles de calibre différent (32 G pour l’ACC droit et 34 G pour l’ACC gauche) à l’aide de sutures en soie 7-0 suivies d’un retrait immédiat de l’aiguille. Les anneaux de suture restants provoquent une réduction persistante du flux sanguin et des troubles cognitifs à long terme associés à des lésions de la substance blanche, des micro-infarctus et une gliose réactive, imitant ainsi étroitement la pathogenèse du VCID. Il est important de noter que dans ce modèle d’aiguille, les représentations cliniques ne s’inversent pas avec le temps, ce qui fournit une déficience cognitive fiable à long terme. De plus, le taux de survie 24 semaines après la chirurgie était de 81,6 %, ce qui est plus élevé que celui des autres modèles établis de VCID avec un niveau similaire de réduction du flux sanguin.
Parmi les autres avantages, citons le faible coût des matériaux et la compatibilité avec l’IRM pour surveiller les lésions cérébrales chez les animaux vivants, car aucun métal n’est implanté. Le principal défi de l’utilisation du modèle d’aiguille du VCID est la nécessité de développer des compétences chirurgicales avancées, car les ACC de souris ont un diamètre inférieur à 0,6 mm et sont très fragiles. Une représentation visuelle de haute qualité de la chirurgie aidera donc les chercheurs à maîtriser cette technique et à faire progresser notre compréhension du VCID, ce qui pourrait conduire au développement de nouvelles modalités thérapeutiques pour diminuer le déclin cognitif dévastateur associé au VCID.
Introduction
Les troubles cognitifs vasculaires et la démence (VCID) sont la deuxième cause de déclin cognitif. Malgré les progrès indéniables qui ont été réalisés dans la compréhension de la pathogenèse du VCID et de ses facteurs de risque, le mécanisme de la façon dont le dysfonctionnement neurovasculaire contribue au déclin des capacités cognitives reste vague. Un certain nombre de modèles de rongeurs de complexité variable ont été établis pour induire une ischémie cérébrale afin d’imiter les représentations cliniques du VCID1 humain. Certains de ces modèles sont basés sur la création d’une hypoperfusion cérébrale transitoire ; cependant, la plupart d’entre eux sont générés par l’induction d’une hypoperfusion cérébrale chronique, le principal mécanisme qui conduit à la VCID chez les patients humains2.
L’hypoperfusion cérébrale chronique peut être introduite par occlusion bilatérale de l’artère carotide (BCAO), qui entraîne des résultats graves, mais souvent mortels, ou par sténose bilatérale de l’artère carotide (BCAS). Le BCAS est généralement réalisé à l’aide de l’une des deux méthodes suivantes : en plaçant des microbobines identiques autour des deux ACC, ce qui entraîne une sténose symétrique3 ; ou en implantant un constricteur améroïde et une microbobine autour des CCA gauche et droit, respectivement, provoquant une occlusion progressive et une réduction du flux sanguin de ~50 % sur les CCA gauche et droit, correspondant à4. Les inconvénients des deux méthodes sont un taux de mortalité élevé si la sténose est trop sévère ou si l’ACC est occlus, et l’incompatibilité avec l’IRM d’animaux vivants en raison de la présence de métal dans le corps. Quelques modèles génétiques de souris ont également été établis 1,5,6,7,8. D’autres options comprennent l’artériopathie cérébrale autosomique dominante avec infarctus sous-corticaux et la leucoencéphalopathie chez la souris 9,10. Néanmoins, aucun des modèles proposés n’imite la gamme complète des lésions ischémiques présentées chez les patients humains, et par conséquent, la recherche de modèles VCID mis à jour se poursuit.
Cet article présente une nouvelle méthode chirurgicale d’induction d’une sténose de l’artère carotide commune (ABCS) bilatérale asymétrique chez la souris, où la sténose de l’ACC est réalisée à l’aide de sutures en soie et est contrôlée par la ligature des CCA à des aiguilles de différents diamètres suivie d’un retrait immédiat de l’aiguille11. En conséquence, des anneaux de suture de diamètres précis sont laissés en permanence sur les ACC pour assurer la sténose chronique. L’avantage d’utiliser l’ABCS par rapport à une méthode symétrique est qu’une hypoperfusion modérée à droite assure une meilleure survie tandis qu’une hypoperfusion plus prononcée à gauche assure des représentations neurologiques et pathologiques à long terme. Ce modèle à aiguille présente plusieurs avantages par rapport aux modèles BCAS traditionnels11 , tels que des résultats persistants, une mortalité plus faible, un coût ultra-faible, une flexibilité et la possibilité d’utiliser des approches analytiques spéciales.
Pour élaborer sur ces avantages, trois ligatures provoquent un fragment de sténose CCA plutôt qu’une sténose du point focal, entraînant une hypoperfusion persistante, des lésions de la substance blanche et un déclin cognitif chez ~90 % des souris. La mortalité des souris aiguille était de ~17 %, inférieure à celle du modèle4 de restricteur/microbobine améroïde de Hattori, qui a une mortalité de ~30 % sur 16 semaines sur la base de notre expérience. Chaque modèle BCAS coûte généralement environ 100 $ en raison des microbobines ou des restricteurs améroïdes coûteux, tandis que le modèle à aiguille ne coûte qu’environ 1 $ par souris. De plus, la jauge des aiguilles pourrait être modifiée en fonction des exigences spécifiques à la recherche pour la restriction du flux sanguin de chaque côté. Dans la variante présentée dans le présent article, le modèle d’aiguille imite la physiopathologie de la sténose carotidienne sévère, causée par une sténose permanente unilatérale sans occlusion, qui est la représentation la plus courante de la maladie en clinique11. De plus, les restricteurs améroïdes et les microbobines utilisés dans les modèles BCAS traditionnels sont en métal, ce qui peut causer des artefacts importants si l’IRM in vivo est effectuée, même si le métal n’est pas implanté dans le cerveau mais dans la poitrine. Il peut être difficile de prédire comment exactement la présence de métal affecterait l’imagerie.
En général, l’IRM in vivo réalisée après l’implantation de microbobines est généralement une imagerie anatomique simple, qui ne convient pas à l’analyse quantitative de plusieurs agressions, ce qui est hautement souhaitable pour la recherche VCID. En revanche, le modèle d’aiguille présenté ici n’utilise que des sutures en soie et est entièrement compatible avec tout type d’IRM in vivo. Ceci est important pour deux raisons : (1) l’IRM est extrêmement sensible aux petites lésions cérébrales, aux microsaignements ou à la sidérose superficielle12, elle est donc préférée aux autres méthodes d’analyse, telles que la tomodensitométrie (2) L’IRM in vivo devrait être préférée à l’IRM ex vivo , car la recherche VCID peut sans aucun doute bénéficier du suivi de la dynamique de la progression/guérison des lésions, en particulier en réponse aux nouveaux traitements proposés. De plus, l’IRMf fonctionnelle peut être réalisée dans le modèle d’aiguille pour fournir des informations essentielles sur l’intégrité du couplage neurovasculaire en réponse à l’hypoperfusion cérébrale. Ainsi, la possibilité d’utiliser l’IRM in vivo ouvre la voie à une analyse approfondie de la corrélation complexe entre la taille et la localisation des lésions et la fonction cognitive, ainsi que le couplage neurovasculaire, en particulier dans les études pharmacodynamiques.
Protocole
Tous les protocoles sur les animaux ont été approuvés par l’Institutional Animal Care and Use Committee de l’Université de Pittsburgh et exécutés conformément au Guide des National Institutes of Health pour le soin et l’utilisation des animaux de laboratoire. Des techniques stériles doivent être maintenues dans toutes les chirurgies de survie. Des souris mâles C57BL/6J âgées de douze semaines et pesant entre 25 et 30 g ont été utilisées dans les expériences présentées.
1. Préparation du matériel et de l’espace de travail
- Préparez les fragments d’aiguille (~4 mm de long ; 32 G pour l’ACC droit et 34 G pour l’ACC gauche). Émoussez légèrement l’extrémité pointue des aiguilles en tapotant soigneusement l’extrémité pointue contre une surface dure et séparez soigneusement les aiguilles des morceaux de plastique à l’aide d’un porte-aiguille. Sutures en soie 7-0 prédécoupées en morceaux de 1 à 2 cm de long.
- Stérilisez les instruments chirurgicaux, les fragments d’aiguilles et les sutures par autoclave ou toute autre méthode appropriée.
2. Réalisation de l’opération
- Pesez la souris et induisez l’anesthésie en plaçant la souris pendant 2-3 min dans une chambre ventilée avec 3 % d’isoflurane dans un mélange de 25 % d’O2 et 72 % de N2O.
- Placez la souris (face ventrale vers le haut) sur un coussin chauffant recouvert d’une feuille chirurgicale stérile pour maintenir une température corporelle constante (37 °C) et fixez un masque facial pour la ventilation avec 1 % d’isoflurane dans un mélange de 25 % d’O2 et de 74 % de N2O. Fixez les membres de la souris avec du ruban adhésif.
- Rasez la fourrure sur le cou avec un rasoir électrique. Nettoyez les cheveux fins avec du ruban adhésif ou un aspirateur à clavier.
- Désinfectez le site chirurgical avec une solution de bétadine (10 % d’iode). Déiodez la peau avec de l’éthanol à 70 %. Répétez la désinfection 3 fois. S’assurer que le niveau d’anesthésie est adéquat par une absence de réponse à un pincement ferme de l’orteil (réflexe de pédale).
- Drapez la zone chirurgicale. Ensuite, faites une incision médiane verticale le long de la trachée et séparez les glandes thyroïdes bilatérales à l’aide d’une micro-pince. Retirez la peau et les tissus à l’aide de petits écarteurs cutanés stériles.
- Au microscope, utilisez une pince à épiler coudée pour exposer soigneusement et disséquer l’un des ACC du nerf vague et de la gaine. Utilisez de l’eau stérile ou une solution saline tamponnée au phosphate (PBS) pour mouiller le site d’incision si l’ACC a tendance à coller à la pince. Placez une petite seringue en plastique sous le cou pour soutenir la posture si nécessaire.
REMARQUE : Faites très attention à ne pas rompre le CCA. - Enfilez trois fragments de suture de soie prédécoupés (taille 7-0) sous le CCA (à 1 mm d’intervalle) à l’aide d’une pince à épiler.
- Dessinez un double nœud très lâche autour de l’ACC sur l’un des fragments de suture.
REMARQUE : Mouiller le site chirurgical et les sutures avec de l’eau stérile ou du PBS peut aider à rédiger un nœud. - Placez un fragment d’aiguille (32 G pour le CCA droit et 34 G pour le CCA gauche) parallèlement au CCA, à l’intérieur du nœud lâche (Figure 1A). Serrez soigneusement le nœud primaire autour de l’aiguille et de l’ACC jusqu’à ce qu’aucun flux sanguin ne soit observé et fixez-le avec un nœud secondaire. Retirez immédiatement l’aiguille pour rétablir une circulation sanguine partielle et coupez les extrémités de la suture.
REMARQUE : Le chirurgien doit être très prudent lors de la coupe des extrémités de la suture une fois les nœuds terminés. Couper trop près du nœud peut entraîner le desserrage du nœud. De plus, il est essentiel d’observer le CCA après avoir retiré l’aiguille pour s’assurer que le flux sanguin est toujours activé en aval du nœud. Si le CCA semble très pâle après le retrait de l’aiguille, cela signifie que le CCA est surcompressé. - Répétez les étapes 2.8 et 2.9 pour les 2e et 3e fils de suture sur le même CCA, à environ 1 mm l’un de l’autre (figure 1B).
- Répétez les étapes 2.6 à 2.10 avec l’ACC opposé à l’aide d’un fragment d’aiguille de 32 G.
- Examinez attentivement si les deux ACC sont efficacement ligaturés : vérifiez que les trois bandes de suture sont solidement nouées en place, mais qu’elles ne sont pas trop serrées pour ne pas bloquer complètement la circulation sanguine (vérifiez que les ACC ne sont pas pâles en aval des nœuds). Vérifiez que les trois bandes de suture de chaque ACC sont espacées d’environ 1 mm les unes des autres.
- Fermez la peau à l’aide de sutures monofilaments stériles.
- Immédiatement après la chirurgie, injecter 100 à 150 μL de kétoprofène (1 mg/mL de stock ; 5 mg/kg de poids corporel) par voie intrapéritonéale pour soulager la douleur postopératoire. Répétez cette injection 24 h et 48 h après l’intervention.
- Placez la souris sur une couverture homéothermique à 37 °C pour une surveillance continue pendant 2 h avant de ramener l’animal à l’animalerie.
REMARQUE : Pour la procédure fictive, les étapes 2.7 à 2.12 doivent être omises.
3. Validation du modèle
REMARQUE : Les lésions cérébrales ont été analysées par IRM in vivo et vérifiées par la coloration Luxol fast blue (LFB) et des tests comportementaux.
- Imagerie de la perfusion sanguine cérébrale.
- Anesthésier la souris à l’aide de 1 à 1,5 % d’isoflurane. Stérilisez le site chirurgical avec une solution de bétadine (10 % d’iode). Ensuite, déiodez la peau avec de l’éthanol à 70 %.
- Fixez le crâne de l’animal dans un cadre stéréotaxique. Faites une incision saggitale médiane dans le cuir chevelu de l’os frontal à l’os occipital pour exposer le crâne et nettoyer la surface du crâne avec une solution saline stérile.
- Placez une caméra à couplage chargé à 10 cm au-dessus du crâne à l’aide d’un système de chatoiement laser bidimensionnel. Placez un support de sonde sur le site de la craniectomie et fixez-le fermement.
- Prenez des images de perfusion sanguine 5 minutes avant la chirurgie et immédiatement après le relâchement de l’aiguille ou 7, 14, 21, 28, 35 et 42 jours après la chirurgie.
- Fermez la peau à l’aide de sutures monofilaments stériles. Injecter 100 à 150 μL de kétoprofène (1 mg/mL stock ; 5 mg/kg de poids corporel) par voie intrapéritonéale pour soulager la douleur postopératoire. Répétez cette injection 24 h et 48 h.
- In vivo IRM
- Anesthésie les souris à l’aide de 1 à 1,5 % d’isoflurane, la respiration est surveillée en permanence et la température est maintenue à 37 °C avec de l’air chaud pendant l’acquisition de l’image.
- Effectuez une IRM in vivo à l’aide d’un scanner 9,4T, d’une bobine Tx de 86 mm et d’un réseau de récepteurs cerveaux de souris à 4 canaux, en exécutant le logiciel associé. Après le positionnement et les balayages pilotes, acquérez des images pondérées T2 (T2WI) à l’aide d’une séquence RADE (Rapid Acquisition with Relaxation Enhancement), avec les paramètres suivants : Temps d’écho/Temps de répétition (TE/TR) = 40/4 000 ms, moyennes = 8 256 × matrice 256, 16 coupes d’une épaisseur de tranche de 0,5 mm, un facteur RARE = 4 et un champ de vision (FOV) de 20 x 20 mm.
- Collectez des données d’imagerie à tenseur de diffusion (DTI) à l’aide d’une séquence d’imagerie EPI-DTI utilisant la même géométrie et les mêmes paramètres que le T2WI, avec les exceptions suivantes : TR/TE = 2 300/22 ms, matrice d’acquisition = 128 x 128, 2 segments, 5 images A0 et 30 images de diffusion non colinéaires, Δ/δ = 10/3 ms et une valeur b = 1 000 s/mm2.
- Analysez les données DTI à l’aide du logiciel DSI Studio (http://dsistudio.labsolver.org/), en recherchant les différences dans les paramètres scalaires de diffusion (anisotropie fractionnelle (FA), diffusivité moyenne (MD), diffusivité axiale (AD) et diffusivité radiale (RD)). Dessinez des régions d’intérêt (ROI) pour le corps calleux (CC), la capsule externe (EC), la capsule interne (IC), la fimbrie, la commissure antérieure (AC), le cingulum (Cing), l’hippocampe (hippopotame), le cortex (C) et le striatum (Str) des deux hémisphères.
- Coloration Luxol fast blue (LFB)
- Préparez des coupes de cerveau : fixez le cerveau avec 4 % de PFA pendant 24 h, puis plongez le cerveau dans 30 % de saccharose jusqu’à ce que le cerveau coule. Intégrez le cerveau dans un composé OCT sur de la glace sèche. Découpez une tranche de cerveau coronal de 20 m d’épaisseur sur un microtome coulissant. Conservez les tranches de cerveau dans une solution de stockage (30 % de glycérol / 30 % d’éthylène glycol dans du PBS).
- Immergez les sections cérébrales dans une solution d’alcool à 0,1 %, maintenez-la à 56 °C pendant la nuit et lavez-vous à l’eau distillée.
- Incuber des sections de cerveau dans du carbonate de lithium à 0,05 % et déshydrater à travers des alcools gradués.
- Teindre les sections avec 0,5 % de violet crésylique pendant 5 min, différencié avec 70 % d’éthanol.
- Montez les sections de cerveau colorées avec un support de montage.
- Évaluation des fonctions cognitives à l’aide d’un test de labyrinthe aquatique de Morris modifié
- Remplissez un réservoir circulaire d’eau (25 °C, profondeur 33 cm) et immergez-le sur une plate-forme carrée en plexiglas de ~10 x 10 cm2 à 1,2 cm sous le niveau de l’eau, à 31 cm du bord nord, est, sud ou ouest de la piscine.
REMARQUE : Cette plateforme doit rester au même endroit pendant toute la durée du test. - Allumez une caméra vidéo montée au plafond. Placez une souris dans le réservoir (ne pas laisser tomber au niveau de l’eau), face au mur et en commençant par le nord-est, le sud-est, le sud-ouest ou le nord-ouest. Laissez la souris nager pendant un maximum de 90 s pour trouver une plate-forme immergée.
- Laissez la souris rester sur la plate-forme immergée pendant 30 s si la plate-forme est trouvée. Si la plate-forme n’est pas trouvée, placez-y la souris pendant 30 s.
- Laissez la souris se reposer pendant 5 minutes et répétez l’essai de natation (étapes 3.4.2 - 3.4.3) 2 fois.
- Séchez la souris avec un morceau de tissu et remettez-la dans sa cage sous une ampoule chauffante.
- Répétez trois essais de natation chaque jour pendant 5 jours consécutifs.
- À l’aide de séquences vidéo, calculez la latence pour vous échapper (combien de temps faut-il pour trouver la plateforme dans chaque essai).
- Le dernier jour du test, retirez la plate-forme et notez le temps que la souris passe dans le quadrant, où la plate-forme se trouvait auparavant.
- Remplissez un réservoir circulaire d’eau (25 °C, profondeur 33 cm) et immergez-le sur une plate-forme carrée en plexiglas de ~10 x 10 cm2 à 1,2 cm sous le niveau de l’eau, à 31 cm du bord nord, est, sud ou ouest de la piscine.
Résultats
Hypoperfusion cérébrale asymétrique à long terme
Le débit sanguin de l’ACC a été mesuré avant et immédiatement après la libération de l’aiguille de la dernière (troisième) ligature, comme décrit précédemment11. Le flux sanguin a été réduit de ~70 % dans l’ACC gauche et de ~50 % dans l’ACC droit. La perfusion sanguine cérébrale a été surveillée dynamiquement à l’aide d’un pointillé laser bidimensionnel. L’opération a provoqué une hypoperfusion cérébrale dans les deux hémisphères, l’hémisphère gauche étant plus gravement touché (Figure 2). L’hypoperfusion cérébrale est maintenue pendant au moins 24 semaines après la chirurgie11.
Baisse de la mortalité
Le taux de survie des souris mâles sur 6 semaines était de 81,6 % (figure 3) ; Les souris étaient plus sujettes à la mort au cours de la première semaine après la chirurgie.
Détection par IRM in vivo de lésions cérébrales
Les images pondérées en T2 ont révélé des régions hypo- ou hyper-intenses dans l’hippocampe (Hippo), la capsule externe (EC), la capsule interne (IC), le corps calleux (CC) et le striatum (Str) chez les souris soumises à une chirurgie ABCS, indiquant une lésion cérébrale (Figure 4A). Des dommages structurels ont été observés dans les cartes en couleurs codées directionnellement (DEC) des souris DTI des souris ABCS par rapport au simulacre (Figure 4B).
Les analyses quantitatives ont montré que les souris ABCS présentaient une anisotropie fractionnée (FA) significativement plus faible dans l’hippopotame gauche, la CI, la commissure antérieure (AC), le cingulum (Cg) et le Fimbria (Fi) par rapport au placebo (P < 0,05 par rapport au simulacre), indiquant une compromission de la microstructure de la substance blanche dans l’hémisphère gauche (panneau supérieur gauche, Figure 4C). Les FA dans le Cg droit et Fi chez les souris ABCS étaient également réduits (P < 0,05 contre placebo). Les FA chez les souris IC et Fi gauches étaient significativement plus faibles que celles de la droite chez les souris ABCS (P < 0,05, gauche contre droite).
De même, une diffusivité axiale (DA) significativement plus faible a été observée chez les souris EC, IC, Str et Fi gauches chez les souris ABCS par rapport aux souris placebo, suggérant une lésion axonale (panneau supérieur droit, Figure 4C (P < 0,05 par rapport au placebo)). Seul le Str gauche a montré une réduction moyenne de la diffusivité (DM) chez les souris ABCS par rapport aux souris placebos (panneau inférieur gauche, Figure 4C). Une différence de diffusivité radiale (DR) a été observée chez les souris CC gauches, Str et Fi chez les souris ABCS (panneau inférieur droit, Figure 4C), suggérant une inflammation et une augmentation de la cellularité dans ces régions13.
Lésions cérébrales asymétriques dans les deux hémisphères et lésions dans les régions de la substance blanche de l’hémisphère gauche
Les lésions cérébrales ont également été analysées avec une coloration LFB en utilisant la procédure décrite précédemment14 (Figure 5). Des images de plus faible puissance ont montré une coloration bleue plus claire dans EC et Str, suggérant une démyélinisation dans ces régions. Des images haute définition ont montré que les souris factices, bien organisées et myélinisées, présentaient des axones avec des oligodendrocytes linéaires orientés dans la CE ; cependant, les axones ont disparu et des cellules envahissantes et colorées en bleu ont été observées dans la CE chez les souris ABCS. Les souris Sham ont montré des structures de faisceaux de fibres bien organisées et colorées en bleu profond dans Str. Cependant, les faisceaux de fibres étaient plus clairs et plus petits, et leur intégrité était compromise ; certains faisceaux de fibres ont été vacuolisés chez les souris ABCS. Les faisceaux de fibres ont été déformés et la matrice inter-faisceaux a été considérablement épaissie en AC chez les souris ABCS. En résumé, la chirurgie ABCS provoque une démyélinisation et des lésions axonales ; Les lésions de la substance blanche se produisent principalement dans l’hémisphère gauche.
Apprentissage et dysfonctionnement de la mémoire
La chirurgie ABCS à l’aiguille a entraîné un trouble d’apprentissage important, comme l’indique une augmentation du temps nécessaire pour trouver une plate-forme submergée (latence pour s’échapper) lors d’un test de labyrinthe aquatique de Morris (figure 6). Cette invalidité s’est manifestée pendant au moins 24 semaines après l’opération. La mémoire a également été considérablement affectée, comme l’indique une diminution du temps passé dans le quadrant cible après le retrait de la plate-forme.
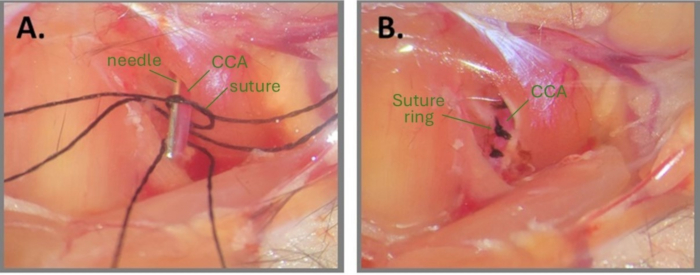
Figure 1 : Étapes de la chirurgie à l’aiguille pour créer l’ABCS. (A) L’ACC gauche est exposée, et trois sutures en soie sont enfilées sous l’ACC. Un nœud lâche est dessiné sur l’un des fragments de suture et l’aiguille est positionnée parallèlement au CCA. (B) Trois anneaux de suture sont positionnés à environ 1 mm l’un de l’autre. Abréviations : ABCS = sténose bilatérale asymétrique de l’artère carotide commune ; ACC = artère carotide commune. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Hypoperfusion cérébrale asymétrique persistante dans le modèle ABCS à aiguille. Surveillance dynamique du flux sanguin cérébral après l’opération. Une hypoperfusion cérébrale persistante peut être observée dans les deux hémisphères, étant plus profonde à gauche. Les astérisques noirs indiquent les régions d’hypoperfusion. Abréviation : ABCS = sténose bilatérale asymétrique de l’artère carotide commune. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Taux de survie après une chirurgie ABCS à l’aiguille. La chirurgie a entraîné un taux de survie de 81,6 % sur 6 semaines ; Le décès est survenu principalement au cours de la première semaine postopératoire. Abréviation : ABCS = sténose bilatérale asymétrique de l’artère carotide commune. Veuillez cliquer ici pour voir une version agrandie de cette figure.
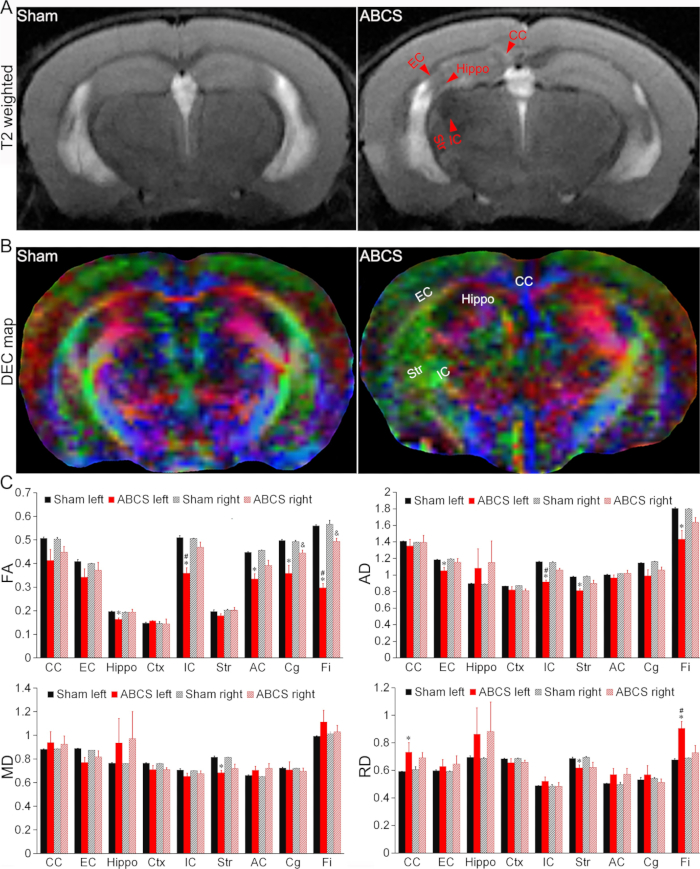
Figure 4 : Détection par IRM in vivo de lésions cérébrales dans le modèle ABCS à aiguille. (A) Images représentatives pondérées en T2 de souris placebo et ABCS. Les pointes de flèches rouges indiquent des régions hypo- ou hyper-intenses. (B) Carte DEC représentative du DTI in vivo 2 semaines après la chirurgie ABCS à l’aiguille. Les couleurs indiquent la directionnalité de l’axe principal de diffusion (rouge = gauche/droite, vert = dorsal/ventral et bleu = rostral/caudal). (C) Analyse quantitative chez les souris fictives et ABCS (ANOVA à un facteur). * représente p < 0,05 ABCS par rapport au placebo (hémisphère gauche). # représente p < 0,05 gauche contre droite. & représente p < 0,05 ABCS par rapport au simulacre (hémisphère droit). Les données sont présentées sous forme de ± moyenne SEM ; n = 4 pour les souris fictives, n = 4 pour les souris ABCS. Abréviations : ABCS = sténose bilatérale asymétrique de l’artère carotide commune ; Hippopotame = hippocampe ; EC = capsule externe ; IC = capsule interne ; CC = corps calleux ; Str = striatum ; DEC = couleur codée de manière directionnelle ; DTI = imagerie du tenseur de diffusion ; FA = anisotropie fractionnelle ; DM = diffusivité moyenne ; AD = diffusivité axiale ; RD = diffusivité radiale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
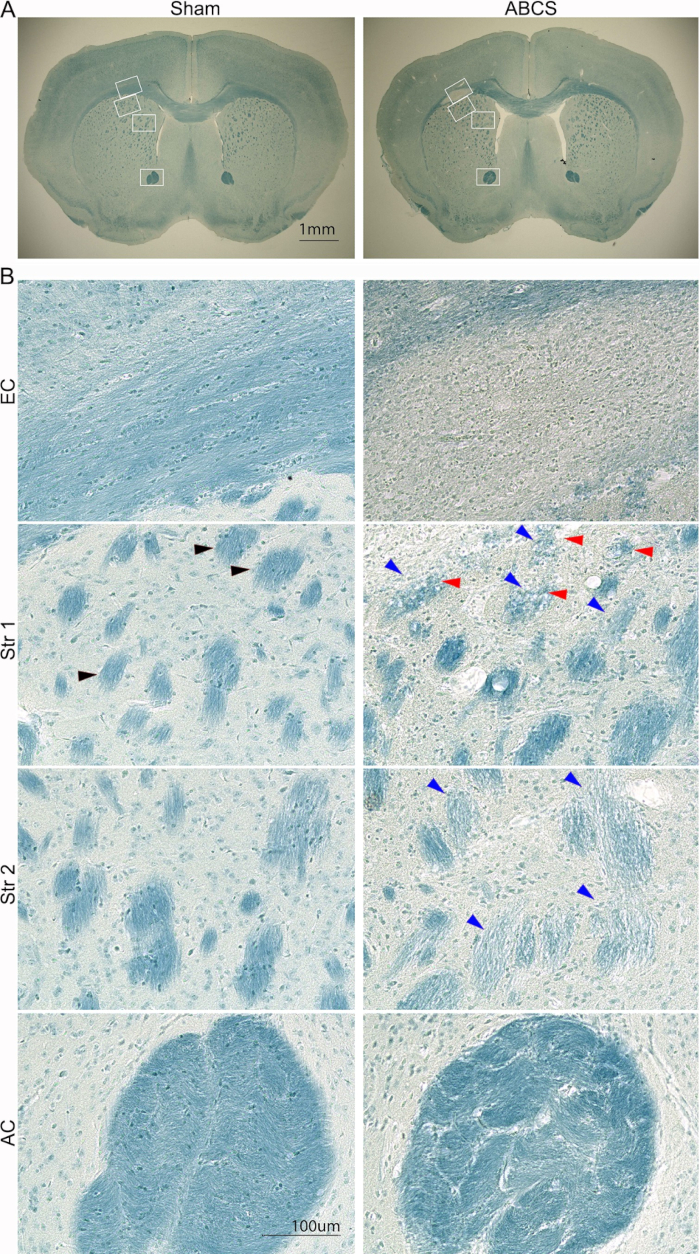
Figure 5 : Coloration LFB représentative des tranches de cerveau 6 semaines après la chirurgie ABCS à l’aiguille. (A) Images de faible puissance de coloration LFB de souris fictives et ABCS. Les cases blanches indiquent l’emplacement correspondant aux images de haute définition dans B. (B) Images haute définition (200x) à partir des emplacements EC (panneau supérieur) et Str 1 et 2 (panneau central) et AC (panneau inférieur). La pointe de flèche noire montre un faisceau de fibres normal. Les pointes de flèches bleues pointent vers un faisceau de fibres endommagé. Les pointes de flèches rouges indiquent les fibres vacuolisées. Barres d’échelle = 1 mm (A), 100 μm (B). Abréviations : ABCS = sténose bilatérale asymétrique de l’artère carotide commune ; LFB = Luxol bleu rapide ; EC = capsule externe ; Str = striatum ; AC = commissure antérieure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
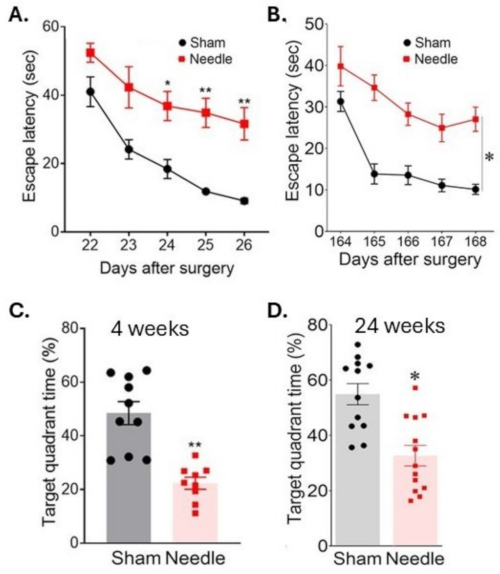
Figure 6 : Apprentissage spatial et évaluation de la mémoire dans le test du labyrinthe aquatique. L’apprentissage spatial a été évalué (A) 3 semaines et (B) 24 semaines après l’opération en mesurant le temps nécessaire pour localiser la plate-forme sur des jours consécutifs. La mémoire a été évaluée (C) 4 semaines et (D) 24 semaines après la chirurgie en mesurant le temps passé dans le quadrant cible après le retrait de la plateforme. La chirurgie a entraîné une perturbation à long terme des fonctions cognitives. Les données ont été exprimées en moyenne ± SEM, *p < 0,05 aiguille par rapport au placebo ; **p < 0,01 contre placebo ; ANOVA à deux facteurs et Neuman-Keuls post hoc. n = 10 pour le simulacre, n = 10 pour les groupes d’aiguilles. Cette figure a été modifiée à partir de Weng et al.11. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Plusieurs méthodes d’induction VCID utilisant la sténose asymétrique de l’ACC ont été décrites, et toutes partagent une étape chirurgicale importante et critique : l’isolement de l’ACC du nerf vague et de la gaine et l’exposition de l’ACC pour le rendre accessible à la sténose. Bien que nous fournissions des conseils visuels de bonne qualité sur l’exposition chirurgicale des ACC avant la ligature, nous aimerions également inviter les chercheurs à regarder des vidéos supplémentaires sur l’isolement des ACC qui sont disponibles en ligne dans le contexte d’autres chirurgies de souris et de rats 15,16,17,18. Des précautions supplémentaires doivent être prises pour ne pas comprimer ou rompre l’ACC car c’est l’artère principale qui alimente le cerveau en sang oxygéné.
Une autre étape critique de la chirurgie qui doit être maîtrisée consiste à dessiner un nœud lâche et à le resserrer davantage autour de l’ACC avec l’aiguille suivie d’un retrait de l’aiguille. Nous vous recommandons vivement de pratiquer cette étape avec l’aiguille seule avant d’essayer de l’effectuer sur une souris anesthésiée. Cela permettra de maîtriser les mouvements délicats des pinces et de perfectionner les manipulations avec les sutures sans risquer de blesser la souris. Le nœud doit être bien fixé sans se désagréger lors du retrait de l’aiguille, suffisamment serré pour tenir l’aiguille mais suffisamment lâche pour permettre de glisser l’aiguille loin de la suture nouée à l’aide d’une pince.
Il est important de noter qu’une seule ligature de chaque ACC n’est pas suffisante pour diminuer de manière fiable le flux sanguin et maintenir une hypoperfusion cérébrale à long terme11. Une explication potentielle pourrait être qu’une seule ligature provoque une sténose ponctuelle, qui est susceptible de provoquer une augmentation locale de la pression, entraînant une augmentation de la vitesse du flux sanguin pour compenser la réduction du flux sanguin. Nous recommandons d’effectuer trois ligatures à ~1 mm d’intervalle l’une de l’autre pour créer un fragment de sténose. Un avantage supplémentaire de l’utilisation de trois ligatures est que les nœuds servent de mécanisme de protection au cas où l’un des nœuds se détacherait lors du retrait supplémentaire de l’aiguille. En effet, un fragment de sténose causé par trois ligatures distinctes du même ACC augmente la cohérence du modèle, conduisant à une hypoperfusion cérébrale persistante chez environ 90 % des souris. De plus, la sténose fragmentaire imite plus précisément la sténose CCA causée par l’athérosclérose chez les patients humains par rapport à la sténose du point focal, augmentant ainsi la pertinence clinique du modèle d’aiguille.
Nous recommandons fortement de retirer rapidement l’aiguille après avoir terminé la première ligature pour s’assurer que le flux sanguin CCA est partiellement rétabli, puis de passer ensuite aux deuxième et troisième ligatures séquentiellement. Il n’est pas recommandé de terminer les trois ligatures avec l’aiguille à l’intérieur des trois nœuds, car cela augmenterait considérablement le temps d’obstruction complète de la circulation sanguine. En règle générale, nous ne recommandons pas plus de 1 minute d’occlusion complète de l’ACC avant de retirer l’aiguille. Cette recommandation est basée sur le rapport selon lequel les souris n’ont montré aucun signe de déficience fonctionnelle après 3 séances d’occlusion de 60 s des deux ACC19. Dans notre modèle, le chirurgien travaille sur un ACC à la fois, ce qui est plus indulgent que l’occlusion simultanée des deux ACC, mais nous recommandons tout de même de suivre cette chronologie pour exclure tout artefact causé par une occlusion prolongée plutôt que par une hypoperfusion chronique de chaque côté.
Bien que ce modèle d’aiguille permette d’ajuster les diamètres des sutures nouées en utilisant des aiguilles de différents diamètres (en fonction du poids corporel ou des exigences spécifiques de restriction du flux sanguin), d’après notre expérience, les souris avaient des taux de survie plus élevés lorsque l’hypoperfusion dans l’hémisphère droit était modérée plutôt que sévère. D’autre part, une hypoperfusion sévère persistante dans l’hémisphère gauche a produit des résultats pathologiques et neurologiques à long terme. Ainsi, nous recommandons d’effectuer une ligature asymétrique en utilisant une aiguille plus épaisse pour ligaturer l’ACC droit (provoquant une hypoperfusion modérée dans l’hémisphère droit) et une aiguille plus fine pour ligaturer l’ACC gauche (provoquant une hypoperfusion sévère dans l’hémisphère gauche).
Enfin, les chercheurs doivent être conscients que différentes souches de souris peuvent produire des résultats différents de l’agression ischémique ou traumatique, principalement en raison de différences dans l’anatomie vasculaire cérébrale20,21. Étant donné que de nombreuses études nécessitent aujourd’hui la génération de nouvelles souris transgéniques, la souche de fond doit être soigneusement prise en compte si une chirurgie BCAO est nécessaire à n’importe quelle étape de la conception expérimentale. Par exemple, les souches C57BL/6 et SV129 sont un choix de fond courant pour générer des animaux transgéniques pour la recherche sur l’AVC21. Cependant, il a été bien documenté que les souris C57BL/6 sont beaucoup plus sensibles à l’ischémie par rapport aux autres souches testées, y compris les souris SV129 20,21. En fait, il existe des preuves que l’effet de la souche murine peut être encore plus important que l’effet de la technique utilisée pour induire le VCID21. Ainsi, il devient extrêmement important de garder les arrière-plans des souris cohérents tout au long de toutes les expériences impliquant l’induction de lésions cérébrales ischémiques chez les rongeurs. Il est important de noter que les chercheurs peuvent évaluer l’efficacité du résultat de la chirurgie chez les animaux vivants à l’aide de systèmes de notation neurologique22 avec un score de 0,5 comme critère d’inclusion. Les lésions cérébrales peuvent être confirmées à l’aide de l’immunocoloration Iba1, qui est très sensible aux lésions cérébrales, même après une agression focale mineure.
En résumé, il est important de se rappeler que la VCI est un terme complexe qui réunit sous un même toit de nombreuses représentations et causes cliniques. Par conséquent, les chercheurs doivent toujours garder à l’esprit quel modèle doit être sélectionné en fonction des aspects VCI qu’ils souhaitent étudier. Il ne peut jamais y avoir un modèle universel unique pour toutes les manifestations VCI. Les modèles de sténose CCA limitent sévèrement le flux sanguin des artères principales, imitant ainsi les patients atteints de sténose artérioscléreuse. La nouvelle méthode à l’aiguille de création de BCAS asymétriques chez les souris C57BL/6J est une méthode fiable pour imiter le VCID qui offre plusieurs avantages par rapport aux méthodes précédemment rapportées (en particulier une flexibilité élevée, une faible mortalité, des résultats à long terme, un coût minimal et une surveillance IRM en direct). En raison de ses avantages par rapport aux autres modèles, il peut être utilisé pour faire progresser nos connaissances sur la progression du VCID et servir de base pour le dépistage d’agents thérapeutiques potentiels visant à guérir ou à ralentir la progression du VCID. À l’instar d’autres méthodes de BCAS, le modèle d’aiguille nécessite des compétences chirurgicales avancées qui peuvent être maîtrisées avec le temps, en utilisant cette démonstration visuelle comme guide.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce projet a été soutenu par les subventions RF1NS117509 des National Institutes of Health/NINDS (G. Cao) et les subventions d’examen du mérite des anciens combattants BX003923 et BX006454 (G. Cao).
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD | 309659 | IP injection of ketoprofen |
| 2.5 mm blunt retractor tips | Kent Scientific Corporation | SURGI-5016-2 | 2 needed |
| Andis Ion T-Blade Pet Trimmer | Andis | BTF3 | To shave fur |
| Betadine Solution | Avrio Health L.P. | NDC 67618-150-17 | |
| Braided silk suture, 5-0 | Teleflex Medical | 106-S | For suturing skin |
| Braided silk suture, 7-0 | Teleflex Medical | 103-S | For ligating CCAs |
| Camera | Med Associates, Inc | VID-CAM-MONO-7 | For model validation |
| cover glass | Fisherbrand | 12-541-012 | For model validation |
| cresyl violet | Thermo Scientific | C581-25 | For model validation |
| Dispensing Tip, Needle, Flex, 34 Gauge, 1/4" OAL | Jensen Global | JG34-0.25HPX | For the left CCA |
| DSIStudio | https://dsi-studio.labsolver.org; for DTI data analysis | ||
| Dumont Tweezers; Pattern #1 | Roboz Surgical Instrument Co | RS-4960 | 2 needed |
| Dumont Tweezers; Pattern #5, 45 Degree Angle | Roboz Surgical Instrument Co | RS-5058 | 2 needed |
| Ethanol | Fisher Scientific | 64-17-5 | Dilute to 70% |
| ethylene glycol | Thermo Scientific | E178-4 | For model validation |
| Eye Needle, Size #4; 3/8 Circle, Cutting Edge, 11 mm Chord Length | Roboz Surgical Instrument Co | RS-7981-4 | For suturing skin |
| E-Z Anesthesia Classic System | E-Z systems | EZ-7000 | |
| glycerol | Thermo Scientific | AAA16205AP | For model validation |
| Homeothermic Monitoring System | Harvard Bioscience | K 022258 | |
| Imaging system EVOS FL Auto | Life Technologies | AMAFD2000 | For model validation |
| Isoflurane | Covetrus | 11695-6777-2 | |
| Ketoprofen | Zoetis | 5487 | |
| Leica M320 F12 clinic and surgery microscope | Leica | M320 F12 | |
| Lidocaine and Prilocaine Cream, USP 2.5%/2.5% | Padagis | NDC 0574-2042-30 | Generic to EMLA cream |
| lithium carbonate | Thermo Scientific | L119-500 | For model validation |
| Luxol fast blue | Thermo Scientific | AC212170250 | For model validation |
| microscope slides | Fisherbrand | 12-550-403 | For model validation |
| Microtome | Leica | SM2010R | For model validation |
| Morris Water Maze with the hidden platform | Maze Engineers | https://maze.conductscience.com/portfolio/morris-water-maze/ | |
| M-Prove Portable Balance | Sartorius | AY711 | Scales for weiging the mouse |
| MRI with ParaVision 6.0.1 | Bruker | AV3HD 9.4T | For model validation |
| Multi gas flow meter | Aalborg Instruments | GMR2-010334 | for low flow rate gas blending (N2O and O2) |
| Nano Ultra Fine Pen Needles - 32G 4mm | BD | 58320883 | For the right CCA |
| O.C.T. | Thermo Scientific | 23-730-571 | For model validation |
| Paraformaldehyde, 4% | Thermo Scientific | J61899.AK | For model validation |
| PBS | Thermo Scientific | BP399500 | For model validation |
| PeriCam PSI System with Aperiflux probe holder | Perimed Inc | PeriCam PSI HR | For model validation |
| permount | Thermo Scientific | SP15-100 | For model validation |
| Round Handle Forceps; Micro Suturing With Tying Platform; Curved | Roboz Surgical Instrument Co | RS-5264 | To help with cutting and suturing the skin |
| Small Animal Heat Lamp, 75 Watt | Morganville Scientific | HL0100 | For model validation |
| Small cotton-tipped applicators | Fisher Scientific | 23-400-118 | |
| Spring Scissors - 8mm Cutting Edge | Fine Science tools | 15024-10 | |
| Student Halsey Needle Holder | Fine Science tools | 91201-13 | 3 needed: 2 for holding skin retractors and 1 for suturing the skin |
| Sucrose | Thermo Scientific | A15583.36 | For model validation |
| Universal Camera Ceiling Mount | Med Associates, Inc | ENV-598 | For model validation |
| water bath | VWR | 89032-226 | For model validation |
Références
- Tuo, Q. Z., Zou, J. J., Lei, P. Rodent models of vascular cognitive impairment. J Mol Neurosci. 71 (5), 1-12 (2021).
- Zhou, Z., et al. Deeper cerebral hypoperfusion leads to spatial cognitive impairment in mice. Stroke Vasc Neurol. 7 (6), 527-533 (2022).
- Shibata, M., Ohtani, R., Ihara, M., Tomimoto, H. White matter lesions and glial activation in a novel mouse model of chronic cerebral hypoperfusion. Stroke. 35 (11), 2598-2603 (2004).
- Hattori, Y., et al. A novel mouse model of subcortical infarcts with dementia. J Neurosci. 35 (9), 3915-3928 (2015).
- Janson, J., et al. Increased risk of type 2 diabetes in Alzheimer disease. Diabetes. 53 (2), 474-481 (2004).
- Herzig, M. C., et al. Abeta is targeted to the vasculature in a mouse model of hereditary cerebral hemorrhage with amyloidosis. Nat Neurosci. 7 (9), 954-960 (2004).
- Miao, J., et al. Cerebral microvascular amyloid beta protein deposition induces vascular degeneration and neuroinflammation in transgenic mice expressing human vasculotropic mutant amyloid beta precursor protein. Am J Pathol. 167 (2), 505-515 (2005).
- Moechars, D., et al. Early phenotypic changes in transgenic mice that overexpress different mutants of amyloid precursor protein in brain. J Biol Chem. 274 (10), 6483-6492 (1999).
- Wallays, G., et al. Notch3 Arg170Cys knock-in mice display pathologic and clinical features of the neurovascular disorder cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy. Arterioscler Thromb Vasc Biol. 31 (12), 2881-2888 (2011).
- Cognat, E., Cleophax, S., Domenga-Denier, V., Joutel, A. Early white matter changes in CADASIL: evidence of segmental intramyelinic oedema in a pre-clinical mouse model. Acta Neuropathol Commun. 2, 49(2014).
- Weng, Z., et al. A novel needle mouse model of vascular cognitive impairment and dementia. J Neurosci. 43 (44), 7351-7360 (2023).
- Biesbroek, J. M., Biessels, G. J. Diagnosing vascular cognitive impairment: Current challenges and future perspectives. Int J Stroke. 18 (1), 36-43 (2023).
- Winklewski, P. J., et al. Understanding the physiopathology behind axial and radial diffusivity changes-what do we know. Front Neurol. 9, 92(2018).
- Jing, Z., et al. Neuronal NAMPT is released after cerebral ischemia and protects against white matter injury. J Cereb Blood Flow Metab. 34 (10), 1613-1621 (2014).
- Yang, S. T., et al. Adult mouse venous hypertension model: common carotid artery to external jugular vein anastomosis. J Vis Exp. (95), e50472(2015).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387(2013).
- Lee, D., et al. A murine model of ischemic retinal injury induced by transient bilateral common carotid artery occlusion. J Vis Exp. (165), (2020).
- Schleimer, K., et al. Training a sophisticated microsurgical technique: interposition of external jugular vein graft in the common carotid artery in rats. J Vis Exp. (69), e4124(2012).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387(2013).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Wellons, J. C., et al. A comparison of strain-related susceptibility in two murine recovery models of global cerebral ischemia. Brain Res. 868 (1), 14-21 (2000).
- Cao, G., et al. In Vivo delivery of a Bcl-xL fusion protein containing the TAT protein transduction domain protects against ischemic brain injury and neuronal apoptosis. J Neurosci. 22 (13), 5423-5431 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon