Method Article
تحديد الخلايا المصابة بفيروس نقص المناعة البشرية في الفئران المعدلة وراثيا التي تم التلاعب بها بواسطة الخلايا الدبقية الصغيرة
In This Article
Summary
يصف هذا البروتوكول كيف أن الجمع بين عدوى فيروس نقص المناعة البشرية البيئية مع الفئران Tmem119-EGFP يوفر نظاما بيولوجيا قيما للتحقيق في التغيرات الدبقية الدقيقة والخزانات الفيروسية في نماذج القوارض للاضطرابات العصبية المعرفية المرتبطة بفيروس نقص المناعة البشرية.
Abstract
أدى العلاج المشترك المضاد للفيروسات القهقرية إلى تحسين نوعية حياة الأشخاص المصابين بفيروس العوز المناعي البشري بشكل كبير. ومع ذلك ، فإن أكثر من 4 ملايين شخص فوق سن الخمسين ويعانون من الاضطرابات العصبية المعرفية المرتبطة بفيروس نقص المناعة البشرية (HAND). لفهم كيفية تأثير فيروس نقص المناعة البشرية على الجهاز العصبي المركزي ، من الضروري وجود نموذج موثوق وممكن لفيروس نقص المناعة البشرية. في السابق ، تم تطوير نظام بيولوجي جديد يستخدم تلقيح فيروس نقص المناعة البشرية (EcoHIV) في نموذج الفئران للتحقيق في الضعف الإدراكي العصبي والخلل الوظيفي المشبكي. ومع ذلك ، لا يزال هناك تحد كبير في توضيح التوزيع التشريحي العصبي ل EcoHIV ، لا سيما تعبيره التفاضلي في أنواع مختلفة من الخلايا في الدماغ. في الدراسة الحالية ، تم تعديل EcoHIV مع وضع العلامات الفلورية mScarlet وحقنها بشكل رجعي في الفئران Tmem119-EGFP (التي تعبر عن بروتين التألق الأخضر المعزز بشكل أساسي في الخلايا الدبقية الصغيرة) لتحديد ما إذا كانت الخلايا الدبقية الصغيرة هي نوع الخلايا الرئيسي المسؤول عن التعبير الفيروسي وخزانات فيروس نقص المناعة البشرية في الدماغ. تظهر البيانات الحالية أن: (1) في المختبر ، كانت إشارات التألق EcoHIV-mScarlet موضعية في الغالب في الخلايا الشبيهة بالخلايا الدبقية الصغيرة بين خلايا دماغ القوارض الأولية. (2) في الجسم الحي ، أدى حقن EcoHIV-mScarlet في الفئران Tmem119-EGFP إلى تعبير كبير عن فيروس نقص المناعة البشرية في دماغ الفأر. يشير التوطين المشترك لإشارات mScarlet و EGFP إلى أن الخلايا الدبقية الصغيرة هي نوع الخلايا الرئيسية التي تؤوي فيروس نقص المناعة البشرية في الدماغ. بشكل عام ، يوفر فيروس نقص المناعة البشرية في القوارض نظاما بيولوجيا قيما لدراسة التغيرات الدبقية الصغيرة ، والخزانات الفيروسية في الدماغ ، والآليات العصبية للاضطرابات العصبية المعرفية المرتبطة بفيروس نقص المناعة البشرية.
Introduction
على الرغم من الفوائد العميقة المستمدة من العلاج المضاد للفيروسات القهقرية ، لا يزال الأشخاص المصابون بفيروس نقص المناعة البشرية (PLWH) يعانون من اضطرابات عصبية معرفية. لفهم الآليات العصبية للاضطراب العصبي المعرفي المرتبط بفيروس نقص المناعة البشرية (HAND) بشكل أفضل ، هناك حاجة ماسة لنماذج فيروس نقص المناعة البشرية لتوضيح مشاركة نوع الخلية المحدد في فيروس نقص المناعة البشرية العصبي.
الجرذ المعدل وراثيا HIV-1 ، الذي تعرض بشكل أساسي للبروتينات الفيروسية لفيروس نقص المناعة البشرية -1 ، هو نموذج قوارض شائع يستخدم للتحقيق في الاضطرابات العصبية المعرفية1،2،3،4والتغيرات التشريحية العصبية5،6،7 المرتبطة ب HAND. يمنع الحذف الوظيفي لمجالات الكمامة والبول تكاثر الفيروس ، مما يجعل الفئران المعدلة وراثيا فيروس نقص المناعة البشرية -1 غير معدية8،9. في الآونة الأخيرة ، تم الإبلاغ عن نموذج عدوى فيروس العوز المناعي البشري الخيمري (EcoHIV) في الفئران بواسطة Potash et al.10 وتم توسيعه لاحقا ليشمل الفئران ، وهو ما قد يكون مفيدا لمزيد من الدراسات حول اضطرابات استخدام اليدوالمخدرات 11. في هذا النظام البيولوجي الجديد ، لوحظت عدوى فيروس نقص المناعة البشرية -1 الجهازية جنبا إلى جنب مع العديد من السمات السريرية لفيروس نقص المناعة البشرية -1 في البشر ، بما في ذلك تورط الخلايا الليمفاوية والبلاعم ، والاستجابات المناعية المضادة للفيروسات ، والغزو العصبي ، والتهاب الدماغ.
تلعب الخلايا الدبقية الصغيرة دورا مهما كضامة متخصصة في الدماغ في الحفاظ على وظائف المخ والتوازن. لتمييز الخلايا الدبقية الصغيرة عن أنواع الخلايا ذات الصلة الوثيقة (على سبيل المثال ، الخلايا الوحيدة في الدم ، والضامة المحيطة بالأوعية الدموية ، والضامة السحائية) ، استخدمت الدراسة الحالية خط الفأر Tmem119-EGFP . أفادت الدراسات السابقة أن البروتين عبر الغشاء 119 (Tmem119) يظهر نمط تعبير خاص حصريا بالخلايا الدبقية الصغيرة في القوارض وأنسجة المخ البشرية12،13،14،15. لوحظت إشارة EGFP في الفئران Tmem119-EGFP في جميع أنحاء الدماغ وتم توطينها خصيصا للخلايا الدبقية الدقيقة.
في هذه الدراسة ، تم تلقيح الفئران Tmem119-EGFP بفيروس EcoHIV-mScarlet ، وتم تحديد الخلايا الإيجابية لفيروس نقص المناعة البشرية في الجهاز العصبي المركزي. نقدم هنا بروتوكولا للتلقيح EcoHIV-mScarlet في الفئران Tmem119-EGFP ، مما يوفر نموذجا موثوقا به لاستهداف التغيرات الدبقية الدقيقة في فيروس نقص المناعة البشرية علاجيا.
Protocol
وافقت لجنة رعاية واستخدامه بجامعة ساوث كارولينا على جميع بروتوكولات (رقم الضمان الفيدرالي: D16-00028). اتبعت جميع التجارب بدقة المبادئ التوجيهية التي وضعتها المعاهد الوطنية للصحة في دليل رعاية واستخدام المختبر. تم الحصول على الفئران Tmem119-EGFP (30 يوما ، ذكور ، 23-26 جم من وزن الجسم) من مصدر تجاري ومجموعة موجودة في مرافق معتمدة من AAALAC. تم إيواء جميع في دورة الضوء والظلام لمدة 12/12 ساعة مع حرية الوصول إلى الطعام والماء. تفاصيل والكواشف والمعدات المستخدمة في هذه الدراسة مدرجة في جدول المواد.
1. عبوات EcoHIV-mScarlet في خلايا 293FT
- احتضان خلايا 293 قدما في قارورة مغلفة مسبقا بالجيلاتين مقاس 75 سم2 . حافظ على نمو الخلايا إلى 30٪ ملتقى عند التعداد.
- إجراء تعداء الحمض النووي البلازميد (15 ميكروغرام) من EcoHIV-mScarlet (الملف التكميلي 1) باستخدام Lipofectamine 3000 (22.5 ميكرولتر) باتباع تعليمات الشركة المصنعة (انظر جدول المواد).
- زراعة الخلايا في وسط DMEM بمصل FBS 10٪ لمدة 3 أيام عند 37 درجة مئوية.
- اجمع الوسط الشرطي مع تعليق فيروسي. جهاز طرد مركزي عند 500 × جم لمدة 10 دقائق عند 4 درجات مئوية. انقل المادة الطافية بماصة سعة 10 مل إلى أنبوب معقم سعة 50 مل.
- أضف كمية معينة من مكثف Lenti-x (نسبة 1: 3) إلى الخليط الفيروسي (على سبيل المثال ، 8 مل من المكثف مع 24 مل من الخليط الفيروسي). اقلب الأنبوب برفق خمس مرات.
- احتفظ بخليط مكثف الفيروس واللينتي عند 4 درجات مئوية لمدة يومين. جهاز طرد مركزي عند 1,500 × جم ، 45 دقيقة ، 4 درجات مئوية. قم بإزالة المادة الطافية بعناية قدر الإمكان باستخدام ماصة.
- أعد تعليق الحبيبات مع 200 ميكرولتر مبرد مسبقا من 100 ملي مولار PBS. قم بتخزين الفيروس عند -80 درجة مئوية.
ملاحظة: تم وصف تفاصيل عبوة EcoHIV-mScarlet في خلايا 293 قدما في دراستنا السابقة16. لا تقم بدوامة أو إدخال فقاعات هواء في المحلول الفيروسي.
2. عدوى EcoHIV-mScarlet في خلايا دماغ الفئران الأولية
- إجراء العزل الأولي لخلايا الدماغ من أجنة الفئران (18 يوما) بعد التقرير المنشورسابقا 16.
- نقل الخلايا المنفصلة إلى ألواح 12 بئرا مطلية مسبقا ب poly-L-Lysine مع إدخالات زجاجية تحتوي على 1 مل من وسط DMEM / F12 بالإضافة إلى 10٪ FBS. استبدل الوسيط في اليوم التالي بالوسط العصبي بمكمل B27.
- زراعة خلايا دماغ الجنين الأولية في حاضنة ثاني أكسيد الكربون2 بنسبة 5٪ لمدة 3 أسابيع.
- أضف EcoHIV-mScarlet (60 ميكرولتر، 1.26 ×10 6 TU/مل) في وسط الاستزراع. احتضان خلايا الدماغ المستنبتة باستخدام EcoHIV-mScarlet لمدة 6 أيام.
- قم بإصلاح الخلايا بنسبة 4٪ PFA وقم بإجراء تلبوخية مناعية على خلايا الدماغ المصابة باستخدام أجسام مضادة أولية محددة (CD11b / c ، Iba1).
- الحصول على الصور باستخدام هدف 40× تحت نظام مجهر متحد البؤر.
3. عدوى فيروس EcoHIV-mScarlet في الخلايا الدبقية الأولية من الفئران البالغة
- تخدير الفئران البالغة بنسبة 5٪ سيفوفلوران لمدة 5 دقائق (باتباع البروتوكولات المعتمدة مؤسسيا). تعقيم جلد الرأس بنسبة 70٪ EtOH.
- بعد التأكد من أن الماوس لم يعد يستجيب للمنبهات الضارة ، استخدم مقصا حادا معقما لإجراء قطع الرأس. انقل الرأس إلى طبق بتري جديد مليء ب 5 مل من HBSS.
- افتح فروة الرأس وانقل أنسجة المخ إلى طبق بتري آخر يحتوي على 5 مل من HBSS المعقم. انزع السحايا وانقل القشرة الأمامية إلى 2 مل من HBSS.
- أضف 20 ميكرولتر من 0.25٪ Trypsin-EDTA إلى الخليط. احتضان لمدة 15 دقيقة في درجة حرارة الغرفة ؛ حرك الأنبوب برفق كل بضع دقائق.
- نقل الخلايا المنفصلة إلى قارورة بولي إل ليسين مطلية مسبقا مقاس 75 سم2 تحتوي على 10 مل من وسط DMEM / F12 و 10٪ FBS.
- خلايا الزراعة عند 37 درجة مئوية ، حاضنة 5٪ ثاني أكسيد الكربون 2 ، حتى التقاء 90٪. هضم خلايا الدماغ ب 2 مل من 0.25٪ Trypsin-EDTA.
- زراعة خلايا الدماغ الفرعية في أطباق ذات قاع زجاجي مقاس 35 مم تحتوي على 5 مل من وسط نمو DMEM / F12 حتى التقاء 80٪.
- أضف EcoHIV-mScarlet (8 ميكرولتر، 1.26 ×10 6 TU/مل) في وسط الاستزراع. احتضان الخلايا الدبقية الفأر لمدة 2 أيام.
- تحقق من إشارات التألق الحمراء (mScarlet) يوميا تحت المجهر الفلوري.
4. الحقن القهقرية للفيروس EcoHIV-mScarlet في الفئران Tmem119-EGFP
- استخدم 3٪ سيفوفلوران لتخدير الفئران Tmem119-EGFP (كل من الفئران من الذكور والإناث في عمر 30 يوما) حتى لا تستجيب للمنبهات الضارة.
- قم بتأمين الفئران في وضع جانبي مع توجيه عين الحقن لأعلى والتنفس من خلال مخروط الأنف المرتبط بنظام التخدير. استخدم حجم مخروط الأنف المناسب لتوفير تخدير مستمر.
- قم بإذابة EcoHIV-mScarlet على الجليد. املأ المحلول الفيروسي في حقنة حاقن داخل العين بإبرة حادة 33 جم.
- ضع الماوس في الراقد الجانبي الأيمن وحافظ على رأسه متجها إلى اليسار. تحديد موقع القنية الإنسية كموقع الحقن.
- بعد تحفيز العين ، أدخل إبرة ببطء وبلطف (زاوية 45 درجة) في القنثوس الإنسي للعين. أدخل الإبرة بعناية إلى الأمام في الأوعية خلف مقلة العين (الجيوب الأنفية المدارية الرجعية).
- يجب حقن 6.5 ميكرولتر من EcoHIV-mScarlet برفق (1.26 × 106 TU/mL، تلقيح العين الثنائية) في الجيب الرجعي المداري. قم بإزالة الإبرة بعناية من الجيوب الأنفية المدارية الرجعية واضغط برفق على الجفون لتوفير الإرقاء.
- ضع مادة التشحيم على العين لمنع القرنية من الجفاف أو الإصابة.
- اسمح للفئران بالتعافي في غرفة الاسترداد باستخدام وسادة تدفئة حتى تستيقظ.
ملاحظة: لا ينبغي وضع شطبة الإبرة بعمق شديد حتى لا تتمزق الشرايين أو تتكسر العظام. يعتمد وقت التسريب الفيروسي على عوامل متعددة (على سبيل المثال ، حجم الحقن ، العيار ، حجم). بالنسبة للتسريب الفيروسي لفيروس نقص المناعة البشرية ، لوحظ تعبير كبير بعد أسبوع واحد من الحقن الرجعية المدارية11 ، 16 ، 17.
5. تصور شرائح أنسجة المخ
- تخدير الفئران بعمق باستخدام 5٪ سيفوفلوران. انتقل إلى الخطوة 5.2 عندما لا تظهر الفئران أي استجابة للمنبهات الضارة وردود الفعل غائبة.
- احتفظ بالفئران في وضع ضعيف داخل غطاء الدخان الكيميائي.
- افتح الجلد على طول خط الوسط الصدري. افصل الحجاب الحاجز وافتح الصدر بالمقص.
- أدخل إبرة 22 G1 1/2 في البطين الأيسر. افتح الأذين الأيمن بالمقص.
- نفخ 50 مل من 100 ملي مولار PBS المبردة مسبقا. Perfuse 100 مل من المخزن المؤقت 4٪ paraformaldehyde المبردمسبقا 16.
- قم بإزالة دماغ الفأر بالكامل16.
- إصلاح بين عشية وضحاها مع 4٪ بارافورمالدهايد.
- قم بتأمين أنسجة المخ باستخدام لاصق الأنسجة على المنصة المعدنية للاهتزاز. قطع سمك 50 ميكرومتر من المقاطع الإكليلية بشفرات من الصلب الكربوني.
- ضع شرائح الدماغ على شرائح زجاجية باستخدام فرشاة. أضف على الفور 0.1 مل من وسيط التثبيت المضاد للبهتان إلى كل قسم.
- ضع غطاء مقاس 22 مم × 50 مم فوق أقسام الدماغ. جفف الشرائح فائقة الصقيع في الظلام لمدة 1 يوم.
- قم بتكوين نظام المجهر متحد البؤر على تكبير قدره 60× (A/1.4، زيت) وتعيين فاصل زمني للمستوى Z يبلغ 0.15 ميكرومتر، بحجم ثقب يبلغ 30 ميكرومتر ونصف قطر ثقب مسقط من الخلف يبلغ 167 نانومتر.
- استخدم الأطوال الموجية 488 نانومتر و 594 نانومتر للحصول على صور متعددة القنوات لمناطق الدماغ ذات الأهمية.
النتائج
تم إدخال جزء من mScarlet (1858 نقطة أساس) يحتوي على مواقع إنزيم من "Cla1" في نهاية 3 'و "Not1" في نهاية 5 'في ناقل الفيروس pNL4-3-EcoHIV (الشكل 1). للتحقق من صحة التعبير عن EcoHIV-mScarlet ، عولجت خلايا الدماغ الأولية المعزولة من قشرة أجنة الفئران E18 باستخدام EcoHIV-mScarlet (60 ميكرولتر ، 1.26 × 10 6 TU / مل) لمدة 6 أيام في المختبر. أظهرت البيانات الواردة في الشكل 2 أن إشارات الفلورسنت الحمراء ل mScarlet كانت موضعية بشكل أساسي في الأنواع الدبقية من الخلايا بناء على مورفولوجيا الخلية المختلفة. علاوة على ذلك ، أظهر وضع العلامات CD11b / c و Iba1 (علامات الخلايا الدبقية الصغيرة) أن إشارات mScarlet كانت مترجمة بشكل مشترك مع خلايا CD11b / c + و / أو Iba1 +. أشارت البيانات إلى أن الخلايا الدبقية الصغيرة كانت نوع الخلايا الرئيسي لتوزيع EcoHIV-mScarlet في المختبر. لم تكن هناك عدوى عصبية كبيرة في الخلايا المستنبتة (الشكل التكميلي 1).
بعد ذلك ، تم اختبار عدوى EcoHIV-mScarlet على الخلايا الدبقية الأولية المختلطة للفأر البالغة. للقيام بذلك ، تم أولا عزل الخلايا الدبقية المختلطة وتنقيتها من الفئران البالغة (شهرين) وإصابة بفيروس نقص المناعة البشرية - mScarlet (8 ميكرولتر ، 1.26 × 106 TU / مل) لمدة يومين. أظهرت الصور في الشكل 3 أن EcoHIV-mScarlet أصاب الخلايا الدبقية للفأر البالغ بنجاح.
لمزيد من معالجة نمط توزيع EcoHIV-mScarlet في دماغ الفأر ، وتحديدا لتحديد نوع الخلية المصابة ، تم حقن EcoHIV-mScarlet في خط الفأر Tmem119-EGFP الذي تم فيه تصنيف الخلايا الدبقية الصغيرة على وجه التحديد بإشارات EGFP دون أي أنواع أخرى من البلاعم منالصراعات 5. تظهر النتائج الواردة في الشكل 4 (أيضا في الشكل التكميلي 2) أن إشارات التألق الأحمر القرمزي لوحظت في الخلايا الإيجابية ل EGFP ، مما يشير إلى أن الخلايا الدبقية الصغيرة هي نوع الخلية الرئيسي لتعبير فيروس نقص المناعة البشرية في أدمغة الفئران.
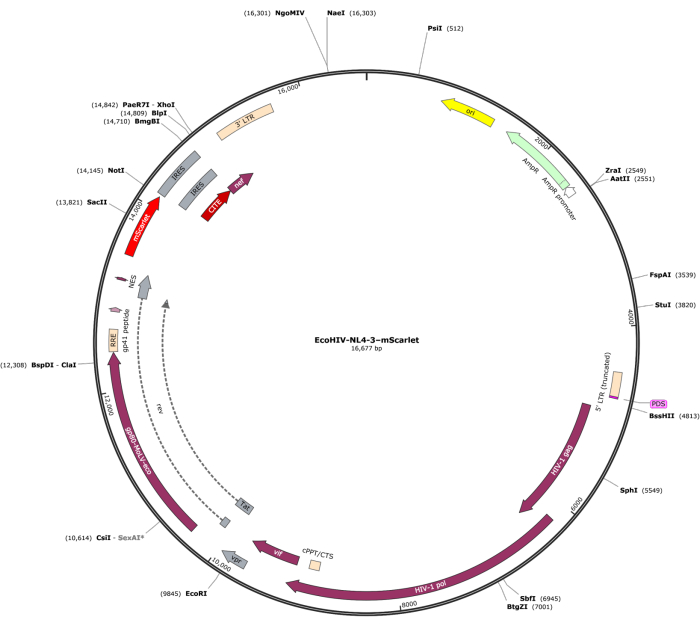
الشكل 1: خريطة متجهات EcoHIV-NL-4-3-mScarlet. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
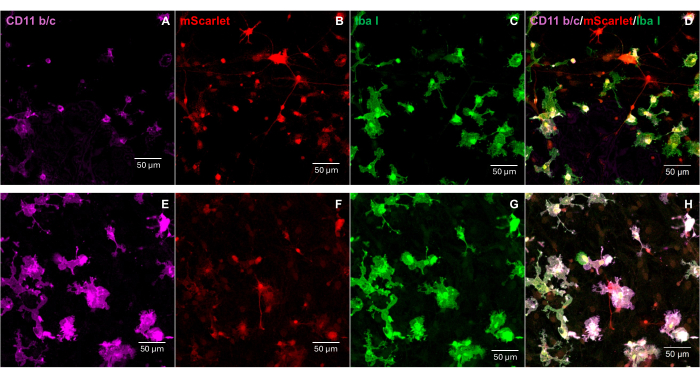
الشكل 2: عدوى EcoHIV-mScarlet في خلايا دماغ الفئران الأولية. (أ ، ه) صور تمثيلية لتلوين CD11b / c في خلايا الدماغ الأولية. تم عزل خلايا الدماغ من أجنة الفئران E18 ومصابة بفيروس EcoHIV-mScarlet لمدة 6 أيام. (ب ، و) صور تمثيلية لإشارات الفلورسنت القرمزية من خلايا الدماغ في المختبر . (ج ، ز) صور تمثيلية لتلوين Iba1 في خلايا الدماغ الأولية. (د ، ح) الصور المدمجة للملصقات الثلاثية ل CD11b / c و mScarlet و Iba1. أشرطة المقياس: 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
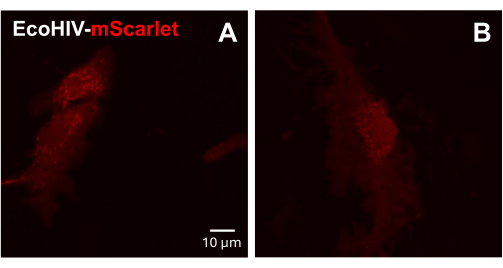
الشكل 3: عدوى EcoHIV-mScarlet في الخلايا الدبقية المختلطة للفأر الأولية. (أ ، ب) صور متحدة البؤر التمثيلية لتوزيع mScarlet في المختبر. تم عزل الخلايا الدبقية المختلطة الأولية من الفئران البالغة C57BL6 (عمر شهرين) وزرعتها لمدة أسبوعين قبل الإصابة الفيروسية. تمت إضافة EcoHIV-mScarlet إلى وسط الاستزراع لمدة يومين والتقط الصور تحت هدف 60× من المجهر متحد البؤر. شريط المقياس: 10 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
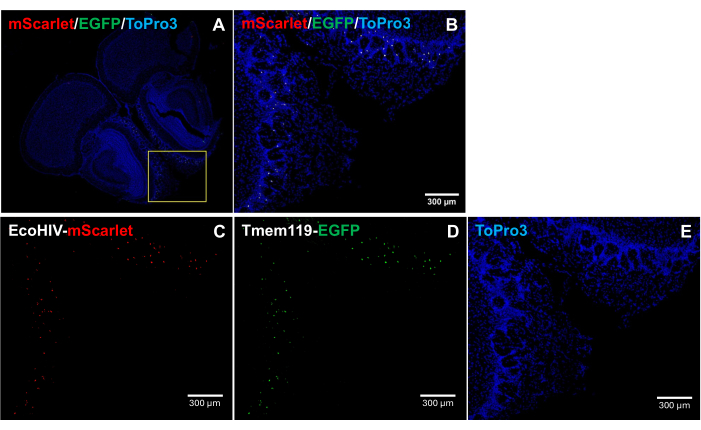
الشكل 4: توزيع EcoHIV-mScarlet في خط الفأر Tmem119-EGFP . (أ ، ب) الصور المدمجة لإشارات mScarlet / EGFP / ToPro3 في أقسام الدماغ. يشير الإطار الأصفر إلى المنطقة المستهدفة (B). شريط المقياس: 300 ميكرومتر (C) صورة تمثيلية لتوزيع mScarlet في الطبقة الضفيرية الخارجية للمنطقة الشمية لخط الماوس Tmem119-EGFP . (د) صورة تمثيلية لتوزيع البرنامج. تم توطين إشارات الفلورسنت في خلايا الخلايا الدبقية الصغيرة في خط الفأر Tmem119-EGFP . (ه) صورة تمثيلية لتلوين نواة TO-PRO-3. أشرطة المقياس: 300 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
الشكل التكميلي 1: تلطيخ MAP2 و MOG لخلايا دماغ الفئران الأولية المصابة بفيروس EcoHIV-mScarlet. أشرطة المقياس: 50 ميكرومتر. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 2: الصور متحدة البؤر لعدوى EcoHIV-mScarlet في خط الفأر Tmem119-EGFP . أشرطة المقياس: 75 ميكرومتر. الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 1: تسلسل الحمض النووي البلازميد EcoHIV-mScarlet. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
في هذه الدراسة ، وجد أن (1) نجحت EcoHIV-mScarlet في إصابة خلايا دماغ الفئران الأولية في المختبر. (2) حدد الملصقات الثلاثية ل mScarlet و CD11b / c و Iba1 الخلايا الدبقية الصغيرة على أنها نوع الخلية السائد لهذا التعبير عن فيروس نقص المناعة البشرية في خلايا دماغ الفئران في المختبر ؛ (3) خلايا دماغ الفئران الأولية من البالغين في المختبر دليل إضافي على عدوى EcoHIV-mScarlet. (4) أظهر توزيع EcoHIV-mScarlet في خط الفأر Tmem119-EGFP نمط توزيع خاص بالخلايا الدبقية الصغيرة للعدوى بفيروس نقص المناعة البشرية المعزز.
اقترحت الدراسات الناشئة أن أنواعا مختلفة من خلايا الدماغ المحددة داخل الجهاز العصبي المركزي (الخلايا العصبية ، الخلايا النجمية ، الخلايا الدبقية الصغيرة ، الخلايا الدبقية قليلة التغصن ، إلخ) تظهر تغيرا وظيفيا ونسخيا أثناء فيروس نقص المناعة البشرية والاضطرابات العصبية المعرفية المرتبطة بفيروس نقص المناعة البشرية18،19. على سبيل المثال ، تساهم الخلايا النجمية بنسبة 30٪ -70٪ من الدماغ وتقوم بالمراقبة للحفاظ على توازن الدماغ20. تعمل الخلايا النجمية أيضا على تعديل وظيفة المناعة وتنظيم إفراز السيتوكينات المتعددة والكيموكينات ، خاصة في حالة التهاب الدماغ والتنكس العصبي في فيروس نقص المناعة البشرية21،22. لا تؤدي عدوى فيروس نقص المناعة البشرية في الخلايا الدبقية الصغيرة إلى الإطلاق المستمر للبروتينات الفيروسية والسيتوكينات المسببة للالتهابات والكيموكينات فحسب ، بل توفر أيضا مصادر سائدة للخزانات الفيروسية لفيروس نقص المناعة البشرية23،24،25،26. علاوة على ذلك ، تساهم الخلايا الدبقية الصغيرة المنشطة في وظيفة مناعية حاسمة في الجهاز العصبي المركزي. ومع ذلك ، قد يؤدي التنشيط المطول أيضا إلى تفاقم التنكس العصبي في تطور فيروس نقص المناعة البشرية10،27. تلعب الخلايا قليلة التغصن أيضا وظيفة مهمة ، بما في ذلك إطلاق العديد من الخلايا العصبية (مثل عامل نمو الأعصاب ، وعامل التغذية العصبية المشتق من الدماغ ، وما إلى ذلك)28. وجدت دراسة سابقة أن عدد الخلايا قليلة التغصن انخفض بشكل كبير في أدمغة مرضى الإيدز ، مما قد يشير إلى تلف مباشر للخلايا قليلة التغصن من البروتينات الفيروسية لفيروس نقص المناعة البشرية29. لذلك ، يجب أن يوفر نوع معين من نموذج العدوى المتلاعب بالخلايا لفيروس نقص المناعة البشرية وسائل أساسية لتحديد الوظائف التفاضلية لخلايا الدماغ المختلفة بعد الإصابة. في الدراسة الحالية ، تم تطوير نظام بيولوجي لتقليد سمات فيروس نقص المناعة البشرية -1 عن طريق التطعيم الخيالي لفيروس نقص المناعة البشرية (EcoHIV). تم أيضا دمج هذا التطعيم ضد فيروس نقص المناعة البشرية مع خط الفأر Tmem119-EGFP لتوليد نموذج قوارض متلاعب به الخلايا الدبقية الصغيرة لفيروس نقص المناعة البشرية والتحقق من صحته.
ومع ذلك، يجب الاعتراف بالقيود المفروضة على هذه الدراسة. كان هناك عدد قليل من الخلايا السالبة Iba1 / CD11b / c التي قدمت إشارات فلورسنت mScarlet في المختبر. قد تكون أنواع أخرى من خلايا الدماغ ، مثل البلاعم الدماغية أو الحمامة ، متورطة في عدوى فيروس نقص المناعة البشرية البيئي ، أو بدلا من ذلك ، قد تعزز بيئة زراعة الخلايا أنماط العدوى الشاذة بالنسبة للتلقيح في الجسم الحي . يجب أن توضح الدراسات المستقبلية للحيوانات الكاملة وظيفة mScarlet + microglia في عملية الإصابة بفيروس نقص المناعة البشرية البيئية ، وتحديد التوزيع الإقليمي ل mScarlet + EcoHIV microglia في الدماغ. بالإضافة إلى ذلك ، يمكن أيضا معالجة التغيرات العصبية المعرفية التي تحدث نتيجة لعدوى الخلايا الدبقية الصغيرة في نموذج القوارض هذا. بشكل جماعي ، يوفر التلقيح EcoHIV-mScarlet للفئران Tmem119-EGFP نموذجا جديدا واستراتيجية بحثية للتحقيق في الآليات التي يحركها الخلايا الدبقية الصغيرة للاضطرابات العصبية المعرفية المرتبطة بفيروس نقص المناعة البشرية.
Disclosures
لا يوجد لدى أي من المؤلفين تضارب في المصالح للإعلان عنه.
Acknowledgements
تم تمويل هذا العمل من خلال منح المعاهد الوطنية للصحة DA059310 و DA058586 و AG082539 و GM109091. نحن نقدر الهدية السخية من EcoHIV-NL4-3-EGFP من الدكتور البوتاس من كلية إيكان للطب في جبل سيناء.
Materials
| Name | Company | Catalog Number | Comments |
| 293FT cells | ThermoFisher Scientific | R70007 | |
| 33 G, Small Hub RN Needle, (Point Style: 3, Needle Length: 19.25 mm) | Hamilton | 7803-05 | |
| Antibiotic-Antimycotic solution | Cellgro | 30004CI | 100x |
| C57BL/6-Tmem119em2Gfng/J | The Jackson Laboratory | Strain #:031823 | |
| Corning BioCoat Gelatin 75cm² Rectangular Canted Neck Cell Culture Flask with Vented Cap | Life Technologies | 354488 | |
| Corning DMEM with L-Glutamine, 4.5 g/L Glucose and Sodium Pyruvate | Life Technologies | 10013CV | |
| Cover glass | VWR | 637-137 | |
| Dumont #5 Forceps | World Precision Instruments | 14095 | |
| Dumont #7 Forceps | World Precision Instruments | 14097 | |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | 12362 | |
| Eppendorf Snap-Cap Microcentrifuge Biopur Safe-Lock Tubes | Life Technologies | 22600028 | |
| Feather Double Edge Carbon Steel Blades | Ted Pella, inc. | 121-9 | |
| Fisher BioReagents Microbiology Media: LB Broth, Miller | Fisher Scientific | BP1426-500 | |
| Human recombinant anti-CD11b antibody | Miltenyi Biotec | 130-120-214 | 1:50 dilution |
| Intraocular Injector Syringe (6.5 µL), Removable Needle | Hamilton | 6609071-01 | |
| Invitrogen Lipofectamine 3000 Transfection Reagent | Life Technologies | L3000015 | |
| Invitrogen One Shot TOP10 Electrocomp E. coli | Fisher Scientific | C404052 | |
| Iris Forceps | World Precision Instruments | 15914 | |
| Iris Scissors | World Precision Instruments | 500216 | |
| Lentivirus-Associated p24 ELISA Kit | Cell Biolabs, inc. | VPK-107-5 | |
| Lenti-X Concentrator | Takara | PT4421-2 | |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 11058021 | |
| Paraformaldehyde | Sigma-Aldrich | 158127-500G | |
| Paraformaldehyde | Sigma | P6148 | |
| PELCO easiSlicer Vibratory Tissue Slicer | Ted Pella, inc. | 11000 | |
| PELCO Pro CA44 Tissue Adhesive | Ted Pella, inc. | 10033 | |
| PELCO Pro Specimen Retrievers | Ted Pella, inc. | 101-33 | |
| ProLong Gold | Fisher Scientific | P36930 | |
| Rabbit monoclonal anti-Iba1 antibody | Abcam | ab178847 | 1:500 dilution |
| RN Compression Fitting 1 mm | Hamilton | 55750-01 | |
| Sevoflurane | Merritt Veterinary Supply | 347075 | |
| Sprague Dawley pregnant rat | Inotiv | ||
| SuperFrost Plus Slides | Fisher Scientific | 12-550-154% | |
| To-Pro-3 | ThermoFisher Scientific | T3605 | Nucleus staining kit |
| Trypsin-EDTA (0.25%), phenol red | ThermoFisher Scientific | 25200-056 | |
| Vannas Scissors | World Precision Instruments | 500086 |
References
- Vigorito, M., Lashomb, A. L., Chang, S. L. Spatial learning and memory in HIV-1 transgenic rats. J Neuroimmune Pharmacol. 2, 319-328 (2007).
- Moran, L. M., Booze, R. M., Mactutus, C. F. Time and time again: Temporal processing demands implicate perceptual and gating deficits in the HIV-1 transgenic rat. J. Neuroimmune Pharmacol. 8 (4), 988-997 (2013).
- Repunte-Canonigo,, et al. Gene expression changes consistent with neuroAIDS and impaired working memory in HIV-1 transgenic rats. Mol Neurodegener. 9, 26(2014).
- Reid, W., et al. An HIV-1 transgenic rat that develops HIV-related pathology and immunologic dysfunction. Proc Natl Acad Sci USA. 98 (16), 9271-9276 (2001).
- McLaurin, K. A., Li, H., Booze, R. M., Mactutus, C. F. Disruption of timing: NeuroHIV progression in the post-cART era. Sci Rep. 9, 827(2019).
- Roscoe, R. F., Mactutus, C. F., Booze, R. M. HIV-1 transgenic female rat: Synaptodendritic alterations of medium spiny neurons in the nucleus accumbens. J Neuroimmune Pharmacol. 9 (5), 642-653 (2014).
- Denton, A. R., et al. Selective monoaminergic and histaminergic circuit dysregulation following long-term HIV-1 protein exposure. J NeuroVirol. 25 (4), 540-550 (2019).
- Peng, J., et al. The HIV-1 transgenic rat as a model for HIV-1 infected individuals on HAART. J Neuroimmunol. 218 (1-2), 94-101 (2010).
- Abbondanzo, S. J., Chang, S. L. HIV-1 transgenic rats display alterations in immunophenotype and cellular responses associated with aging. PLoS ONE. 9, e105256(2014).
- Potash, M. J., et al. A mouse model for study of systemic HIV-1 infection, antiviral immune responses, and neuroinvasiveness. Proc Natl Acad Sci USA. 102 (10), 3760-3765 (2005).
- Li, H., McLaurin, K. A., Illenberger, J. M., Mactutus, C. F., Booze, R. M. Microglial HIV-1 expression: Role in HIV-1 associated neurocognitive disorders. Viruses. 13 (5), 924(2021).
- Kaiser, T., Feng, G. Tmem119-EGFP and Tmem119-CreERT2 transgenic mice for labeling and manipulating microglia. eNeuro. 6 (4), (2019).
- Bennett, M. L., et al. New tools for studying microglia in the mouse and human CNS. Proc Natl Acad Sci. USA. 113 (12), E1738-E1746 (2016).
- Satoh, J., et al. TMEM119 marks a subset of microglia in the human brain. Neuropathology. 36 (1), 39-49 (2016).
- Li, H., Aksenova, M., Bertrand, S. J., Mactutus, C. F., Booze, R. M. Quantification of filamentous actin (F-actin) puncta in rat cortical neurons. J Vis Exp. (108), e53697(2016).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. A rat model of EcoHIV brain infection. J Vis Exp. (167), e62137(2021).
- Alfar, H. R., et al. Protocol for optimizing production and quality control of infective EcoHIV virions. STAR Protoc. 4 (3), 102368(2023).
- Malatesta, P., Hartfuss, E., Götz, M. Isolation of radial glial cells by fluorescent-activated cell sorting reveals a neuronal lineage. Development. 127 (24), 5253-5263 (2000).
- Parpura, V., et al. Glutamate-mediated astrocyte-neuron signaling. Nature. 369 (6483), 744-747 (1994).
- Wahl, A., Al-Harthi, L. HIV infection of non-classical cells in the brain. Retrovirology. 20 (1), 1(2023).
- Pandey, H. S., Seth, P. Friends turn foe-astrocytes contribute to neuronal damage in NeuroAIDS. J. Mol. Neurosci. 69 (2), 286-297 (2019).
- Minagar, A., et al. The role of macrophage/microglia and astrocytes in the pathogenesis of three neurologic disorders: HIV-associated dementia, Alzheimer's disease, and multiple sclerosis. J Neurol Sci. 202 (1-2), 13-23 (2002).
- Borrajo, A., Spuch, C., Penedo, M. A., Olivares, J. M., Agís-Balboa, R. C. Important role of microglia in HIV-1 associated neurocognitive disorders and the molecular pathways implicated in its pathogenesis. Ann Med. 53 (1), 43-69 (2021).
- González-Scarano, F., Martín-García, J. The neuropathogenesis of AIDS. Nat Rev Immunol. 5 (1), 69-81 (2005).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. Microglia proliferation underlies synaptic dysfunction in the prefrontal cortex: Implications for the pathogenesis of HIV-1-associated neurocognitive and affective alterations. J. Neurovirol. 29 (4), 460-471 (2023).
- Kim, B. H., et al. EcoHIV infection of primary murine brain cell cultures to model HIV replication and neuropathogenesis. Viruses. 16 (5), 693(2024).
- Réu, P., et al. The lifespan and turnover of microglia in the human brain. Cell Rep. 20 (4), 779-784 (2017).
- Jones, J. D. Potential of glial cell modulators in the management of substance use disorders. CNS Drugs. 34 (7), 697-722 (2020).
- Kaalund, S. S., Johansen, A., Fabricius, K., Pakkenberg, B. Untreated patients dying with aids have loss of neocortical neurons and glial cells. Front Neurosci. 13, 1398(2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved