Method Article
在小胶质细胞作的转基因小鼠中鉴定 EcoHIV 感染的细胞
摘要
该方案描述了 EcoHIV 感染与 Tmem119-EGFP 小鼠的组合如何为研究 HIV 相关神经认知障碍的啮齿动物模型中的小胶质细胞改变和病毒库提供有价值的生物系统。
摘要
联合抗逆转录病毒疗法 (cART) 极大地改善了 HIV 感染者 (PLWH) 的生活质量。然而,超过 400 万 PLWH 年龄在 50 岁以上,并患有 HIV 相关神经认知障碍 (HAND)。要了解 HIV 如何影响中枢神经系统,需要一个可靠且可行的 HIV 模型。以前,在大鼠模型中开发了一种使用嵌合 HIV (EcoHIV) 接种的新型生物系统,用于研究神经认知障碍和突触功能障碍。然而,阐明 EcoHIV 的神经解剖学分布仍然存在重大挑战,特别是它在大脑中各种细胞类型的差异表达。在目前的研究中,将带有 mScarlet 荧光标记的 EcoHIV 修饰并眶后注射到 Tmem119-EGFP 敲入小鼠(主要在小胶质细胞中表达增强的绿色荧光蛋白)以确定小胶质细胞是否是负责病毒表达的主要细胞类型和大脑中 HIV 的储存库。目前的数据显示:(1) 在体外,EcoHIV-mScarlet 荧光信号主要位于原代啮齿动物脑细胞的小胶质细胞样细胞中;(2) 体内注射 EcoHIV-mScarlet 到 Tmem119-EGFP 小鼠体内诱导小鼠大脑中 HIV 显著表达。mScarlet 和 EGFP 信号的共定位表明,小胶质细胞是大脑中携带 HIV 的主要细胞类型。总体而言,啮齿动物中的 EcoHIV 为研究小胶质细胞改变、大脑中的病毒库以及 HIV 相关神经认知障碍的神经机制提供了一个有价值的生物系统。
引言
尽管抗逆转录病毒疗法带来了深远的好处,但 HIV 感染者 (PLWH) 仍然会出现神经认知障碍。为了更好地了解 HIV 相关神经认知障碍 (HAND) 的神经元机制,迫切需要 HIV 模型来进一步阐明 NeuroHIV 中涉及的特定细胞类型。
HIV-1 转基因大鼠组成性暴露于 HIV-1 病毒蛋白,是一种流行的啮齿动物模型,用于研究与 HAND 相关的神经认知障碍 1,2,3,4 和神经解剖学改变 5,6,7。gag 和 pol 结构域的功能缺失阻止了病毒复制,使 HIV-1 转基因大鼠具有非感染性 8,9。最近,Potash 等人最初报道了小鼠的嵌合 HIV (EcoHIV) 感染模型10,后来扩展到大鼠,这可能有利于进一步研究 HAND 和物质使用障碍11。在这个新的生物系统中,观察到全身性 HIV-1 感染以及人类 HIV-1 的许多临床特征,包括淋巴细胞和巨噬细胞受累、抗病毒免疫反应、神经侵袭性和脑炎症。
小胶质细胞作为专门的大脑驻留巨噬细胞在维持大脑功能和体内平衡方面起着关键作用。为了区分小胶质细胞与密切相关的细胞类型 (例如,血液单核细胞、血管周围巨噬细胞、脑膜巨噬细胞),目前的研究使用了 Tmem119-EGFP 敲入小鼠系。先前的研究报道,跨膜蛋白 119 (Tmem119) 在啮齿动物和人脑组织中表现出独特的小胶质细胞特异性表达模式 12,13,14,15。Tmem119-EGFP 敲入小鼠的 EGFP 信号在整个大脑中观察到,并特异性定位于小胶质细胞。
在本研究中, Tmem119-EGFP 敲入小鼠接种 EcoHIV-mScarlet 病毒,并鉴定出中枢神经系统中 EcoHIV 阳性的细胞。在这里,我们提出了一种在 Tmem119-EGFP 敲入小鼠中接种 EcoHIV-mScarlet 的方案,为治疗靶向 HIV 中的小胶质细胞改变提供了一个可靠的模型。
研究方案
南卡罗来纳大学动物护理和使用委员会批准了所有动物协议(联邦保证编号:D16-00028)。所有实验均严格遵循美国国立卫生研究院在 实验动物护理和使用指南中制定的指南。 Tmem119-EGFP 敲入小鼠 (30 天龄,雄性,体重 23-26 g) 从商业来源获得,并分组饲养在 AAALAC 认可的设施中。所有动物均在 12/12 小时的明暗循环下饲养,可自由获取食物和水。本研究中使用的动物、试剂和设备的详细信息列在 材料表中。
1. EcoHIV-mScarlet 包装在 293FT 细胞中
- 将 293 个 FT 细胞在明胶预包被的 75 cm2 培养瓶中孵育。转染时保持细胞生长至 30% 汇合。
- 按照制造商的说明,使用 Lipofectamine 3000 (22.5 μL) 转染 EcoHIV-mScarlet 的质粒 DNA (15 μg)(补充文件 1)(参见 材料表)。
- 将细胞在含 10% FBS 血清的 DMEM 培养基中于 37 °C 培养 3 天。
- 收集带有病毒悬浮液的条件培养基。在 4 °C 下以 500 × g 离心 10 分钟。 用 10 mL 移液管将上清液转移到无菌的 50 mL 试管中。
- 在病毒混合物中加入一定量的 Lenti-x 浓缩器(比例为 1:3)(例如,8 mL 浓缩器与 24 mL 病毒混合物)。轻轻倒置试管五次。
- 将病毒 - 慢浓缩器混合物在 4 °C 下保存 2 天。在 1,500 × g,45 分钟,4 °C 下离心。 使用移液管尽可能小心地去除上清液。
- 用预冷的 200 μL 100 mM PBS 重悬沉淀。将病毒储存在 -80 °C。
注意:我们之前的研究16 描述了 293FT 细胞中 EcoHIV-mScarlet 包装的细节。不要在病毒溶液中涡旋或引入气泡。
2. 原代大鼠脑细胞中的 EcoHIV-mScarlet 感染
- 按照先前发布的报告16 从大鼠胎儿(18 天)中进行原代脑细胞分离。
- 将解离的细胞转移到带有玻璃插件的聚-L-赖氨酸预包被的 12 孔板中,玻璃插件含有 1 mL DMEM/F12 培养基和 10% FBS。第二天用 B27 补充剂替换 Neurobasal 培养基的培养基。
- 在 5% CO2 培养箱中培养原代胎儿脑细胞 3 周。
- 将 EcoHIV-mScarlet (60 μL, 1.26 × 106 TU/mL) 添加到培养基中。将培养的脑细胞与 EcoHIV-mScarlet 一起孵育 6 天。
- 用 4% PFA 固定细胞,并使用特异性一抗 (CD11b/c, Iba1) 对感染的脑细胞进行免疫染色。
- 在共聚焦显微镜系统下使用 40× 物镜获取图像。
3. 成年小鼠原代神经胶质细胞中的 EcoHIV-mScarlet 病毒感染
- 用 5% 七氟烷麻醉成年小鼠 5 分钟(遵循机构批准的方案)。用 70% 乙醇对头部皮肤进行消毒。
- 确认鼠标不再对有害刺激有反应后,使用消毒过的锋利剪刀进行斩首。将头部转移到装有 5 mL HBSS 的新培养皿中。
- 打开头皮,将脑组织转移到另一个含有 5 mL 无菌 HBSS 的培养皿中。剥去脑膜,将额叶皮层转移到 2 mL HBSS 中。
- 向混合物中加入 20 μL 0.25% 胰蛋白酶-EDTA。在室温下孵育 15 分钟;每隔几分钟轻轻旋转一次试管。
- 将解离的细胞转移到预包被的 75 cm2 培养瓶中,该培养瓶含有 10 mL DMEM/F12 培养基和 10% FBS。
- 在 37 °C、5% CO2 培养箱中培养细胞, 直至 90% 汇合。用 2 mL 的 0.25% 胰蛋白酶-EDTA 消化脑细胞。
- 将脑细胞传代培养到含有 5 mL DMEM/F12 生长培养基的 35 mm 玻璃底培养皿中,直至 80% 汇合。
- 将 EcoHIV-mScarlet (8 μL, 1.26 × 106 TU/mL) 添加到培养基中。小鼠神经胶质细胞孵育 2 天。
- 每天在荧光显微镜下检查红色 (mScarlet) 荧光信号。
4. EcoHIV-mScarlet 病毒眶后注射到 Tmem119-EGFP 小鼠中
- 使用 3% 七氟烷麻醉 Tmem119-EGFP 小鼠(30 日龄的雄性和雌性小鼠),直到它们不再对有害刺激有反应。
- 将小鼠固定在横向位置,注射眼朝上,并通过与麻醉系统相连的鼻锥呼吸。使用适当尺寸的鼻锥提供持续麻醉。
- 在冰上解冻 EcoHIV-mScarlet。用 33 G 钝针将病毒溶液填充到眼内注射器中。
- 将鼠标放在右侧卧位上,并保持头部朝左。确定内眦的位置作为注射部位。
- 将眼睛凸起后,缓慢而轻柔地将针头(45 度角)插入眼睛的内眦。小心地将针头向前插入眼球后面的血管(眶后窦)。
- 将 6.5 μL EcoHIV-mScarlet(1.26 × 106 TU/mL,双侧眼接种)轻轻注射到眶后窦中。小心地从眶后窦中取出针头,轻轻地对眼睑施加压力以提供止血。
- 在眼睛上涂抹润滑剂,以防止角膜干燥或受伤。
- 让小鼠在带有加热垫的恢复室中恢复,直到它醒来。
注意:针斜面的位置不应太深,以免动脉破裂或骨折。病毒输注时间取决于多种因素(例如,注射量、滴度、动物大小)。对于 EcoHIV 病毒输注,在眼眶后注射后一周观察到显着表达 11,16,17。
5. 脑组织切片的可视化
- 使用 5% 七氟烷深度麻醉小鼠。当小鼠对有害刺激没有反应并且没有反射时,继续进行步骤 5.2。
- 将小鼠保持在化学通风橱内的仰卧位。
- 沿胸中线打开皮肤。分开隔膜,用剪刀打开胸部。
- 将 22 G1 1/2 针插入左心室。用剪刀打开右心房。
- 灌注 50 mL 预冷的 100 mM PBS。灌注 100 mL 预冷的 4% 多聚甲醛缓冲液16.
- 去除整个小鼠大脑16.
- 用 4% 多聚甲醛固定过夜。
- 使用 Vibratome 金属平台上的组织粘合剂固定脑组织。用碳钢刀片切割 50 μm 厚的冠状切片。
- 使用刷子将脑切片放在载玻片上。立即向每个切片中加入 0.1 mL 的抗淬灭封片剂。
- 将 22 mm x 50 mm 盖玻片放在脑切片上。将超级霜载玻片在黑暗中干燥 1 天。
- 将共聚焦显微镜系统配置为 60× 的放大倍率(A/1.4,油),并将 Z 平面间隔设置为 0.15 μm,针孔尺寸为 30 μm,反向投影针孔半径为 167 nm。
- 使用 488 nm 和 594 nm 波长采集感兴趣大脑区域的多通道图像。
结果
将含有 3' 端"Cla1"和 5' 端"Not1"酶位点的 mScarlet 片段 (1858 bp) 插入 pNL4-3-EcoHIV 慢病毒载体中(图 1)。为了验证 EcoHIV-mScarlet 的表达,从大鼠 E18 胚胎皮层分离的原代脑细胞用 EcoHIV-mScarlet (60 μL, 1.26 × 106 TU/mL) 在 体外处理 6 天。 图 2 中的数据显示,根据不同的细胞形态,mScarlet 的红色荧光信号主要定位于神经胶质细胞类型。此外,CD11b/c 和 Iba1 (小胶质细胞的细胞标志物) 标记显示 mScarlet 信号与 CD11b/c + 和/或 Iba1 + 细胞共定位。数据表明,小胶质细胞是 EcoHIV-mScarlet 在 体外分布的主要细胞类型。培养的细胞中没有明显的神经元感染(补充图 1)。
接下来,在成年小鼠原代混合神经胶质细胞上检测 EcoHIV-mScarlet 的感染。为此,首先从成年小鼠(2 个月)中分离和纯化混合神经胶质细胞,并用 EcoHIV-mScarlet(8 μL、1.26 × 106 TU/mL)感染 2 天。 图 3 中的图像显示 EcoHIV-mScarlet 成功感染了成年小鼠神经胶质细胞。
为了进一步解决 EcoHIV-mScarlet 在小鼠大脑中的分布模式,特别是为了识别感染的细胞类型,将 EcoHIV-mScarlet 眶后注射到 Tmem119-EGFP 敲入小鼠系中,其中小胶质细胞用 EGFP 信号特异性标记,没有任何其他巨噬细胞类型的冲突5。 图 4 中的结果(也在 补充图 2 中)显示,在 EGFP 阳性细胞中观察到 mScarlet 红色荧光信号,表明小胶质细胞是小鼠大脑中 EcoHIV 表达的主要细胞类型。
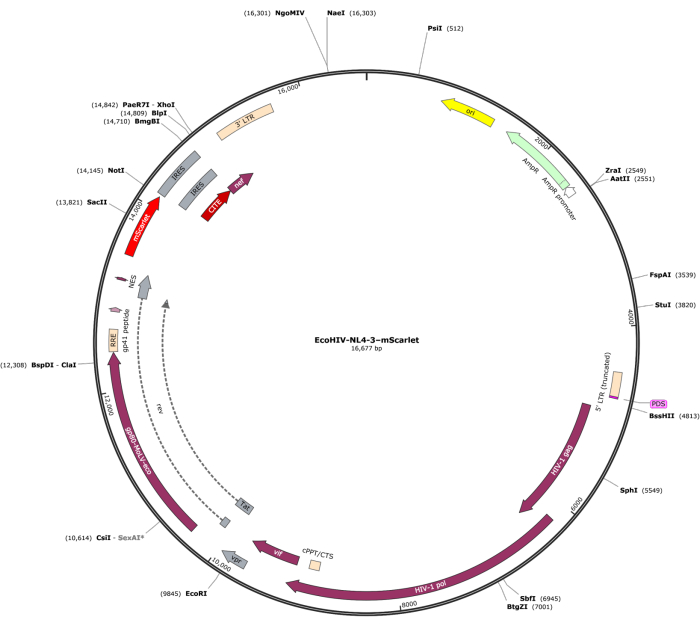
图 1:EcoHIV-NL-4-3-mScarlet 的载体图。请单击此处查看此图的较大版本。
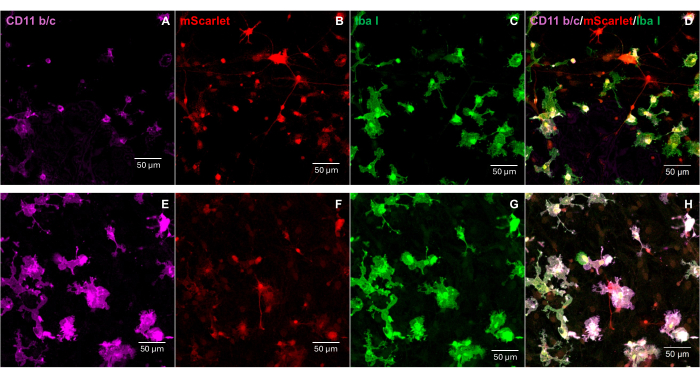
图 2:原代大鼠脑细胞中的 EcoHIV-mScarlet 感染。 (A,E) 原代脑细胞 CD11b/c 染色的代表性图像。从 E18 大鼠胚胎中分离脑细胞,并用 EcoHIV-mScarlet 病毒感染 6 天。(早、女)来自体外脑细胞 的 mScarlet 荧光信号的代表性图像。(C,G)原代脑细胞 Iba1 染色的代表性图像。(D,H)CD11b/c、mScarlet 和 Iba1 三重标记的合并图像。比例尺:50 μm。 请点击此处查看此图的较大版本。
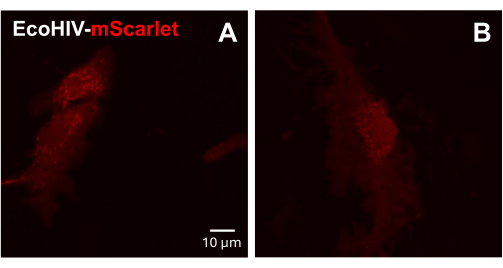
图 3:原代小鼠混合神经胶质细胞中的 EcoHIV-mScarlet 感染。 (A,B) mScarlet 体外分布的代表性共聚焦图像。从成年 C57BL6 小鼠 (2 月龄) 中分离原代混合胶质细胞,并在病毒感染前培养 2 周。将 EcoHIV-mScarlet 加入培养基中两天,并在共聚焦显微镜的 60× 物镜下捕获图像。比例尺:10 μm。 请点击此处查看此图的较大版本。
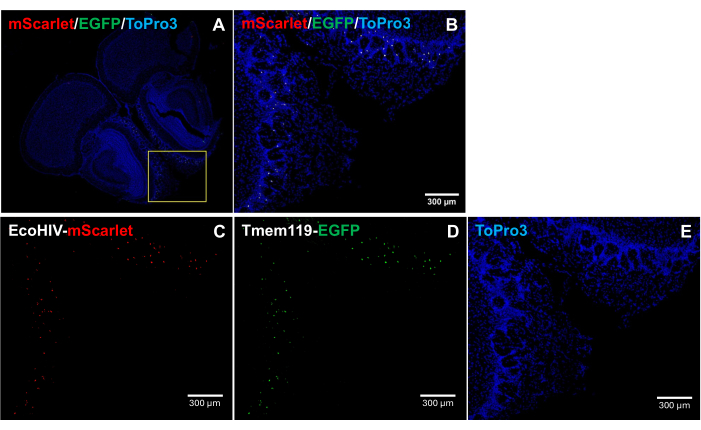
图 4:EcoHIV-mScarlet 在 Tmem119-EGFP 敲入小鼠系中的分布。 (A,B)脑切片中 mScarlet/EGFP/ToPro3 信号的合并图像。黄框表示 (B) 的目标区域。比例尺:300 μm。(C) Tmem119-EGFP 敲入小鼠系嗅觉区域外丛状层中 mScarlet 分布的代表性图像。(D) EGFP 分布的代表性图像。荧光信号位于 Tmem119-EGFP 敲入小鼠系的小胶质细胞中。(E) TO-PRO-3 细胞核染色的代表性图像。比例尺:300 μm。 请单击此处查看此图的较大版本。
补充图 1:感染 EcoHIV-mScarlet 病毒的原代大鼠脑细胞的 MAP2 和 MOG 染色。 比例尺:50 μm。 请点击此处下载此文件。
补充图 2: Tmem119-EGFP 敲入小鼠系中 EcoHIV-mScarlet 感染的共聚焦图像。 比例尺:75 μm。 请点击此处下载此文件。
补充文件 1:EcoHIV-mScarlet 质粒 DNA 序列。请点击此处下载此文件。
讨论
在本研究中,发现 (1) 新型 EcoHIV-mScarlet 在 体外成功感染原代大鼠脑细胞;(2) mScarlet、CD11b/c 和 Iba1 的三重标记确定小胶质细胞是 体外大鼠脑细胞中这种 EcoHIV 表达的主要细胞类型;(3) 来自 成人的原代小鼠脑细胞体外进一步证明了 EcoHIV-mScarlet 感染;(4) Tmem119-EGFP 敲入小鼠系中的 EcoHIV-mScarlet 分布表明 EcoHIV 感染的小胶质细胞特异性分布模式。
新兴研究表明,在中枢神经系统中鉴定的各种类型的脑细胞(神经元、星形胶质细胞、小胶质细胞、少突胶质细胞等)在 HIV 和 HIV 相关神经认知障碍期间表现出功能和转录组学改变18,19。例如,星形胶质细胞贡献了大脑的 30%-70% 并进行监测以维持大脑稳态20。星形胶质细胞还调节免疫功能并调节多细胞因子和趋化因子的分泌,尤其是在 HIV 脑发炎和神经退行性变的情况下21,22。小胶质细胞的 HIV 感染不仅导致病毒蛋白和促炎细胞因子和趋化因子的持续释放,而且还为 HIV 病毒库提供了主要来源 23,24,25,26。此外,活化的小胶质细胞在 CNS 中起着关键的免疫功能;然而,长时间激活也可能加剧 HIV 进展中的神经退行性变10,27。少突胶质细胞也起着重要作用,包括释放几种神经营养因子(如神经生长因子、脑源性神经营养因子等)28. 之前的一项研究发现,艾滋病患者大脑中少突胶质细胞的数量显着减少,这可能表明 HIV 病毒蛋白对少突胶质细胞的直接损伤29。因此,一种特定类型的 HIV 细胞纵感染模型应该提供识别感染后各种脑细胞不同功能的基本手段。在目前的研究中,开发了一种生物系统,通过嵌合 HIV (EcoHIV) 接种来模拟 HIV-1 的特征。这种 HIV 接种还与 Tmem119-EGFP 敲入小鼠系相结合,以生成和验证小胶质细胞纵的 HIV 啮齿动物模型。
然而,必须认识到本研究的局限性。有一些 Iba1/CD11b/c 阴性细胞 在体外呈 mScarlet 荧光信号。其他类型的脑细胞,如脑巨噬细胞或周细胞,可能参与 EcoHIV 感染,或者,相对于 体内 接种,细胞培养环境可能会促进异常的感染模式。未来的全动物研究应进一步阐明 mScarlet+ 小胶质细胞在 EcoHIV 感染过程中的功能,并进一步确定 mScarlet+EcoHIV 小胶质细胞在大脑中的区域分布。此外,由于小胶质细胞感染而发生的神经认知改变也可以在这种啮齿动物模型中得到解决。总的来说, Tmem119-EGFP 敲入小鼠的 EcoHIV-mScarlet 接种为研究 HIV 相关神经认知障碍的小胶质细胞驱动机制提供了一种新的模型和研究策略。
披露声明
作者均无利益冲突需要声明。
致谢
这项工作由 NIH 赠款 DA059310、DA058586、AG082539 和 GM109091 资助。我们感谢西奈山伊坎医学院的 Potash 博士慷慨捐赠的 EcoHIV-NL4-3-EGFP。
材料
| Name | Company | Catalog Number | Comments |
| 293FT cells | ThermoFisher Scientific | R70007 | |
| 33 G, Small Hub RN Needle, (Point Style: 3, Needle Length: 19.25 mm) | Hamilton | 7803-05 | |
| Antibiotic-Antimycotic solution | Cellgro | 30004CI | 100x |
| C57BL/6-Tmem119em2Gfng/J | The Jackson Laboratory | Strain #:031823 | |
| Corning BioCoat Gelatin 75cm² Rectangular Canted Neck Cell Culture Flask with Vented Cap | Life Technologies | 354488 | |
| Corning DMEM with L-Glutamine, 4.5 g/L Glucose and Sodium Pyruvate | Life Technologies | 10013CV | |
| Cover glass | VWR | 637-137 | |
| Dumont #5 Forceps | World Precision Instruments | 14095 | |
| Dumont #7 Forceps | World Precision Instruments | 14097 | |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | 12362 | |
| Eppendorf Snap-Cap Microcentrifuge Biopur Safe-Lock Tubes | Life Technologies | 22600028 | |
| Feather Double Edge Carbon Steel Blades | Ted Pella, inc. | 121-9 | |
| Fisher BioReagents Microbiology Media: LB Broth, Miller | Fisher Scientific | BP1426-500 | |
| Human recombinant anti-CD11b antibody | Miltenyi Biotec | 130-120-214 | 1:50 dilution |
| Intraocular Injector Syringe (6.5 µL), Removable Needle | Hamilton | 6609071-01 | |
| Invitrogen Lipofectamine 3000 Transfection Reagent | Life Technologies | L3000015 | |
| Invitrogen One Shot TOP10 Electrocomp E. coli | Fisher Scientific | C404052 | |
| Iris Forceps | World Precision Instruments | 15914 | |
| Iris Scissors | World Precision Instruments | 500216 | |
| Lentivirus-Associated p24 ELISA Kit | Cell Biolabs, inc. | VPK-107-5 | |
| Lenti-X Concentrator | Takara | PT4421-2 | |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 11058021 | |
| Paraformaldehyde | Sigma-Aldrich | 158127-500G | |
| Paraformaldehyde | Sigma | P6148 | |
| PELCO easiSlicer Vibratory Tissue Slicer | Ted Pella, inc. | 11000 | |
| PELCO Pro CA44 Tissue Adhesive | Ted Pella, inc. | 10033 | |
| PELCO Pro Specimen Retrievers | Ted Pella, inc. | 101-33 | |
| ProLong Gold | Fisher Scientific | P36930 | |
| Rabbit monoclonal anti-Iba1 antibody | Abcam | ab178847 | 1:500 dilution |
| RN Compression Fitting 1 mm | Hamilton | 55750-01 | |
| Sevoflurane | Merritt Veterinary Supply | 347075 | |
| Sprague Dawley pregnant rat | Inotiv | ||
| SuperFrost Plus Slides | Fisher Scientific | 12-550-154% | |
| To-Pro-3 | ThermoFisher Scientific | T3605 | Nucleus staining kit |
| Trypsin-EDTA (0.25%), phenol red | ThermoFisher Scientific | 25200-056 | |
| Vannas Scissors | World Precision Instruments | 500086 |
参考文献
- Vigorito, M., Lashomb, A. L., Chang, S. L. Spatial learning and memory in HIV-1 transgenic rats. J Neuroimmune Pharmacol. 2, 319-328 (2007).
- Moran, L. M., Booze, R. M., Mactutus, C. F. Time and time again: Temporal processing demands implicate perceptual and gating deficits in the HIV-1 transgenic rat. J. Neuroimmune Pharmacol. 8 (4), 988-997 (2013).
- Repunte-Canonigo,, et al. Gene expression changes consistent with neuroAIDS and impaired working memory in HIV-1 transgenic rats. Mol Neurodegener. 9, 26(2014).
- Reid, W., et al. An HIV-1 transgenic rat that develops HIV-related pathology and immunologic dysfunction. Proc Natl Acad Sci USA. 98 (16), 9271-9276 (2001).
- McLaurin, K. A., Li, H., Booze, R. M., Mactutus, C. F. Disruption of timing: NeuroHIV progression in the post-cART era. Sci Rep. 9, 827(2019).
- Roscoe, R. F., Mactutus, C. F., Booze, R. M. HIV-1 transgenic female rat: Synaptodendritic alterations of medium spiny neurons in the nucleus accumbens. J Neuroimmune Pharmacol. 9 (5), 642-653 (2014).
- Denton, A. R., et al. Selective monoaminergic and histaminergic circuit dysregulation following long-term HIV-1 protein exposure. J NeuroVirol. 25 (4), 540-550 (2019).
- Peng, J., et al. The HIV-1 transgenic rat as a model for HIV-1 infected individuals on HAART. J Neuroimmunol. 218 (1-2), 94-101 (2010).
- Abbondanzo, S. J., Chang, S. L. HIV-1 transgenic rats display alterations in immunophenotype and cellular responses associated with aging. PLoS ONE. 9, e105256(2014).
- Potash, M. J., et al. A mouse model for study of systemic HIV-1 infection, antiviral immune responses, and neuroinvasiveness. Proc Natl Acad Sci USA. 102 (10), 3760-3765 (2005).
- Li, H., McLaurin, K. A., Illenberger, J. M., Mactutus, C. F., Booze, R. M. Microglial HIV-1 expression: Role in HIV-1 associated neurocognitive disorders. Viruses. 13 (5), 924(2021).
- Kaiser, T., Feng, G. Tmem119-EGFP and Tmem119-CreERT2 transgenic mice for labeling and manipulating microglia. eNeuro. 6 (4), (2019).
- Bennett, M. L., et al. New tools for studying microglia in the mouse and human CNS. Proc Natl Acad Sci. USA. 113 (12), E1738-E1746 (2016).
- Satoh, J., et al. TMEM119 marks a subset of microglia in the human brain. Neuropathology. 36 (1), 39-49 (2016).
- Li, H., Aksenova, M., Bertrand, S. J., Mactutus, C. F., Booze, R. M. Quantification of filamentous actin (F-actin) puncta in rat cortical neurons. J Vis Exp. (108), e53697(2016).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. A rat model of EcoHIV brain infection. J Vis Exp. (167), e62137(2021).
- Alfar, H. R., et al. Protocol for optimizing production and quality control of infective EcoHIV virions. STAR Protoc. 4 (3), 102368(2023).
- Malatesta, P., Hartfuss, E., Götz, M. Isolation of radial glial cells by fluorescent-activated cell sorting reveals a neuronal lineage. Development. 127 (24), 5253-5263 (2000).
- Parpura, V., et al. Glutamate-mediated astrocyte-neuron signaling. Nature. 369 (6483), 744-747 (1994).
- Wahl, A., Al-Harthi, L. HIV infection of non-classical cells in the brain. Retrovirology. 20 (1), 1(2023).
- Pandey, H. S., Seth, P. Friends turn foe-astrocytes contribute to neuronal damage in NeuroAIDS. J. Mol. Neurosci. 69 (2), 286-297 (2019).
- Minagar, A., et al. The role of macrophage/microglia and astrocytes in the pathogenesis of three neurologic disorders: HIV-associated dementia, Alzheimer's disease, and multiple sclerosis. J Neurol Sci. 202 (1-2), 13-23 (2002).
- Borrajo, A., Spuch, C., Penedo, M. A., Olivares, J. M., Agís-Balboa, R. C. Important role of microglia in HIV-1 associated neurocognitive disorders and the molecular pathways implicated in its pathogenesis. Ann Med. 53 (1), 43-69 (2021).
- González-Scarano, F., Martín-García, J. The neuropathogenesis of AIDS. Nat Rev Immunol. 5 (1), 69-81 (2005).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. Microglia proliferation underlies synaptic dysfunction in the prefrontal cortex: Implications for the pathogenesis of HIV-1-associated neurocognitive and affective alterations. J. Neurovirol. 29 (4), 460-471 (2023).
- Kim, B. H., et al. EcoHIV infection of primary murine brain cell cultures to model HIV replication and neuropathogenesis. Viruses. 16 (5), 693(2024).
- Réu, P., et al. The lifespan and turnover of microglia in the human brain. Cell Rep. 20 (4), 779-784 (2017).
- Jones, J. D. Potential of glial cell modulators in the management of substance use disorders. CNS Drugs. 34 (7), 697-722 (2020).
- Kaalund, S. S., Johansen, A., Fabricius, K., Pakkenberg, B. Untreated patients dying with aids have loss of neocortical neurons and glial cells. Front Neurosci. 13, 1398(2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。