Method Article
ミクログリア操作トランスジェニックマウスにおけるエコHIV感染細胞の同定
要約
このプロトコルでは、EcoHIV感染と Tmem119-EGFP マウスの組み合わせが、HIV関連神経認知障害のげっ歯類モデルにおけるミクログリアの変化とウイルスリザーバーを調査するための貴重な生物学的システムを提供する方法について説明します。
要約
併用抗レトロウイルス療法(cART)は、HIV陽性者(PLWH)の生活の質を劇的に改善しました。しかし、400万人以上のPLWHが50歳以上で、HIV関連神経認知障害(HAND)を伴った経験があります。HIVが中枢神経系にどのような影響を与えるかを理解するためには、信頼性と実現可能性に優れたHIVのモデルが必要である。これまでに、神経認知障害やシナプス機能障害を調べるために、ラットモデルでキメラHIV(EcoHIV)接種を用いた新しい生体システムを開発しました。それにもかかわらず、EcoHIVの神経解剖学的分布、特に脳内のさまざまな細胞タイプでの発現差を明らかにするには、大きな課題が残っています。現在の研究では、mScarlet蛍光標識を施したEcoHIVを改変し、 Tmem119-EGFP ノックインマウス(主にミクログリアで増強された緑色蛍光タンパク質を発現する)に眼窩後注射して、ミクログリアが脳内のHIVのウイルス発現とリザーバーに関与する主要な細胞タイプであるかどうかを判断しました。現在のデータは、(1) in vitroで、EcoHIV-mScarlet蛍光シグナルは、主に一次げっ歯類の脳細胞の中のミクログリア様細胞に局在していたことを示しています。(2) in vivoでは、 Tmem119-EGFP マウスにEcoHIV-mScarletを注射すると、マウスの脳に有意なHIV発現が誘導されました。mScarletシグナルとEGFPシグナルの共局在は、ミクログリアが脳内にHIVを保有する主要な細胞タイプであることを示唆しています。全体として、げっ歯類のEcoHIVは、ミクログリアの変化、脳内のウイルス貯蔵庫、およびHIV関連神経認知障害の神経学的メカニズムを研究するための貴重な生物学的システムを提供します。
概要
抗レトロウイルス療法には大きなメリットがあるにもかかわらず、HIV陽性者(PLWH)は依然として神経認知障害を経験しています。HIV関連神経認知障害(HAND)の神経メカニズムをよりよく理解するためには、神経HIVにおける特定の細胞タイプの関与をさらに解明するためのHIVモデルが不可欠です。
HIV-1ウイルスタンパク質への構成的曝露を有するHIV-1トランスジェニックラットは、HANDに関連する神経認知障害1,2,3,4および神経解剖学的変化5,6,7を調査するために使用される一般的なげっ歯類モデルである。gagドメインとpolドメインの機能的欠失はウイルスの複製を防ぎ、HIV-1トランスジェニックラットを非感染性にします8,9。最近、マウスにおけるキメラHIV(EcoHIV)感染モデルがPotashらによって最初に報告され10、後にラットにも拡大されました。これは、HANDおよび物質使用障害11に関するさらなる研究に有利になる可能性があります。この新しい生物学的システムでは、全身性HIV-1感染が観察され、リンパ球とマクロファージの関与、抗ウイルス免疫応答、神経侵襲性、脳の炎症など、ヒトにおけるHIV-1の多くの臨床的特徴が観察されました。
ミクログリアは、脳機能や恒常性の維持に重要な役割を果たしています。ミクログリアを近縁の細胞種(血液単球、血管周囲マクロファージ、髄膜マクロファージなど)と区別するために、本研究ではTmem119-EGFPノックインマウス系統を使用しました。これまでの研究では、膜貫通タンパク質119(Tmem119)は、げっ歯類およびヒトの脳組織12,13,14,15において、もっぱらミクログリア特異的な発現パターンを示すことが報告されている。Tmem119-EGFPノックインマウスのEGFPシグナルは、脳全体で観察され、ミクログリア細胞に特異的に局在していました。
本研究では、 Tmem119-EGFP ノックインマウスにEcoHIV-mScarletウイルスを接種し、中枢神経系でEcoHIV陽性の細胞を同定しました。ここでは、 Tmem119-EGFP ノックインマウスにおけるEcoHIV-mScarlet接種のプロトコルを提示し、HIVのミクログリア変化を治療的に標的とするための信頼性の高いモデルを提供します。
プロトコル
サウスカロライナ大学の動物管理および使用委員会は、すべての動物プロトコルを承認しました(連邦保証番号:D16-00028)。すべての実験は、国立衛生研究所が 「実験動物の世話と使用に関するガイド」で定めたガイドラインに厳密に従いました。 Tmem119-EGFP ノックインマウス(30日齢、雄、体重23-26g)を市販の供給源から入手し、AAALAC認定施設でグループ飼育しました。すべての動物は、食物と水への自由なアクセスで12/12時間の明暗サイクルの下で飼育されました。この研究で使用された動物、試薬、および機器の詳細は、 資料表に記載されています。
1. 293FTセルのEcoHIV-mScarletパッケージ
- 293 FT細胞をゼラチンでプレコートした75 cm2 フラスコでインキュベートします。トランスフェクション時に細胞を30%コンフルエントに増殖させます。
- 製造元の指示に従って、Lipofectamine 3000(22.5 μL)を使用して、EcoHIV-mScarlet(補足ファイル1)のプラスミドDNA(15 μg)のトランスフェクションを実行します( 材料の表を参照)。
- DMEM培地で10%FBS血清を含む細胞を37°Cで3日間培養します。
- ウイルス懸濁液を含む条件付き培地を収集します。500 g×gで4°Cで 10分間遠心分離します。 10mLピペットで上清を滅菌50mLチューブに移します。.
- ウイルス混合物に一定量のLenti-x濃縮器(1:3の比率)を追加します(たとえば、8 mLの濃縮器と24 mLのウイルス混合物)。チューブを5回静かに反転させます。
- ウイルス-レンチ濃縮器混合物を4°Cで2日間保管します。.1,500 × gで45分間、4°Cで遠心分離します。 ピペットを使用して上澄みをできるだけ慎重に取り除きます。
- 100 mM PBSの200 μLでペレットを再懸濁します。ウイルスは-80°Cで保存します。
注:293FT細胞におけるEcoHIV-mScarletパッケージングの詳細は、以前の研究16で説明されました。ウイルス溶液に渦を巻いたり、気泡を導入したりしないでください。
2. 初代ラット脳細胞におけるEcoHIV-mScarlet感染
- ラット胎児からの一次脳細胞単離(18日後)を、以前に発表された報告16に続いて実施する。
- 解離した細胞を、1 mLのDMEM/F12培地と10% FBSを含むガラスインサートを備えたポリ-L-リジンプレコート12ウェルプレートに移します。翌日、培地をニューロベース培地に交換し、B27サプリメントと交換します。
- 初代胎児脳細胞を5%CO2 インキュベーターで3週間培養します。
- EcoHIV-mScarlet(60 μL、1.26 × 106 TU/mL)を培地に加えます。培養した脳細胞をEcoHIV-mScarletで6日間インキュベートします。
- 細胞を4% PFAで固定し、特異的な一次抗体(CD11b/c、Iba1)を用いて感染した脳細胞に免疫染色を行います。
- 共焦点顕微鏡システム下で40×対物レンズを使用して画像を取得します。
3. 成体マウスの初代グリア細胞におけるEcoHIV-mScarletウイルス感染
- 成体マウスに 5% セボフルランを 5 分間麻酔します (施設で承認されたプロトコルに従います)。頭の皮膚を70%EtOHで滅菌します。
- マウスが有害な刺激に反応しなくなったことを確認したら、滅菌した鋭利なハサミを使用して斬首を行います。5mLのHBSSで満たされた新しいシャーレにヘッドを移します。
- 頭皮を開き、脳組織を滅菌したHBSS5mLを含む別のシャーレに移します。髄膜を剥がし、前頭皮質を2mLのHBSSに移します。
- 20 μLの0.25%トリプシン-EDTAを混合物に加えます。室温で15分間インキュベートします。数分ごとにチューブを静かに回転させます。
- 解離した細胞を、10 mLのDMEM/F12培地と10% FBSを含むポリ-L-リジンプレコート75 cm2 フラスコに移します。
- 細胞を37°C、5%CO2 インキュベーターで、 90%のコンフルエントになるまで培養します。2mLの0.25%トリプシン-EDTAで脳細胞を消化します。
- 脳細胞を5 mLのDMEM/F12増殖培地を含む35 mmガラス底皿に、80%の密度になるまで継代培養します。
- EcoHIV-mScarlet(8 μL、1.26 × 106 TU/mL)を培地に加えます。マウスグリア細胞を2日間インキュベートします。
- 赤色(mScarlet)蛍光シグナルを蛍光顕微鏡で毎日チェックします。
4. Tmem119-EGFP マウスへのEcoHIV-mScarletウイルス眼窩後周窩注射
- 3%セボフルランを使用して、 Tmem119-EGFP マウス(30日齢の雄と雌の両方のマウス)を、有害な刺激に反応しなくなるまで麻酔します。.
- 注射眼を上に向けてマウスを横位置に固定し、麻酔システムにリンクされている鼻円錐を通して呼吸します。適切なノーズコーンサイズを使用して、継続的な麻酔を提供します。
- EcoHIV-mScarletを氷の上で解凍します。ウイルス溶液を33Gの鈍い針で眼内注射器シリンジに充填します。.
- マウスを右側の横臥位に置き、頭を左に向けておきます。内側眼瞼の位置を注射部位として特定します。
- 眼球をプロップした後、針(45度の角度)を眼の内側眼角にゆっくりとゆっくりと挿入します。針を眼球の後ろの血管(眼窩後洞)に慎重に前方に挿入します。
- 6.5 μL の EcoHIV-mScarlet (1.26 ×10 6 TU/mL、両側眼接種) を眼窩後洞に静かに注入します。眼窩後洞から針を慎重に取り外し、まぶたにそっと圧力をかけて止血を行います。
- 角膜が乾燥したり怪我をしたりするのを防ぐために、目に潤滑剤を塗布します。
- マウスが目覚めるまで、加熱パッド付きの回復チャンバーでマウスを回復させます。
注意: 動脈が破裂したり骨折したりしないように、針の斜角を深く配置しすぎないでください。ウイルス注入時間は、複数の要因(例:.、注入量、力価、動物サイズ)。.EcoHIVウイルス注入では、眼窩後注射11,16,17の1週間後に有意な発現が観察されている。
5. 脳組織切片の可視化
- 5%セボフルランを使用してマウスに深く麻酔をかけます。マウスが有害な刺激に対して反応を示さず、反射がない場合、ステップ5.2に進みます。
- マウスを化学ヒュームフード内で仰臥位に保ちます。
- 胸部の正中線に沿って皮膚を開きます。横隔膜を分離し、ハサミで胸を開きます。
- 22 G1 1/2針を左心室に挿入します。ハサミで右のアトリウムを開きます。
- 予め冷却した100 mM PBSの50 mLを灌流します。予め冷却した4%パラホルムアルデヒド緩衝液16を100mL灌流します。
- マウスの脳16全体を取り外す。
- 4%パラホルムアルデヒドで一晩固定します。
- ビブラトームの金属プラットフォームに組織接着剤を使用して脳組織を固定します。炭素鋼ブレードで冠状切片の厚さ50μmを切断します。
- ブラシを使用して、脳のスライスをスライドガラスに置きます。すぐに0.1 mLの退色防止用封入剤を各切片に加えます。
- 22 mm x 50 mmのカバースリップを脳の切片の上に置きます。スーパーフロストスライドを暗闇で1日間乾燥させます。
- 共焦点顕微鏡システムを倍率60×(A/1.4、油彩)に構成し、Z面間隔を0.15μm、ピンホールサイズ30μm、バックプロジェクションピンホール半径167nmに設定します。
- 488 nmおよび594 nmの波長を使用して、関心のある脳領域のマルチチャンネル画像を取得します。
結果
3'末端に「Cla1」、5'末端に「Not1」の酵素部位を含むmScarlet(1858 bp)の断片をpNL4-3-EcoHIVレンチウイルスベクターに挿入しました(図1)。EcoHIV-mScarletの発現を検証するために、ラットE18胚の皮質から単離された初代脳細胞をEcoHIV-mScarlet(60μL、1.26×106TU /mL)で6日間in vitroで処理しました。 図2 のデータは、mScarletの赤色蛍光シグナルが、異なる細胞形態に基づいて主にグリアタイプの細胞に局在していることを示しました。さらに、CD11b/cおよびIba1(ミクログリアの細胞マーカー)標識は、mScarletシグナルがCD11b/c+および/またはIba1+細胞と共局在していることを示した。データは、ミクログリアが in vitroでのEcoHIV-mScarlet分布の主要な細胞タイプであることを示しました。培養細胞には重大な神経感染はありませんでした(補足図1)。
次に、EcoHIV-mScarletの感染を成体マウス初代混合グリア細胞で試験しました。そのために、まず混合グリア細胞を成体マウスから単離および精製し(2か月)、EcoHIV-mScarlet(8μL、1.26×106 TU/mL)に2日間感染させました。 図3 の画像は、EcoHIV-mScarletが成体マウスグリアに感染することに成功したことを示しました。
マウス脳におけるEcoHIV-mScarletの分布パターンをさらに解明するために、特に感染細胞型を特定するために、EcoHIV-mScarletを Tmem119-EGFP ノックインマウス系統に眼窩後から注入し、ミクログリアはEGFPシグナルで特異的に標識され、他のマクロファージタイプの競合はありませんでした5。 図4 の結果( 補足図2にも記載)は、EGFP陽性細胞でmScarlet red蛍光シグナルが観察されたことを示しており、マウスの脳におけるEcoHIV発現の主要な細胞タイプとしてミクログリアが示唆されています。
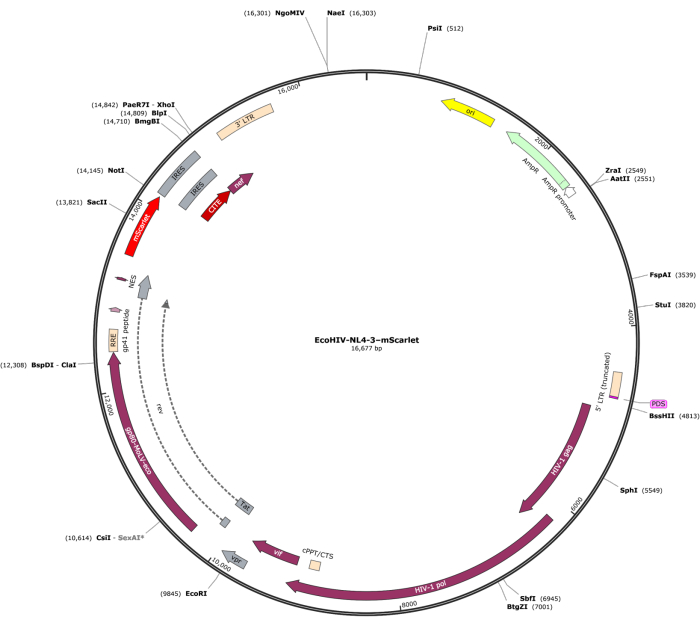
図1:EcoHIV-NL-4-3-mScarletのベクトルマップ。この図の拡大版を表示するには、ここをクリックしてください。
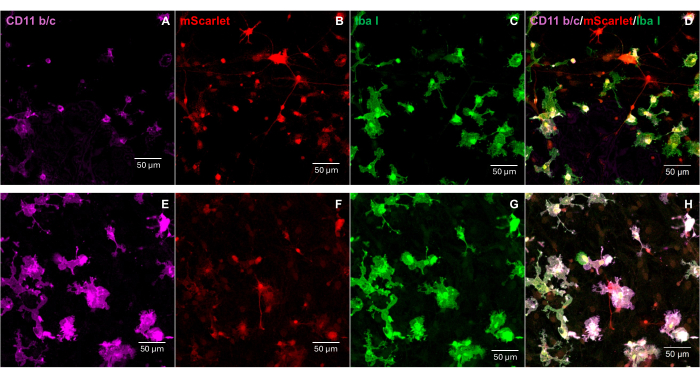
図2:初代ラット脳細胞におけるEcoHIV-mScarlet感染 (A,E)初代脳細胞におけるCD11b/c染色の代表的な画像。脳細胞をE18ラット胚から単離し、EcoHIV-mScarletウイルスに6日間感染させました。(B,F) in vitro 脳細胞からのmScarlet蛍光シグナルの代表的な画像。(C,G)初代脳細胞におけるIba1染色の代表的な画像。(D,H)CD11b/c、mScarlet、Iba1のトリプルラベリングの画像を結合しました。スケールバー:50μmこの 図の拡大版を表示するには、ここをクリックしてください。
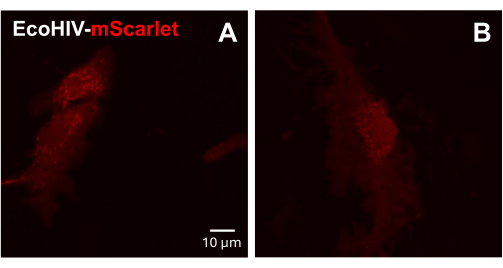
図3:初代マウス混合グリア細胞におけるEcoHIV-mScarlet感染 (A,B) in vitroでのmScarlet分布の代表的な共焦点画像。初代混合グリア細胞は、成体C57BL6マウス(生後2ヶ月)から単離し、ウイルス感染の2週間前に培養しました。EcoHIV-mScarletを培地に2日間加え、共焦点顕微鏡の60×対物レンズで画像を撮影しました。スケールバー:10μmこの 図の拡大版を表示するには、ここをクリックしてください。
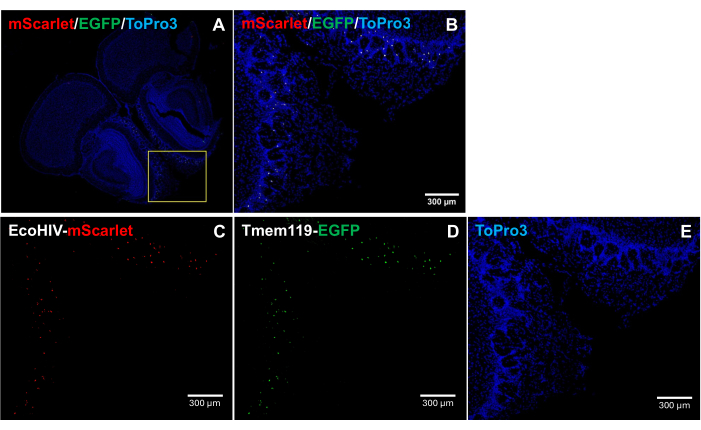
図4: Tmem119-EGFP ノックインマウス系統におけるEcoHIV-mScarletの分布。 (A,B)脳切片のmScarlet/EGFP/ToPro3シグナルの画像を統合しました。黄色枠部分が(B)の対象エリアを示しています。スケールバー:300μm.(C) Tmem119-EGFP ノックインマウス系統の嗅覚領域の外部プレジカル層におけるmScarlet分布の代表的な画像。(D)EGFP分布の代表画像。蛍光シグナルは、 Tmem119-EGFP ノックインマウス系統のミクログリア細胞に局在しました。(E)TO-PRO-3核染色の代表画像。スケールバー:300μmこの 図の拡大版を表示するには、ここをクリックしてください。
補足図1:EcoHIV-mScarletウイルスに感染した初代ラット脳細胞のMAP2およびMOG染色。 スケールバー:50μm. このファイルをダウンロードするには、ここをクリックしてください。
補足図2: Tmem119-EGFP ノックインマウス系統におけるEcoHIV-mScarlet感染の共焦点画像。 スケールバー:75μmこの ファイルをダウンロードするには、ここをクリックしてください。
補足ファイル1:EcoHIV-mScarletプラスミドDNA配列。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
本研究では、(1)新規のEcoHIV-mScarletが in vitroで初代ラット脳細胞に感染することに成功しました。(2)mScarlet、CD11b / c、およびIba1のトリプルラベルにより、 in vitroでラット脳細胞におけるこのEcoHIV発現の主要な細胞タイプとしてミクログリアが特定されました。(3)in vitro で成体由来の初代マウス脳細胞は、EcoHIV-mScarlet感染をさらに証明しています。(4) Tmem119-EGFP ノックインマウス系統のEcoHIV-mScarlet分布は、EcoHIV感染のミクログリア特異的な分布パターンを示した。
新たな研究では、中枢神経系内で同定されたさまざまな種類の脳細胞(ニューロン、アストロサイト、ミクログリア、オリゴデンドロサイトなど)が、HIVおよびHIV関連神経認知障害の間に機能的およびトランスクリプトーム的変化を示すことが示唆されました18,19。例えば、アストロサイトは脳の30%〜70%を占めており、脳の恒常性を維持するための監視を行う20。また、アストロサイトは免疫機能を調節し、特にHIVの脳の炎症や神経変性の状況で、マルチサイトカインやケモカインの分泌を調節します21,22。ミクログリアのHIV感染は、ウイルスタンパク質、炎症誘発性サイトカイン、ケモカインの連続的な放出をもたらすだけでなく、HIVウイルスリザーバー23,24,25,26の主要な供給源も提供します。さらに、活性化されたミクログリアは、CNSにおける重要な免疫学的機能に寄与しています。しかし、活性化が長引くと、HIV進行の神経変性を悪化させる可能性もあります10,27。オリゴデンドロサイトは、いくつかのニューロトロフィン(神経成長因子、脳由来神経栄養因子など)を放出するなど、重要な機能も果たしています28.以前の研究では、エイズ患者の脳内でオリゴデンドロサイトの数が有意に減少したことがわかったが、これはHIVウイルスタンパク質によるオリゴデンドロサイトへの直接的な損傷を示している可能性がある29。したがって、特定の種類のHIVの細胞操作感染モデルは、感染後のさまざまな脳細胞の異なる機能を特定する基本的な手段を提供するはずです。本研究では、キメラHIV(EcoHIV)接種により、HIV-1の特徴を模倣する生物学的システムを開発しました。このHIV接種は、Tmem119-EGFPノックインマウスラインとも組み合わせて、HIVのミクログリア操作げっ歯類モデルを生成し、検証しました。
ただし、本研究の限界を認識する必要があります。 in vitroでmScarlet蛍光シグナルを示すIba1/CD11b/c陰性細胞がいくつかありました。脳マクロファージや周皮細胞などの他の種類の脳細胞がEcoHIV感染に関与している可能性があり、あるいは、細胞培養環境が in vivo 接種に比べて異常な感染パターンを促進する可能性があります。将来的には、全動物実験により、EcoHIV感染過程におけるmScarlet+ミクログリアの機能をさらに明らかにし、脳内のmScarlet+EcoHIVミクログリアの地域分布をさらに定義するはずです。さらに、ミクログリア感染の結果として生じる神経認知障害も、このげっ歯類モデルで対処できます。 全体として、Tmem119-EGFP ノックインマウスのEcoHIV-mScarlet接種は、HIV関連神経認知障害のミクログリア駆動メカニズムを調査するための新しいモデルと研究戦略を提供します。
開示事項
著者のいずれも、宣言すべき利益相反を持っていません。
謝辞
この研究は、NIHの助成金DA059310、DA058586、AG082539、およびGM109091によって資金提供されました。マウントサイナイのアイカーン医科大学のカリ博士からのEcoHIV-NL4-3-EGFPの寛大な贈り物に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 293FT cells | ThermoFisher Scientific | R70007 | |
| 33 G, Small Hub RN Needle, (Point Style: 3, Needle Length: 19.25 mm) | Hamilton | 7803-05 | |
| Antibiotic-Antimycotic solution | Cellgro | 30004CI | 100x |
| C57BL/6-Tmem119em2Gfng/J | The Jackson Laboratory | Strain #:031823 | |
| Corning BioCoat Gelatin 75cm² Rectangular Canted Neck Cell Culture Flask with Vented Cap | Life Technologies | 354488 | |
| Corning DMEM with L-Glutamine, 4.5 g/L Glucose and Sodium Pyruvate | Life Technologies | 10013CV | |
| Cover glass | VWR | 637-137 | |
| Dumont #5 Forceps | World Precision Instruments | 14095 | |
| Dumont #7 Forceps | World Precision Instruments | 14097 | |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | 12362 | |
| Eppendorf Snap-Cap Microcentrifuge Biopur Safe-Lock Tubes | Life Technologies | 22600028 | |
| Feather Double Edge Carbon Steel Blades | Ted Pella, inc. | 121-9 | |
| Fisher BioReagents Microbiology Media: LB Broth, Miller | Fisher Scientific | BP1426-500 | |
| Human recombinant anti-CD11b antibody | Miltenyi Biotec | 130-120-214 | 1:50 dilution |
| Intraocular Injector Syringe (6.5 µL), Removable Needle | Hamilton | 6609071-01 | |
| Invitrogen Lipofectamine 3000 Transfection Reagent | Life Technologies | L3000015 | |
| Invitrogen One Shot TOP10 Electrocomp E. coli | Fisher Scientific | C404052 | |
| Iris Forceps | World Precision Instruments | 15914 | |
| Iris Scissors | World Precision Instruments | 500216 | |
| Lentivirus-Associated p24 ELISA Kit | Cell Biolabs, inc. | VPK-107-5 | |
| Lenti-X Concentrator | Takara | PT4421-2 | |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 11058021 | |
| Paraformaldehyde | Sigma-Aldrich | 158127-500G | |
| Paraformaldehyde | Sigma | P6148 | |
| PELCO easiSlicer Vibratory Tissue Slicer | Ted Pella, inc. | 11000 | |
| PELCO Pro CA44 Tissue Adhesive | Ted Pella, inc. | 10033 | |
| PELCO Pro Specimen Retrievers | Ted Pella, inc. | 101-33 | |
| ProLong Gold | Fisher Scientific | P36930 | |
| Rabbit monoclonal anti-Iba1 antibody | Abcam | ab178847 | 1:500 dilution |
| RN Compression Fitting 1 mm | Hamilton | 55750-01 | |
| Sevoflurane | Merritt Veterinary Supply | 347075 | |
| Sprague Dawley pregnant rat | Inotiv | ||
| SuperFrost Plus Slides | Fisher Scientific | 12-550-154% | |
| To-Pro-3 | ThermoFisher Scientific | T3605 | Nucleus staining kit |
| Trypsin-EDTA (0.25%), phenol red | ThermoFisher Scientific | 25200-056 | |
| Vannas Scissors | World Precision Instruments | 500086 |
参考文献
- Vigorito, M., Lashomb, A. L., Chang, S. L. Spatial learning and memory in HIV-1 transgenic rats. J Neuroimmune Pharmacol. 2, 319-328 (2007).
- Moran, L. M., Booze, R. M., Mactutus, C. F. Time and time again: Temporal processing demands implicate perceptual and gating deficits in the HIV-1 transgenic rat. J. Neuroimmune Pharmacol. 8 (4), 988-997 (2013).
- Repunte-Canonigo,, et al. Gene expression changes consistent with neuroAIDS and impaired working memory in HIV-1 transgenic rats. Mol Neurodegener. 9, 26(2014).
- Reid, W., et al. An HIV-1 transgenic rat that develops HIV-related pathology and immunologic dysfunction. Proc Natl Acad Sci USA. 98 (16), 9271-9276 (2001).
- McLaurin, K. A., Li, H., Booze, R. M., Mactutus, C. F. Disruption of timing: NeuroHIV progression in the post-cART era. Sci Rep. 9, 827(2019).
- Roscoe, R. F., Mactutus, C. F., Booze, R. M. HIV-1 transgenic female rat: Synaptodendritic alterations of medium spiny neurons in the nucleus accumbens. J Neuroimmune Pharmacol. 9 (5), 642-653 (2014).
- Denton, A. R., et al. Selective monoaminergic and histaminergic circuit dysregulation following long-term HIV-1 protein exposure. J NeuroVirol. 25 (4), 540-550 (2019).
- Peng, J., et al. The HIV-1 transgenic rat as a model for HIV-1 infected individuals on HAART. J Neuroimmunol. 218 (1-2), 94-101 (2010).
- Abbondanzo, S. J., Chang, S. L. HIV-1 transgenic rats display alterations in immunophenotype and cellular responses associated with aging. PLoS ONE. 9, e105256(2014).
- Potash, M. J., et al. A mouse model for study of systemic HIV-1 infection, antiviral immune responses, and neuroinvasiveness. Proc Natl Acad Sci USA. 102 (10), 3760-3765 (2005).
- Li, H., McLaurin, K. A., Illenberger, J. M., Mactutus, C. F., Booze, R. M. Microglial HIV-1 expression: Role in HIV-1 associated neurocognitive disorders. Viruses. 13 (5), 924(2021).
- Kaiser, T., Feng, G. Tmem119-EGFP and Tmem119-CreERT2 transgenic mice for labeling and manipulating microglia. eNeuro. 6 (4), (2019).
- Bennett, M. L., et al. New tools for studying microglia in the mouse and human CNS. Proc Natl Acad Sci. USA. 113 (12), E1738-E1746 (2016).
- Satoh, J., et al. TMEM119 marks a subset of microglia in the human brain. Neuropathology. 36 (1), 39-49 (2016).
- Li, H., Aksenova, M., Bertrand, S. J., Mactutus, C. F., Booze, R. M. Quantification of filamentous actin (F-actin) puncta in rat cortical neurons. J Vis Exp. (108), e53697(2016).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. A rat model of EcoHIV brain infection. J Vis Exp. (167), e62137(2021).
- Alfar, H. R., et al. Protocol for optimizing production and quality control of infective EcoHIV virions. STAR Protoc. 4 (3), 102368(2023).
- Malatesta, P., Hartfuss, E., Götz, M. Isolation of radial glial cells by fluorescent-activated cell sorting reveals a neuronal lineage. Development. 127 (24), 5253-5263 (2000).
- Parpura, V., et al. Glutamate-mediated astrocyte-neuron signaling. Nature. 369 (6483), 744-747 (1994).
- Wahl, A., Al-Harthi, L. HIV infection of non-classical cells in the brain. Retrovirology. 20 (1), 1(2023).
- Pandey, H. S., Seth, P. Friends turn foe-astrocytes contribute to neuronal damage in NeuroAIDS. J. Mol. Neurosci. 69 (2), 286-297 (2019).
- Minagar, A., et al. The role of macrophage/microglia and astrocytes in the pathogenesis of three neurologic disorders: HIV-associated dementia, Alzheimer's disease, and multiple sclerosis. J Neurol Sci. 202 (1-2), 13-23 (2002).
- Borrajo, A., Spuch, C., Penedo, M. A., Olivares, J. M., Agís-Balboa, R. C. Important role of microglia in HIV-1 associated neurocognitive disorders and the molecular pathways implicated in its pathogenesis. Ann Med. 53 (1), 43-69 (2021).
- González-Scarano, F., Martín-García, J. The neuropathogenesis of AIDS. Nat Rev Immunol. 5 (1), 69-81 (2005).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. Microglia proliferation underlies synaptic dysfunction in the prefrontal cortex: Implications for the pathogenesis of HIV-1-associated neurocognitive and affective alterations. J. Neurovirol. 29 (4), 460-471 (2023).
- Kim, B. H., et al. EcoHIV infection of primary murine brain cell cultures to model HIV replication and neuropathogenesis. Viruses. 16 (5), 693(2024).
- Réu, P., et al. The lifespan and turnover of microglia in the human brain. Cell Rep. 20 (4), 779-784 (2017).
- Jones, J. D. Potential of glial cell modulators in the management of substance use disorders. CNS Drugs. 34 (7), 697-722 (2020).
- Kaalund, S. S., Johansen, A., Fabricius, K., Pakkenberg, B. Untreated patients dying with aids have loss of neocortical neurons and glial cells. Front Neurosci. 13, 1398(2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved