Method Article
Mikroglia ile Manipüle Edilmiş Transgenik Farelerde EcoHIV ile Enfekte Hücrelerin Tanımlanması
Bu Makalede
Özet
Bu protokol, EcoHIV enfeksiyonunun Tmem119-EGFP fareleri ile kombinasyonunun, HIV ile ilişkili nörobilişsel bozuklukların kemirgen modellerinde mikroglial değişiklikleri ve viral rezervuarları araştırmak için nasıl değerli bir biyolojik sistem sunduğunu açıklar.
Özet
Kombine antiretroviral tedavi (cART), HIV (PLWH) ile yaşayan insanlar için yaşam kalitesini önemli ölçüde iyileştirmiştir. Bununla birlikte, 4 milyondan fazla PLWH elli yaşın üzerindedir ve HIV ile ilişkili nörobilişsel bozukluklara (HAND) eşlik eden deneyimler yaşamaktadır. HIV'in merkezi sinir sistemini nasıl etkilediğini anlamak için güvenilir ve uygulanabilir bir HIV modeli gereklidir. Daha önce, nörobilişsel bozuklukları ve sinaptik disfonksiyonu araştırmak için bir sıçan modelinde kimerik HIV (EcoHIV) aşılaması kullanan yeni bir biyolojik sistem geliştirilmiştir. Bununla birlikte, EcoHIV'in nöroanatomik dağılımını, özellikle de beyindeki çeşitli hücre tiplerindeki diferansiyel ekspresyonunu açıklığa kavuşturmada önemli bir zorluk devam etmektedir. Bu çalışmada, mScarlet floresan etiketlemeli EcoHIV, mikroglia'nın viral ekspresyondan ve beyindeki HIV rezervuarlarından sorumlu ana hücre tipi olup olmadığını belirlemek için Tmem119-EGFP knock-in farelere (esas olarak mikroglia'da gelişmiş yeşil floresan proteini eksprese eden) modifiye edildi ve retro-orbital olarak enjekte edildi. Mevcut veriler şunu göstermektedir: (1) in vitro, EcoHIV-mScarlet floresan sinyalleri, birincil kemirgen beyin hücreleri arasında ağırlıklı olarak mikroglia benzeri hücrelerde lokalize edilmiştir; (2) in vivo, EcoHIV-mScarlet'in Tmem119-EGFP farelerine enjeksiyonu, fare beyninde önemli HIV ekspresyonuna neden oldu. mScarlet ve EGFP sinyallerinin birlikte lokalizasyonu, mikroglia'nın beyinde HIV'i barındıran ana hücre tipi olduğunu düşündürmektedir. Genel olarak, kemirgenlerdeki EcoHIV, mikroglial değişiklikleri, beyindeki viral rezervuarları ve HIV ile ilişkili nörobilişsel bozuklukların nörolojik mekanizmalarını incelemek için değerli bir biyolojik sistem sunar.
Giriş
Antiretroviral tedaviden elde edilen derin faydalara rağmen, HIV (PLWH) ile yaşayan insanlar hala nörobilişsel bozukluklar yaşamaktadır. HIV ile ilişkili nörobilişsel bozukluğun (HAND) nöronal mekanizmalarını daha iyi anlamak için, NeuroHIV'deki spesifik hücre tipi tutulumunu daha fazla aydınlatmak için HIV modellerine kritik bir ihtiyaç vardır.
HIV-1 viral proteinlerine yapısal maruziyeti olan HIV-1 transgenik sıçan, HAND ile ilişkili nörobilişsel bozuklukları 1,2,3,4 ve nöroanatomik değişiklikleri 5,6,7 araştırmak için kullanılan popüler bir kemirgen modelidir. Gag ve pol alanlarının fonksiyonel olarak silinmesi, viral replikasyonu önleyerek HIV-1 transgenik sıçanı enfeksiyöz olmayan hale getirir 8,9. Son zamanlarda, farelerde bir kimerik HIV (EcoHIV) enfeksiyon modeli ilk olarak Potash ve ark.10 tarafından bildirilmiş ve daha sonra sıçanlara genişletilmiştir, bu da EL ve madde kullanım bozuklukları11 ile ilgili daha ileri çalışmalar için avantajlı olabilir. Bu yeni biyolojik sistemde, insanlarda HIV-1'in lenfosit ve makrofaj tutulumu, antiviral immün yanıtlar, nöroinvazivlik ve beyin iltihabı dahil olmak üzere birçok klinik özelliği ile birlikte sistemik HIV-1 enfeksiyonu gözlenmiştir.
Mikroglia, beyin fonksiyonunun ve homeostazın korunmasında özelleşmiş beyinde yerleşik makrofajlar olarak kritik bir rol oynar. Mikroglia'yı yakından ilişkili hücre tiplerinden (örneğin, kan monositleri, perivasküler makrofajlar, meningeal makrofajlar) ayırt etmek için, bu çalışmada Tmem119-EGFP knock-in fare hattı kullanılmıştır. Önceki çalışmalar, transmembran protein 119'un (Tmem119) kemirgen ve insan beyin dokusunda yalnızca mikrogliaya özgü bir ekspresyon paterni sergilediğini bildirmiştir 12,13,14,15. Tmem119-EGFP knock-in farelerdeki EGFP sinyali beyin boyunca gözlendi ve spesifik olarak mikroglial hücrelere lokalize edildi.
Bu çalışmada, Tmem119-EGFP knock-in fareler EcoHIV-mScarlet virüsü ile aşılandı ve merkezi sinir sisteminde EcoHIV için pozitif hücreler tanımlandı. Burada, HIV'deki mikroglial değişiklikleri terapötik olarak hedeflemek için güvenilir bir model sağlayan Tmem119-EGFP knock-in farelerde EcoHIV-mScarlet aşılaması için bir protokol sunuyoruz.
Protokol
Güney Carolina Üniversitesi'ndeki Hayvan Bakımı ve Kullanımı Komitesi, tüm hayvan protokollerini onayladı (federal güvence numarası: D16-00028). Tüm deneyler, Ulusal Sağlık Enstitüleri tarafından Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'nda belirlenen yönergeleri sıkı bir şekilde takip etti. Tmem119-EGFP knock-in fareler (30 günlük, erkek, 23-26 g vücut ağırlığı) ticari bir kaynaktan elde edildi ve AAALAC tarafından akredite edilmiş tesislerde grup halinde barındırıldı. Tüm hayvanlar, yiyecek ve suya ücretsiz erişim ile 12/12 saatlik bir aydınlık-karanlık döngüsü altında barındırıldı. Bu çalışmada kullanılan hayvanların, reaktiflerin ve ekipmanların detayları Malzeme Tablosunda listelenmiştir.
1. 293FT hücrelerinde EcoHIV-mScarlet ambalajı
- 293 FT hücreyi jelatin önceden kaplanmış 75cm2'lik bir şişede inkübe edin. Transfeksiyon sırasında hücrelerin% 30'a kadar büyümesini sağlayın.
- Üreticinin talimatlarını izleyerek Lipofectamine 3000 (22.5 μL) kullanarak EcoHIV-mScarlet'in (Ek Dosya 1) plazmid DNA'sının (15 μg) transfeksiyonunu gerçekleştirin (bkz. Malzeme Tablosu).
- Hücreleri DMEM ortamında% 10 FBS serumu ile 37 ° C'de 3 gün boyunca kültürleyin.
- Viral süspansiyon ile koşullu ortamı toplayın. 500 × g'da 4 °C'de 10 dakika santrifüjleyin. Süpernatanı 10 mL'lik bir pipetle 50 mL'lik steril bir tüpe aktarın.
- Viral karışıma belirli bir miktarda Lenti-x yoğunlaştırıcı (1:3 oranında) ekleyin (örneğin, 24 mL viral karışım ile 8 mL yoğunlaştırıcı). Tüpü beş kez yavaşça ters çevirin.
- Virüs-Lenti yoğunlaştırıcı karışımını 2 gün boyunca 4 °C'de tutun. 1.500 × g, 45 dakika, 4 °C'de santrifüjleyin. Bir pipet kullanarak süpernatanı mümkün olduğunca dikkatlice çıkarın.
- Petiği önceden soğutulmuş 200 μL 100 mM PBS ile yeniden süspanse edin. Virüsü -80 °C'de saklayın.
NOT: 293FT hücrelerinde EcoHIV-mScarlet ambalajının detayları önceki çalışmamızdaaçıklanmıştır 16. Viral çözeltiye girdap yapmayın veya hava kabarcıkları sokmayın.
2. Birincil sıçan beyin hücrelerinde EcoHIV-mScarlet enfeksiyonu
- Daha önce yayınlanan raporu takiben sıçan fetüslerinden (18 gün) birincil beyin hücresi izolasyonunu gerçekleştirin16.
- Ayrışmış hücreleri, 1 mL DMEM / F12 ortamı ve% 10 FBS içeren cam eklere sahip poli-L-Lizin önceden kaplanmış 12 oyuklu plakalara aktarın. Ertesi gün Neurobazal besiyeri için besiyerini B27 takviyesi ile değiştirin.
- Birincil fetal beyin hücrelerini 3 hafta boyunca% 5 CO2 inkübatörde kültürleyin.
- Kültür ortamına EcoHIV-mScarlet (60 μL, 1.26 × 106 TU / mL) ekleyin. Kültürlenmiş beyin hücrelerini EcoHIV-mScarlet ile 6 gün boyunca inkübe edin.
- Hücreleri %4 PFA ile sabitleyin ve spesifik primer antikorlar (CD11b/c, Iba1) kullanarak enfekte beyin hücreleri üzerinde immün boyama yapın.
- Konfokal mikroskopi sistemi altında ×40 objektif kullanarak görüntü elde edin.
3. Yetişkin farelerden alınan primer glia hücrelerinde EcoHIV-mScarlet virüsü enfeksiyonu
- Yetişkin fareleri 5 dakika boyunca% 5 sevofluran ile uyuşturun (kurumsal olarak onaylanmış protokolleri izleyerek). Başın cildini% 70 EtOH ile sterilize edin.
- Farenin artık zararlı uyaranlara yanıt vermediğini onayladıktan sonra, kafa kesme işlemini gerçekleştirmek için sterilize edilmiş keskinleştirilmiş bir makas kullanın. Kafayı 5 mL HBSS ile doldurulmuş yeni bir Petri kabına aktarın.
- Kafa derisini açın ve beyin dokusunu 5 mL sterilize HBSS içeren başka bir Petri kabına aktarın. Meninksleri soyun ve frontal korteksi 2 mL HBSS'ye aktarın.
- Karışıma 20 μL %0.25 Tripsin-EDTA ekleyin. Oda sıcaklığında 15 dakika inkübe edin; Tüpü birkaç dakikada bir hafifçe döndürün.
- Ayrışmış hücreleri, 10 mL DMEM /F12 ortamı ve% 10 FBS içeren poli-L-Lizin önceden kaplanmış 75 cm2 şişeye aktarın.
- 37 ° C'de kültür hücreleri,% 5 CO2 inkübatör, % 90 birleşmeye kadar. Beyin hücrelerini 2 mL% 0.25 Tripsin-EDTA ile sindirin.
- Beyin hücrelerini, %80 birleşmeye kadar 5 mL DMEM / F12 büyüme ortamı içeren 35 mm cam tabanlı kaplara alt kültürleyin.
- Kültür ortamına EcoHIV-mScarlet (8 μL, 1.26 × 106 TU / mL) ekleyin. Fare glial hücrelerini 2 gün boyunca inkübe edin.
- Kırmızı (mScarlet) floresan sinyallerini her gün floresan mikroskobu altında kontrol edin.
4. Tmem119-EGFP farelerine EcoHIV-mScarlet virüsü retroorbital enjeksiyonu
- Tmem119-EGFP farelerini (30 günlükken hem erkek hem de dişi fareler) zararlı uyaranlara artık yanıt vermeyene kadar uyuşturmak için% 3 sevofluran kullanın.
- Fareleri, enjeksiyon gözü yukarı bakacak ve bir anestezi sistemine bağlı olan burun konisi aracılığıyla solunum yapacak şekilde yanal pozisyonda sabitleyin. Sürekli anestezi sağlamak için uygun bir burun konisi boyutu kullanın.
- EcoHIV-mScarlet'i buz üzerinde çözdürün. Viral çözeltiyi 33 G künt iğne ile göz içi enjektör şırıngasına doldurun.
- Fareyi sağ yanal yaslanacak şekilde yerleştirin ve başını sola bakacak şekilde tutun. Medial canthus'un yerini enjeksiyon bölgesi olarak tanımlayın.
- Gözü proptosladıktan sonra, gözün medial kantusuna yavaşça ve nazikçe bir iğne (45 derecelik açı) sokun. İğneyi dikkatlice göz küresinin arkasındaki damarlara (retro-orbital sinüs) yerleştirin.
- Retroorbital sinüse nazikçe 6.5 μL EcoHIV-mScarlet (1.26 × 106 TU / mL, iki taraflı göz aşısı) enjekte edin. İğneyi retro-orbital sinüsten dikkatlice çıkarın ve hemostaz sağlamak için göz kapaklarına hafifçe baskı uygulayın.
- Korneanın kurumasını veya yaralanmasını önlemek için göze kayganlaştırıcı sürün.
- Farelerin uyanana kadar bir ısıtma yastığı ile bir kurtarma odasında iyileşmesine izin verin.
NOT: Atardamarların yırtılmaması veya kemiklerin kırılmaması için iğne eğimi çok derine yerleştirilmemelidir. Viral infüzyon süresi birden fazla faktöre bağlıdır (ör., enjeksiyon hacmi, titre, hayvan boyutu). EcoHIV viral infüzyonu için, retro-orbital enjeksiyonlardan bir hafta sonra anlamlı ekspresyon gözlenmiştir 11,16,17.
5. Beyin dokusu dilimlerinin görselleştirilmesi
- % 5 sevofluran kullanarak fareleri derinlemesine uyuşturun. Fareler zararlı uyaranlara yanıt vermediğinde ve refleksler olmadığında adım 5.2'ye geçin.
- Fareleri kimyasal bir davlumbaz içinde sırtüstü pozisyonda tutun.
- Cildi torasik orta hat boyunca açın. Diyaframı ayırın ve göğsü makasla açın.
- Sol ventriküle 22 G1 1/2 iğnesi yerleştirin. Sağ atriyumu makasla açın.
- 50 mL önceden soğutulmuş 100 mM PBS perfüz. 100 mL önceden soğutulmuş %4 paraformaldehit tamponu16 perfuse.
- Fare beyninin tamamını çıkarın16.
- % 4 paraformaldehit ile gece boyunca sabitleyin.
- Vibratomun metal platformu üzerinde doku yapıştırıcısı kullanarak beyin dokusunu sabitleyin. Karbon çelik bıçaklarla 50 μm kalınlığında koronal bölümler kesin.
- Beyin dilimlerini bir fırça kullanarak cam slaytların üzerine yerleştirin. Hemen her bölüme 0.1 mL antifade montaj ortamı ekleyin.
- Beyin bölümlerinin üzerine 22 mm x 50 mm'lik bir lamel yerleştirin. Süper don slaytlarını karanlıkta 1 gün kurutun.
- Konfokal mikroskop sistemini ×60 büyütme (A/1.4, yağ) olacak şekilde yapılandırın ve iğne deliği boyutu 30 μm ve arkadan projeksiyonlu iğne deliği yarıçapı 167 nm ile 0.15 μm'lik bir Z düzlemi aralığı ayarlayın.
- 488 nm ve 594 nm dalga boylarını kullanarak beynin ilgilendiği bölgelerin çok kanallı görüntülerini elde edin.
Sonuçlar
3' ucunda "Cla1" ve 5' ucunda "Not1" enzim bölgelerini içeren bir mScarlet (1858 bp) fragmanı pNL4-3-EcoHIV lentiviral vektörüne yerleştirildi (Şekil 1). EcoHIV-mScarlet'in ekspresyonunu doğrulamak için, sıçan E18 embriyolarının korteksinden izole edilen birincil beyin hücreleri, in vitro olarak 6 gün boyunca EcoHIV-mScarlet (60 μL, 1.26 × 106 TU / mL) ile tedavi edildi. Şekil 2'deki veriler, mScarlet'in kırmızı floresan sinyallerinin esas olarak farklı hücre morfolojisine dayalı olarak glial hücre tiplerinde lokalize olduğunu göstermiştir. Ayrıca, CD11b/c ve Iba1 (mikroglia için hücre belirteçleri) etiketlemesi, mScarlet sinyallerinin CD11b/c + ve/veya Iba1 + hücreleri ile birlikte lokalize olduğunu gösterdi. Veriler, mikroglia'nın in vitro EcoHIV-mScarlet dağılımının ana hücre tipi olduğunu gösterdi. Kültürlenen hücrelerde önemli bir nöronal enfeksiyon yoktu (Ek Şekil 1).
Daha sonra, EcoHIV-mScarlet enfeksiyonu yetişkin fare primer karışık glial hücreleri üzerinde test edildi. Bunu yapmak için, karışık glia hücreleri önce yetişkin farelerden (2 ay) izole edildi ve saflaştırıldı ve 2 gün boyunca EcoHIV-mScarlet (8 μL, 1.26 × 106 TU / mL) ile enfekte edildi. Şekil 3'teki görüntüler, EcoHIV-mScarlet'in yetişkin fare gliasını başarıyla enfekte ettiğini gösterdi.
EcoHIV-mScarlet'in fare beynindeki dağılım modelini daha fazla ele almak için, özellikle enfekte hücre tipini tanımlamak için, EcoHIV-mScarlet, mikroglia'nın başka herhangi bir makrofaj türü çatışma olmaksızın EGFP sinyalleri ile spesifik olarak etiketlendiği Tmem119-EGFP knock-in fare hattına retro-orbital enjekte edildi5. Şekil 4'teki sonuçlar (ayrıca Ek Şekil 2'de), EGFP pozitif hücrelerde mScarlet kırmızı floresan sinyallerinin gözlendiğini göstermektedir, bu da fare beyinlerinde EcoHIV ekspresyonunun ana hücre tipi olarak mikroglia'yı düşündürmektedir.
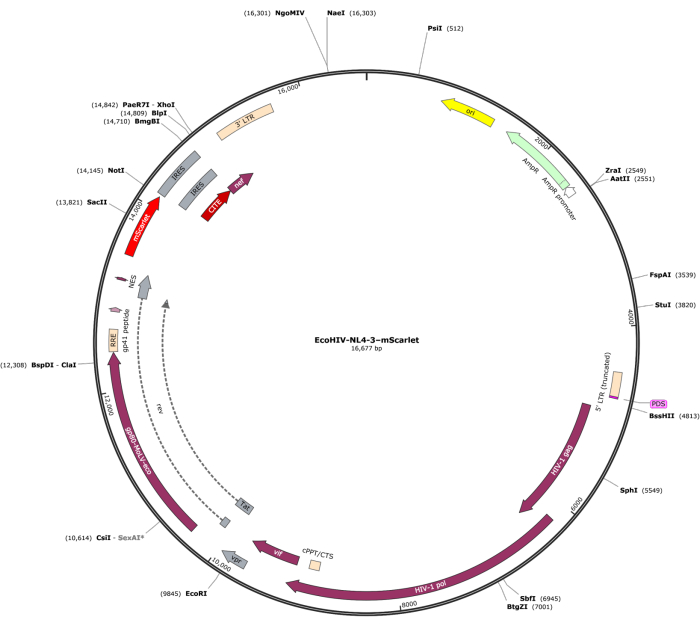
Resim 1: EcoHIV-NL-4-3-mScarlet'in vektör haritası. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
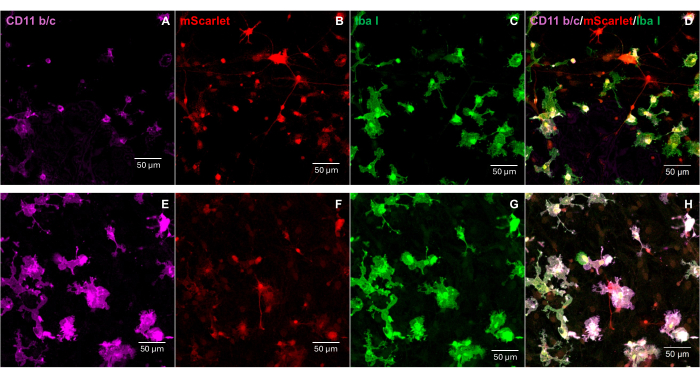
Şekil 2: Primer sıçan beyin hücrelerinde EcoHIV-mScarlet enfeksiyonu. (A,E) Primer beyin hücrelerinde CD11b/c boyamasının temsili görüntüleri. Beyin hücreleri E18 sıçan embriyolarından izole edildi ve 6 gün boyunca EcoHIV-mScarlet virüsü ile enfekte edildi. (B,F) İn vitro beyin hücrelerinden mScarlet floresan sinyallerinin temsili görüntüleri. (C,G) Birincil beyin hücrelerinde Iba1 boyamasının temsili görüntüleri. (D,H) CD11b/c, mScarlet ve Iba1'in üçlü etiketlemesinin birleştirilmiş görüntüleri. Ölçek çubukları: 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
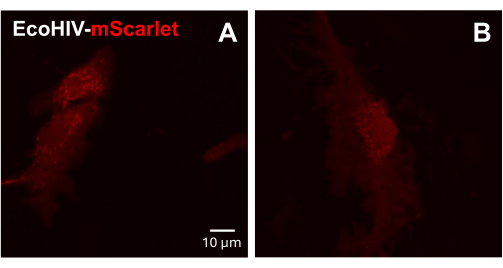
Şekil 3: Primer fare karışık glial hücrelerinde EcoHIV-mScarlet enfeksiyonu. (A,B) mScarlet dağılımının in vitro temsili konfokal görüntüleri. Birincil karışık glia hücreleri, yetişkin C57BL6 farelerinden (2 aylık) izole edildi ve viral enfeksiyondan önce 2 hafta boyunca kültürlendi. EcoHIV-mScarlet, iki gün boyunca kültür ortamına eklendi ve görüntüleri Konfokal mikroskobun ×60 objektifi altında yakaladı. Ölçek çubuğu: 10 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
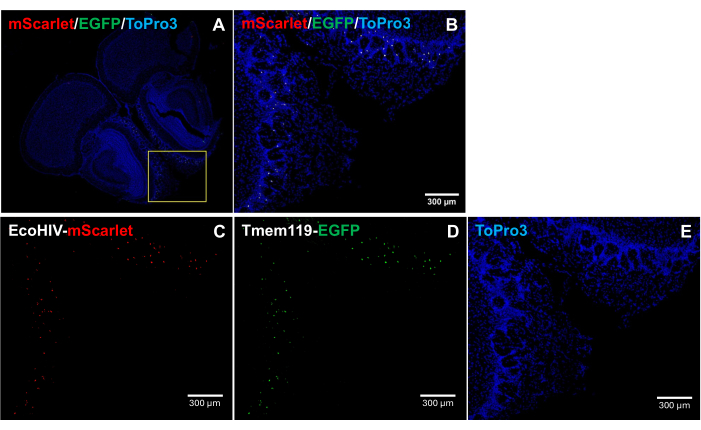
Şekil 4: Tmem119-EGFP knock-in mouse serisinde EcoHIV-mScarlet dağılımı. (A,B) Beyin bölümlerinde mScarlet/EGFP/ToPro3 sinyallerinin birleştirilmiş görüntüleri. Sarı çerçeve (B) hedef alanını gösterir. Ölçek çubuğu: 300 μm. (C) Tmem119-EGFP knock-in mouse serisinin koku alma bölgesinin dış pleksiform tabakasındaki mScarlet dağılımının temsili görüntüsü. (D) EGFP dağıtımının temsili görüntüsü. Floresan sinyaller, Tmem119-EGFP knock-in mouse serisindeki mikroglia hücrelerinde lokalize edildi. (E) TO-PRO-3 çekirdek boyamanın temsili görüntüsü. Ölçek çubukları: 300 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: EcoHIV-mScarlet virüsü ile enfekte olmuş birincil sıçan beyin hücrelerinin MAP2 ve MOG boyaması. Ölçek çubukları: 50 μm. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 2: Tmem119-EGFP knock-in fare hattında EcoHIV-mScarlet enfeksiyonunun konfokal görüntüleri. Ölçek çubukları: 75 μm. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 1: EcoHIV-mScarlet plazmit DNA dizisi. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu çalışmada, (1) yeni EcoHIV-mScarlet'in primer sıçan beyin hücrelerini in vitro olarak başarılı bir şekilde enfekte ettiği; (2) mScarlet, CD11b / c ve Iba1'in üçlü etiketlemesi, in vitro sıçan beyin hücrelerinde bu EcoHIV ekspresyonu için baskın hücre tipi olarak mikroglia'yı tanımladı; (3) yetişkinlerden alınan birincil fare beyin hücreleri in vitro EcoHIV-mScarlet enfeksiyonu hakkında daha fazla kanıt sunar; (4) Tmem119-EGFP knock-in fare serisindeki EcoHIV-mScarlet dağılımı, EcoHIV enfeksiyonunun mikrogliaya özgü bir dağılım modelini göstermiştir.
Ortaya çıkan çalışmalar, merkezi sinir sistemi içinde tanımlanan çeşitli beyin hücresi türlerinin (nöronlar, astrositler, mikroglia, oligodendrositler, vb.) HIV ve HIV ile ilişkili nörobilişsel bozukluklar sırasında fonksiyonel ve transkriptomik değişiklik gösterdiğini göstermiştir18,19. Örneğin, astrositler beynin %30-70'ine katkıda bulunur ve beyin homeostazını korumak için sürveyans yapar20. Astrositler ayrıca bağışıklık fonksiyonunu modüle eder ve özellikle HIV'de beyin iltihabı ve nörodejenerasyon durumunda çoklu sitokinlerin ve kemokinlerin salgılanmasını düzenler21,22. Mikroglia'nın HIV enfeksiyonu sadece viral proteinlerin ve proinflamatuar sitokinlerin ve kemokinlerin sürekli salınımına neden olmakla kalmaz, aynı zamanda HIV viral rezervuarları için baskın kaynaklar sağlar 23,24,25,26. Ayrıca, aktive edilmiş mikroglia, CNS'de kritik bir immünolojik fonksiyona katkıda bulunur; bununla birlikte, uzun süreli aktivasyon, HIV ilerlemesinde nörodejenerasyonu da şiddetlendirebilir10,27. Oligodendrositler ayrıca birkaç nörotrofin (sinir büyüme faktörü, beyin kaynaklı nörotrofik faktör vb.) salınması da dahil olmak üzere önemli bir işlev görür.28. Daha önce yapılan bir çalışma, AIDS hastalarının beyinlerinde oligodendrosit sayısının önemli ölçüde azaldığını buldu, bu da HIV viral proteinlerinden oligodendrositlere doğrudan zarar verebilir29. Bu nedenle, HIV'in spesifik bir hücre tarafından manipüle edilmiş enfeksiyon modeli, enfeksiyonu takiben çeşitli beyin hücrelerinin farklı işlevlerini tanımlamak için temel araçlar sağlamalıdır. Bu çalışmada, kimerik HIV (EcoHIV) aşılaması ile HIV-1'in özelliklerini taklit etmek için biyolojik bir sistem geliştirilmiştir. Bu HIV aşılaması, mikroglia ile manipüle edilmiş bir HIV kemirgen modeli oluşturmak ve doğrulamak için Tmem119-EGFP knock-in fare hattı ile birleştirildi.
Bununla birlikte, bu çalışmanın sınırlılıkları kabul edilmelidir. İn vitro olarak mScarlet floresan sinyalleri sunan birkaç Iba1 / CD11b / c negatif hücre vardı. Beyin makrofajları veya perisitler gibi diğer beyin hücresi türleri EcoHIV enfeksiyonunda rol oynayabilir veya alternatif olarak hücre kültürü ortamı, in vivo aşılamaya göre anormal enfeksiyon modellerini teşvik edebilir. Gelecekte, tüm hayvan çalışmaları, EcoHIV enfeksiyonu sürecinde mScarlet + microglia'nın işlevini daha da netleştirmeli ve mScarlet + EcoHIV microglia'nın beyindeki bölgesel dağılımını daha fazla tanımlamalıdır. Ek olarak, mikroglial enfeksiyonların bir sonucu olarak ortaya çıkan nörobilişsel değişiklikler de bu kemirgen modelinde ele alınabilir. Toplu olarak, Tmem119-EGFP knock-in farelerin EcoHIV-mScarlet aşılaması, HIV ile ilişkili nörobilişsel bozuklukların mikroglial güdümlü mekanizmalarını araştırmak için yeni bir model ve araştırma stratejisi sağlar.
Açıklamalar
Yazarların hiçbirinin beyan edecek çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, NIH hibeleri DA059310, DA058586, AG082539 ve GM109091 tarafından finanse edildi. Mount Sinai'deki Icahn Tıp Okulu'ndan Dr. Potash'ın EcoHIV-NL4-3-EGFP'nin cömert hediyesini takdir ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 293FT cells | ThermoFisher Scientific | R70007 | |
| 33 G, Small Hub RN Needle, (Point Style: 3, Needle Length: 19.25 mm) | Hamilton | 7803-05 | |
| Antibiotic-Antimycotic solution | Cellgro | 30004CI | 100x |
| C57BL/6-Tmem119em2Gfng/J | The Jackson Laboratory | Strain #:031823 | |
| Corning BioCoat Gelatin 75cm² Rectangular Canted Neck Cell Culture Flask with Vented Cap | Life Technologies | 354488 | |
| Corning DMEM with L-Glutamine, 4.5 g/L Glucose and Sodium Pyruvate | Life Technologies | 10013CV | |
| Cover glass | VWR | 637-137 | |
| Dumont #5 Forceps | World Precision Instruments | 14095 | |
| Dumont #7 Forceps | World Precision Instruments | 14097 | |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | 12362 | |
| Eppendorf Snap-Cap Microcentrifuge Biopur Safe-Lock Tubes | Life Technologies | 22600028 | |
| Feather Double Edge Carbon Steel Blades | Ted Pella, inc. | 121-9 | |
| Fisher BioReagents Microbiology Media: LB Broth, Miller | Fisher Scientific | BP1426-500 | |
| Human recombinant anti-CD11b antibody | Miltenyi Biotec | 130-120-214 | 1:50 dilution |
| Intraocular Injector Syringe (6.5 µL), Removable Needle | Hamilton | 6609071-01 | |
| Invitrogen Lipofectamine 3000 Transfection Reagent | Life Technologies | L3000015 | |
| Invitrogen One Shot TOP10 Electrocomp E. coli | Fisher Scientific | C404052 | |
| Iris Forceps | World Precision Instruments | 15914 | |
| Iris Scissors | World Precision Instruments | 500216 | |
| Lentivirus-Associated p24 ELISA Kit | Cell Biolabs, inc. | VPK-107-5 | |
| Lenti-X Concentrator | Takara | PT4421-2 | |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 11058021 | |
| Paraformaldehyde | Sigma-Aldrich | 158127-500G | |
| Paraformaldehyde | Sigma | P6148 | |
| PELCO easiSlicer Vibratory Tissue Slicer | Ted Pella, inc. | 11000 | |
| PELCO Pro CA44 Tissue Adhesive | Ted Pella, inc. | 10033 | |
| PELCO Pro Specimen Retrievers | Ted Pella, inc. | 101-33 | |
| ProLong Gold | Fisher Scientific | P36930 | |
| Rabbit monoclonal anti-Iba1 antibody | Abcam | ab178847 | 1:500 dilution |
| RN Compression Fitting 1 mm | Hamilton | 55750-01 | |
| Sevoflurane | Merritt Veterinary Supply | 347075 | |
| Sprague Dawley pregnant rat | Inotiv | ||
| SuperFrost Plus Slides | Fisher Scientific | 12-550-154% | |
| To-Pro-3 | ThermoFisher Scientific | T3605 | Nucleus staining kit |
| Trypsin-EDTA (0.25%), phenol red | ThermoFisher Scientific | 25200-056 | |
| Vannas Scissors | World Precision Instruments | 500086 |
Referanslar
- Vigorito, M., Lashomb, A. L., Chang, S. L. Spatial learning and memory in HIV-1 transgenic rats. J Neuroimmune Pharmacol. 2, 319-328 (2007).
- Moran, L. M., Booze, R. M., Mactutus, C. F. Time and time again: Temporal processing demands implicate perceptual and gating deficits in the HIV-1 transgenic rat. J. Neuroimmune Pharmacol. 8 (4), 988-997 (2013).
- Repunte-Canonigo,, et al. Gene expression changes consistent with neuroAIDS and impaired working memory in HIV-1 transgenic rats. Mol Neurodegener. 9, 26(2014).
- Reid, W., et al. An HIV-1 transgenic rat that develops HIV-related pathology and immunologic dysfunction. Proc Natl Acad Sci USA. 98 (16), 9271-9276 (2001).
- McLaurin, K. A., Li, H., Booze, R. M., Mactutus, C. F. Disruption of timing: NeuroHIV progression in the post-cART era. Sci Rep. 9, 827(2019).
- Roscoe, R. F., Mactutus, C. F., Booze, R. M. HIV-1 transgenic female rat: Synaptodendritic alterations of medium spiny neurons in the nucleus accumbens. J Neuroimmune Pharmacol. 9 (5), 642-653 (2014).
- Denton, A. R., et al. Selective monoaminergic and histaminergic circuit dysregulation following long-term HIV-1 protein exposure. J NeuroVirol. 25 (4), 540-550 (2019).
- Peng, J., et al. The HIV-1 transgenic rat as a model for HIV-1 infected individuals on HAART. J Neuroimmunol. 218 (1-2), 94-101 (2010).
- Abbondanzo, S. J., Chang, S. L. HIV-1 transgenic rats display alterations in immunophenotype and cellular responses associated with aging. PLoS ONE. 9, e105256(2014).
- Potash, M. J., et al. A mouse model for study of systemic HIV-1 infection, antiviral immune responses, and neuroinvasiveness. Proc Natl Acad Sci USA. 102 (10), 3760-3765 (2005).
- Li, H., McLaurin, K. A., Illenberger, J. M., Mactutus, C. F., Booze, R. M. Microglial HIV-1 expression: Role in HIV-1 associated neurocognitive disorders. Viruses. 13 (5), 924(2021).
- Kaiser, T., Feng, G. Tmem119-EGFP and Tmem119-CreERT2 transgenic mice for labeling and manipulating microglia. eNeuro. 6 (4), (2019).
- Bennett, M. L., et al. New tools for studying microglia in the mouse and human CNS. Proc Natl Acad Sci. USA. 113 (12), E1738-E1746 (2016).
- Satoh, J., et al. TMEM119 marks a subset of microglia in the human brain. Neuropathology. 36 (1), 39-49 (2016).
- Li, H., Aksenova, M., Bertrand, S. J., Mactutus, C. F., Booze, R. M. Quantification of filamentous actin (F-actin) puncta in rat cortical neurons. J Vis Exp. (108), e53697(2016).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. A rat model of EcoHIV brain infection. J Vis Exp. (167), e62137(2021).
- Alfar, H. R., et al. Protocol for optimizing production and quality control of infective EcoHIV virions. STAR Protoc. 4 (3), 102368(2023).
- Malatesta, P., Hartfuss, E., Götz, M. Isolation of radial glial cells by fluorescent-activated cell sorting reveals a neuronal lineage. Development. 127 (24), 5253-5263 (2000).
- Parpura, V., et al. Glutamate-mediated astrocyte-neuron signaling. Nature. 369 (6483), 744-747 (1994).
- Wahl, A., Al-Harthi, L. HIV infection of non-classical cells in the brain. Retrovirology. 20 (1), 1(2023).
- Pandey, H. S., Seth, P. Friends turn foe-astrocytes contribute to neuronal damage in NeuroAIDS. J. Mol. Neurosci. 69 (2), 286-297 (2019).
- Minagar, A., et al. The role of macrophage/microglia and astrocytes in the pathogenesis of three neurologic disorders: HIV-associated dementia, Alzheimer's disease, and multiple sclerosis. J Neurol Sci. 202 (1-2), 13-23 (2002).
- Borrajo, A., Spuch, C., Penedo, M. A., Olivares, J. M., Agís-Balboa, R. C. Important role of microglia in HIV-1 associated neurocognitive disorders and the molecular pathways implicated in its pathogenesis. Ann Med. 53 (1), 43-69 (2021).
- González-Scarano, F., Martín-García, J. The neuropathogenesis of AIDS. Nat Rev Immunol. 5 (1), 69-81 (2005).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. Microglia proliferation underlies synaptic dysfunction in the prefrontal cortex: Implications for the pathogenesis of HIV-1-associated neurocognitive and affective alterations. J. Neurovirol. 29 (4), 460-471 (2023).
- Kim, B. H., et al. EcoHIV infection of primary murine brain cell cultures to model HIV replication and neuropathogenesis. Viruses. 16 (5), 693(2024).
- Réu, P., et al. The lifespan and turnover of microglia in the human brain. Cell Rep. 20 (4), 779-784 (2017).
- Jones, J. D. Potential of glial cell modulators in the management of substance use disorders. CNS Drugs. 34 (7), 697-722 (2020).
- Kaalund, S. S., Johansen, A., Fabricius, K., Pakkenberg, B. Untreated patients dying with aids have loss of neocortical neurons and glial cells. Front Neurosci. 13, 1398(2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır