Method Article
آلية تثبيط Kemeng Fang لموت الخلايا المبرمج في الفئران المصابة باعتلال الكلية الغشائي من خلال مسار إشارات PI3K / AKT
In This Article
Summary
يصف البروتوكول الحالي إنشاء نموذج حيواني لاعتلال الكلية الغشائي (MN) ، وكيف يقلل تثبيط Kemeng Fang من موت الخلايا المبرمج للفئران MN عن طريق تنشيط مسار إشارات PI3K / AKT.
Abstract
اعتلال الكلية الغشائي (MN) هو نوع مرضي شائع من المتلازمة الكلوية للبالغين. يصاب ما يصل إلى 20٪ من المرضى الذين يعانون من MN بمرض كلوي في المرحلة النهائية (ESRD). تلعب الخلايا البودوية وظيفة مهمة في الحفاظ على حاجز الترشيح الكبيبي وتلعب دورا مهما في حدوث وتطور البيلة البروتينية و MN. يشارك مسار إشارات PI3K / AKT في العملية الكاملة لنمو الخلايا البودوية وتمايزها وموت الخلايا المبرمج. Kemeng Fang (KMF) هي تركيبة الطب الصيني التقليدي التي تم استخدامها لتأخير إصابة الكلى. ومع ذلك ، فإن الآلية العلاجية ل KMF في MN غير واضحة. هنا ، تم إنشاء نموذج الفئران MN عن طريق حقن الوريد الإبطي والإربي والذيل لألبومين مصل الأبقار الموجبة (C-BSA) ، ثم تم إعطاء مثبط KMF و PI3K (LY294002). أظهرت بيانات وظائف الكبد ، ووظائف الكلى ، ودهون الدم ، وأمراض الكلى ، ووظيفة الخلايا البودوية ، ومستوى التعبير عن مسار إشارات PI3K / AKT ، ونسخ الفئران أن KMF له تأثير وقائي على خلايا الفئران MN عن طريق تنشيط مسار إشارات PI3K / AKT ، ويمكن أن يمنع بشكل فعال تطور MN.
Introduction
اعتلال الكلية الغشائي (MN) هو نوع مرضي شائع من المتلازمة الكلوية للبالغين ، حيث يبلغ معدل الإصابة السنوي حوالي 5-10 لكل 100,000 فرد. يحدث في الغالب بين سن 30 و 50 وهو نادر عند الأطفال (حوالي 5٪). إنه أكثر انتشارا عند الرجال منه عند النساء (2: 1). علاوة على ذلك ، يصاب ما يصل إلى 20٪ من المرضى الذين يعانون من MN بمرض الكلى في المرحلة النهائية (ESRD). علاوة على ذلك ، هناك اتجاه متزايد حيث يصاب المرضى الذين يعانون من MN ب ESRD عامابعد عام 1 ، 2 ، 3. السمة المرضية ل MN هي أن الغلوبين المناعي الحبيبي G (IgG) ومركب هجوم غشاء النظام التكميلي (MAC) يترسب بشكل كبير في الغشاء القاعدي الكبيبي (GBM) المجاور للخلايا البودوسيات. يؤدي هذا الترسيب إلى سماكة GBM وتعطيل سلامة حاجز الترشيح الكبيبي ، مما يؤدي في النهاية إلى البيلة البروتينية4.
العلاج الداعم ومثبطات المناعة والأجسام المضادة وحيدة النسيلة المستهدفة هي الطرق الرئيسية لعلاج MN. على الرغم من أن هذه التدخلات يمكن أن تقلل بشكل كبير من البيلة البروتينية وتؤخر تطور التدهور الكلوي ، إلا أن لديها أيضا العديد من أوجه القصور. أولا ، العلاج الداعم مناسب فقط للمرضى ذوي المخاطر المنخفضة5. ثانيا ، يمكن أن تسبب مثبطات المناعة ردود فعل سلبية ، مثل نخر رأس الفخذ ، والعدوى الثانوية ، وتثبيط وظيفة المكونة للدم في نخاع العظم6. ثالثا ، هناك حاجة إلى إجراء بحث مكثف في التجارب العشوائية ذات الشواهد لتوفير الطب القائم على الأدلة لاستخدام الأجسام المضادة وحيدة النسيلة مثل أوفاميزوماب وأوتوزوماب وداريتوزوماب وإيساتوكسيماب7،8،9. لذلك ، فإن البحث النشط عن طرق العلاج الفعالة ل MN له أهمية كبيرة في تأخير ظهور ESRD وتحسين نوعية حياة المرضى الذين يعانون من MN.
ترتبط الخلايا البودوية ، والمعروفة أيضا باسم الخلايا الظهارية الحشوية الكبيبية ، بالجانب الخارجي من GBM ، وتشكل البطانة الشعرية GBM معا حاجز ترشيح الدم الكبيبي. لديهم وظائف مهمة ، مثل الحفاظ على حاجز ترشيح البروتين الكبيبي ، وتصنيع الغشاء القاعدي الطبيعي ، وتوفير الدعم الهيكلي للضفيرة الشعرية الكبيبية10،11. أظهرت الأبحاث أن موت الخلايا المبرمج للخلايا البودوية يلعب دورا مهما في حدوث وتطور البيلة البروتينية و MN ، ويشارك مسار إشارات PI3K / AKT في العملية الكاملة لنمو الخلايا البودوية وتمايزها وموت الخلايا المبرمج12،13،14.
أظهر عدد متزايد من الدراسات أن الطب الصيني له مزايا كبيرة في علاج MN ، والذي يمكن أن يقلل بشكل كبير من الكرياتينين في الدم والبيلة البروتينية وإصابة الكلى المتأخرة15،16. KMF هو مركب الطب الصيني التقليدي بمكونات مشتقة من 13 نباتا: Codonopsis pilosula (Franch.) نانف. (دانغشين ، DS) ؛ Astragalus membranaceus (Fisch.) بنجي. (هوانغتشي ، المقر الرئيسي) ؛ القبطية الصينية فرانش. (هوانغليان ، إتش إل) ؛ Perilla frutescens (L.) Britt. (سوي ، SY) ؛ Rehmannia glutinosa (Gaertn.) DC. (Shudihuang ، SDH) ؛ Ligusticum chuanxiong Hort. (Chuanxiong ، CX) ؛ يوريالي فيروكس ساليسب. (تشيانشي ، كيو إس) ؛ سابيا جابونيكا مكسيم. (Qinfengteng ، QFT) ؛ روس تشينينسيس مطحنة (Wubeizi ، WBZ) ؛ اللوبيليا تشينينسيس لور. (بانبيانيان ، BBL) ؛ Oldenlandia diffusa (Willd.) روكسب. (Baihuasheshecao, BHSSC; الجدول 1). لدى KFM العديد من الوظائف ، مثل تنغيم الكلى (تعزيز وظائف الكلى) ، وتعزيز تشي (تقوية المناعة) ، وتعزيز إدرار البول ، وتجريف الضمانات (تعزيز الدورة الدموية). ومع ذلك ، فإن الآلية العلاجية ل KMF في MN غير واضحة17،18.
في الوقت الحاضر ، هناك العديد من الطرق لبناء نماذج MN ، بما في ذلك نموذج التهاب الكلية Heymann ، ونموذج التهاب الكلية C-BSA ، ونموذج الفأر α3NC1 ، حيث نموذج التهاب الكلية Heymann ، لا يوجد بروتين ميجالين المستضد الممرض الرئيسي في MN البشري ، لذلك فهو يختلف عن التسبب في MN البشري ، نموذج الفأر α3NC1 ، فقط الخلفية الجينية DBA / 1 لمعدل نجاح نموذج الفأر أعلى ، كانت بقية الفئران أقل نجاحا في النمذجة ، أو حتى غير قادرة على نمذجتها19،20،21. نموذج التهاب الكلية C-BSA فعال من حيث التكلفة وسهل التشغيل ، كما أن التسبب في المرض يشبه إلى حد كبير نموذج MN البشري19. المبدأ الأساسي هو أنه نظرا لأن GBM سالب الشحنة ، و C-BSA مشحون بشكل إيجابي ، فيمكنه بسهولة عبور GBM ليصبح مستضد مزروعا ، مما يحفز الأجسام المضادة المنتشرة على التراكم هناك لتشكيل مركب مناعي في الموقع ، وبالتالي بناء نموذج MN22،23. كان الهدف من هذه الدراسة هو مراقبة التأثير العلاجي ل KMF على MN وآليتها الجزيئية من خلال مزيج من النسخ والبيولوجيا الجزيئية وتوفير أساس علمي موثوق به لعلاج MN باستخدام KMF.
Protocol
تمت مراجعة هذه الدراسة والموافقة عليها من قبل لجنة إدارة التجريبية واستخدامها التابعة لمركز مقاطعة هوبي لمكافحة الأمراض والوقاية منها (رقم الهوية: 202220144). خضعت الفئران لدورة ضوئية / مظلمة مدتها 12 ساعة في ظل ظروف غير مسببة للأمراض تتراوح من 23 ± 1 درجة مئوية و 50٪ -60٪ رطوبة جوية. اشترينا 100 من ذكور فأر Sprague-Dawley البالغ من العمر 8 أسابيع من مركز مقاطعة هوبي لمكافحة الأمراض والوقاية منها (رقم الترخيص: SYXK [E] 2022-0065) ، وتعرضوا للتغذية التكيفية في بيئة محددة خالية من مسببات الأمراض لمدة أسبوع واحد مع تغذية صيانة عادية وشرب مياه معقمة.
1. تحضير الدواء
- تحضير KMF
- تم توفير الأدوية الصينية المستخدمة من قبل المستشفى التابع لجامعة تشانغتشون للطب الصيني التقليدي ، ويبين التركيب والجرعة المحددة في الجدول 1. للتحضير ، استخدم ما مجموعه 147 جم من الأدوية الخام - Codonopsis pilosula (20 جم) ، Astragalus membranaceus (30 جم) ، Coptis chinensis (3 جم) ، Perilla frutescens (6 جم) ، Rehmannia glutinosa (15 جم) ، Ligusticum chuanxiong (15 جم) ، Euryale ferox (15 جم) ، Sabia japonica (10 جم) ، Rhus chinensis (3 جم) ، Lobelia chinensis (15 جم) ، Oldenlandia diffusa (15 جم). اخلطي وانقعي في 1470 مل من الماء المقطر لمدة 30 دقيقة.
- ضعي الخليط العشبي في قدر خزفي وسخنيه على حرارة 100 درجة مئوية لمدة 90 دقيقة للمغلي. قم بالتصفية من خلال طبقتين من الشاش الطبي واحفظها في درجة حرارة الغرفة.
- أضف الماء المقطر (1470 مل) مرة أخرى إلى الخليط العشبي المتبقي وكرر عملية ديكوتيون المذكورة أعلاه مرة أخرى ، كما هو موضح في الخطوة 1.1.2. قم بتخزين المرشح في درجة حرارة الغرفة.
- امزج المرشحين المذكورين أعلاه وجففهما في الفرن عند 80 درجة مئوية لمدة 10 ساعات حتى يتبخر المحلول المائي تماما ويتم الاحتفاظ بالمذاب فقط على شكل مسحوق.
- قم بوزن المسحوق وقم بإذابه في محلول ملحي لعمل محلول يحتوي على 1.323 جم و 2.646 جم و 5.292 جم من الدواء لكل 4 مل (كانت التركيزات 0.331 جم / مل و 0.662 جم / مل و 1.323 جم / مل على التوالي) ، وهي الجرعة اليومية من الدواء الذي يتم إعطاؤه للفئران.
- تحضير بينادريل هيدروكلوريد
- أضف قرص بينادريل هيدروكلوريد (90 جم) إلى 100 مل من المحلول الملحي ورجه جيدا حتى يذوب تماما.
- تحضير مثبطات PI3K LY294002
- أضف 82.3 مجم من مسحوق LY294002 إلى 1.1 مل من DMSO ورجه جيدا لإذابته تماما. بعد ذلك ، أضف 198.9 مل من المحلول الملحي لتخفيفه للحصول على تركيز 0.41 مجم / مل.
- تحضير مستحلب C-BSA
- أضف 67 مل من الإيثيلين ديامين اللامائي إلى 500 مل من الماء المقطر المزدوج واخلطه. أضف ببطء 350 مل من حمض الهيدروكلوريك 6 M واضبط الرقم الهيدروجيني على 4.75. حافظ على درجة حرارة المحلول النهائي عند 25 درجة مئوية.
- قم بإذابة 5 جم من ألبومين مصل الأبقار الطبيعي في 25 مل من الماء المقطر المزدوج والحفاظ على المحلول عند درجة حرارة ثابتة تبلغ 25 درجة مئوية مع التحريك المستمر. أضف 1.8 جم من هيدروكلوريد كاربوديميد و 30 مل من محلول حمض الخليك 4 M مع درجة الحموضة 4.75 بعد ساعتين للحصول على محلول C-BSA.
- غسيل المحلول الذي تم الحصول عليه في ماء مقطر مزدوج عند 4 درجات مئوية لمدة 72 ساعة (مع تغيير الماء كل 3-5 ساعات) باستخدام ورق السيلينيت وجففه بالتجميد للحصول على مسحوق مجفف بالتجميد C-BSA ، يخزن في -80 درجة مئوية24.
- أضف 100 مجم من مسحوق C-BSA المجفف في 50 مل من المحلول الملحي لتشكيل محلول C-BSA. امزج هذا مع حجم متساو من مساعد فرويند غير المكتمل للاستحلاب الكامل ؛ تركيزه 1 مجم / مل.
- تحضير محلول C-BSA
- أضف 640 مجم من مسحوق C-BSA الجاف في 100 مل من PBS ورجه جيدا لإذابته تماما ؛ تركيزه 6.4 مجم / مل.
2. إنشاء نموذج حيواني MN
ملاحظة: تم تقسيم التجربة إلى ثماني مجموعات: المجموعة الضابطة العادية (CON) ، والمجموعة النموذجية (MOD) ، ومجموعة هيدروكلوريد بينازيبريل (BEN) ، ومجموعة الجرعة المنخفضة KMF (KM-L) ، ومجموعة الجرعة المتوسطة KMF (KM-M) ، ومجموعة الجرعات العالية KMF (KM-H) ، ومجموعة مثبطات PI3K (PI3K) ، ومثبطات PI3K + مجموعة الجرعة المتوسطة KMF (PI3K + KM-M). باستثناء المجموعة الضابطة العادية ، تم إعطاء جميع المجموعات C-BSA لإنتاج نموذج MN.
- في الأسبوع التاسع إجراء التحصين المسبق: الحقن المتعددة تحت الجلد من مستحلب C-BSA في الإبط والفخذ.
ملاحظة: قفظة الرقبة (بين الكتف) هي موقع بديل للإعطاء تحت الجلد لمستحلب C-BSA.- أمسك الجلد الخلفي للفئران باليد اليسرى وأدر بطنها لأعلى مع شد جلد البطن. حقن مستحلب C-BSA تحت الجلد في إبط الفئران والفخذ باستخدام حقنة 2.5 مل بجرعة 1 مل / 400 جم مرة كل يومين لمدة أسبوع واحد.
- التحصين الرسمي: حقن الوريد الذيل لمحلول C-BSA
- في الأسبوع العاشر ، أخرج الفئران من أقفاصها وضعها على غطاء قضيب السلك مع ذيولها في مواجهة المجريب.
- امسح ذيل الجرذ بكرة قطنية كحولية واضغط على جانبي ذيل الجرذ بإبهام والسبابة من اليد اليسرى لملء الوريد وإبقاء الوريد متجها لأعلى.
- أمسك حقنة سعة 1 مل في اليد اليمنى بحيث تكون الإبرة عند 30 درجة إلى وريد الذيل. حافظ على طرف الإبرة مشطوفا لأعلى والإبرة موازية للوعاء فور وخز الجلد برفق. إذا كان هناك أي عودة للدم من الإبرة ، فقم بحقنها مرة أخرى مع جرعة C-BSA 2.5 مل / كجم 3 مرات في الأسبوع لمدة 4 أسابيع.
- بعد الانتهاء من الحقن ، استخدم كرة قطنية جافة للضغط على نقطة الحقن لمدة 1 دقيقة تقريبا لوقف النزيف. قم بإزالة الفئران من مانع الحركة والعودة إلى القفص.
3. تحليل KMF
- قم بوزن عينة 1 جم في أنبوب طرد مركزي سعة 2 مل ، وأضف 600 ميكرولتر من MeOH (مخزن عند -20 درجة مئوية يحتوي على 2-Amino-3- (2-chloro-phenyl) -propionic acid (4 ppm)) ، وقم بدوامة الخليط لمدة 30 ثانية.
- أضف ما يقرب من 100 مجم من الخرزة الزجاجية وضع الخليط في مطحنة المناديل لمدة 90 ثانية عند 60 هرتز.
- قم بإجراء الموجات فوق الصوتية عند 40 كيلو هرتز لمدة 15 دقيقة في درجة حرارة الغرفة.
- جهاز طرد مركزي لمدة 10 دقائق عند 15،984 × جم ، 4 درجات مئوية ، وتصفية المادة الطافية من خلال غشاء 0.22 ميكرومتر. نقل زجاجة الكشف للكشف عن LC-MS.
4. العلاجات الدوائية
ملاحظة: يحتاج البشر البالغون إلى 147 جم كمبر مكعب يوميا. وفقا لصيغة التحويل للجرذ التجريبي وجرعة المخدرات البشرية ، فإن الجرعة التجريبية المكافئة للفئران (جم / كجم) = الجرعة البشرية (جم) / وزن الجسم (70 كجم) × 6.3 ، كانت الجرعة اليومية للفأر حوالي 13.23 جم / كجم.
- في الأسبوع الرابع عشر ، باستخدام اليد اليسرى ، أمسك الجلد على ظهر الفئران ، وقم بتحويل بطنها لأعلى ، وشد جلد البطن. أمسك إبرة حقنة سعة 10 مل في اليد اليمنى وأدخلها في الفم من جانب واحد ، وانزلق على طول الحنك والجدار الخلفي للبلعوم وإلى المعدة باستخدام عملية البلع.
- يجب تطبيق الدواء ببطء باستخدام السبابة في اليد اليمنى وسحب إبرة المعدة للخارج بعد اكتمال الإعطاء. جرعة الدواء المعطاة 10 مل / كجم لمدة إجمالية تبلغ 4 أسابيع.
- بالنسبة لمجموعات CON و MOD ، قم بإعطاء 10 مل / كجم / يوم من المحلول الملحي عن طريق التزقيم.
- بالنسبة لمجموعة BEN ، قم بإعطاء 9 مجم / كجم / يوم محلول مائي بينادريل هيدروكلوريد عن طريق التزقيم.
- بالنسبة لمجموعة KM-L ، قم بإدارة 3.3075 جم / كجم / يوم مستخلص مائي من KMF عن طريق التزقيم. بالنسبة لمجموعة KM-M ، قم بإدارة 6.615 جم / كجم / يوم مستخلص مائي من KMF عن طريق التزقيم. بالنسبة لمجموعة KM-H ، قم بإدارة 13.23 جم / كجم / يوم مستخلص مائي من KMF عن طريق التزقيم.
- بالنسبة لمجموعة PI3K، يتم تطبيق 2.1 ملغم/كغ/يوم LY294002 عن طريق التزقيم.
- بالنسبة لمجموعة PI3K + KM-M ، قم بإعطاء 2.1 مجم / كجم / يوم LY294002 (5 مل / كجم) + 6.615 جم / كجم / يوم مستخلص مائي KMF (5 مل / كجم) عن طريق التزقيم.
5. تقييم فعالية KMF
- الكشف عن المؤشرات الكيميائية الحيوية للدم والبول
- من الأسبوع الرابع عشر فصاعدا ، اجمع البول كل أسبوعين بعد بدء التجربة. ضع فأرا واحدا في قفص استقلابي لمدة 24 ساعة. تقييد النظام الغذائي وتوفير الوصول المجاني إلى مياه الشرب. اجمع البول باستخدام أنبوب طرد مركزي سعة 50 مل يوضع أسفل القفص الأيضي.
- قم بالطرد المركزي للبول عند 15,984 × جم لمدة 10 دقائق واستخدم المادة الطافية لتقدير مستوى البروتين البولي وفقا لتعليمات مجموعة اختبار البروتين البولي.
- في الأسبوع الثامن عشر ، قتل الفئران عن طريق استنشاق 5٪ من الأيزوفلوران. استخدم مرهما بيطري على العينين لمنع الجفاف. تأكيد الوفاة باستخدام طريقة خلع عنق الرحم. أمسك الجلد على ظهر الفئران باليد اليسرى وقم بقص شعيرات الفئران بالمقص.
- تطهير الجلد حول مقل العيون بالإيثانول وإزالة مقل العيون بسرعة باستخدام ملقط مرقئ. اجمع الدم الذي تم إسقاطه في أنبوب الطرد المركزي وجهاز الطرد المركزي لمدة 10 دقائق عند 15,984 × جم بعد الوقوف في درجة حرارة الغرفة لمدة 30 دقيقة. اجمع المادة الطافية.
- الكشف عن ألانين أمينوترانسفيراز (ALT) ، ترانساميناز الأسبارتات (AST) ، الألبومين (ALB) ، الدهون الثلاثية (TG) ، الكوليسترول الكلي (TC) ، نيتروجين اليوريا في الدم (BUN) ، الكرياتينين في الدم (Scr) ، TotalProtein (TP) ومؤشرات الدم الأخرى باستخدام محلل كيميائي حيوي تلقائي.
- فصل الأنسجة الكلوية
- بعد أخذ الدم من الفئران ، قم بتثبيتها على الصفيحة الجراحية ، وقم بقطع طبقة الفراء والعضلات ببطء عند خط الوسط للبطن ، ودفع الأنابيب المعوية مفتوحة لكشف الشريان الأورطي البطني والكلى25.
- سد الشريان الأورطي البطني فوق الكلية اليمنى باستخدام مشابك الشريان الجراحي. قم بتوصيل إبرة فروة الرأس بحقنة سعة 5 مل لثقبها أسفل الكتلة وقم ببث المخزن المؤقت PBS لري الكلى حتى تصبح كلتا الكليتين بيضاء أو شاحبة اللون.
- قم بإزالة الكلى وافصل السمحاق بصراحة. قسمي الكلية اليمنى إلى أنابيب تخزين بالتجميد واحفظيها في الثلاجة عند -80 درجة مئوية. ثبت الكلية اليسرى في محلول بارافورمالدهيد 4٪.
- بعد 24 ساعة من التثبيت ، قم بإزالة الكلى. قم بإجراء الجفاف والشفافية وتضمين البارافين. بعد أن تصلب كتلة الشمع ، قم بتقطيعها بتقطيع مناديل بسمك 3 ميكرومتر ، واصطادها بشريحة مضادة للتفكك ، واخبزي الشرائح على حرارة 98 درجة مئوية لمدة 20 دقيقة ، واحفظيها لمدة26 دقيقة.
- التحليل النسيجي المرضي الكلوي
- أخضع الأقسام لإزالة الشمع المتدرج من الزيلين وتجفيف الإيثانول اللامائي وشطفه باستخدام الماء المقطر. يخضع للزيلين لمدة 15 دقيقة ، متبوعا بمحلول الزيلين الطازج لمدة 15 دقيقة. قم بالتبديل إلى الإيثانول اللامائي لمدة 5 دقائق ، وقم بالتغيير إلى الإيثانول اللامائي الطازج لمدة 5 دقائق ، متبوعا بنسبة 90٪ من الإيثانول لمدة 5 دقائق ، ثم 80٪ إيثانول لمدة 5 دقائق ، ثم 70٪ إيثانول لمدة 5 دقائق ، وأخيرا اغسل بالماء المقطر.
- اتبع التعليمات الخاصة بتلوين الهيماتوكسيلين - اليوزين (H & E) ، ومجموعات تلطيخ الأحماض الدورية (PAS) ، ومجموعات تلطيخ ماسون لتلوين العينات.
- قم بإجراء جفاف الإيثانول اللامائي المتدرج وإزالة الزيلين مرة أخرى.
- ضعي الشرائح في حاضنة بدرجة حرارة ثابتة ، واضبطي درجة الحرارة على 90 درجة مئوية ، واخبزيها لمدة 20 دقيقة. بعد الخبز ، أزيلي الشرائح وأضيفي العلكة المحايدة. قم بتغطيتها بغطاء زجاجي.
- راقب تحت المجهر الضوئي بتكبير 200x واجمع الصور.
- تحليل التألق المناعي (IF) للأنسجة الكلوية
- إزالة الشمع من الأقسام وتجفيفها كما هو موضح في الخطوة 5.3.1. ضع العينات في محلول عازل 0.01 M EDTA للتثبيت عالي الضغط والحرارة العالية (125 درجة مئوية عند 103 كيلو باسكال) لمدة 15 دقيقة. دع العينة تبرد بشكل طبيعي ، واغسل 3 مرات لمدة 3 دقائق لكل منها في PBS.
- ضع الأقسام في محلول بيروكسيد الهيدروجين بنسبة 3٪ واحتضانها لمدة 10 دقائق. اغسل العينات 3 مرات لمدة 5 دقائق لكل منها في PBS. بعد ذلك ، ضع الأقسام في مصل الماعز بنسبة 10٪ ، واحتضنها لمدة 30 دقيقة ، واغسلها 3 مرات لمدة 3 دقائق لكل منها في PBS.
- أضف الجسم المضاد الأساسي IgG (1: 100) و C3 (1: 100) بالتنقيط واحتضانه في صندوق مبلل عند 4 درجات مئوية طوال الليل. تظهر نسبة تخفيف الأجسام المضادة الأولية في الجدول 2. أخرجي الأقسام من الثلاجة واغسليها باستخدام TBST 3x لمدة 3 دقائق لكل منهما.
- أضف الجسم المضاد الثانوي الفلوري (1: 100) بالتنقيط ، واحتضن عند 37 درجة مئوية لمدة ساعة واحدة ، واغسله باستخدام TBST 3x لمدة 3 دقائق لكل منهما.
ملاحظة: يجب تنفيذ هذه الخطوة وجميع الخطوات اللاحقة في الظلام27،28. - احتضن مع 4 '، 6-diamidino-2-phenylindole (DAPI) لمدة 5 دقائق في درجة حرارة الغرفة وتجنب الضوء ، واغسلها بمحلول ملحي مخفض ب tris مع tween 20 (TBST) 3x لمدة 5 دقائق لكل منهما لإزالة DAPI الزائد.
- أضف مروي التألق الذاتي في دائرة ، واحتضنه لمدة 5 دقائق ، واشطفه بالماء الجاري لمدة 10 دقائق. رج الأقسام وجففها وأغلقها باستخدام مانع تسرب مضاد للتألق. راقب تحت المجهر الفلوري عند 200x واجمع الصور.
- تحليل الكيمياء المناعية (IHC) لأنسجة الكلى
- إزالة الشمع من الأقسام وتجفيفها كما هو موضح في الخطوة 5.3.1. إصلاح تحت ضغط عال (125 درجة مئوية · 103 كيلو باسكال) في محلول عازل 0.01 متر EDTA لمدة 15 دقيقة. بعد التبريد الطبيعي ، اغسلها باستخدام PBS 3x لمدة 3 دقائق لكل منهما.
- منع بيروكسيداز داخلي المنشأ وطريقة تشغيل ختم المصل كما هو موضح في الخطوة 5.4.2.
- أضف الجسم المضاد الأساسي WT-1 (1: 200) و Nephrin (1: 100) بالتنقيط واحتضنه في صندوق مبلل في الثلاجة عند 4 درجات مئوية بين عشيةوضحاها 29.
- قم بإزالة الأقسام من الثلاجة 4 درجات مئوية ، واغسلها باستخدام PBS 3x لمدة 5 دقائق لكل منها. أضف الجسم المضاد الثانوي (1: 200) بالتنقيط ، واحتضن عند 37 درجة مئوية لمدة 30 دقيقة ، واغسله باستخدام PBS 3x لمدة 3 دقائق لكل منهما.
- أضف قطرات من محلول كروموجينيك ديامينوبنزيدين (DAB) المحضر حديثا وراقب تحت المجهر الضوئي عند 200x. الإشارة الإيجابية هي أصفر بني أو بني مائل للبني. اغسل محلول التلوين على الفور بماء الصنبور عند ملاحظة تغير اللون في القسم.
- استخدم الهيماتوكسيلين للتخلص لمدة 3 دقائق ، ثم أضف 1٪ كحول حمض الهيدروكلوريك للتمايز واشطفه بماء الصنبور لمدة 10 دقائق.
- قم بتجفيف الأقسام ، وشفافة ، وإغلاقها ، كما هو موضح في الخطوة 5.2.4. راقب تحت المجهر الضوئي عند 200x واجمع الصور.
- تحليل تلطيخ ملصقات نهاية dUTP بوساطة ديوكسي نيوكليوتيديل ترانسفيراز الطرفية (TUNEL) للأنسجة الكلوية
- استخدم الخطوة 5.3.1 لإزالة البارافينات وتجفيف الأقسام. ارسم دوائر حول الأنسجة باستخدام قلم الكيمياء المناعية وأضف 100 ميكرولتر من محلول عمل البروتيناز K بالتنقيط إلى كل عينة. احتضن عند 37 درجة مئوية لمدة 20 دقيقة ، واغسله باستخدام PBS 3x لمدة 5 دقائق لكل منهما ، وقم بتخزين العينات المعالجة في صندوق مبلل.
- ضع الأقسام في محلول بيروكسيد الهيدروجين بنسبة 3٪ ، واحتضنها لمدة 10 دقائق ، واغسلها باستخدام PBS 3x لمدة 5 دقائق لكل منها.
- أضف عازلة التوازن (100 ميكرولتر) بالتنقيط إلى الدائرة لتغطية الأنسجة واحتضانها لمدة 20 دقيقة في درجة حرارة الغرفة.
- أضف 50 ميكرولتر من محلول عمل وضع العلامات (محلول التوازن: محلول وضع العلامات الفلورية: إنزيم TDT = 35 ميكرولتر: 10 ميكرولتر: 5 ميكرولتر) بالتنقيط لكل عينة ، واحتضانه في صندوق مبلل عند 37 درجة مئوية لمدة 60 دقيقة ، محمي من الضوء ، واغسله باستخدام PBS 3x لمدة 5 دقائق لكل منهما.
- أضف DAPI واحتضنه باستخدام DAPI لمدة 5 دقائق في درجة حرارة الغرفة تحت الضوء ، واغسله باستخدام PBS 3x لمدة 5 دقائق لكل منهما.
- بعد أن تم رج الأقسام جافة وإغلاقها باستخدام مادة مانعة للتسرب مضادة للمضان ، راقب تحت المجهر الفلوري عند 200x واجمع الصور.
- تحضير عينة للتحليل المجهري الإلكتروني للأنسجة الكلوية
- قم بإصلاح أنسجة الكلى بنسبة 2.5٪ من الجلوتارالديهايد عند 4 درجات مئوية لمدة 2-4 ساعات وغسل 3 مرات لمدة 15 دقيقة لكل منها في PBS.
- ثبت حمض الأوزميوم (1٪) في درجة حرارة الغرفة بعيدا عن الضوء لمدة ساعتين واغسلها باستخدام PBS 3x لمدة 15 دقيقة لكل منهما.
- قم بإجراء تجفيف الكحول والأسيتون المتدرج ، باستخدام الأسيتون وعامل التضمين انغمس في تدرجات 1: 1 و 1: 2 و 1: 31 لمدة 2 ساعة و 4 ساعات و 8 ساعات على التوالي. بعد ذلك ، استخدم عامل التضمين النقي وقم بتضمين العينات عند 37 درجة مئوية طوال الليل.
- بعد 8 ساعات ، ضع اللوحة المدمجة في فرن 60 درجة مئوية للبلمرة لمدة 48 ساعة. قم بتقطيع كتلة الراتنج المعالجة أعلاه في قطاعة رفيعة للغاية ، بسماكة شريحة مضبوطة على 60-80 نانومتر ؛ استخدم شبكة نحاسية لإخراج الشرائح.
- استخدم محلول خلات بيروكسيد الهيدروجين بنسبة 2٪ والكحول للتلطيخ لمدة 8 دقائق ، متبوعا بغسل 70٪ من الإيثانول والماء عالي النقاء 3x. استكمل بالغسيل بنسبة 2.6٪ إيثانول وماء فائق النقاء.
- مراقبة والحصول على الصور تحت المجهر الإلكتروني الناقل.
- تحليل مقايسة تفاعل البوليميراز المتسلسل الكمي في الوقت الحقيقي (qRT-PCR)
- أضف 20 ملجم من أنسجة الكلى المجمدة إلى أنبوب الطرد المركزي الدقيق وطحنها جيدا باستخدام مطحنة أنسجة عالية السرعة حتى لا تكون هناك كتلة أنسجة مرئية.
- اجمع المادة الطافية بعد الطرد المركزي عند 15,984 × جم لمدة 10 دقائق. أضف 250 ميكرولتر من الكلوروفورم واقلب الأنبوب لمدة 15 ثانية ؛ يتم خلط المحلول جيدا. اتركيه للوقوف في درجة حرارة الغرفة لمدة 3 دقائق ، ثم جهاز الطرد المركزي عند 15,984 × جم لمدة 10 دقائق عند 4 درجات مئوية.
- اجمع المرحلة المائية العلوية وانقلها إلى أنبوب طرد مركزي جديد خال من RNase. أضف حجما متساويا من 70٪ من الإيثانول (تحضير ماء خال من RNase) ، واقلبها واخلطها.
- أضف المحلول إلى عمود الممتزات الذي تم تحميله في أنبوب التجميع لغسل الحمض النووي الريبي. بعد غسل Buffer RW ، اترك العمود في درجة حرارة الغرفة لمدة 5 دقائق حتى يجف.
- ضع العمود في أنبوب طرد مركزي جديد خال من RNase ، وأضف 30-50 ميكرولتر من الماء الخالي من RNase إلى منتصف العمود ، واتركه في درجة حرارة الغرفة لمدة دقيقة واحدة ، ثم جهاز الطرد المركزي عند 15,984 × جم لمدة دقيقة واحدة. اجمع محلول الحمض النووي الريبي وقم بتخزينه عند -80 درجة مئوية.
- قم بإزالة محلول الحمض النووي الريبي من الفريزر وقم بتغيير طبيعته مسبقا عند 90 درجة مئوية لمدة 10 دقائق ، متبوعا ب 40 دورة من 95 درجة مئوية لمدة 15 ثانية ، و 60 درجة مئوية لمدة 35 ثانية ، و 72 درجة مئوية لمدة 25 ثانية ، وأخيرا في ترتيب 95 درجة مئوية لمدة 15 ثانية ، و 60 درجة مئوية لمدة 60 ثانية ، و 95 درجة مئوية لمدة 15 ثانية (الجدول التكميلي 1).
- باستخدام β-actin كمرجع داخلي ، احسب التعبير النسبي ل WT-1 و Nephrin باستخدام طريقة 2 ¬-ΔΔCt بناء على قيمة Ct لكل عينة (ΔΔCt = قيمة Ct للجين المستهدف - قيمة Ct للجين المرجعي الداخلي) 30. يتم عرض معلومات مفصلة عن الاشعال في الجدول 3.
- تحليل اللطخة الغربية (WB)
- تحضير المحللة وفقا لنسبة مثبط البروتياز: مثبط الفوسفاتيز: RIPA = 1: 1: 100 ، وأضف 500 ميكرولتر من المحللة إلى أنبوب الطرد المركزي الدقيق.
- أضف 100 مجم من أنسجة الكلى المجمدة إلى أنبوب الطرد المركزي الدقيق وطحنها جيدا باستخدام مطحنة أنسجة عالية السرعة حتى لا تكون هناك كتلة أنسجة مرئية.
- قم بإزالة أنبوب الطرد المركزي الدقيق ، وقم بعمل اللزل على الجليد لمدة 30 دقيقة ، ثم جهاز الطرد المركزي عند 15,984 × جم لمدة 10 دقائق. استنشاق المادة الطافية وتخزينها عند -80 درجة مئوية.
- اكتشف تركيز البروتين وفقا لتعليمات مجموعة فحص تركيز البروتين لحمض البيسنكونينيك (BCA) وأضف محلول PBS بالتنقيط لضمان تركيز ثابت للبروتين في كل مجموعة.
- أضف 5x مخزن مؤقت لأخذ عينات البروتين إلى أنبوب الطرد المركزي الدقيق ، واحتضنه عند 100 درجة مئوية لمدة 15 دقيقة لتشويه طبيعته بالكامل ، ثم قم بإزالته بعد التبريد.
- افصل البروتينات عن طريق الرحلان الكهربائي للهلام SDS-PAGE بنسبة 12.5٪ ، باستخدام 80 فولت أولا ، مما يتسبب في ضغط جميع العينات في خط أزرق مسطح ، ثم ضبط الجهد على 130 فولت ، حتى ينفد اللون الأزرق البروموفينول من أسفل لوحة الهلام. أوقف الرحلان الكهربائي.
- قم بإزالة الجل. بلل ورق الترشيح بمخزن مؤقت لنقل الغشاء. قم بتنشيط غشاء فلوريد البولي فينيلدين (PVDF) في الميثانول لمدة 30 ثانية. بعد ذلك ، رتب كل شيء بالترتيب التالي: شبكة إسفنجية / ورق ترشيح / هلام / غشاء PVDF / ورق ترشيح / ورق ترشيح / شبكة إسفنجية في المشبك المستخدم لنقل الغشاء.
- ضع الجل في القطب السالب ، وغشاء PVDF في القطب الموجب ، وانقل الغشاء بتيار 200 مللي أمبير لمدة 90 دقيقة.
- قم بإزالة غشاء PVDF واغسله باستخدام TBST مرة واحدة لمدة 5 دقائق. أضف محلول الإغلاق في درجة حرارة الغرفة أثناء رجه لمدة 90 دقيقة. يغسل ب TBST 3x لمدة 5 دقائق لكل منهما.
- أضف الأجسام المضادة الأولية PI3K (1: 1000) ، PIK3CA (1: 1000) ، AKT (1: 1000) ، P-AKT (1: 1000) ، BAD (1: 1000) ، P-BAD (1: 1000) ، BCL-2 (1: 1000) ، bax (1: 4000) ، و c-caspase3 (1: 1000) واحتضانها في صندوق مبلل طوال الليل عند 4 درجات مئوية في الثلاجة31،32.
- قم بإزالة غشاء PVDF من الثلاجة 4 درجات مئوية ، واغسله باستخدام TBST 3x لمدة 5 دقائق لكل منهما. أضف الجسم المضاد الثانوي (1: 10,000) بالتنقيط ، واحتضانه عند 37 درجة مئوية لمدة 90 دقيقة ، واغسله باستخدام TBST 3x لمدة 3 دقائق لكل منهما.
- قم بإعداد المحلول المطور وفقا للنسبة (A: B = 1: 1) وتطويره على الجهاز حسب التعليمات.
النتائج
نتائج تحليل مكونات KMF
في أوضاع الأيونات الموجبة والسالبة التي تم تحليلها بواسطة LC-MS / MS ، تم تحديد 147 و 120 مركبا ، على التوالي (الشكل 1 أ - ب). تظهر بعض المركبات ووزنها الجزيئي المحسوب بواسطة MF ، وقيمة m / z ، ووقت الاحتفاظ ، والأيونات الأم في الجدول التكميلي 2.
حسنت KMF اضطرابات التمثيل الغذائي للدهون وإصابة الكبد والكلى في فئران مينيسوتا
باستخدام فئران SD و C-BSA ، أنشأنا نموذج MN. بعد أسبوع واحد من حقن وريد الذيل من C-BSA ، أظهرت الفئران MN درجات متفاوتة من التعب العقلي ، وانخفاض الشهية ، والنمو البطيء ، ولون الشعر الباهت ، والفراء الرقيق ، وتأخر الاستجابة ، وفقدان الوزن ، مع إصابة بعض الفئران بوذمة كيس الصفن. بعد 4 أسابيع من الإعطاء ، خفضت جرعات مختلفة من KMF بشكل كبير مستويات التعبير عن البروتين الكلي للبول لمدة 24 ساعة (24 ساعة-UTP) ، Scr ، و BUN ، مما أدى إلى تحسين وظيفة الكلى (الشكل 2A-C) ؛ انخفاض مستويات تعبير ALT و AST وزيادة مستويات التعبير TP و ALB ، وتعزيز وظائف الكبد (الشكل 2D-G) ؛ قلل من مستويات التعبير عن TC و TG ، وحسن وظيفة تنظيم الدهون (الشكل 2H-I). تشير هذه النتائج إلى أن KMF له تأثير وقائي على وظائف الكلى. ومع ذلك، فإن آلية عملها المحددة ليست واضحة بعد.
يحسن KMF الضرر النسيجي المرضي للأنسجة الكلوية في فئران MN
لاختبار ما إذا كان KMF يمكن أن يحسن إصابة الكلى في فئران MN ، باستخدام H & E و PAS و Masson و IF التي اكتشفت تلفا نسيجيا مرضيا للأنسجة الكلوية. أظهر تلطيخ H & E و PAS تضخما كبيبيا ، وانتشارا خفيفا للخلايا المتوسطة ، وتمدد أنبوبي كلوي ، وتنكس فراغي للخلايا الظهارية الأنبوبية الكلوية في مجموعة MOD (الشكل 3 أ). أظهر تلطيخ ماسون زيادة كبيرة في منطقة التليف الكلوي في مجموعة MOD (الشكل 3B-C). أظهر التألق المناعي أن شدة التألق النسبية ل IgG و C3 في مجموعة MOD كانت أعلى بكثير من تلك الموجودة في مجموعة CON (الشكل 3D-F). بعد إعطاء مثبطات KMF أو BEN أو PI3K + KM-M ، تم تقليل درجة تضخم الكبيبات ، وكذلك درجة تكاثر الخلايا المربوطة ، وتم تقليل مساحة التليف الكلوي بشكل كبير ، وكانت شدة التألق النسبي ل IgG و C3 أقل بكثير. تشير هذه النتائج إلى أن KMF يمكن أن يخفف من الضرر المرضي الكلوي في فئران MN.
يخفف KMF من تلف الخلايا البودوية عن طريق تنشيط مسار إشارات PI3K / AKT
لوحظ أيضا تلف الخلايا البودية الرئيسية في MN باستخدام الطرق الموضحة هنا ، وهي IHC و PCR و TUNEL و TEM. أظهرت نتائج IHC و PCR أنه بالمقارنة مع مجموعة CON ، كان لدى مجموعة MOD انخفاض كبير في مستويات التعبير عن بروتينات العلامات الوظيفية الخاصة بالخلايا البودوية ، WT-1 و Nephrin، مما يشير إلى تلف الخلايا البودوية ، بينما يزيد علاج KMF من مستويات التعبير عن WT-1 و Nephrin ويخفف من تلف الخلايا البودوية (الشكل 4A-E). أظهرت نتائج تلطيخ TUNEL موت الخلايا المبرمج الشديد للخلايا البودوية في مجموعة MOD ، بينما قلل علاج KMF بشكل كبير من شدة التألق وقلل من حدوث موت الخلايا المبرمج (الشكل 4F-G). أظهرت نتائج TEM أن الغشاء القاعدي للكبيبة في مجموعة MOD كان سميكا بشكل غير متساو بشكل ملحوظ ، وأظهرت الميتوكوندريا للخلايا البودية تورما شديدا ومصفوفة متناثرة وقصفا فارغا للمصفوفة ، مع انخفاض أو غياب. بعد إعطاء KMF ، تم تقليل سماكة الغشاء القاعدي الكبيبي بشكل كبير ، وتم استعادة مورفولوجيا الميتوكوندريا البودوكسية بشكل كبير (الشكل 4H). تشير هذه النتائج إلى أن KMF يمكن أن يخفف من تلف الخلايا البودوية في فئران MN.
كشف الكشف الإضافي عن التعبير عن البروتينات المرتبطة بمسار إشارات PI3K / AKT26،27 بواسطة WB أنه بالمقارنة مع مجموعة CON ، أظهرت مجموعة MOD زيادة كبيرة في مستويات التعبير عن PI3K و PIK3CA و AKT و P-AKT و BAD و BAX و C-caspase3 ، بينما انخفضت مستويات التعبير عن P-BAD و BCL-2 بشكل كبير. بينما يقلل علاج KMF من مستويات التعبير عن PI3K و PIK3CA و AKT و P-AKT و BAD و BAX و C-caspase3 ، فإنه يزيد من مستويات التعبير عن P-BAD و BCL-2 (الشكل 4I-J). تشير هذه النتائج أيضا إلى أن KMF يمكن أن يحسن تلف الخلايا البودوية في فئران MN عن طريق تنشيط مسار إشارات PI3K / AKT.
استكشاف الآليات الممكنة لعلاج KMF ل MN بناء على النسخ
للكشف بشكل أكبر عن الأهداف والآليات المحتملة ل KMF في علاج MN ، تم إجراء تحليل نسخي بناء على علامة الكتلة الترادفية (TMT). أظهرت النتائج أن هناك 898 جينا معبر عنه تفاضليا (DEGs) بين مجموعات CON و MOD ، بما في ذلك 372 جينا منظما و 526 جينا منخفضا (الشكل 5A-B). وبالمثل ، كان هناك 360 DEGs بين مجموعات KM-L و MOD ، بما في ذلك 202 جينا منظما و 158 جينا منخفضا (الشكل 5C-D). لتحديد الجينات ومسارات الإشارات التي قد تتأثر ، تم إجراء التحليل الوظيفي لتخصيب الأنطولوجيا الجينية (GO) وموسوعة كيوتو للجينات والجينومات (KEGG) (الشكل 5E-H). أظهرت النتائج أن العمليات البيولوجية ل DEG تركز بشكل أساسي على العمليات الخلوية والتنظيم البيولوجي ، بينما تركز وظائف DEG بشكل أساسي على تفاعلات مستقبلات الترابط العصبية ، مثل مسارات إشارات CAMP و PPAR و PI3K-AKT و p53. تشير هذه النتائج إلى أن KMF قد يعالج MN من خلال التأثير على مسارات الإشارات هذه ، مع التحقق من صحة مسار إشارات PI3K / AKT في التجارب. أخيرا ، تم اختيار أفضل 100 DEGs بترتيب قيمة الدرجة لبناء شبكة تفاعل البروتين والبروتين (PPI) (الشكل 5I-J).
الشكل 1: كروماتوجرام أيون الذروة LC-MS / MS. (أ) وضع الأيونات الموجبة. (ب) وضع الأيونات السالبة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
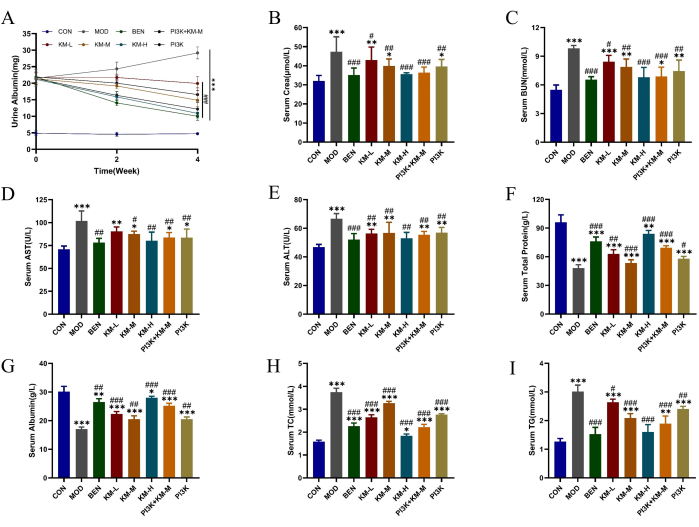
الشكل 2: يحسن KMF اضطراب التمثيل الغذائي للدهون وإصابة الكبد والكلى في فئران MN. (A-C) آثار Kemeng Fang على وظائف الكلى ، بما في ذلك ألبومين البول لمدة 24 ساعة ، ومصل سيرا ، ومصل BUN. (D-G) تشمل تأثيرات Kemeng Fang على وظائف الكبد ألانين أمينوترانسفيراز (ALT) ، وترانساميناز الأسبارتات (AST) ، والبروتين الكلي ، وألبومين المصل. (ح-أ) تأثير Kemeng Fang على تنظيم التمثيل الغذائي للدهون في الدم ، بما في ذلك الدهون الثلاثية (TG) والكوليسترول الكلي (TC). يتم التعبير عن البيانات كوسيلة ± الانحرافات المعيارية ل 3-6 عينات مستقلة ، باستخدام ANOVA أحادي الاتجاه في اختبار T ، مقارنة بالمجموعة الفارغة ، * p<0.05 ، ** p<0.01 ، ***p<0.001 ، ومقارنتها بالمجموعة النموذجية ، # p < 0.05 ، # # p < 0.01 ، ### p < 0.001. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
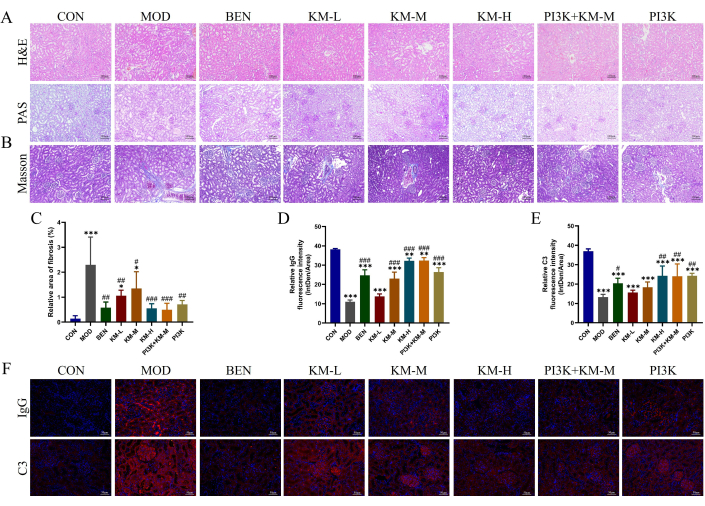
الشكل 3: يحسن Kemeng Fang الضرر النسيجي المرضي لكلى فئران MN. (أ) الفحص النسيجي للكلى ، بما في ذلك H & E و PAS (200x). (ب - ج) التحليل شبه الكمي للتليف الكلوي (ألياف الكولاجين الأزرق) المنطقة النسبية باستخدام تلطيخ ماسون وبرنامج Image J. (D-F) تحليل شبه كمي لكثافة التألق النسبية (Intden / Area ؛ حيث Intden هي إجمالي شدة التألق الإقليمية ، والمنطقة هي المنطقة الإقليمية) ل IgG و C3 في الأنسجة الكلوية باستخدام برنامج IF و Image J. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
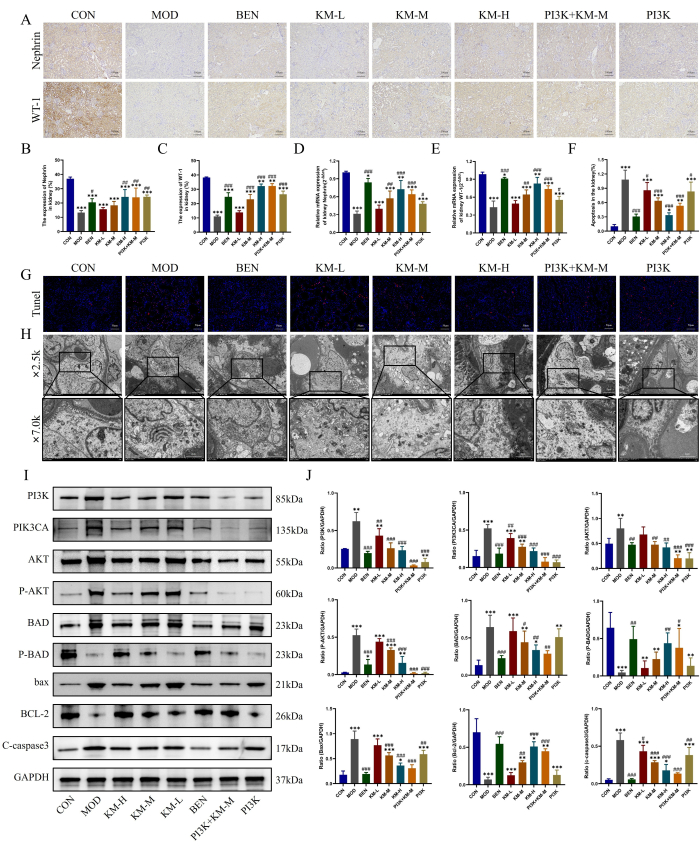
الشكل 4: يخفف Kemeng Fang من تلف الخلايا البودوية عن طريق تنشيط مسار إشارات PI3K / AKT. (AC) تم استخدام IHC للكشف عن مستويات التعبير النسبية لبروتينين من علامات الخلايا البودوية ، WT-1 ، والنيفرين ، في الأنسجة الكلوية. (D-E) كشف تفاعل البوليميراز المتسلسل للتعبير النسبي عن mRNA لبروتينين من علامات الخلايا البودوية ، WT-1 و Nephrin، في الأنسجة الكلوية. (إف جي) تم استخدام تلطيخ TUNEL للكشف عن حدوث موت الخلايا المبرمج في الأنسجة الكلوية. (ح) مراقبة الغشاء القاعدي الكبيبي وبنية الميتوكوندريا للخلايا البودية باستخدام TEM (2,500x ، bar = 5 μM ؛ 7,000x ، bar = 2 μM). (I-J) كشف WB لمستويات التعبير النسبي عن البروتين ل PI3K و PIK3CA و AKT و P-AKT و BAD و P-BAD و BCL-2 و BAX و C-caspase3 في الأنسجة الكلوية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
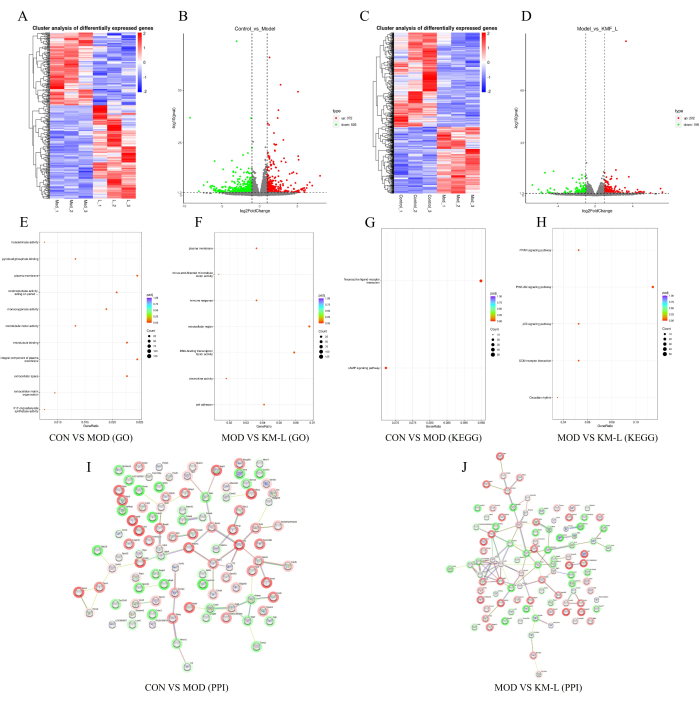
الشكل 5: استكشاف الآلية الممكنة ل Kemeng Fang في علاج MN بناء على النسخ. (A-B) خرائط الحرارة الجينية التفاضلية ومخططات البراكين بين مجموعات CON و MOD ، حيث يمثل اللون الأزرق التنظيم السفلي والأحمر يمثل التنظيم الإضافي. (C-D) خرائط الحرارة الجينية التفاضلية ومخططات البراكين بين مجموعات MOD و KM-L ، حيث يمثل اللون الأزرق التنظيم المنخفض والأحمر يمثل التنظيم الإضافي. (ه) إثراء GO بين مجموعتي CON و MOD. (و) تخصيب GO بين مجموعتي MOD و KM-L. (ز) إثراء KEGG بين مجموعتي CON و MOD. (ح) إثراء KEGG بين مجموعتي MOD و KM-L. (I) مخطط التفاعل بين البروتين والبروتين (PPI) لأفضل 100 جين معبر عنه تفاضليا بين مجموعات CON و MOD. (ي) مخطط PPI لأعلى 100 درجة قيم درجة بين مجموعات MOD و KM-L. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| لا. | الاسم الصيني | الاسم اللاتيني | أسرة | الجزء المستخدم | الجرعة (ز) |
| 1 | Dangshen (DS) | Codonopsis pilosula (فرانش.) نانف. | كامبانولاسي | جذر | 20 |
| 2 | هوانغتشي (المقر الرئيسي) | Astragalus membranaceus (Fisch.) بنجي. | البقوليات | جذر | 30 |
| 3 | هوانغليان (HL) | القبطية الصينية فرانش. | الحوذان | الجذر والدرنات | 3 |
| 4 | سوي (SY) | Perilla frutescens (L.) بريت | الشفرين | ورقة | 6 |
| 5 | شوديهوانغ (SDH) | Rehmannia glutinosa (Gaertn.) العاصمة. | Scrophulariaceae | الجذر والدرنات | 15 |
| 6 | تشوانشيونغ (CX) | Ligusticum chuanxiong Hort. | Umbelliferae | الجذر والدرنات | 15 |
| 7 | كيانشي (QS) | يوريالي فيروكس ساليسب. | Nymphaeaceae | بذرة | 15 |
| 8 | تشينفنغتنغ (QFT) | سابيا جابونيكا مكسيم. | Sabiaceae | الجذر والدرنات والأوراق | 10 |
| 9 | وبيزي (WBZ) | روس تشينينسيس مطحنه. | أنكاردياسي | ورقة | 3 |
| 10 | بانبيانيان (BBL) | اللوبيليا تشينينسيس لور. | كامبانولاسي | درنة وورقة | 15 |
| 11 | بايهواشيشيكاو (BHSSC) | Oldenlandia diffusa (Willd.) روكسب. | الروبياسيا | درنة وورقة | 15 |
الجدول 1: تكوين Kemeng Fang (KMF).
| جسم | التخفيف متعدد |
| IgG | 1:100 |
| ج3 | 1:100 |
| WT-1 | 1:200 |
| نيفرين | 1:100 |
| PI3K | 1:1000 |
| PI3K3CA | 1:1000 |
| AKT | 1:1000 |
| ب - AKT | 1:1000 |
| سيئ | 1:1000 |
| ب سيئة | 1:1000 |
| BCL-2 | 1:1000 |
| باكس | 1:4000 |
| سي كاسباس3 | 1:1000 |
| جابد دي إتش | 1:1000 |
الجدول 2: مضاعفات تخفيف الأجسام المضادة.
| الجين | التمهيدي | التسلسل (5'-3') | منتجات PCR | |
| جرذ جابده | أمامي | ACAGCACACAGGGTGGTGGAC | 253 نقطة أساس | |
| عكس | TTTGAGGGTGCAGCGAACTT | |||
| الجرذ WT-1 | أمامي | أتجاكاجكاكاجاجاجكا | 209 نقطة أساس | |
| عكس | TGGGTACGCACACATGAAAGG | |||
| الفئران نيفرين | أمامي | CGGAGAACAAGAACGTGACC | 177 نقطة أساس | |
| عكس | ATTGTCTTCTCTCCGCACCA | |||
الجدول 3: معلومات مفصلة عن بادئات qRT-PCR.
الجدول التكميلي 1: تفاعل تفاعل البوليميراز المتسلسل (PCR). الرجاء النقر هنا لتنزيل هذا الملف.
الجدول التكميلي 2: القائمة الكمية لتحديد المستقلب. معرف: الرقم التسلسلي للوزن الجزيئي من الدرجة الأولى ؛ الاسم: نتيجة التعريف. Mz: نسبة الكتلة إلى النواة. Rt: وقت الاحتفاظ (S); الكتلة الدقيقة: الوزن الجزيئي الدقيق ؛ جزء في المليون: الخطأ بين الوزن الجزيئي المكتشف والوزن الجزيئي النظري ، يقاس بجزء في المليون. precursor_type: وضع التأين ، [M + H] + هو وضع الأيونات الموجب ، [M-H] - هو وضع الأيونات السالبة ؛ الفئة: التصنيف الثلاثي في قاعدة بيانات HMDB ؛ sub_class: تصنيف رباعي المستويات في قاعدة بيانات HMDB ؛ كيج: رقم مركب كيج. KEGG_Pathway: مسار إشارات KEGG. CAS: رقم تسجيل خدمة الملخصات الكيميائية؛ HMDB: رقم قاعدة بيانات HMDB ؛ المكتبة: قاعدة البيانات. الصيغة: الصيغة الجزيئية النظرية. كيج: رقم مركب كيج. المكتبة: قاعدة البيانات. المستوى: مستوى تحديد المستقلب ؛ نقاط البيع: وضع الأيونات الإيجابية ؛ neg: وضع الأيونات السالبة ؛ KMF_1/2/3: إجمالي كثافة الأيونات لثلاث تجارب. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
تهدف هذه الدراسة إلى مراقبة التأثيرات الدوائية ل KMF واستكشاف آليتها المحددة لتثبيط موت الخلايا المبرمج لخلايا الفئران MN. أولا ، أظهر في الجسم الحي أن KMF يمكن أن يخفف من موت الخلايا المبرمج للخلايا البودوية ويؤخر تقدم MN عن طريق تنشيط مسار إشارات PI3K / AKT. ثانيا ، أظهرت نتائج النسخ أن KMF قد يمارس آثاره من خلال مسارات إشارات PPAR و PI3K / AKT و p53 ، وتفاعل مستقبلات ECM ، وما إلى ذلك. من بينها ، تم التحقق من صحة مسار إشارات PI3K / AKT في التجارب. قد توفر هذه النتائج أساسا علميا للاستخدام السريري ل KMF كخيار علاجي محتمل للمرضى الذين يعانون من MN.
أظهرت الأبحاث أن موت الخلايا المبرمج للخلايا البودوسية هو أحد العوامل الرئيسية التي تؤدي إلى التقدم التدريجي ل MN. علاوة على ذلك ، تحد MN من قدرة الخلايا البودوية على الانقسام والانتشار. وبالتالي ، بمجرد تلفها أو فقدانها ، تؤثر هذه العواقب بشكل خطير على وظيفة الكلى. عندما ينخفض عدد الخلايا البودوية إلى النقطة التي لا يمكنها فيها تغطية GBM بالكامل ، فإن GBM مكشوف تماما ويلتصق بكبسولة بومان ، مما يتسبب في ضغط أو حتى انهيار الحلقة الشعرية الكبيبية ، مما يؤدي في النهاية إلى تطور MN إلىESRD 33،34،35،36. لذلك ، فإن المزيد من البحث حول الآلية المحددة لموت الخلايا المبرمج للخلايا البودوسية وطرق منع أو تثبيط موت الخلايا المبرمج هو المفتاح لتأخير تطور MN. أظهرت الأبحاث أن مسار إشارات PI3K / AKT له وظائف متعددة في تنظيم موت الخلايا المبرمج ، والإجهاد التأكسدي ، والاستجابة الالتهابية ويلعب دورا تنظيميا مهما في حدوث وتطور MN. WT-1 و Nephrin عبارة عن بروتينات غشاء مسام يتم التعبير عنها على الخلايا البودوية ، والتي لا تلعب دورا مهما في الحفاظ على الهيكل الطبيعي ووظيفة غشاء المسام فحسب ، بل تبدأ أيضا مسارات الإشارات المعتمدة على PI3K / AKT وتشارك في إشارات الخلايا البودوية. غالبا ما يشير الانخفاض في مستويات التعبير عن هذه البروتينات إلى تلف الخلايا البودية37،38،39.
PI3K عبارة عن ثنائي يتكون من وحدة فرعية تنظيمية ، p85 ، ووحدة فرعية تحفيزية ، p110 ، والتي يمكن تنشيطها بواسطة عوامل ومجمعات النمو المختلفة. إنه عامل رئيسي وبدء في هذا المسار40. يقع جين PIK3CA على الكروموسوم 3 ويحتوي على إجمالي 20 إكسون. وتتمثل وظيفتها الرئيسية في تشفير إحدى الوحدات الفرعية التحفيزية لإنزيم PI3K ، p110 α Protein. وبالتالي ، يمكن أن تتسبب التغييرات في PIK3CA في بقاء إنزيم PI3K في حالة تنشيط مستمر41. بمجرد تنشيط PI3K ، سيقوم الرسول الثاني ، PIP3 ، بإنشاء مسار إشارات AKT النهائي وتحفزه باستمرار ، بينما يعزز p-AKT فسفرة الجزيء المؤيد لموت الخلايا المبرمج ، Bad ، ويفصل المركب المؤيد لموت الخلايا المبرمج من Bad مع Bcl-2 و Bcl-xL ، ويشكل مركبا مع بروتين 14-3-3 في السيتوبلازم ، وبالتالي يفقد وظيفته المؤيدة لموت الخلايا المبرمج. يمكن فصل الجزيئات المضادة لموت الخلايا المبرمج ، BCL-2 و Bcl-xL ، تماما ولها تأثير مثبط على موت الخلايا المبرمجللخلايا البودوية 42،43. Caspase-3 هو بروتياز يلعب دورا أساسيا في مرحلة تنفيذ موت الخلايا المبرمج الخلوي ، مما يؤدي في النهاية إلى موت الخلايا المبرمج عن طريق شق إنزيم إصلاح الحمض النووي PARP إلى أجزاءصغيرة 44. يعد تحريض إطلاق السيتوكروم ج من الميتوكوندريا إلى السيتوبلازم بواسطة البروتين المؤيد لموت الخلايا المبرمج Bad خطوة أساسية في تنشيط الكاسباز ، ومركب ارتباط P-Bad بالبروتين 14-3-3 يثبط هذه العملية ، وبالتالي يمنع حدوث سلسلة موت الخلايا المبرمج45،46،47.
تشير نتائج النسخ إلى أن علاج KMF ل MN يرتبط ارتباطا وثيقا بمسارات إشارات PI3K / AKT و PPAR و p53. التحقق من صحة مسار إشارات PI3K/AKT من خلال تحليل WB. أظهرت النتائج التجريبية أن مسار إشارات PI3K / AKT في فئران MN قد تم تثبيطه بشكل كبير ، بينما يمكن ل KMF تنشيط مسار إشارات PI3K / AKT بشكل كبير ، مما يقلل من توليد الجزيئات المؤيدة لموت الخلايا المبرمج Bad و Bax وتعزيز توليد الجزيء المضاد لموت الخلايا المبرمج BCL-2 ، وبالتالي زيادة مستويات التعبير عن بروتينات غشاء الحجاب الحاجز ، WT-1 و Nephrin. والحد من حدوث موت الخلايا المبرمج للخلايا البودوية. لذلك ، يقلل KMF من موت الخلايا المبرمج للخلايا عن طريق تنشيط مسار إشارات PI3K / AKT ووجد أن له تأثيرا وقائيا على الفئران النموذجية MN.
ومع ذلك ، فإن هذه الدراسة لها بعض القيود. أولا ، استكشفت هذه الدراسة فقط آلية تثبيط KMF لموت الخلايا المبرمج للخلايا البودوية على مستوى التجارب الحيوانية في الجسم الحي ، والتي تحتاج إلى التحقق من خلال التجارب الخلوية في المختبر بالإضافة إلى الاستكشافات المتعمقة للآلية. ثانيا ، ترتبط إصابة الخلايا البودية أيضا ارتباطا وثيقا بالالتهام الذاتي ، والالتهاب المناعي ، والحمى ، وتحتاج إلى مزيد من الاستكشاف مما إذا كان KMF يمكن أن يؤثر على MN من خلال تنظيم الالتهام الذاتي والالتهاب المناعي والحمى48،49.
عائلة PPAR (PPAR α ، PPAR β / δ ، PPAR γ) هي مستقبلات هرمون نووي تعتمد على تنشيط الترابط ولها وظائف مهمة مثل المشاركة في استقلاب الطاقة ، وتنظيم موت الخلايا المبرمج للخلايا ، والاستجابة الالتهابية50،51. إنها تؤثر على النسخ الجيني عن طريق تكوين ثنائي التغاير مع مستقبلات حمض الريتينويك X (RXR) ، حيث ينظم γ PPAR العامل الالتهابي NF- κB. يكمن مفتاح تنشيط B في وظيفته المتمثلة في حماية الخلايا البودوية من التلف52،53،54. أظهرت دراسات متعددة أن ناهضات γ PPAR (TZD ، مثل البيوغليتازون ) لها تأثيرات وقائية كلوية مستقلة عن تأثيرات نقص السكر في الدم ، مما يحمي الخلايا البودوية بشكل مباشر من التلف ويقلل من البيلة البروتينية والتلف الكبيبي في مختلف النماذج الحيوانية لأمراض الكلى55،56،57،58،59. هناك أيضا تقارير تشير إلى أن PPAR يمكن أن يقلل من موت الخلايا المبرمج للخلايا البودوية عن طريق تثبيط تنشيط Caspase-360. تشير أحدث الأبحاث إلى أن نوعا جديدا من γ PPAR ، وهو المنظم الانتقائي GQ-16 ، أكثر فعالية من TZD في تقليل البيلة البروتينية والمضاعفات المرتبطة بالمتلازمة الكلوية ، والتي تعيد أيضا الفجر لعلاج أمراض الكلى61. KMF له تأثير وقائي على موت الخلايا المبرمج لخلايا الفئران MN عن طريق تنشيط مسار إشارات PI3K / AKT. بناء على الدور المهم لمسار إشارات PPAR في الكلى ، يلزم إجراء مزيد من الاستكشاف المتعمق للعلاقة بين KMF و PPAR و MN في المستقبل.
Disclosures
جميع المؤلفين ليس لديهم تضارب في المصالح للإعلان عنهم.
Acknowledgements
تم دعم هذا العمل من قبل مؤسسة العلوم الطبيعية لمقاطعة جيلين (رقم YDZJ202301ZYTS145 ورقم . YDZJ202301ZYTS208).
Materials
| Name | Company | Catalog Number | Comments |
| 2-Amino-3-(2-chloro-phenyl)-propionic acid | Aladdin | 103616-89-3 | |
| 30% H2O2 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10011218 | |
| 812 embedding agent | SPI | 90529-77-4 | |
| Acetone | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000418 | |
| Acetonitrile | Thermo | 75-05-8 | |
| Ammonia | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10002118 | |
| Ammonium formate | Sigma | 540-69-2 | |
| Analytical balance | Changzhou Lucky Electronic Equipment Co., Ltd | FA | |
| Anhydrous ethanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10009218 | |
| Anti fluorescence quenching and sealing agent | southernbiotech | 0100-01 | |
| Automatic biochemical analyzer | Rayto Life and Analytical Sciences | Chemray240 | |
| BCA Protein Assay Kit | Solarbio | PC0020 | |
| Benazepril hydrochloride tablets | Xinya Minhang | H20044840 | |
| Blender | Kylin-Bell | BE-2600 | |
| Brick and stone cutting blade | Daitome | Ultra45 | |
| BSA | ZSGB-BIO | ZLI-9027 | |
| Buffer RW | Beijing Baiao Leibo | WK191 | |
| Carbodiimide hydrochloride | Hubei Xinghengye Technology | 25952-53-8 | |
| Cell apoptosis detection kit | Elabscience | E-CK-A322 | |
| Chemiluminescence imaging system | Hangzhou Shenhua Technology Co., Ltd | SH-523 | |
| Chloroform | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10006818 | |
| Constant temperature drying oven | Thermo Fisher | Heto PowerDiy LL3000 | |
| Cover glass slide | Jiangsu Shitai Experimental Equipment Co., Ltd | 10212450C | |
| CY3 Conjugated AffiniPure Goat Anti-rabbit IgG (H+L) | BOSTER | BA1032 | |
| DAB reagent kit | Servicebio | G1212-200T | |
| DAPI | Blue Cloud Sky | C1002 | |
| Decolorization shaker | Wuhan Lingsi Biotechnology Co., Ltd | TSY-B | |
| Dehydration machine | Wuhan Junjie Electronics Co., Ltd | JJ-12J | |
| DL2000 DNA Marker | TIANGEN | MD114 | |
| DMSO | MCE | HY-Y0320 | |
| dNTP | TIANGEN | CD117 | |
| EBlot L1 Rapid Wet Rotation Instrument | Kingsray Biotechnology Co., Ltd | L00686C | |
| ECL substrate solution | affinity | KF8003 | |
| Electric constant temperature water bath pot | Fisaff Instrument (Hebei) Co., Ltd | DK-20000-IIIL | |
| Electrophoresis instrument power supply | Beijing Longfang Technology Co., Ltd | LF-600S | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd | JB-P5 | |
| Equilibrium buffer | Wuhan Lingsi Biotechnology Co., Ltd | E8090 | |
| Ethylenediamine | Ruichengkang Pharmaceutical Technology | 107-15-3 | |
| FA series multifunctional analytical electronic balance | Changzhou Lucky Electronic Equipment Game Company | FA1204 | |
| Filter membrane | Jinteng | Nylon6-0.22μm | |
| Formaldehyde solution | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10010018 | |
| Formic acid | TCI | 64-18-6 | |
| Freezing centrifuge | Xiangyi | H1850-R | |
| Frozen platform | Wuhan Junjie Electronics Co., Ltd | JB-L5 | |
| Glacial acetic acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000218 | |
| Glass bead | Sigma | G8772-500G | |
| Glass slide | Nantong Meiweide Life Science Co., Ltd | PC2-301 | |
| glycine | Biofroxx | 30166428 | |
| Hematoxylin | Wuhan Lingsi Biotechnology Co., Ltd | G1140 | |
| High speed refrigerated centrifuge | Hunan Kecheng Instrument Equipment Co., Ltd | H1-16KR | |
| Horizontal agarose electrophoresis tank | Long Fang | LF-31DS | |
| Horizontal shaker | Jiangsu Haimen Qilin Bell Instrument Manufacturing Co., Ltd | TS-1 | |
| HRP Conjugated AffiniPure Goat Anti-rabbit IgG (H+L) | BOSTER | BA1054 | |
| hydrochloric acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10011028 | |
| Imaging system | Nikon | Nikon DS-U3 | |
| Incomplete Freund's adjuvant | MCE | ISA-51 | |
| Intelligent digital magnetic heating stirrer | Hangzhou Miou Instrument Co., Ltd | TP-350E+ | |
| Isoflurane | Sigma | 26675-46-7 | |
| Isopropanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 80109218 | |
| KCl | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10020318 | |
| KH2PO4 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 1115GR500 | |
| Liquid chromatograph | Thermo | IQLAAAGABHFAPUMBJC | |
| marker(10-250KD) | Mei5bio | MF028-plus-01 | |
| marker(20-120KD) | GenScript | M00521 | |
| Mass spectrometer | Thermo | IQLAAEGAAPFALGMBDK | |
| Masson staining kit | BASO | BA4079B | |
| Methanol | Thermo | 67-56-1 | |
| microscope | Nikon | ECLIPSE Ci | |
| microwave oven | Galanz Microwave Oven Electrical Appliance Co., Ltd | P70D20TL-P4 | |
| Multi sample tissue grinder | Shanghai Jingxin Industrial Development Co., Ltd | Tissuelyser-24L | |
| Multiskan FC ELISA reader | Thermo scientific | 1410101 | |
| Na2HPO4.12H2O | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10017618 | |
| NaCl | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000218 | |
| Neutral resin | Wuhan Lingsi Biotechnology Co., Ltd | G8590 | |
| Normal Goat Serum | Solarbio | SL038 | |
| Organizational spreading machine | Zhejiang Jinhua Kedi Instrument Equipment Co., Ltd | KD-P | |
| Osmic acid | Ted Pella Inc | 18450 | |
| oven | Shanghai Huitai Instrument Manufacturing Co., Ltd | DHG-9140A | |
| Palm centrifuge | Wuhan Lingsi Biotechnology Co., Ltd | D1008E | |
| Paraformaldehyde | Solarbio | P1110 | |
| PAS staining kit | BASO | BA4114B | |
| Pathological slicer | Shanghai Leica Instrument Co., Ltd | RM2016 | |
| PBS | Solarbio | P1020 | |
| PCR instrument | Hangzhou Miou Instrument Co., Ltd | PR-96 | |
| PH meter | Sedolis Scientific Instruments (Beijing) Co., Ltd | PB-10 | |
| PH meter | Sedolis Scientific Instruments (Beijing) Co., Ltd | 2018C132-11 | |
| PI3K inhibitor LY294002 | MCE | HY-10108 | |
| Pipette gun | Dragon | KE0003087/KA0056573 | |
| Protein phosphatase inhibitor complex | Meilunbio | MB12707-1 | |
| PVDF membrane (0.22 μm) | Solarbio | ISEQ00010 | |
| PVDF membrane (0.45 μm) | Solarbio | YA1701 | |
| Quick primary/secondary antibody diluent | Solarbio | A1811 | |
| Rabbit anti-AKT | Affinity | AF0836 | |
| Rabbit anti-BAD | Affinity | AF6471 | |
| Rabbit anti-C3 | Affinity | DF13224 | |
| Rabbit anti-GAPDH | Hangzhou Xianzhi | AB-P-R 001 | |
| Rabbit anti-IgG | CST | 3900S | |
| Rabbit anti-Nephrin | bioss | bs-10233R | |
| Rabbit anti-P-AKT | Affinity | AF0016 | |
| Rabbit anti-p-BAD | invitrogen | PA5-105023 | |
| Rabbit anti-PI3K | Affinity | AF6241 | |
| Rabbit anti-PIK3CA | Bioss | Bs-2067R | |
| Rabbit anti-WT-1 | Affinity | DF6331 | |
| Real-Time PCR System | ABI | QuantStudio 6 | |
| RIPA Lysis Buffer | Meilunbio | MA0151 | |
| SDS | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10019318 | |
| Slide and cover glass | Jiangsu Shitai Experimental Equipment Co., Ltd | 10212432C | |
| Super pure water instrument | Zhiang Instrument (Shanghai) Co., Ltd | Clever-S15 | |
| SYBR Green Master Mix | VAZYME | Q111-02 | |
| Taq Plus DNA Polymerase | TIANGEN | ET105-02 | |
| Tissue grinder | Beautiful Wall | MB-96 | |
| Transmission electron microscope | HITACHI | HT7800/HT7700 | |
| Tris-base | Biofroxx | 10019318 | |
| Trizol | Ambion | 15596-026 | |
| TUNEL Cell Apoptosis Detection Kit (FITC) | Beijing Baiao Leibo | SY0475 | |
| Tween 20 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 30189328 | |
| Ultra micro UV visible spectrophotometer | Hangzhou Miou Instrument Co., Ltd | ND-100 | |
| Ultra thin slicer | Leica | Leica UC7 | |
| Ultrasonic cleaner | shumei | KQ- 800DE | |
| Upright optical microscope | Nikon | Nikon Eclipse CI | |
| Urinary Protein Test Kit | Nanjing Jiancheng Bioengineering Research Institute | C035-2 | |
| Vertical electrophoresis tank | Beijing 61 Instrument Factory | DYCZ-24DN | |
| Vortex mixer | Wuhan Lingsi Biotechnology Co., Ltd | MX-F | |
| Western Blocking Buffer | Solarbio | SW3010 | |
| xylene | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10023418 |
References
- McQuarrie, E. P., Mackinnon, B., Stewart, G. A., Geddes, C. C., Registry, S. R. B. Membranous nephropathy remains the commonest primary cause of nephrotic syndrome in a northern European Caucasian population. Nephrol Dial Transplant. 25 (3), 1009-1011 (2010).
- Ronco, P. H., Debiec, H. Pathophysiological advances in membranous nephropathy: time for a shift in patient's care. Lancet. 385 (9981), 1983-1992 (2015).
- Xu, X., et al. Long-term exposure to air pollution and increased risk of membranous nephropathy in China. J Am Soc Nephrol. 27 (12), 3739-3746 (2016).
- Fogo, A. B., Lusco, M. A., Najafian, B., Alpers, C. E. AJKD atlas of renal pathology: Membranous nephropathy. Am J Kidney Dis. 66 (3), e15-e17 (2015).
- Li, X., Zhang, X. Comments on the 2021 Kidney Disease: Improving Global Outcomes (KDIGO) clinical practice guideline for anticoagulant therapy in patients with membranous nephropathy. Kidney Int. 101 (1), 186-187 (2022).
- Ruggenenti, P., Fervenza, F. C., Remuzzi, G. Treatment of membranous nephropathy: time for a paradigm shift. Nat Rev Nephrol. 13 (9), 563-579 (2017).
- Klomjit, N., Fervenza, F. C., Zand, L. Successful treatment of patients with refractory PLA2R-associated membranous nephropathy with Obinutuzumab: A report of 3 cases. Am J Kidney Dis. 76 (6), 883-888 (2020).
- Podestà, M. A., Ruggiero, B., Remuzzi, G., Ruggenenti, P. Ofatumumab for multirelapsing membranous nephropathy complicated by rituximab-induced serum-sickness. BMJ Case Rep. 13 (1), e232890-e232896 (2020).
- Stehlé, T., et al. Anti-CD38 therapy for PLA2R-positive membranous nephropathy resistant to conventional immunosuppression. Kidney Int. 101 (2), 416-418 (2022).
- Trimarchi, H., Coppo, R. Podocytopathy in the mesangial proliferative immunoglobulin A nephropathy: new insights into the mechanisms of damage and progression. Nephrol Dial Transplant. 34 (8), 1280-1285 (2019).
- Kopp, J. B., et al. Podocytopathies. Nat Rev Dis Primers. 6 (1), 68-72 (2020).
- Hoxha, E., Reinhard, L., Stahl, R. A. K. Membranous nephropathy: new pathogenic mechanisms and their clinical implications. Nat Rev Nephrol. 18 (7), 466-478 (2022).
- Chiou, T. T., et al. Rapamycin attenuates PLA2R activation-mediated podocyte apoptosis via the PI3K/AKT/mTOR pathway. Biomed Pharmacother. 144 (8), 112349-112356 (2021).
- Chen, J., et al. Danshen injection induces autophagy in podocytes to alleviate nephrotic syndrome via the PI3K/AKT/mTOR pathway. Phytomedicine. 107 (7), 154477-154489 (2022).
- Wang, Y., et al. Fangji Huangqi decoction ameliorates membranous nephropathy through the upregulation of BNIP3-mediated mitophagy. J Ethnopharmacol. 324 (13), 117734-117743 (2024).
- Wei, L., et al. Shenqi granule upregulates CD2AP and α-actinin4 and activates autophagy through regulation of mTOR/ULK1 pathway in MPC5 cells. J Ethnopharmacol. 303 (16), 115942-115954 (2023).
- Wang, P., et al. A review of the botany, phytochemistry, traditional uses, pharmacology, toxicology, and quality control of the Astragalus memeranaceus. Front Pharmacol. 14 (2), 1242318-1242325 (2023).
- Wang, Q., et al. Traditional Chinese medicine method of tonifying kidney for hypertension: Clinical evidence and molecular mechanisms. Front Cardiovasc Med. 20229 (16), 1038480-1038487 (2022).
- Tang, X., et al. Experimental models for elderly patients with membranous nephropathy: Application and advancements. Exp Gerontol. 185 (8), 112341-112353 (2024).
- Zhang, J. J., et al. Murine membranous nephropathy: immunization with α3(IV) collagen fragment induces subepithelial immune complexes and FcγR-independent nephrotic syndrome. J Immunol. 188 (7), 3268-3277 (2012).
- Hopfer, H., et al. The importance of cell-mediated immunity in the course and severity of autoimmune anti-glomerular basement membrane disease in mice. FASEB J. 17 (8), 860-868 (2003).
- Fleuren, G., Grond, J., Hoedemaeker, P. J. In situ formation of subepithelial glomerular immune complexes in passive serum sickness. Kidney Int. 17 (5), 631-637 (1980).
- Border, W. A., Ward, H. J., Kamil, E. S., Cohen, A. H. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen. J Clin Invest. 69 (2), 451-461 (1982).
- Border, W. A., Ward, H. J., Kamil, E. S., Cohen, A. H. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen. J Clin Invest. 69 (2), 451-461 (1982).
- Rubio-Navarro, A., et al. Phenotypic characterization of macrophages from rat kidney by flow cytometry. J Vis Exp. (116), e54599 (2016).
- Hou, Y., et al. Longzhibu disease and its therapeutic effects by traditional Tibetan medicine: Ershi-wei Chenxiang pills. J Ethnopharmacol. 249, 112426 (2020).
- Sethi, S., et al. Hematopoietic stem cell transplant-membranous nephropathy is associated with protocadherin FAT1. J Am Soc Nephrol. 33 (5), 1033-1044 (2022).
- Gong, Q., Lai, T., Liang, L., Jiang, Y., Liu, F. Targeted inhibition of CX3CL1 limits podocytes ferroptosis to ameliorate cisplatin-induced acute kidney injury. Mol Med. 29 (1), 140-148 (2023).
- Li, H., et al. IL-23 reshapes kidney resident cell metabolism and promotes local kidney inflammation. J Clin Invest. 131 (12), e142428-e142441 (2021).
- Wang, C., et al. Artificially cultivated Ophiocordyceps sinensis alleviates diabetic nephropathy and its podocyte injury via inhibiting P2X7R expression and NLRP3 inflammasome activation. J Diabetes Res. 356 (11), 1390418-1390431 (2018).
- Cheng, H., et al. PI3K/Akt signaling pathway and Hsp70 activate in hippocampus of rats with chronic manganese sulfate exposure. J Trace Elem Med Biol. 50 (12), 332-338 (2018).
- Ji, K., et al. The immunoreaction and antioxidant capacity of juvenile blunt snout bream (Megalobrama amblycephala) involves the PI3K/Akt/Nrf2 and NF-κB signal pathways in response to dietary methionine levels. Fish Shellfish Immunol. 105 (10), 126-134 (2020).
- Chiou, T. T., et al. Rapamycin attenuates PLA2R activation-mediated podocyte apoptosis via the PI3K/AKT/mTOR pathway. Biomed Pharmacother. 144 (3), 112349-112357 (2021).
- Lv, Q., Yang, F., Chen, K., Zhang, Y. Autophagy protects podocytes from sublytic complement induced injury. Exp Cell Res. 341 (2), 132-138 (2016).
- Mundel, P., Shankland, S. J. Podocyte biology and response to injury. J Am Soc Nephrol. 13 (12), 3005-3015 (2002).
- Sun, Z., Xu, Q., Ma, Y., Yang, S., Shi, J. Circ_0000524/miR-500a-5p/CXCL16 axis promotes podocyte apoptosis in membranous nephropathy. Eur J Clin Invest. 51 (3), e13414-e13422 (2021).
- Huber, T. B., et al. Nephrin and CD2AP associate with phosphoinositide 3-OH kinase and stimulate AKT-dependent signaling. Mol Cell Biol. 23 (14), 4917-4928 (2003).
- Ai, Z., et al. Deciphering the pharmacological mechanisms of Rostellularia procumbens (L) Nees. Extract alleviates adriamycin-induced nephropathy in vivo and in vitro. Phytomedicine. 113 (6), 154736-154742 (2023).
- Wang, X., et al. Nicorandil alleviates apoptosis in diabetic cardiomyopathy through PI3K/Akt pathway. J Cell Mol Med. 23 (8), 5349-5359 (2019).
- Fox, M., Mott, H. R., Owen, D. Class IA PI3K regulatory subunits: p110-independent roles and structures. Biochem Soc Trans. 48 (4), 1397-1417 (2020).
- Miricescu, D., et al. PI3K/AKT/mTOR signaling pathway in breast cancer: From molecular landscape to clinical aspects. Int J Mol Sci. 22 (1), 173-179 (2020).
- Feng, C., et al. Neuroprotective effect of Danhong injection on cerebral ischemia-reperfusion injury in rats by activation of the PI3K-Akt pathway. Front Pharmacol. 11 (4), 298-312 (2020).
- Zhou, Y., et al. 1,3-Dicaffeoylquinic acid targeting 14-3-3 tau suppresses human breast cancer cell proliferation and metastasis through IL6/JAK2/PI3K pathway. Biochem Pharmacol. 172 (12), 113752-113761 (2020).
- Li, J., et al. Tetrandrine inhibits colon carcinoma HT-29 cells growth via the Bcl-2/Caspase 3/PARP pathway and G1/S phase. Biosci Rep. 39 (5), (2019).
- Downward, J. How BAD phosphorylation is good for survival. Nat Cell Biol. 1 (2), E33-E35 (1999).
- Fan, J., et al. A model of ischemia and reperfusion increases JNK activity, inhibits the association of BAD and 14-3-3, and induces apoptosis of rabbit spinal neurocytes. Neurosci Lett. 473 (3), 196-201 (2010).
- Chipuk, J. E., Green, D. R. How do BCL-2 proteins induce mitochondrial outer membrane permeabilization. Trends Cell Biol. 18 (4), 157-164 (2008).
- Yin, L., Yu, L., He, J. C., Chen, A. Controversies in podocyte loss: Death or detachment. Front Cell Dev Biol. 9 (11), 771931-771942 (2021).
- Yang, C., et al. Research progress on multiple cell death pathways of podocytes in diabetic kidney disease. Mol Med. 29 (1), 135-143 (2023).
- Calvier, L., et al. PPARγ links BMP2 and TGFβ1 pathways in vascular smooth muscle cells, regulating cell proliferation and glucose metabolism. Cell Metab. 25 (5), 1118-1134 (2017).
- Dai, Z. W., Cai, K. D., Xu, L. C., Wang, L. L. Perilipin2 inhibits diabetic nephropathy-induced podocyte apoptosis by activating the PPARγ signaling pathway. Mol Cell Probes. 53 (3), 101584-101596 (2020).
- Kota, B. P., Huang, T. H., Roufogalis, B. D. An overview on biological mechanisms of PPARs. Pharmacol Res. 51 (2), 85-94 (2005).
- Wahli, W. Peroxisome proliferator-activated receptors (PPARs): from metabolic control to epidermal wound healing. Swiss Med Wkly. 132 (7-8), 83-91 (2002).
- Agrawal, S., He, J. C., Tharaux, P. L. Nuclear receptors in podocyte biology and glomerular disease. Nat Rev Nephrol. 17 (3), 185-204 (2021).
- Miglio, G., et al. Protective effects of peroxisome proliferator-activated receptor agonists on human podocytes: proposed mechanisms of action. Br J Pharmacol. 167 (3), 641-653 (2012).
- Miglio, G., et al. The subtypes of peroxisome proliferator-activated receptors expressed by human podocytes and their role in decreasing podocyte injury. Br J Pharmacol. 162 (1), 111-125 (2011).
- Agrawal, S., Guess, A. J., Benndorf, R., Smoyer, W. E. Comparison of direct action of thiazolidinediones and glucocorticoids on renal podocytes: protection from injury and molecular effects. Mol Pharmacol. 80 (3), 389-399 (2011).
- Sonneveld, R., et al. Sildenafil prevents podocyte injury via PPAR-γ-mediated TRPC6 inhibition. J Am Soc Nephrol. 28 (5), 1491-1505 (2017).
- Agrawal, S., et al. Pioglitazone enhances the beneficial effects of glucocorticoids in experimental nephrotic syndrome. Sci Rep. 6 (3), 24392-24404 (2016).
- Kanjanabuch, T., et al. PPAR-gamma agonist protects podocytes from injury. Kidney Int. 71 (12), 1232-1239 (2007).
- Bryant, C., et al. Selective modulator of nuclear receptor PPARγ with reduced adipogenic potential ameliorates experimental nephrotic syndrome. iScience. 25 (4), 104001 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved