Method Article
Mécanisme de l’inhibition de Kemeng Fang de l’apoptose des podocytes chez les rats atteints de néphropathie membraneuse par la voie de signalisation PI3K/AKT
Dans cet article
Résumé
Le présent protocole décrit l’établissement d’un modèle animal de néphropathie membraneuse (MN) et comment l’inhibition de Kemeng Fang réduit l’apoptose des podocytes du rat MN en activant la voie de signalisation PI3K/AKT.
Résumé
La néphropathie membraneuse (MN) est un type pathologique courant de syndrome néphrotique de l’adulte. Jusqu’à 20 % des patients atteints de MN développent une insuffisance rénale terminale (IRT). Les podocytes ont une fonction importante dans le maintien de la barrière de filtration glomérulaire et jouent un rôle crucial dans l’apparition et le développement de la protéinurie et de la MN. La voie de signalisation PI3K/AKT est impliquée dans l’ensemble du processus de croissance, de différenciation et d’apoptose des podocytes. Kemeng Fang (KMF) est une formule de médecine traditionnelle chinoise qui a été utilisée pour retarder les lésions rénales. Cependant, le mécanisme thérapeutique de la KMF dans le MN n’est pas clair. Ici, le modèle de rat MN a été établi par des injections axillaires, inguinales et caudales d’albumine sérique bovine cationisée (C-BSA), puis d’inhibiteur de KMF et de PI3K (LY294002) ont été administrés. Les données sur la fonction hépatique, la fonction rénale, les lipides sanguins, la pathologie rénale, la fonction des podocytes, le niveau d’expression de la voie de signalisation PI3K/AKT et la transcriptomique des rats ont démontré que KMF a un effet protecteur sur les podocytes des rats MN en activant la voie de signalisation PI3K/AKT, et qu’il peut empêcher efficacement la progression de la MN.
Introduction
La néphropathie membraneuse (MN) est un type pathologique courant de syndrome néphrotique de l’adulte, avec un taux d’incidence annuel d’environ 5 à 10 pour 100 000 individus. Elle survient principalement entre 30 et 50 ans et est rare chez les enfants (environ 5 %). Il est nettement plus répandu chez les hommes que chez les femmes (2:1). De plus, jusqu’à 20 % des patients atteints de MN développent une insuffisance rénale terminale (IRT). De plus, il y a une tendance croissante où les patients atteints de MN développent une IRT année après année1, 2, 3. La caractéristique pathologique de la MN est que l’immunoglobine G granulaire (IgG) et le complexe d’attaque membranaire du système du complément (MAC) sont fortement déposés dans la membrane basale glomérulaire (GBM) adjacente aux podocytes. Ce dépôt conduit à l’épaississement du GBM et à la perturbation de l’intégrité de la barrière de filtration glomérulaire, conduisant finalement à une protéinurie4.
Le traitement de soutien, les immunosuppresseurs et les anticorps monoclonaux ciblés sont les principales méthodes de traitement de la MN. Bien que ces interventions puissent réduire considérablement la protéinurie et retarder la progression de la détérioration rénale, elles présentent également de nombreuses lacunes. Tout d’abord, le traitement de soutien ne convient qu’aux patients à faible risque5. Deuxièmement, les immunosuppresseurs peuvent provoquer des effets indésirables, tels que la nécrose de la tête fémorale, une infection secondaire et l’inhibition de la fonction hématopoïétique de la moelle osseuse6. Troisièmement, des essais contrôlés randomisés approfondis sont nécessaires pour fournir une médecine fondée sur des données probantes pour l’utilisation d’anticorps monoclonaux tels que l’ofamizumab, l’otuzumab, le daretozumab et l’isatuximab 7,8,9. Par conséquent, la recherche active de méthodes de traitement efficaces pour la MN a une grande importance pour retarder l’apparition de l’IRT et améliorer la qualité de vie des patients atteints de MN.
Les podocytes, également connus sous le nom de cellules épithéliales viscérales glomérulaires, sont attachés à la face externe du GBM, et l’endothélium capillaire du GBM forme ensemble la barrière de filtration du sang glomérulaire. Ils ont des fonctions importantes, telles que le maintien de la barrière de filtration des protéines glomérulaires, la synthèse de la membrane basale normale et le soutien structurel du plexus capillaire glomérulaire10,11. La recherche a montré que l’apoptose des podocytes joue un rôle crucial dans l’apparition et le développement de la protéinurie et de la MN, et que la voie de signalisation PI3K/AKT est impliquée dans l’ensemble du processus de croissance, de différenciation et d’apoptosedes podocytes 12,13,14.
Un nombre croissant d’études ont montré que la médecine chinoise présente des avantages significatifs dans le traitement de la MN, ce qui peut réduire considérablement la créatinine sanguine, la protéinurie et les lésions rénales retardées15,16. KMF est un composé de la médecine traditionnelle chinoise avec des ingrédients dérivés de 13 plantes : Codonopsis pilosula (Franch.) Nannf. (Dangshen, DS) ; Astragalus membranaceus (Fisch.) Bunge. (Huangqi, QG) ; Coptis chinensis Franch. (Huanglian, HL) ; Perilla frutescens (L.) Britt. (Suye, SY) ; Rehmannia glutinosa (Gaertn.) DC (Shudihuang, SDH) ; Ligusticum chuanxiong Hort. (Chuanxiong, CX) ; Euryale ferox Salisb. (Qianshi, QS) ; Sabia japonica Sentence. (Qinfengteng, QFT) ; Rhus chinensis Moulin (Wubeizi, WBZ) ; Lobelia chinensis Lour. (Banbianlian, BBL) ; Oldenlandia diffusa (Willd.) Roxb. (Baihuasheshecao, BHSSC ; Tableau 1). La KFM a de nombreuses fonctions, telles que la tonification des reins (amélioration de la fonction rénale), l’amélioration du qi (renforcement de l’immunité), la promotion de la diurèse et le dragage des collatéraux (promotion de la circulation sanguine). Cependant, le mécanisme thérapeutique de la KMF dans le MN n’est pas clair17,18.
À l’heure actuelle, il existe de nombreuses façons de construire des modèles MN, y compris le modèle de néphrite de Heymann, le modèle de néphrite C-BSA, le modèle de souris α3NC1, dans lequel le modèle de néphrite de Heymann, la principale protéine de mégaline de l’antigène pathogène n’est pas trouvée dans le MN humain, il est donc différent de la pathogenèse de la MN humaine, modèle de souris α3NC1, seul le patrimoine génétique DBA / 1 du taux de réussite du modèle de souris est plus élevé, Les autres souris ont eu moins de succès dans la modélisation, ou même n’ont pas pu être modélisées 19,20,21. Le modèle de néphrite C-BSA est rentable et simple à utiliser, et sa pathogenèse est très similaire à celle du modèle animal MNhumain 19. Le principe de base est que, parce que le GBM est chargé négativement et que le C-BSA est chargé positivement, il peut facilement traverser le GBM pour devenir un antigène planté, ce qui induit l’accumulation d’anticorps circulants pour former un complexe immunitaire in situ, construisant ainsi un modèle MN22,23. Le but de cette étude était d’observer l’effet thérapeutique de la KMF sur la MN et son mécanisme moléculaire par une combinaison de transcriptomique et de biologie moléculaire et de fournir une base scientifique fiable pour le traitement de la MN avec la KMF.
Protocole
Cette étude a été examinée et approuvée par le Comité de gestion et d’utilisation des animaux de laboratoire du Centre provincial de contrôle et de prévention des maladies du Hubei (numéro d’identification : 202220144). Les rats ont subi un cycle lumière/obscurité de 12 h dans des conditions non pathogènes de 23 ± 1 °C et de 50 à 60 % d’humidité atmosphérique. Nous nous sommes procuré 100 rats Sprague-Dawley mâles âgés de 8 semaines du Centre provincial de contrôle et de prévention des maladies du Hubei (numéro de licence : SYXK [E] 2022-0065), et ils ont été soumis à une alimentation adaptative dans un environnement spécifique exempt d’agents pathogènes pendant 1 semaine avec une alimentation d’entretien normale et de l’eau stérile en boire.
1. Préparation du médicament
- Préparation de KMF
- Les médicaments chinois utilisés ont été fournis par l’hôpital affilié à l’Université de médecine traditionnelle chinoise de Changchun, la composition spécifique et la posologie sont indiquées dans le tableau 1. Pour préparer, utilisez un total de 147 g de médicaments crus-Codonopsis pilosula (20 g), Astragalus membranaceus (30 g), Coptis chinensis (3 g), Perilla frutescens (6 g), Rehmannia glutinosa (15 g), Ligusticum chuanxiong (15 g), Euryale ferox (15 g), Sabia japonica (10 g), Rhus chinensis (3 g), Lobelia chinensis (15 g), Oldenlandia diffusa (15 g). Mélanger et tremper dans 1470 mL d’eau distillée pendant 30 min.
- Placez le mélange d’herbes dans un pot en céramique et faites-le chauffer à 100 °C pendant 90 min pour la décoction. Filtrer à travers deux couches de gaze médicale et conserver à température ambiante.
- Ajoutez de l’eau distillée (1470 ml) à nouveau au mélange de plantes restant et répétez l’opération de décoction ci-dessus une fois de plus, comme décrit à l’étape 1.1.2. Conservez le filtrat à température ambiante.
- Mélanger les deux filtrats ci-dessus et les faire sécher au four à 80 °C pendant 10 h jusqu’à ce que la solution aqueuse se soit complètement évaporée et que seul le soluté soit retenu sous forme de poudre.
- Pesez la poudre et dissolvez-la dans une solution saline pour obtenir une solution contenant 1,323 g, 2,646 g et 5,292 g du médicament par 4 ml (les concentrations étaient de 0,331 g/ml, 0,662 g/ml et 1,323 g/ml, respectivement), ce qui correspond à la dose quotidienne du médicament administré aux rats.
- Préparation du chlorhydrate de Benadryl
- Ajouter la pastille de chlorhydrate de Benadryl (90 g) dans 100 mL de solution saline et bien agiter pour dissoudre complètement.
- Préparation de l’inhibiteur de PI3K LY294002
- Ajoutez 82,3 mg de poudre de LY294002 dans 1,1 ml de DMSO et secouez bien pour le dissoudre complètement. Ensuite, ajoutez 198,9 mL de solution saline pour la diluer afin d’obtenir une concentration de 0,41 mg/mL.
- Préparation de l’émulsifiant C-BSA
- Ajouter 67 ml d’éthylènediamine anhydre à 500 ml d’eau doublement distillée et mélanger. Ajouter lentement 350 ml d’acide chlorhydrique 6 M et ajuster le pH à 4,75. Maintenir la température de la solution finale à 25 °C.
- Dissoudre 5 g d’albumine sérique bovine naturelle dans 25 mL d’eau bidistillée et maintenir la solution à une température constante de 25 °C en agitant constamment. Ajouter 1,8 g de chlorhydrate de carbodiimide et 30 mL de tampon d’acide acétique 4 M à pH 4,75 après 2 h pour obtenir la solution de C-BSA.
- Dialyser la solution obtenue dans de l’eau bi-distillée à 4 °C pendant 72 h (avec l’eau changée toutes les 3 à 5 h) à l’aide d’un papier sélénite et lyophiliser pour obtenir de la poudre lyophilisée C-BSA, conserver à -80 °C24.
- Ajouter 100 mg de poudre séchée de C-BSA dans 50 mL de solution saline pour former une solution de C-BSA. Mélangez-le avec un volume égal d’adjuvant de Freund incomplet pour une émulsification complète ; sa concentration est de 1 mg/mL.
- Préparation de la solution C-BSA
- Ajouter 640 mg de poudre sèche C-BSA dans 100 mL de PBS et bien agiter pour le dissoudre complètement ; sa concentration est de 6,4 mg/mL.
2. Mise en place du modèle animal MN
REMARQUE : L’expérience a été divisée en huit groupes : groupe témoin normal (CON), groupe modèle (MOD), groupe chlorhydrate de bénazépril (BEN), groupe KMF à faible dose (KM-L), groupe KMF à dose moyenne (KM-M), groupe KMF à forte dose (KM-H), groupe inhibiteur de PI3K (PI3K) et inhibiteur de PI3K + groupe KMF à dose moyenne (PI3K + KM-M). À l’exception du groupe témoin normal, tous les groupes ont reçu du C-BSA pour produire le modèle MN.
- À la neuvième semaine, effectuez une pré-immunisation : De multiples injections sous-cutanées d’émulsifiant C-BSA dans l’aisselle et l’aine.
REMARQUE : La peau du cou (interscapulaire) est un site alternatif pour l’administration sous-cutanée de l’émulsifiant C-BSA.- Saisissez la peau arrière des rats avec la main gauche et tournez leur abdomen vers le haut avec la peau abdominale resserrée. Injecter l’émulsifiant C-BSA par voie sous-cutanée dans les aisselles et l’aine des rats à l’aide d’une seringue de 2,5 mL à la dose de 1 mL/400 g une fois tous les deux jours pendant 1 semaine.
- Vaccination formelle : injection de la solution de C-BSA dans la veine caudale
- À la dixième semaine, retirez les rats de leurs cages et placez-les sur le couvercle de la barre métallique, la queue tournée vers l’expérimentateur.
- Essuyez la queue du rat avec une boule de coton imbibée d’alcool et pincez les deux côtés de la queue du rat avec le pouce et l’index de la main gauche pour remplir la veine et garder la veine vers le haut.
- Tenez une seringue de 1 mL dans la main droite de manière à ce que l’aiguille soit à 30° par rapport à la veine de la queue. Gardez la pointe de l’aiguille biseautée vers le haut et l’aiguille parallèle au vaisseau immédiatement après avoir doucement piqué dans la peau. S’il y a un retour de sang de l’aiguille, réinjectez-le avec une dose de C-BSA de 2,5 mL/kg 3 fois par semaine pendant 4 semaines.
- Une fois l’injection terminée, utilisez une boule de coton sec pour appuyer sur le point d’injection pendant environ 1 minute pour arrêter le saignement. Retirez les souris de l’antidémarrage et retournez-les dans la cage.
3. Analyse de KMF
- Peser 1 g d’échantillon dans un tube à centrifuger de 2 mL, ajouter 600 μL de MeOH (stocké à -20 °C contenant de l’acide 2-Amino-3-(2-chloro-phényl)-propionique (4 ppm)) et agiter le mélange pendant 30 s.
- Ajouter environ 100 mg de bille de verre et placer le mélange dans un broyeur à mouchoirs pendant 90 s à 60 Hz.
- Effectuez une échographie à 40 kHz pendant 15 min à température ambiante.
- Centrifuger pendant 10 min à 15 984 x g, 4 °C, et filtrer le surnageant à travers une membrane de 0,22 μm. Transférez un flacon de détection pour la détection LC-MS.
4. Traitements médicamenteux
REMARQUE : Les humains adultes ont besoin de 147 g de KMF par jour. Selon la formule de conversion de la dose expérimentale de rat et de médicament humain, la dose expérimentale équivalente pour le rat (g/kg) = dose humaine (g)/poids corporel (70 kg) x 6,3, la dose quotidienne du rat était d’environ 13,23 g/kg.
- À la 14e semaine, à l’aide de la main gauche, saisissez la peau sur le dos des rats, tournez leur abdomen vers le haut et resserrez la peau abdominale. Tenez l’aiguille d’une seringue de 10 ml dans la main droite et insérez-la dans la bouche d’un côté, en glissant le long du palais et de la paroi postérieure du pharynx et plus loin vers l’estomac en utilisant l’action de déglutition.
- Administrez le médicament lentement à l’aide de l’index de la main droite et retirez l’aiguille gastrique une fois l’administration terminée. La posologie du médicament administré est de 10 mL/kg pour une durée totale de 4 semaines.
- Pour les groupes CON et MOD, administrer 10 mL/kg/jour de solution saline par gavage.
- Pour le groupe BEN, administrer une solution aqueuse de chlorhydrate de Benadryl à 9 mg/kg/jour par gavage.
- Pour le groupe KM-L, administrer 3,3075 g/kg/jour d’extrait aqueux de KMF par gavage. Pour le groupe KM-M, administrer 6,615 g/kg/jour d’extrait aqueux de KMF par gavage. Pour le groupe KM-H, administrer 13,23 g/kg/jour d’extrait aqueux de KMF par gavage.
- Pour le groupe PI3K, administrer 2,1 mg/kg/jour LY294002 par gavage.
- Pour le groupe PI3K+KM-M, administrer par gavage 2,1 mg/kg/jour LY294002 (5 mL/kg) + 6,615 g/kg/jour d’extrait aqueux KMF (5 mL/kg) par gavage.
5. Évaluation de l’efficacité de KMF
- Détection des indices biochimiques sanguins et urinaires
- À partir de la 14e semaine, prélevez l’urine toutes les 2 semaines après le début de l’expérience. Placez un seul rat dans une cage métabolique pendant 24 h. Limitez votre régime alimentaire et donnez un accès gratuit à l’eau potable. Prélever l’urine à l’aide d’un tube à centrifuger de 50 ml placé sous la cage métabolique.
- Centrifugez l’urine à 15 984 x g pendant 10 min et utilisez le surnageant pour estimer le niveau de protéines urinaires selon les instructions du kit de test de protéines urinaires.
- À la 18e semaine, euthanasier les rats par inhalation d’isoflurane à 5 %. Utilisez une pommade vétérinaire sur les yeux pour prévenir la sécheresse. Confirmez le décès à l’aide de la méthode de la luxation cervicale. Saisissez la peau sur le dos des rats avec la main gauche et coupez les moustaches des rats avec des ciseaux.
- Désinfectez la peau autour des globes oculaires avec de l’éthanol et retirez rapidement les globes oculaires à l’aide d’une pince hémostatique. Prélevez le sang déposé dans le tube de centrifugation et centrifugez pendant 10 min à 15 984 x g après avoir laissé reposer à température ambiante pendant 30 min. Récupérez le surnageant.
- Détectez l’alanine aminotransférase (ALT), l’aspartate transaminase (AST), l’albumine (ALB), le triglycéride (TG), le cholestérol total (TC), l’azote uréique sanguin (BUN), la créatinine sérique (Scr), la protéine totale (TP) et d’autres indices sanguins à l’aide d’un analyseur biochimique automatique.
- Séparation des tissus rénaux
- Une fois le sang prélevé sur les rats, fixez-les sur la plaque chirurgicale et coupez lentement la fourrure et la couche musculaire à mi-chemin de l’abdomen, en poussant les tubes intestinaux pour exposer l’aorte abdominale et les reins25.
- Bloquez l’aorte abdominale au-dessus du rein droit à l’aide de pinces artérielles chirurgicales. Fixez une aiguille pour cuir chevelu à une seringue de 5 ml pour percer sous le bloc et perfuser un tampon PBS pour irriguer les reins jusqu’à ce que les deux reins deviennent blancs ou de couleur pâle.
- Retirez les reins et séparez brusquement le périoste. Répartissez le rein droit dans des tubes de congélation et conservez-le au réfrigérateur à -80 °C. Fixez le rein gauche dans une solution de paraformaldéhyde à 4 %.
- Après 24 h de fixation, retirez le rein. Effectuer la déshydratation, la transparence et l’enrobage de paraffine. Une fois le bloc de cire solidifié, trancher à l’aide d’une trancheuse à mouchoirs d’une épaisseur de 3 μm, pêcher avec une lame anti-déhiscence, cuire les tranches à 98 °C pendant 20 min et les stocker pendant26 minutes.
- Analyse histopathologique rénale
- Soumettre les sections à un déparaffinage dégradé au xylène et à une déshydratation à l’éthanol anhydre et rincer à l’eau distillée. Soumis au xylène pendant 15 min, suivi d’une solution fraîche de xylène pendant 15 min. Passez à l’éthanol anhydre pendant 5 min, passez à l’éthanol anhydre frais pendant 5 min, suivi de 90 % d’éthanol pendant 5 min, puis d’éthanol à 80 % pendant 5 min, puis d’éthanol à 70 % pendant 5 min, et enfin rincez à l’eau distillée.
- Suivez les instructions pour la coloration à l’hématoxyline-éosine (H&E), l’acide périodique Schiff (PAS) et les kits de coloration Masson pour la coloration des échantillons.
- Effectuez une déshydratation à l’éthanol anhydre gradient et le xylène clair à nouveau.
- Placez les tranches dans un incubateur à température constante, réglez la température à 90 °C et faites cuire au four pendant 20 min. Après la cuisson, retirez les tranches et ajoutez de la gomme neutre goutte à goutte. Couvrez-les d’un verre de protection.
- Observez au microscope optique à un grossissement de 200x et collectez des images.
- Analyse par immunofluorescence (FI) des tissus rénaux
- Décaffinez les sections et déshydratez-les comme décrit à l’étape 5.3.1. Placer les échantillons dans une solution tampon EDTA de 0,01 M pour une fixation à haute pression et à haute température (125 °C à 103 KPa) pendant 15 min. Laissez l’échantillon refroidir naturellement et lavez-le 3 fois pendant 3 minutes chacun dans du PBS.
- Placez les sections dans une solution de peroxyde d’hydrogène à 3 % et incubez pendant 10 min. Lavez les échantillons 3 fois pendant 5 minutes chacun dans du PBS. Ensuite, placez les sections dans du sérum de chèvre à 10 %, incubez pendant 30 minutes et lavez-les 3 fois pendant 3 minutes chacune dans du PBS.
- Ajouter les anticorps primaires IgG (1:100) et C3 (1:100) goutte à goutte et incuber dans une boîte humide à 4 °C pendant la nuit. Le taux de dilution des anticorps primaires est indiqué dans le tableau 2. Sortez les sections du réfrigérateur et lavez-les avec du TBST 3x pendant 3 min chacune.
- Ajouter l’anticorps secondaire fluorescent (1:100) goutte à goutte, incuber à 37 °C pendant 1 h et laver avec du TBST 3x pendant 3 min chacun.
REMARQUE : Cette étape et toutes les étapes suivantes doivent être effectuées dans l’obscurité27,28. - Incuber avec du 4',6-diamidino-2-phénylindole (DAPI) pendant 5 min à température ambiante et éviter la lumière, laver avec une solution saline tamponnée au tris avec tween 20 (TBST) 3x pendant 5 min chacune pour éliminer l’excès de DAPI.
- Ajouter l’extincteur à autofluorescence en cercle, incuber pendant 5 minutes et rincer à l’eau courante pendant 10 minutes. Secouez, séchez les sections et scellez avec un scellant de trempe anti-fluorescence. Observez au microscope à fluorescence à 200x et collectez des images.
- Analyse immunohistochimique (IHC) du tissu rénal
- Décaffinez les sections et déshydratez-les comme décrit à l’étape 5.3.1. Réparation sous haute pression (125 °C · 103KPa) dans une solution tampon EDTA 0,01M pendant 15 minutes. Après refroidissement naturel, laver avec du PBS 3x pendant 3 min chacun.
- Méthode d’opération de scellement de la peroxydase endogène et du sérum comme décrit à l’étape 5.4.2.
- Ajouter l’anticorps primaire WT-1 (1:200) et la néphrine (1:100) goutte à goutte et incuber dans une boîte humide au réfrigérateur à 4 °C pendant la nuit29.
- Sortez les sections du réfrigérateur à 4 °C, lavez-les avec du PBS 3x pendant 5 min chacune. Ajouter l’anticorps secondaire (1:200) goutte à goutte, incuber à 37 °C pendant 30 min et laver avec du PBS 3x pendant 3 min chacun.
- Ajoutez des gouttes de solution chromogène de diaminobenzidine (DAB) fraîchement préparée et observez au microscope optique à 200x. Le signal positif est jaune brunâtre ou brun brunâtre. Lavez immédiatement la solution de coloration à l’eau du robinet lorsqu’un changement de couleur dans la section est observé.
- Utilisez de l’hématoxyline pour reteindre pendant 3 min, puis ajoutez de l’alcool acide chlorhydrique à 1 % pour différencier et rincez à l’eau du robinet pendant 10 min.
- Déshydratez les sections, transparentes et scellées, comme décrit à l’étape 5.2.4. Observez au microscope optique à 200x et collectez des images.
- Analyse de la coloration terminale du tissu rénal par le marquage dUTP Nick-end (TUNEL) médiée par la désoxynucléotidyltransférase
- Utilisez l’étape 5.3.1 pour déparaffiniser et déshydrater les sections. Tracez des cercles autour des tissus à l’aide d’un stylo d’immunohistochimie et ajoutez 100 μL de solution de travail de protéinase K goutte à goutte à chaque échantillon. Incuber à 37 °C pendant 20 min, laver avec du PBS 3x pendant 5 min chacun et stocker les échantillons traités dans une boîte humide.
- Placez les sections dans une solution de peroxyde d’hydrogène à 3 %, incubez pendant 10 minutes et lavez avec du PBS 3x pendant 5 minutes chacune.
- Ajouter le tampon d’équilibre (100 μL) goutte à goutte sur le cercle pour couvrir le tissu et incuber pendant 20 min à température ambiante.
- Ajouter 50 μL de solution de travail de marquage (solution d’équilibre : solution de marquage fluorescente : enzyme TDT = 35 μL : 10 μL : 5 μL) goutte à goutte à chaque échantillon, incuber dans une boîte humide à 37 °C pendant 60 min, à l’abri de la lumière, et laver avec du PBS 3x pendant 5 min chacun.
- Ajouter le DAPI et incuber avec le DAPI pendant 5 min à température ambiante sous la lumière, laver avec du PBS 3x pendant 5 min chacun.
- Après que les sections aient été secouées à sec et scellées avec un scellant de trempe anti-fluorescence, observez au microscope à fluorescence à 200x et collectez des images.
- Préparation d’échantillons pour l’analyse au microscope électronique du tissu rénal
- Fixez les tissus rénaux avec 2,5 % de glutaraldéhyde à 4 °C pendant 2 à 4 h et lavez-les 3 fois pendant 15 minutes chacune dans du PBS.
- Fixer à l’acide d’osmium (1 %) à température ambiante à l’abri de la lumière pendant 2 h et laver avec du PBS 3x pendant 15 min chacun.
- Effectuer une déshydratation dégradée à l’alcool et à l’acétone, à l’aide d’acétone et d’un agent d’enrobage. Immergez-vous dans des dégradés de 1:1, 1:2 et 1:31 pendant 2 h, 4 h et 8 h, respectivement. Ensuite, utilisez un agent d’enrobage pur et encastrez les échantillons à 37 °C pendant la nuit.
- Après 8 h, placez la plaque encastrée dans un four à 60 °C pour la polymérisation pendant 48 h. Coupez le bloc de résine traité ci-dessus dans une trancheuse ultra-fine, avec une épaisseur de tranche réglée sur 60-80 nm ; Utilisez un treillis de cuivre pour déloger les tranches.
- Utilisez une solution d’acétate de peroxyde d’hydrogène à 2 % et d’alcool pour la coloration pendant 8 min, suivie d’un lavage à l’éthanol à 70 % et à l’eau ultrapure 3 fois. Compléter par un lavage avec de l’éthanol à 2,6 % et de l’eau ultra-pure.
- Observer et acquérir des images au microscope électronique à transmission.
- Analyse quantitative de réaction en chaîne par polymérase en temps réel (qRT-PCR)
- Ajoutez 20 mg de tissu rénal congelé dans le tube de microcentrifugation et broyez soigneusement avec un broyeur à tissus à grande vitesse jusqu’à ce qu’il n’y ait plus de masse tissulaire visible.
- Recueillir le surnageant après centrifugation à 15 984 x g pendant 10 min. Ajouter 250 μL de chloroforme et retourner le tube pendant 15 s ; La solution est bien mélangée. Laisser reposer à température ambiante pendant 3 min, puis centrifuger à 15 984 x g pendant 10 min à 4 °C.
- Recueillir la phase aqueuse supérieure et la transférer dans un nouveau tube à centrifuger exempt de RNase. Ajoutez un volume égal d’éthanol à 70 % (préparation d’eau sans RNase), retournez et mélangez.
- Ajouter la solution dans la colonne d’adsorbant chargée dans le tube de prélèvement pour le lavage de l’ARN. Après le lavage Buffer RW, laissez la colonne à température ambiante pendant 5 min pour qu’elle sèche.
- Placez la colonne dans un nouveau tube de centrifugation sans RNase, ajoutez 30 à 50 μL d’eau sans RNase au milieu de la colonne, laissez reposer à température ambiante pendant 1 min, puis centrifugez à 15 984 x g pendant 1 min. Prélevez la solution d’ARN et conservez-la à -80 °C.
- Sortir la solution d’ARN du congélateur et la pré-dénaturer à 90 °C pendant 10 min, puis 40 cycles de 95 °C pendant 15 s, 60 °C pendant 35 s et 72 °C pendant 25 s, et enfin lyser dans l’ordre de 95 °C pendant 15 s, 60 °C pendant 60 s, 95 °C pendant 15 s (tableau supplémentaire 1).
- En utilisant la β-actine comme référence interne, calculer l’expression relative de WT-1 et de Nephrin à l’aide de la méthode 2¬-ΔΔCt basée sur la valeur Ct de chaque échantillon (ΔΔCt = Valeur Ct du gène cible - Valeur Ct du gène de référence interne)30. Le tableau 3 fournit des informations détaillées sur les amorces.
- Analyse par Western blot (WB)
- Préparez le lysat selon le rapport inhibiteur de protéase :inhibiteur de phosphatase :RIPA= 1:1:100, et ajoutez 500 μL de lysat dans un tube de microcentrifugation.
- Ajoutez 100 mg de tissu rénal congelé dans le tube de microcentrifugation et broyez soigneusement avec un broyeur à tissu à grande vitesse jusqu’à ce qu’il n’y ait plus de masse tissulaire visible.
- Retirez le tube de la microcentrifugeuse, laissez reposer sur de la glace pendant 30 min, puis centrifugez à 15 984 x g pendant 10 min. Aspirez le surnageant et conservez-le à -80 °C.
- Détectez la concentration en protéines selon les instructions du kit de dosage de la concentration en protéines de l’acide bicinchoninique (BCA) et ajoutez la solution de PBS goutte à goutte pour assurer une concentration constante en protéines dans chaque groupe.
- Ajoutez 5 tampons de suréchantillonnage des protéines dans le tube de la microcentrifugeuse, incubez à 100 °C pendant 15 minutes pour le dénaturer complètement, puis retirez-le après refroidissement.
- Séparez les protéines par électrophorèse sur gel SDS-PAGE à 12,5 %, en utilisant d’abord 80 V, ce qui fait que tous les échantillons sont pressés en une ligne bleue plate, puis ajustez la tension à 130 V, jusqu’à ce que le bleu de bromophénol s’écoule du bas de la plaque de gel. Arrêtez l’électrophorèse.
- Retirez le gel. Mouillez le papier filtre avec un tampon de transfert à membrane. Activez la membrane de fluorure de polyvinylidène (PVDF) dans le méthanol pendant 30 secondes. Ensuite, disposez le tout dans l’ordre suivant : maille éponge/papier filtre/gel/membrane PVDF/papier filtre/papier filtre/maille éponge dans le clip utilisé pour le transfert de la membrane.
- Placez le gel dans le pôle négatif, la membrane PVDF dans le pôle positif, et transférez la membrane avec un courant de 200 MA pendant 90 min.
- Retirez la membrane PVDF et lavez-la une fois avec du TBST pendant 5 min. Ajouter la solution de fermeture à température ambiante en agitant pendant 90 min. Laver avec du TBST 3x pendant 5 min chacun.
- Ajouter les anticorps primaires PI3K (1:1000), PIK3CA (1:1000), AKT (1:1000), P-AKT (1:1000), BAD (1:1000), P-BAD (1:1000), BCL-2 (1:1000), bax (1:4000) et c-caspase3 (1:1000) et incuber dans une boîte humide pendant la nuit à 4 °C au réfrigérateur31,32.
- Retirez la membrane PVDF du réfrigérateur à 4 °C, lavez-la avec du TBST 3x pendant 5 min chacune. Ajouter l’anticorps secondaire (1:10 000) goutte à goutte, incuber à 37 °C pendant 90 min et laver avec du TBST 3x pendant 3 min chacun.
- Préparez la solution de développement selon le rapport (A : B = 1:1) et développez-les sur la machine selon les instructions.
Résultats
Résultats d’analyse des composants de KMF
Dans les modes ioniques positifs et négatifs analysés par LC-MS/MS, 147 et 120 composés ont été identifiés, respectivement (Figure 1A-B). Certains composés et leur masse moléculaire calculée en MF, leur valeur m/z, leur temps de rétention et leurs ions parents sont présentés dans le tableau supplémentaire 2.
KMF a amélioré les troubles du métabolisme des lipides et les lésions hépatiques et rénales chez les rats MN
En utilisant des rats SD et C-BSA, nous avons établi un modèle MN. Après 1 semaine d’injections de C-BSA dans la veine de la queue, les rats MN ont présenté divers degrés de fatigue mentale, une diminution de l’appétit, une croissance lente, une couleur de cheveux terne, une fourrure duveteuse, une réponse retardée et une perte de poids, certains rats développant un œdème scrotal. Après 4 semaines d’administration, différentes doses de KMF ont significativement réduit les niveaux d’expression de la protéine totale urinaire sur 24 h (24 h-UTP), du Scr et de l’BUN, améliorant la fonction rénale (Figure 2A-C) ; la réduction des niveaux d’expression de l’ALT et de l’ASAT et l’augmentation des niveaux d’expression du TP et de l’ALB améliorent la fonction hépatique (Figure 2D-G) ; a réduit les niveaux d’expression de TC et TG, et amélioré la fonction de régulation des lipides (Figure 2H-I). Ces résultats suggèrent que KMF a un effet protecteur sur la fonction rénale ; Cependant, son mécanisme d’action spécifique n’est pas encore clair.
KMF améliore les dommages histopathologiques du tissu rénal chez les rats MN
Pour tester si KMF pouvait améliorer les lésions rénales chez les rats MN, en utilisant H&E, PAS, Masson et IF ont détecté des lésions histopathologiques du tissu rénal. La coloration H&E et PAS a montré une hypertrophie glomérulaire, une légère prolifération des cellules mésangiales, une dilatation tubulaire rénale et une dégénérescence vacuolaire des cellules épithéliales tubulaires rénales dans le groupe MOD (Figure 3A). La coloration de Masson a montré une augmentation significative de la zone de fibrose rénale dans le groupe MOD (Figure 3B-C). L’immunofluorescence a montré que l’intensité relative de fluorescence des IgG et C3 dans le groupe MOD était significativement plus élevée que celle dans le groupe CON (Figure 3D-F). Après l’administration d’inhibiteurs de KMF, BEN ou PI3K + KM-M, le degré d’hypertrophie glomérulaire, ainsi que le degré de prolifération des cellules attachées, ont été réduits, la zone de fibrose rénale a été significativement réduite et l’intensité de fluorescence relative des IgG et C3 était significativement plus faible. Ces résultats indiquent que la KMF peut atténuer les lésions pathologiques rénales chez les rats MN.
KMF atténue les dommages aux podocytes en activant la voie de signalisation PI3K/AKT
Les dommages des podocytes clés dans la MN ont également été observés à l’aide des méthodes décrites ici, à savoir IHC, PCR, TUNEL et TEM. Les résultats de l’IHC et de la PCR ont montré que, par rapport au groupe CON, le groupe MOD présentait une diminution significative des niveaux d’expression des protéines marqueurs spécifiques et fonctionnelles des podocytes, WT-1 et Nephrin, indiquant des lésions des podocytes, tandis que le traitement KMF augmente les niveaux d’expression de WT-1, Nephrin et atténue les lésions des podocytes (Figure 4A-E). Les résultats de la coloration TUNEL ont montré une apoptose sévère des podocytes dans le groupe MOD, tandis que le traitement KMF a significativement diminué l’intensité de la fluorescence et réduit l’incidence de l’apoptose (Figure 4F-G). Les résultats de la TEM ont montré que la membrane basale du glomérule dans le groupe MOD était significativement inégalement épaissie, et que les mitochondries des podocytes présentaient un gonflement sévère, une matrice clairsemée et un bombardement vide de la matrice, avec des crêtes réduites ou absentes. Après l’administration de KMF, l’épaississement de la membrane basale glomérulaire a été significativement réduit et la morphologie des mitochondries podocytaires a été significativement restaurée (Figure 4H). Ces résultats indiquent que KMF peut atténuer les dommages causés aux podocytes chez les rats MN.
Une détection plus poussée de l’expression des protéines liées à la voie de signalisation PI3K/AKT26,27 par WB a révélé que, par rapport au groupe CON, le groupe MOD a montré une augmentation significative des niveaux d’expression de PI3K, PIK3CA, AKT, P-AKT, BAD, BAX et C-caspase3, tandis que les niveaux d’expression de P-BAD et BCL-2 ont diminué de manière significative. Bien que le traitement KMF réduise les niveaux d’expression de PI3K, PIK3CA, AKT, P-AKT, BAD, BAX et C-caspase3, il augmente les niveaux d’expression de P-BAD et BCL-2 (Figure 4I-J). Ces résultats indiquent en outre que KMF peut améliorer les dommages aux podocytes chez les rats MN en activant la voie de signalisation PI3K/AKT.
Explorer les mécanismes possibles de la thérapie KMF pour la MN sur la base de la transcriptomique
Pour révéler davantage les cibles et les mécanismes potentiels de la KMF dans le traitement de la MN, une analyse transcriptomique a été réalisée sur la base du Tandem Mass Tag (TMT). Les résultats ont montré qu’il y avait 898 gènes exprimés différentiellement (DEG) entre les groupes CON et MOD, dont 372 gènes régulés à la hausse et 526 gènes régulés à la baisse (Figure 5A-B). De même, il y avait 360 DEG entre les groupes KM-L et MOD, dont 202 gènes régulés à la hausse et 158 gènes régulés à la baisse (figure 5C-D). Pour identifier les gènes et les voies de signalisation qui peuvent être affectés, une analyse fonctionnelle de l’enrichissement de l’ontologie génétique (GO) et de l’Encyclopédie de Kyoto des gènes et des génomes (KEGG) a été réalisée (figure 5E-H). Les résultats ont montré que les processus biologiques de la DEG se concentrent principalement sur les processus cellulaires et la régulation biologique, tandis que les fonctions de la DEG se concentrent principalement sur les interactions ligand-récepteur neuroactifs, telles que les voies de signalisation CAMP, PPAR, PI3K-AKT et p53. Ces résultats suggèrent que KMF pourrait traiter la MN en affectant ces voies de signalisation, la voie de signalisation PI3K/AKT ayant été validée dans des expériences. Enfin, les 100 premiers DEG ont été sélectionnés par ordre de valeur en degrés pour construire le réseau d’interaction protéine-protéine (IPP) (Figure 5I-J).
Figure 1 : Chromatogramme d’ions de crête LC-MS/MS. (A) Mode d’ions positifs. (B) Mode d’ions négatifs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
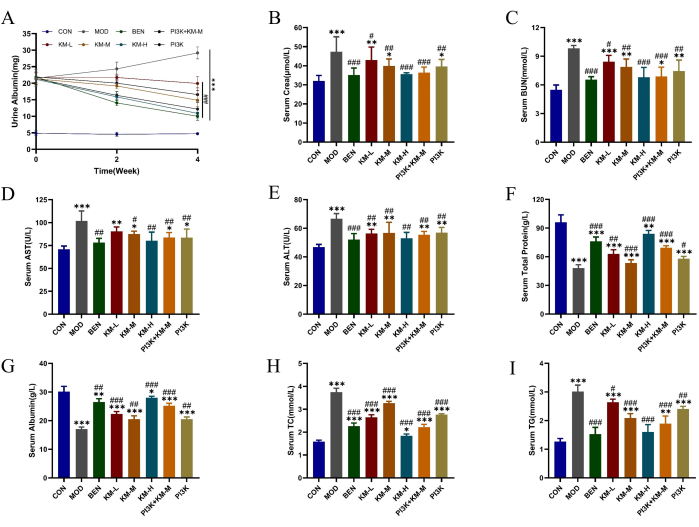
Figure 2 : KMF améliore les troubles du métabolisme des lipides et les lésions hépatiques et rénales chez les rats MN. (A-C) Les effets de Kemeng Fang sur la fonction rénale, y compris l’albumine urinaire de 24 heures, le Cera sérique et le BUN sérique. (D-G) Les effets de Kemeng Fang sur la fonction hépatique comprennent l’alanine aminotransférase (ALT), l’aspartate transaminase (AST), les protéines totales et l’albumine sérique. (H-I) L’effet de Kemeng Fang sur la régulation du métabolisme des lipides sanguins, y compris les triglycérides (TG) et le cholestérol total (TC). Les données sont exprimées sous forme de moyennes ±écarts-types de 3 à 6 échantillons indépendants, en utilisant l’ANOVA à un facteur dans le test T, par rapport au groupe à blanc, *p<0,05, **p<0,01, ***p<0,001, et comparées au groupe modèle, #p < 0,05, ##p < 0,01, ###p < 0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
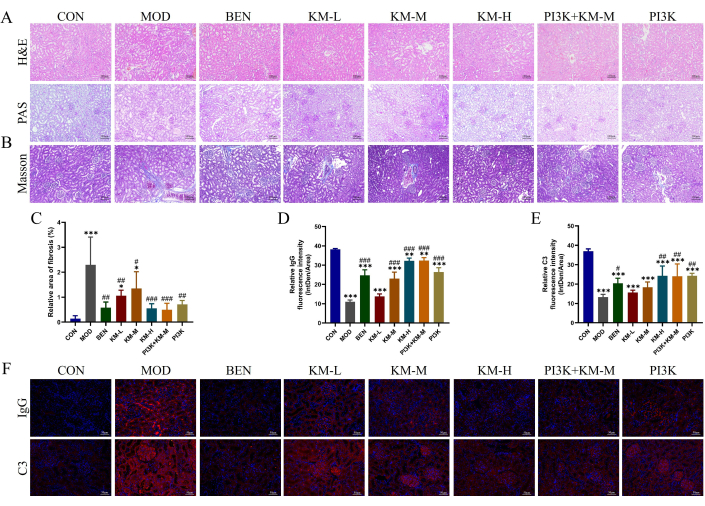
Figure 3 : Kemeng Fang améliore les lésions histopathologiques des reins de rats MN. (A) Examen histologique rénal, y compris H&E et PAS (200x). (B-C) Analyse semi-quantitative de la surface relative de la fibrose rénale (fibres de collagène bleues) à l’aide de la coloration Masson et du logiciel Image J. (D-F) Analyse semi-quantitative de l’intensité relative de fluorescence (Intden/Aire ; où Intden est l’intensité de fluorescence régionale totale, l’aire est l’aire régionale) des IgG et C3 dans le tissu rénal à l’aide des logiciels IF et Image J. Veuillez cliquer ici pour voir une version agrandie de cette figure.
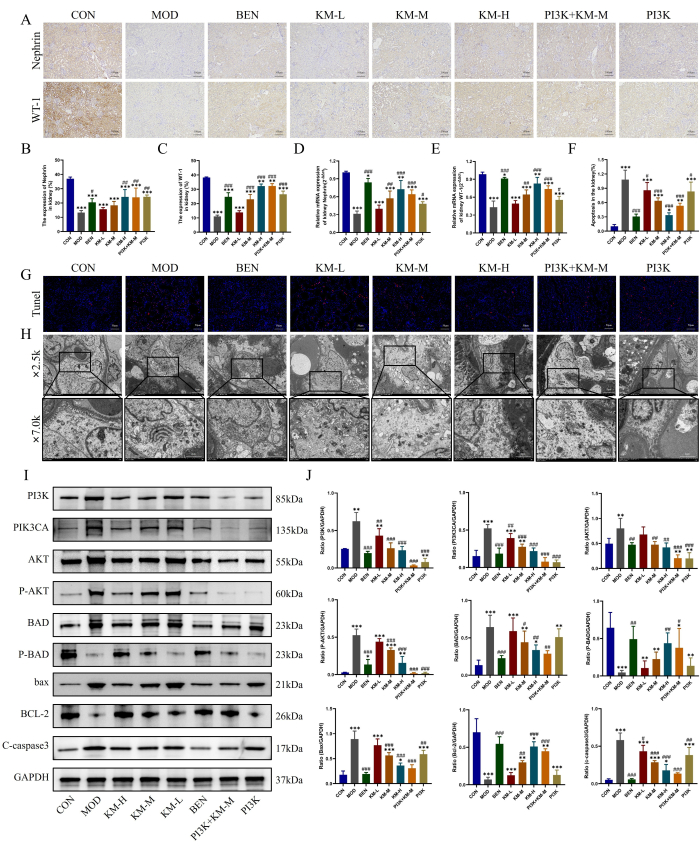
Figure 4 : Kemeng Fang atténue les dommages aux podocytes en activant la voie de signalisation PI3K/AKT. (A-C) L’IHC a été utilisée pour détecter les niveaux d’expression relatifs de deux protéines marqueurs de podocytes, WT-1 et Nephrin, dans le tissu rénal. (D-E) Détection par PCR de l’expression relative de l’ARNm de deux protéines marqueurs de podocytes, WT-1 et Nephrin, dans le tissu rénal. (F-G) La coloration TUNEL a été utilisée pour détecter l’incidence de l’apoptose dans le tissu rénal. (H) Observation de la membrane basale glomérulaire et de la structure mitochondriale des podocytes à l’aide de la MET (2 500x, bar = 5 μM ; 7 000x, bar = 2 μM). (I-J) Détection WB des niveaux d’expression protéique relatifs de PI3K, PIK3CA, AKT, P-AKT, BAD, P-BAD, BCL-2, bax et C-caspase3 dans le tissu rénal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
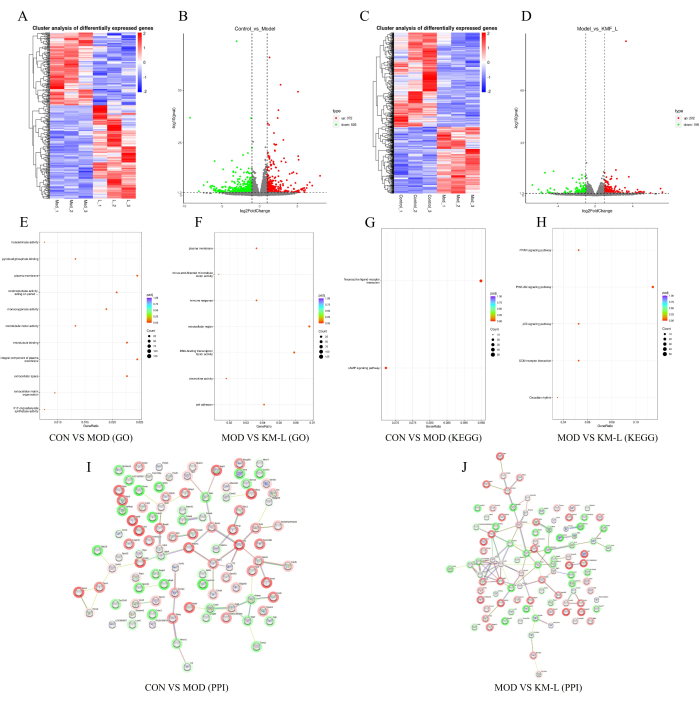
Figure 5 : Exploration du mécanisme possible de Kemeng Fang dans le traitement de la MN sur la base de la transcriptomique. (A-B) Cartes thermiques différentielles des gènes et tracés des volcans entre les groupes CON et MOD, le bleu représentant la régulation négative et le rouge représentant la régulation positive. (C-D) Cartes thermiques différentielles des gènes et tracés des volcans entre les groupes MOD et KM-L, le bleu représentant la régulation négative et le rouge la régulation positive. (E) Enrichissement GO entre les groupes CON et MOD. (F) Enrichissement GO entre les groupes MOD et KM-L. (G) Enrichissement de KEGG entre les groupes CON et MOD. (H) Enrichissement KEGG entre les groupes MOD et KM-L. (I) Tableau d’interaction protéine-protéine (IPP) des 100 principaux gènes différentiellement exprimés entre les groupes CON et MOD. (J) Tableau PPI des valeurs supérieures de 100 degrés DEG entre les groupes MOD et KM-L. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| NON. | Nom chinois | Nom latin | Famille | Pièce utilisée | Dose(g) |
| 1 | Dangshen (DS) | Codonopsis pilosula (Franch.) Nannf. | Campanulaceae | Racine | 20 |
| 2 | Huangqi (QG) | Astragalus membranaceus (Fisch.) Bunge. | Leguminosae | Racine | 30 |
| 3 | Huanglian (HL) | Coptis chinensis Franch. | Ranunculaceae | Racine et tubercule | 3 |
| 4 | Suye (SY) | Perilla frutescens (L.) Britt | Labiatae | feuille | 6 |
| 5 | Shudihuang (SDH) | Rehmannia glutinosa (Gaertn.) Courant continu. | Scrophulariaceae | Racine et tubercule | 15 |
| 6 | Chuanxiong (CX) | Ligusticum chuanxiong Hort. | Anmmellières | Racine et tubercule | 15 |
| 7 | Qianshi (QS) | Euryale ferox Salisb. | Nymphaeaceae | Graines | 15 |
| 8 | Qinfengteng (QFT) | Sabia japonica Sentence. | Sabiacées | Racine, tubercule et feuille | 10 |
| 9 | Wubeizi (WBZ) | Rhus chinensis Moulin. | Anacardiaceae | feuille | 3 |
| 10 | Banbianlien (BBL) | Lobelia chinensis Lour. | Campanulaceae | Tubercule et feuille | 15 |
| 11 | Baihuasheshecao (BHSSC) | Oldenlandia diffusa (Willd.) Roxb. | Rubiaceae | Tubercule et feuille | 15 |
Tableau 1 : Composition de Kemeng Fang (KMF).
| Anticorps | Dilution multiple |
| IgG | 1:100 |
| C3 | 1:100 |
| WT-1 | 1:200 |
| Néphrine | 1:100 |
| PI3K | 1:1000 |
| PI3K3CA | 1:1000 |
| AKT | 1:1000 |
| P-AKT | 1:1000 |
| MAUVAIS | 1:1000 |
| P-BAD | 1:1000 |
| BCL-2 | 1:1000 |
| Bax | 1:4000 |
| C-caspase3 | 1:1000 |
| GAPDH | 1:1000 |
Tableau 2 : Multiples de dilution des anticorps.
| Gène | Amorce | Séquence (5'-3') | Produits PCR | |
| Rat GAPDH | En avant | ACAGCAACAGGGTGGTGGAC | 253 pb | |
| Inverse | TTTGAGGGTGCAGCGAACTT | |||
| Rat WT-1 | En avant | AATGGACAGAAGGGCAGAGCA | 209 pb | |
| Inverse | TGGGTACGCACACATGAAAGG | |||
| Néphrine de rat | En avant | CGGAGAACAAGAACGTGACC | 177 pb | |
| Inverse | ATTGTCTTCTCTCCGCACCA | |||
Tableau 3 : Informations détaillées sur les amorces qRT-PCR.
Tableau supplémentaire 1 : Réaction PCR. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 2 : Liste quantitative de l’identification des métabolites. ID : Numéro de série de poids moléculaire de premier ordre ; Nom : Résultat de l’identification ; Mz : rapport masse/noyau ; Rt : temps de rétention (S) ; Masse exacte : Poids moléculaire précis ; Ppm : L’erreur entre la masse moléculaire détectée et la masse moléculaire théorique, mesurée en ppm ; precursor_type : Mode d’ionisation, [M+H]+ est en mode d’ions positifs, [M-H]- est en mode d’ions négatifs ; class : Classification triple dans la base de données HMDB ; sub_class : Classification à quatre niveaux dans la base de données HMDB ; KEGG : Nombre de composés KEGG ; KEGG_Pathway : Voie de signalisation KEGG ; CAS : Numéro d’enregistrement du Chemical Abstracts Service ; HMDB : numéro de base de données HMDB ; Bibliothèque : Base de données ; Formule : Formule moléculaire théorique ; KEGG : Nombre de composés KEGG ; Bibliothèque : Base de données ; niveau : Niveau d’identification du métabolite ; POS : mode d’ions positifs ; négatif : mode d’ions négatifs ; KMF_1/2/3 : intensité ionique totale de trois expériences. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Cette étude visait à observer les effets pharmacologiques de KMF et à explorer son mécanisme spécifique d’inhibition de l’apoptose des podocytes de rat MN. Tout d’abord, il a démontré in vivo que KMF peut atténuer l’apoptose des podocytes et retarder la progression des MN en activant la voie de signalisation PI3K/AKT. Deuxièmement, les résultats transcriptomiques ont montré que KMF peut exercer ses effets par le biais des voies de signalisation PPAR, PI3K/AKT et p53, de l’interaction entre les récepteurs ECM, etc. Parmi elles, la voie de signalisation PI3K/AKT a été validée dans des expériences. Ces résultats peuvent fournir une base scientifique pour l’utilisation clinique de KMF comme option de traitement potentielle pour les patients atteints de MN.
La recherche a montré que l’apoptose des podocytes est l’un des facteurs clés conduisant à la progression progressive de la MN. De plus, la MN limite la division et la capacité de prolifération des podocytes ; Par conséquent, une fois endommagée ou perdue, cette séquelle affecte gravement la fonction rénale. Lorsque le nombre de podocytes diminue au point de ne plus pouvoir couvrir complètement le GBM, le GBM est complètement exposé et adhère à la capsule de Bowman, provoquant une compression ou même un effondrement de la boucle capillaire glomérulaire, favorisant finalement le développement de MN en ESRD 33,34,35,36. Par conséquent, des recherches supplémentaires sur le mécanisme spécifique de l’apoptose des podocytes et les méthodes pour bloquer ou inhiber l’apoptose des podocytes sont essentielles pour retarder la progression de la MN. La recherche a montré que la voie de signalisation PI3K/AKT a de multiples fonctions dans la régulation de l’apoptose cellulaire, du stress oxydatif et de la réponse inflammatoire et joue un rôle régulateur important dans l’apparition et le développement de la MN. WT-1 et la néphrine sont des protéines de la membrane interstitielle exprimées sur les podocytes, qui jouent non seulement un rôle important dans le maintien de la structure et de la fonction normales de la membrane interstitielle, mais initient également les voies de signalisation dépendantes de PI3K/AKT et participent à la signalisation des podocytes. La diminution des niveaux d’expression de ces protéines indique souvent des dommages aux podocytes 37,38,39.
PI3K est un dimère composé d’une sous-unité régulatrice, p85, et d’une sous-unité catalytique, p110, qui peut être activée par divers facteurs et complexes de croissance. C’est un facteur clé et initiateur de ce parcours40. Le gène PIK3CA est situé sur le chromosome 3 et possède un total de 20 exons. Sa fonction principale est de coder l’une des sous-unités catalytiques de l’enzyme PI3K, la protéine p110 α ; par conséquent, les modifications de PIK3CA peuvent faire en sorte que l’enzyme PI3K reste dans un état d’activation soutenue41. Une fois que PI3K est activé, le second messager, PIP3, va générer et stimuler en continu la voie de signalisation AKT en aval, tandis que p-AKT favorise la phosphorylation de la molécule pro-apoptotique, Bad, dissociant le complexe pro-apoptotique de Bad avec Bcl-2 et Bcl-xL, et formant un complexe avec la protéine 14-3-3 dans le cytoplasme, perdant ainsi sa fonction pro-apoptotique. Les molécules anti-apoptotiques, BCL-2 et Bcl-xL, peuvent être complètement dissociées et exercer un effet inhibiteur sur l’apoptose des podocytes42,43. La caspase-3 est une protéase qui joue un rôle central dans la phase d’exécution de l’apoptose cellulaire, conduisant finalement à l’apoptose cellulaire en clivant l’enzyme de réparation de l’ADN PARP en petits fragments44. L’induction de la libération du cytochrome c des mitochondries vers le cytoplasme par la protéine pro-apoptotique Bad est une étape clé dans l’activation de la caspase, et le complexe de liaison de P-Bad à la protéine 14-3-3 inhibe ce processus, empêchant ainsi l’apparition de la cascade apoptotique 45,46,47.
Les résultats transcriptomiques indiquent que le traitement KMF pour la MN est étroitement lié aux voies de signalisation PI3K/AKT, PPAR et p53. Validation de la voie de signalisation PI3K/AKT par l’analyse WB. Les résultats expérimentaux ont montré que la voie de signalisation PI3K/AKT chez les rats MN était significativement inhibée, tandis que KMF pouvait activer de manière significative la voie de signalisation PI3K/AKT, réduisant la génération des molécules pro-apoptotiques Bad et Bax et favorisant la génération de la molécule anti-apoptotique BCL-2, augmentant ainsi les niveaux d’expression des protéines de la membrane hiatale des podocytes, WT-1 et Nephrin. et la réduction de l’incidence de l’apoptose des podocytes. Par conséquent, KMF réduit l’apoptose des podocytes en activant la voie de signalisation PI3K/AKT et s’est avéré avoir un effet protecteur sur les rats modèles MN.
Cependant, cette étude présente certaines limites. Tout d’abord, cette étude n’a exploré que le mécanisme de l’inhibition KMF de l’apoptose des podocytes au niveau des expériences animales in vivo, ce qui doit être vérifié par des expériences cellulaires in vitro ainsi que par des explorations approfondies du mécanisme ; deuxièmement, les lésions podocytaires sont également étroitement liées à l’autophagie, à l’inflammation immunitaire et à la pyroptose, et il faut explorer davantage si KMF peut affecter MN en régulant l’autophagie, l’inflammation immunitaire et la pyroptose48,49.
La famille des PPAR (PPAR α, PPAR β/δ, PPAR γ) est un récepteur d’hormone nucléaire qui repose sur l’activation des ligands et a des fonctions importantes telles que la participation au métabolisme énergétique, la régulation de l’apoptose cellulaire et la réponse inflammatoire50,51. Ils affectent la transcription des gènes en formant une hétérodimérisation avec le récepteur X de l’acide rétinoïque (RXR), où les PPAR γ régulent tous deux le facteur inflammatoire NF-κB. La clé de l’activation B réside dans sa fonction de protection des podocytes contre les dommages 52,53,54. De nombreuses études ont montré que les agonistes des γ PPAR (TZD, tels que la pioglitazone) ont des effets protecteurs rénaux indépendants des effets hypoglycémiants, protégeant directement les podocytes des dommages et réduisant la protéinurie et les lésions glomérulaires dans divers modèles animaux de maladies rénales 55,56,57,58,59. Il existe également des rapports indiquant que la PPAR peut réduire l’apoptose des podocytes en inhibant l’activation de la caspase-360. Les dernières recherches indiquent qu’un nouveau type de PPAR γ, le régulateur sélectif GQ-16, est plus efficace que le TZD pour réduire la protéinurie et les complications liées au syndrome néphrotique, ce qui ouvre également la voie au traitement des maladies rénales61. KMF a un effet protecteur sur l’apoptose des podocytes de rat MN en activant la voie de signalisation PI3K/AKT. Sur la base du rôle important de la voie de signalisation PPAR dans les reins, une exploration plus approfondie de la relation entre KMF, PPAR et MN est nécessaire à l’avenir.
Déclarations de divulgation
Tous les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Ce travail a été soutenu par la Fondation provinciale des sciences naturelles du Jilin (n° YDZJ202301ZYTS145 et n° 1. YDZJ202301ZYTS208).
matériels
| Name | Company | Catalog Number | Comments |
| 2-Amino-3-(2-chloro-phenyl)-propionic acid | Aladdin | 103616-89-3 | |
| 30% H2O2 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10011218 | |
| 812 embedding agent | SPI | 90529-77-4 | |
| Acetone | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000418 | |
| Acetonitrile | Thermo | 75-05-8 | |
| Ammonia | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10002118 | |
| Ammonium formate | Sigma | 540-69-2 | |
| Analytical balance | Changzhou Lucky Electronic Equipment Co., Ltd | FA | |
| Anhydrous ethanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10009218 | |
| Anti fluorescence quenching and sealing agent | southernbiotech | 0100-01 | |
| Automatic biochemical analyzer | Rayto Life and Analytical Sciences | Chemray240 | |
| BCA Protein Assay Kit | Solarbio | PC0020 | |
| Benazepril hydrochloride tablets | Xinya Minhang | H20044840 | |
| Blender | Kylin-Bell | BE-2600 | |
| Brick and stone cutting blade | Daitome | Ultra45 | |
| BSA | ZSGB-BIO | ZLI-9027 | |
| Buffer RW | Beijing Baiao Leibo | WK191 | |
| Carbodiimide hydrochloride | Hubei Xinghengye Technology | 25952-53-8 | |
| Cell apoptosis detection kit | Elabscience | E-CK-A322 | |
| Chemiluminescence imaging system | Hangzhou Shenhua Technology Co., Ltd | SH-523 | |
| Chloroform | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10006818 | |
| Constant temperature drying oven | Thermo Fisher | Heto PowerDiy LL3000 | |
| Cover glass slide | Jiangsu Shitai Experimental Equipment Co., Ltd | 10212450C | |
| CY3 Conjugated AffiniPure Goat Anti-rabbit IgG (H+L) | BOSTER | BA1032 | |
| DAB reagent kit | Servicebio | G1212-200T | |
| DAPI | Blue Cloud Sky | C1002 | |
| Decolorization shaker | Wuhan Lingsi Biotechnology Co., Ltd | TSY-B | |
| Dehydration machine | Wuhan Junjie Electronics Co., Ltd | JJ-12J | |
| DL2000 DNA Marker | TIANGEN | MD114 | |
| DMSO | MCE | HY-Y0320 | |
| dNTP | TIANGEN | CD117 | |
| EBlot L1 Rapid Wet Rotation Instrument | Kingsray Biotechnology Co., Ltd | L00686C | |
| ECL substrate solution | affinity | KF8003 | |
| Electric constant temperature water bath pot | Fisaff Instrument (Hebei) Co., Ltd | DK-20000-IIIL | |
| Electrophoresis instrument power supply | Beijing Longfang Technology Co., Ltd | LF-600S | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd | JB-P5 | |
| Equilibrium buffer | Wuhan Lingsi Biotechnology Co., Ltd | E8090 | |
| Ethylenediamine | Ruichengkang Pharmaceutical Technology | 107-15-3 | |
| FA series multifunctional analytical electronic balance | Changzhou Lucky Electronic Equipment Game Company | FA1204 | |
| Filter membrane | Jinteng | Nylon6-0.22μm | |
| Formaldehyde solution | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10010018 | |
| Formic acid | TCI | 64-18-6 | |
| Freezing centrifuge | Xiangyi | H1850-R | |
| Frozen platform | Wuhan Junjie Electronics Co., Ltd | JB-L5 | |
| Glacial acetic acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000218 | |
| Glass bead | Sigma | G8772-500G | |
| Glass slide | Nantong Meiweide Life Science Co., Ltd | PC2-301 | |
| glycine | Biofroxx | 30166428 | |
| Hematoxylin | Wuhan Lingsi Biotechnology Co., Ltd | G1140 | |
| High speed refrigerated centrifuge | Hunan Kecheng Instrument Equipment Co., Ltd | H1-16KR | |
| Horizontal agarose electrophoresis tank | Long Fang | LF-31DS | |
| Horizontal shaker | Jiangsu Haimen Qilin Bell Instrument Manufacturing Co., Ltd | TS-1 | |
| HRP Conjugated AffiniPure Goat Anti-rabbit IgG (H+L) | BOSTER | BA1054 | |
| hydrochloric acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10011028 | |
| Imaging system | Nikon | Nikon DS-U3 | |
| Incomplete Freund's adjuvant | MCE | ISA-51 | |
| Intelligent digital magnetic heating stirrer | Hangzhou Miou Instrument Co., Ltd | TP-350E+ | |
| Isoflurane | Sigma | 26675-46-7 | |
| Isopropanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 80109218 | |
| KCl | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10020318 | |
| KH2PO4 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 1115GR500 | |
| Liquid chromatograph | Thermo | IQLAAAGABHFAPUMBJC | |
| marker(10-250KD) | Mei5bio | MF028-plus-01 | |
| marker(20-120KD) | GenScript | M00521 | |
| Mass spectrometer | Thermo | IQLAAEGAAPFALGMBDK | |
| Masson staining kit | BASO | BA4079B | |
| Methanol | Thermo | 67-56-1 | |
| microscope | Nikon | ECLIPSE Ci | |
| microwave oven | Galanz Microwave Oven Electrical Appliance Co., Ltd | P70D20TL-P4 | |
| Multi sample tissue grinder | Shanghai Jingxin Industrial Development Co., Ltd | Tissuelyser-24L | |
| Multiskan FC ELISA reader | Thermo scientific | 1410101 | |
| Na2HPO4.12H2O | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10017618 | |
| NaCl | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000218 | |
| Neutral resin | Wuhan Lingsi Biotechnology Co., Ltd | G8590 | |
| Normal Goat Serum | Solarbio | SL038 | |
| Organizational spreading machine | Zhejiang Jinhua Kedi Instrument Equipment Co., Ltd | KD-P | |
| Osmic acid | Ted Pella Inc | 18450 | |
| oven | Shanghai Huitai Instrument Manufacturing Co., Ltd | DHG-9140A | |
| Palm centrifuge | Wuhan Lingsi Biotechnology Co., Ltd | D1008E | |
| Paraformaldehyde | Solarbio | P1110 | |
| PAS staining kit | BASO | BA4114B | |
| Pathological slicer | Shanghai Leica Instrument Co., Ltd | RM2016 | |
| PBS | Solarbio | P1020 | |
| PCR instrument | Hangzhou Miou Instrument Co., Ltd | PR-96 | |
| PH meter | Sedolis Scientific Instruments (Beijing) Co., Ltd | PB-10 | |
| PH meter | Sedolis Scientific Instruments (Beijing) Co., Ltd | 2018C132-11 | |
| PI3K inhibitor LY294002 | MCE | HY-10108 | |
| Pipette gun | Dragon | KE0003087/KA0056573 | |
| Protein phosphatase inhibitor complex | Meilunbio | MB12707-1 | |
| PVDF membrane (0.22 μm) | Solarbio | ISEQ00010 | |
| PVDF membrane (0.45 μm) | Solarbio | YA1701 | |
| Quick primary/secondary antibody diluent | Solarbio | A1811 | |
| Rabbit anti-AKT | Affinity | AF0836 | |
| Rabbit anti-BAD | Affinity | AF6471 | |
| Rabbit anti-C3 | Affinity | DF13224 | |
| Rabbit anti-GAPDH | Hangzhou Xianzhi | AB-P-R 001 | |
| Rabbit anti-IgG | CST | 3900S | |
| Rabbit anti-Nephrin | bioss | bs-10233R | |
| Rabbit anti-P-AKT | Affinity | AF0016 | |
| Rabbit anti-p-BAD | invitrogen | PA5-105023 | |
| Rabbit anti-PI3K | Affinity | AF6241 | |
| Rabbit anti-PIK3CA | Bioss | Bs-2067R | |
| Rabbit anti-WT-1 | Affinity | DF6331 | |
| Real-Time PCR System | ABI | QuantStudio 6 | |
| RIPA Lysis Buffer | Meilunbio | MA0151 | |
| SDS | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10019318 | |
| Slide and cover glass | Jiangsu Shitai Experimental Equipment Co., Ltd | 10212432C | |
| Super pure water instrument | Zhiang Instrument (Shanghai) Co., Ltd | Clever-S15 | |
| SYBR Green Master Mix | VAZYME | Q111-02 | |
| Taq Plus DNA Polymerase | TIANGEN | ET105-02 | |
| Tissue grinder | Beautiful Wall | MB-96 | |
| Transmission electron microscope | HITACHI | HT7800/HT7700 | |
| Tris-base | Biofroxx | 10019318 | |
| Trizol | Ambion | 15596-026 | |
| TUNEL Cell Apoptosis Detection Kit (FITC) | Beijing Baiao Leibo | SY0475 | |
| Tween 20 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 30189328 | |
| Ultra micro UV visible spectrophotometer | Hangzhou Miou Instrument Co., Ltd | ND-100 | |
| Ultra thin slicer | Leica | Leica UC7 | |
| Ultrasonic cleaner | shumei | KQ- 800DE | |
| Upright optical microscope | Nikon | Nikon Eclipse CI | |
| Urinary Protein Test Kit | Nanjing Jiancheng Bioengineering Research Institute | C035-2 | |
| Vertical electrophoresis tank | Beijing 61 Instrument Factory | DYCZ-24DN | |
| Vortex mixer | Wuhan Lingsi Biotechnology Co., Ltd | MX-F | |
| Western Blocking Buffer | Solarbio | SW3010 | |
| xylene | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10023418 |
Références
- McQuarrie, E. P., Mackinnon, B., Stewart, G. A., Geddes, C. C., Registry, S. R. B. Membranous nephropathy remains the commonest primary cause of nephrotic syndrome in a northern European Caucasian population. Nephrol Dial Transplant. 25 (3), 1009-1011 (2010).
- Ronco, P. H., Debiec, H. Pathophysiological advances in membranous nephropathy: time for a shift in patient's care. Lancet. 385 (9981), 1983-1992 (2015).
- Xu, X., et al. Long-term exposure to air pollution and increased risk of membranous nephropathy in China. J Am Soc Nephrol. 27 (12), 3739-3746 (2016).
- Fogo, A. B., Lusco, M. A., Najafian, B., Alpers, C. E. AJKD atlas of renal pathology: Membranous nephropathy. Am J Kidney Dis. 66 (3), e15-e17 (2015).
- Li, X., Zhang, X. Comments on the 2021 Kidney Disease: Improving Global Outcomes (KDIGO) clinical practice guideline for anticoagulant therapy in patients with membranous nephropathy. Kidney Int. 101 (1), 186-187 (2022).
- Ruggenenti, P., Fervenza, F. C., Remuzzi, G. Treatment of membranous nephropathy: time for a paradigm shift. Nat Rev Nephrol. 13 (9), 563-579 (2017).
- Klomjit, N., Fervenza, F. C., Zand, L. Successful treatment of patients with refractory PLA2R-associated membranous nephropathy with Obinutuzumab: A report of 3 cases. Am J Kidney Dis. 76 (6), 883-888 (2020).
- Podestà, M. A., Ruggiero, B., Remuzzi, G., Ruggenenti, P. Ofatumumab for multirelapsing membranous nephropathy complicated by rituximab-induced serum-sickness. BMJ Case Rep. 13 (1), e232890-e232896 (2020).
- Stehlé, T., et al. Anti-CD38 therapy for PLA2R-positive membranous nephropathy resistant to conventional immunosuppression. Kidney Int. 101 (2), 416-418 (2022).
- Trimarchi, H., Coppo, R. Podocytopathy in the mesangial proliferative immunoglobulin A nephropathy: new insights into the mechanisms of damage and progression. Nephrol Dial Transplant. 34 (8), 1280-1285 (2019).
- Kopp, J. B., et al. Podocytopathies. Nat Rev Dis Primers. 6 (1), 68-72 (2020).
- Hoxha, E., Reinhard, L., Stahl, R. A. K. Membranous nephropathy: new pathogenic mechanisms and their clinical implications. Nat Rev Nephrol. 18 (7), 466-478 (2022).
- Chiou, T. T., et al. Rapamycin attenuates PLA2R activation-mediated podocyte apoptosis via the PI3K/AKT/mTOR pathway. Biomed Pharmacother. 144 (8), 112349-112356 (2021).
- Chen, J., et al. Danshen injection induces autophagy in podocytes to alleviate nephrotic syndrome via the PI3K/AKT/mTOR pathway. Phytomedicine. 107 (7), 154477-154489 (2022).
- Wang, Y., et al. Fangji Huangqi decoction ameliorates membranous nephropathy through the upregulation of BNIP3-mediated mitophagy. J Ethnopharmacol. 324 (13), 117734-117743 (2024).
- Wei, L., et al. Shenqi granule upregulates CD2AP and α-actinin4 and activates autophagy through regulation of mTOR/ULK1 pathway in MPC5 cells. J Ethnopharmacol. 303 (16), 115942-115954 (2023).
- Wang, P., et al. A review of the botany, phytochemistry, traditional uses, pharmacology, toxicology, and quality control of the Astragalus memeranaceus. Front Pharmacol. 14 (2), 1242318-1242325 (2023).
- Wang, Q., et al. Traditional Chinese medicine method of tonifying kidney for hypertension: Clinical evidence and molecular mechanisms. Front Cardiovasc Med. 20229 (16), 1038480-1038487 (2022).
- Tang, X., et al. Experimental models for elderly patients with membranous nephropathy: Application and advancements. Exp Gerontol. 185 (8), 112341-112353 (2024).
- Zhang, J. J., et al. Murine membranous nephropathy: immunization with α3(IV) collagen fragment induces subepithelial immune complexes and FcγR-independent nephrotic syndrome. J Immunol. 188 (7), 3268-3277 (2012).
- Hopfer, H., et al. The importance of cell-mediated immunity in the course and severity of autoimmune anti-glomerular basement membrane disease in mice. FASEB J. 17 (8), 860-868 (2003).
- Fleuren, G., Grond, J., Hoedemaeker, P. J. In situ formation of subepithelial glomerular immune complexes in passive serum sickness. Kidney Int. 17 (5), 631-637 (1980).
- Border, W. A., Ward, H. J., Kamil, E. S., Cohen, A. H. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen. J Clin Invest. 69 (2), 451-461 (1982).
- Border, W. A., Ward, H. J., Kamil, E. S., Cohen, A. H. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen. J Clin Invest. 69 (2), 451-461 (1982).
- Rubio-Navarro, A., et al. Phenotypic characterization of macrophages from rat kidney by flow cytometry. J Vis Exp. (116), e54599 (2016).
- Hou, Y., et al. Longzhibu disease and its therapeutic effects by traditional Tibetan medicine: Ershi-wei Chenxiang pills. J Ethnopharmacol. 249, 112426 (2020).
- Sethi, S., et al. Hematopoietic stem cell transplant-membranous nephropathy is associated with protocadherin FAT1. J Am Soc Nephrol. 33 (5), 1033-1044 (2022).
- Gong, Q., Lai, T., Liang, L., Jiang, Y., Liu, F. Targeted inhibition of CX3CL1 limits podocytes ferroptosis to ameliorate cisplatin-induced acute kidney injury. Mol Med. 29 (1), 140-148 (2023).
- Li, H., et al. IL-23 reshapes kidney resident cell metabolism and promotes local kidney inflammation. J Clin Invest. 131 (12), e142428-e142441 (2021).
- Wang, C., et al. Artificially cultivated Ophiocordyceps sinensis alleviates diabetic nephropathy and its podocyte injury via inhibiting P2X7R expression and NLRP3 inflammasome activation. J Diabetes Res. 356 (11), 1390418-1390431 (2018).
- Cheng, H., et al. PI3K/Akt signaling pathway and Hsp70 activate in hippocampus of rats with chronic manganese sulfate exposure. J Trace Elem Med Biol. 50 (12), 332-338 (2018).
- Ji, K., et al. The immunoreaction and antioxidant capacity of juvenile blunt snout bream (Megalobrama amblycephala) involves the PI3K/Akt/Nrf2 and NF-κB signal pathways in response to dietary methionine levels. Fish Shellfish Immunol. 105 (10), 126-134 (2020).
- Chiou, T. T., et al. Rapamycin attenuates PLA2R activation-mediated podocyte apoptosis via the PI3K/AKT/mTOR pathway. Biomed Pharmacother. 144 (3), 112349-112357 (2021).
- Lv, Q., Yang, F., Chen, K., Zhang, Y. Autophagy protects podocytes from sublytic complement induced injury. Exp Cell Res. 341 (2), 132-138 (2016).
- Mundel, P., Shankland, S. J. Podocyte biology and response to injury. J Am Soc Nephrol. 13 (12), 3005-3015 (2002).
- Sun, Z., Xu, Q., Ma, Y., Yang, S., Shi, J. Circ_0000524/miR-500a-5p/CXCL16 axis promotes podocyte apoptosis in membranous nephropathy. Eur J Clin Invest. 51 (3), e13414-e13422 (2021).
- Huber, T. B., et al. Nephrin and CD2AP associate with phosphoinositide 3-OH kinase and stimulate AKT-dependent signaling. Mol Cell Biol. 23 (14), 4917-4928 (2003).
- Ai, Z., et al. Deciphering the pharmacological mechanisms of Rostellularia procumbens (L) Nees. Extract alleviates adriamycin-induced nephropathy in vivo and in vitro. Phytomedicine. 113 (6), 154736-154742 (2023).
- Wang, X., et al. Nicorandil alleviates apoptosis in diabetic cardiomyopathy through PI3K/Akt pathway. J Cell Mol Med. 23 (8), 5349-5359 (2019).
- Fox, M., Mott, H. R., Owen, D. Class IA PI3K regulatory subunits: p110-independent roles and structures. Biochem Soc Trans. 48 (4), 1397-1417 (2020).
- Miricescu, D., et al. PI3K/AKT/mTOR signaling pathway in breast cancer: From molecular landscape to clinical aspects. Int J Mol Sci. 22 (1), 173-179 (2020).
- Feng, C., et al. Neuroprotective effect of Danhong injection on cerebral ischemia-reperfusion injury in rats by activation of the PI3K-Akt pathway. Front Pharmacol. 11 (4), 298-312 (2020).
- Zhou, Y., et al. 1,3-Dicaffeoylquinic acid targeting 14-3-3 tau suppresses human breast cancer cell proliferation and metastasis through IL6/JAK2/PI3K pathway. Biochem Pharmacol. 172 (12), 113752-113761 (2020).
- Li, J., et al. Tetrandrine inhibits colon carcinoma HT-29 cells growth via the Bcl-2/Caspase 3/PARP pathway and G1/S phase. Biosci Rep. 39 (5), (2019).
- Downward, J. How BAD phosphorylation is good for survival. Nat Cell Biol. 1 (2), E33-E35 (1999).
- Fan, J., et al. A model of ischemia and reperfusion increases JNK activity, inhibits the association of BAD and 14-3-3, and induces apoptosis of rabbit spinal neurocytes. Neurosci Lett. 473 (3), 196-201 (2010).
- Chipuk, J. E., Green, D. R. How do BCL-2 proteins induce mitochondrial outer membrane permeabilization. Trends Cell Biol. 18 (4), 157-164 (2008).
- Yin, L., Yu, L., He, J. C., Chen, A. Controversies in podocyte loss: Death or detachment. Front Cell Dev Biol. 9 (11), 771931-771942 (2021).
- Yang, C., et al. Research progress on multiple cell death pathways of podocytes in diabetic kidney disease. Mol Med. 29 (1), 135-143 (2023).
- Calvier, L., et al. PPARγ links BMP2 and TGFβ1 pathways in vascular smooth muscle cells, regulating cell proliferation and glucose metabolism. Cell Metab. 25 (5), 1118-1134 (2017).
- Dai, Z. W., Cai, K. D., Xu, L. C., Wang, L. L. Perilipin2 inhibits diabetic nephropathy-induced podocyte apoptosis by activating the PPARγ signaling pathway. Mol Cell Probes. 53 (3), 101584-101596 (2020).
- Kota, B. P., Huang, T. H., Roufogalis, B. D. An overview on biological mechanisms of PPARs. Pharmacol Res. 51 (2), 85-94 (2005).
- Wahli, W. Peroxisome proliferator-activated receptors (PPARs): from metabolic control to epidermal wound healing. Swiss Med Wkly. 132 (7-8), 83-91 (2002).
- Agrawal, S., He, J. C., Tharaux, P. L. Nuclear receptors in podocyte biology and glomerular disease. Nat Rev Nephrol. 17 (3), 185-204 (2021).
- Miglio, G., et al. Protective effects of peroxisome proliferator-activated receptor agonists on human podocytes: proposed mechanisms of action. Br J Pharmacol. 167 (3), 641-653 (2012).
- Miglio, G., et al. The subtypes of peroxisome proliferator-activated receptors expressed by human podocytes and their role in decreasing podocyte injury. Br J Pharmacol. 162 (1), 111-125 (2011).
- Agrawal, S., Guess, A. J., Benndorf, R., Smoyer, W. E. Comparison of direct action of thiazolidinediones and glucocorticoids on renal podocytes: protection from injury and molecular effects. Mol Pharmacol. 80 (3), 389-399 (2011).
- Sonneveld, R., et al. Sildenafil prevents podocyte injury via PPAR-γ-mediated TRPC6 inhibition. J Am Soc Nephrol. 28 (5), 1491-1505 (2017).
- Agrawal, S., et al. Pioglitazone enhances the beneficial effects of glucocorticoids in experimental nephrotic syndrome. Sci Rep. 6 (3), 24392-24404 (2016).
- Kanjanabuch, T., et al. PPAR-gamma agonist protects podocytes from injury. Kidney Int. 71 (12), 1232-1239 (2007).
- Bryant, C., et al. Selective modulator of nuclear receptor PPARγ with reduced adipogenic potential ameliorates experimental nephrotic syndrome. iScience. 25 (4), 104001 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon