Method Article
可萌方通过 PI3K/AKT 信号通路抑制膜性肾病大鼠足细胞凋亡的机制
摘要
本方案描述了膜性肾病 (MN) 动物模型的建立,以及 Kemeng Fang 的抑制如何通过激活 PI3K/AKT 信号通路来减少 MN 大鼠足细胞凋亡。
摘要
膜性肾病 (MN) 是成人肾病综合征的一种常见病理类型。高达 20% 的 MN 患者会发展为终末期肾病 (ESRD)。足细胞在维持肾小球滤过屏障方面具有重要功能,在蛋白尿和 MN 的发生和发展中起着至关重要的作用。PI3K/AKT 信号通路参与足细胞生长、分化和凋亡的整个过程。可蒙方 (KMF) 是一种中药配方,已被用于延缓肾损伤。然而,KMF 在 MN 中的治疗机制尚不清楚。在这里,通过腋静脉、腹股沟静脉和尾静脉注射阳离子牛血清白蛋白 (C-BSA) 建立 MN 大鼠模型,然后给予 KMF 和 PI3K 抑制剂 (LY294002)。大鼠肝功能、肾功能、血脂、肾脏病理、足细胞功能、PI3K/AKT 信号通路表达水平和转录组学数据表明,KMF 通过激活 PI3K/AKT 信号通路对 MN 大鼠足细胞具有保护作用,可有效阻止 MN 的进展。
引言
膜性肾病 (MN) 是成人肾病综合征的一种常见病理类型,年发病率约为每 100,000 人 5-10 人。它主要发生在 30 至 50 岁之间,在儿童中很少见(约 5%)。它在男性中的发病率明显高于女性 (2:1)。此外,高达 20% 的 MN 患者会发展为终末期肾病 (ESRD)。此外,MN 患者每年发展为 ESRD 的趋势呈增加趋势 1,2,3。MN 的病理特征是颗粒免疫球蛋白 G (IgG) 和补体系统膜攻击复合物 (MAC) 大量沉积在与足细胞相邻的肾小球基底膜 (GBM) 中。这种沉积导致 GBM 增厚和肾小球滤过屏障完整性破坏,最终导致蛋白尿4。
支持疗法、免疫抑制剂和靶向单克隆抗体是治疗 MN 的主要方法。尽管这些干预措施可以显着减少蛋白尿并延缓肾脏恶化的进展,但它们也有许多缺点。首先,支持疗法仅适用于低风险患者5。其次,免疫抑制剂可引起不良反应,如股骨头坏死、继发感染、骨髓造血功能抑制等 6。第三,需要广泛的随机对照试验研究,为使用单克隆抗体(如奥法珠单抗、奥妥珠单抗、达雷妥珠单抗和伊沙妥昔单抗)提供循证医学 7,8,9。因此,积极寻求有效的 MN 治疗方法对于延缓 ESRD 的发作和提高 MN 患者的生活质量具有重要意义。
足细胞,也称为肾小球内脏上皮细胞,附着在 GBM 的外侧,GBM 毛细血管内皮共同形成肾小球血液过滤屏障。它们具有重要功能,例如维持肾小球蛋白滤过屏障、合成正常的基底膜以及为肾小球毛细血管丛提供结构支撑10,11。研究表明,足细胞凋亡在蛋白尿和 MN 的发生和发展中起着至关重要的作用,PI3K/AKT 信号通路参与足细胞生长、分化和凋亡的整个过程 12,13,14。
越来越多的研究表明,中医在治疗 MN 方面具有显着优势,可以显着降低血肌酐、蛋白尿和迟发性肾损伤15,16。KMF 是一种传统中药化合物,其成分来自 13 种植物:党参 (Franch.)南夫。(Dangshen, DS);黄芪 (Fisch.)邦吉。(黄琦,总部);黄连弗兰奇。(黄连,HL);紫苏 frutescens (L.) Britt.(苏耶,SY);地黄 (Gaertn.)DC. (Shudihuang, SDH);川芎园艺 (Chuanxiong, CX);Euryale ferox萨利斯布。(Qianshi, QS);日本栗格言。(秦风腾,QFT);中华大黄米尔。(乌北子,WBZ);半边莲洛尔。(班比安利亚语,BBL);Oldenlandia diffusa (Willd.)罗克斯布。(百花舍舍草,BHSSC;表 1)。KFM 具有补肾(增强肾功能)、益气(增强免疫力)、利尿、疏络(促进血液循环)等许多功能。然而,KMF 在 MN 中的治疗机制尚不清楚17,18。
目前构建MN模型的方法有很多,包括Heymann肾炎模型、C-BSA肾炎模型、α3NC1小鼠模型,其中Heymann肾炎模型,主要致病抗原巨蛋白在人MN中未发现,因此与人MN的发病机制不同,α3NC1小鼠模型,只有DBA/1遗传背景的小鼠模型成功率更高, 其余小鼠在建模方面不太成功,甚至无法建模 19,20,21。C-BSA 肾炎模型具有成本效益且易于作,其发病机制与人类 MN 动物模型高度相似19。基本原理是,由于 GBM 带负电,而 C-BSA 带正电,它很容易穿过 GBM 成为种植抗原,诱导循环抗体在那里积累,形成原位免疫复合物,从而构建 MN 模型22,23。本研究旨在通过转录组学和分子生物学相结合的方式观察 KMF 对 MN 的治疗效果及其分子机制,为 KMF 治疗 MN 提供可靠的科学依据。
研究方案
本研究由湖北省疾病预防控制中心实验动物管理和使用委员会(ID 号:202220144)审查批准。大鼠在 23 ± 1 °C 和 50%-60% 大气湿度的非致病性条件下进行 12 h 光照/黑暗循环。我们从湖北省疾病预防控制中心(许可证号:SYXK [E] 2022-0065)采购了 100 只雄性 8 周龄 Sprague-Dawley 大鼠,它们在特定无病原体等级环境中进行适应性饲喂 1 周,正常维护饲料和饮用无菌水。
1. 药物制备
- KMF 的准备
- 所用中药由长春中医药大学附属医院提供,具体成分和剂量见 表1。准备时,总共使用147克生药-党参 (20 克)、黄 芪(30 克)、 黄连 (3 克)、紫 苏 (6 克)、 熟 地黄(15 克)、 川芎 (15 克)、 芜 蓿(15 克)、 樣 木(10 克)、黄 桦 (3 克)、 半边莲 (15 克)、 香桔 (15 克)。混合并浸泡在 1470 mL 蒸馏水中 30 分钟。
- 将草药混合物放入陶瓷锅中,在 100 °C 下加热 90 分钟煎煮。通过两层医用纱布过滤并在室温下储存。
- 在剩余的草药混合物中再次加入蒸馏水 (1470 mL),然后再次重复上述煎煮作,如步骤 1.1.2 所述。将滤液储存在室温下。
- 混合上述两种滤液,并在 80 °C 下烘箱干燥 10 小时,直到水溶液完全蒸发,只有溶质以粉末形式保留。
- 称取粉末并溶于盐水中,制成每 4 mL 含 1.323 g、2.646 g 和 5.292 g 药物的溶液(浓度分别为 0.331 g/mL、0.662 g/mL 和 1.323 g/mL),即给予大鼠的药物的每日剂量。
- 盐酸苯那君的制备
- 将盐酸苯那君片剂 (90 g) 加入 100 mL 生理盐水中,摇匀以完全溶解。
- PI3K 抑制剂LY294002的制备
- 将 82.3 mg LY294002 粉末加入 1.1 mL DMSO 中,摇匀使其完全溶解。接下来,加入 198.9 mL 生理盐水稀释,得到 0.41 mg/mL 的浓度。
- C-BSA 乳化剂的制备
- 将 67 mL 无水乙二胺加入 500 mL 双蒸水中并混合。缓慢加入 350 mL 6 M 盐酸,并将 pH 值调节至 4.75。将最终溶液的温度保持在 25 °C。
- 将 5 g 天然牛血清白蛋白溶于 25 mL 双蒸水中,并在不断搅拌下将溶液保持在 25 °C 的恒定温度下。2 小时后加入 1.8 g 碳二亚胺盐酸盐和 30 mL pH 值为 4.75 的 4 M 乙酸缓冲液,得到 C-BSA 溶液。
- 使用亚硒酸盐纸将所得溶液在 4 °C 的双蒸水中透析 72 小时(每 3-5 小时换水一次)并冷冻干燥以获得 C-BSA 冻干粉,在 -80 °C 下储存24。
- 在 50 mL 生理盐水中加入 100 mg C-BSA 干粉,形成 C-BSA 溶液。将其与等体积的不完全弗氏佐剂混合以完全乳化;其浓度为 1 mg/mL。
- C-BSA 溶液的制备
- 在 100 mL PBS 中加入 640 mg C-BSA 干粉,并充分摇匀以使其完全溶解;其浓度为 6.4 mg/mL。
2. MN动物模型的建立
注:实验分为正常对照组(CON)、模型组(MOD)、盐酸贝那普利组(BEN)、KMF低剂量组(KM-L)、KMF中剂量组(KM-M)、KMF高剂量组(KM-H)、PI3K抑制剂组(PI3K)和PI3K抑制剂+KMF中剂量组(PI3K+KM-M)。除正常对照组外,所有组均给予 C-BSA 以产生 MN 模型。
- 在第九周进行免疫前:在腋窝和腹股沟多次皮下注射 C-BSA 乳化剂。
注意:颈部的 scuff(肩胛间)是作为皮下施用 C-BSA 乳化剂的替代部位。- 用左手抓住大鼠的背部皮肤,将腹部向上转动,收紧腹部皮肤。使用 2.5 mL 注射器以 1 mL/400 g 的剂量将 C-BSA 乳化剂皮下注射到大鼠的腋窝和腹股沟中,每隔一天一次,持续 1 周。
- 正式免疫:尾静脉注射 C-BSA 溶液
- 在第十周,将大鼠从笼子中取出,将它们放在金属丝杆盖上,尾巴面向实验者。
- 用酒精棉球擦拭鼠尾巴,用左手的拇指和食指捏住鼠尾巴的两侧,使静脉充满,保持静脉朝上。
- 用右手握住 1 mL 注射器,使针头与尾静脉成 30° 角。轻轻刺入皮肤后,立即保持针尖向上倾斜,针头与血管平行。如果针头有任何回流,请将其与 2.5 mL/kg 剂量的 C-BSA 剂量一起注射,每周 3 次,持续 4 周。
- 注射完成后,用干燥的棉球按压注射点约 1 分钟以止血。从固定器中取出小鼠并返回笼子。
3. KMF 分析
- 称取 1 g 样品放入 2 mL 离心管中,加入 600 μL 甲醇(储存在 -20 °C 下,含有 2-氨基-3-(2-氯-苯基)-丙酸 (4 ppm)),并将混合物涡旋 30 秒。
- 加入大约 100 毫克玻璃珠,并将混合物放入组织研磨机中以 60 Hz 放置 90 秒。
- 在室温下以 40 kHz 进行超声 15 分钟。
- 在 15,984 x g 、4 °C 下离心 10 分钟,并通过 0.22 μm 膜过滤上清液。转移检测瓶进行 LC-MS 检测。
4. 药物治疗
注意:成年人每天需要 147 克 KMF。根据实验大鼠与人药物剂量的换算公式,大鼠的等效实验剂量(g/kg)=人剂量(g)/体重(70 kg)×6.3,大鼠的日剂量约为13.23 g/kg。
- 第 14 周时,用左手抓住大鼠背部的皮肤,将腹部向上转动,收紧腹部皮肤。用右手握住 10 mL 注射器的针头,从一侧插入口中,沿着上颚和咽后壁滑动,然后用吞咽动作进一步滑到胃部。
- 用右手食指缓慢给药,给药完成后将胃针拉出。给药药物的剂量为 10 mL/kg,总持续时间为 4 周。
- 对于 CON 和 MOD 组,通过管饲法施用 10 mL/kg/天盐水。
- 对于 BEN 组,通过管饲法施用 9 mg/kg/天的盐酸苯那君水溶液。
- 对于 KM-L 组,通过管饲法施用 3.3075 g/kg/天的 KMF 水提取物。对于 KM-M 组,通过管饲法施用 6.615 g/kg/天的 KMF 水提取物。对于 KM-H 组,通过管饲法施用 13.23 g/kg/天的 KMF 水提取物。
- 对于 PI3K 组,通过管饲法LY294002施用 2.1 mg/kg/天。
- 对于 PI3K+KM-M 组,通过管饲法施用 2.1 mg/kg/天LY294002 (5 mL/kg) + 6.615 g/kg/天 KMF 水提取物 (5 mL/kg)。
5. KMF 疗效评价
- 血液和尿液生化指标的检测
- 从第 14 周开始,实验开始后每 2 周收集一次尿液。将一只大鼠置于代谢笼中 24 小时。限制饮食并提供免费饮用水。使用放置在代谢笼下方的 50 mL 离心管收集尿液。
- 将尿液以 15,984 x g 离心 10 分钟,并根据尿蛋白检测试剂盒的说明使用上清液估计尿蛋白水平。
- 在第 18 周,通过吸入 5% 异氟醚对大鼠实施安乐死。在眼睛上使用兽医软膏以防止干燥。使用颈椎脱位法确认死亡。用左手抓住大鼠背部的皮肤,用剪刀修剪大鼠的胡须。
- 用乙醇对眼球周围的皮肤进行消毒,并使用止血钳快速取出眼球。收集滴入离心管中的血液,在室温下放置 30 分钟后,以 15,984 x g 的速度离心 10 分钟。收集上清液。
- 使用自动生化分析仪检测丙氨酸转氨酶 (ALT)、天冬氨酸转氨酶 (AST)、白蛋白 (ALB)、甘油三酯 (TG)、总胆固醇 (TC)、血尿素氮 (BUN)、血清肌酐 (Scr)、总蛋白 (TP) 和其他血液指标。
- 肾组织分离
- 从大鼠身上取血后,将其固定在手术板上,慢慢切开腹部中线的皮毛和肌肉层,推开肠管,露出腹主动脉和肾脏25。
- 使用手术动脉夹阻断右肾上方的腹主动脉。将头皮针头连接到 5 mL 注射器上,刺穿阻滞块下方,并灌注 PBS 缓冲液以冲洗肾脏,直到两个肾脏都变成白色或苍白。
- 切除肾脏并钝分离骨膜。将右肾分成冷冻储存管中,并储存在 -80 °C 的冰箱中。 将左肾固定在 4% 多聚甲醛溶液中。
- 固定 24 小时后,取出肾脏。执行脱水、透明度和石蜡包埋。蜡块凝固后,用组织切片机以 3 μm 的厚度切片,用防裂玻片捞出,将切片在 98 °C 下烘烤 20 分钟,并储存备用26 分钟。
- 肾脏组织病理学分析
- 将切片进行梯度二甲苯脱蜡和无水乙醇脱水,并使用蒸馏水冲洗。二甲苯 15 分钟,然后新鲜二甲苯溶液 15 分钟。改用无水乙醇 5 分钟,换成新鲜的无水乙醇 5 分钟,然后用 90% 乙醇 5 分钟,然后用 80% 乙醇 5 分钟,然后用 70% 乙醇 5 分钟,最后用蒸馏水冲洗。
- 按照苏木精-伊红染色 (H&E)、高碘酸-希夫 (PAS) 和 Masson 染色试剂盒的说明进行样品染色。
- 进行梯度无水乙醇脱水,再次进行二甲苯澄清。
- 将切片放入恒温培养箱中,将温度设置为 90 °C,烘烤 20 分钟。烘烤后,取出切片,滴加中性胶。用盖玻片盖住它们。
- 在放大 200 倍的光学显微镜下观察并收集图像。
- 肾组织的免疫荧光 (IF) 分析
- 如步骤 5.3.1 中所述对切片脱蜡并脱水。将样品置于 0.01 M EDTA 缓冲溶液中,进行高压、高温(125 °C ,103 KPa)固定 15 分钟。让样品自然冷却,并在 PBS 中洗涤 3 次,每次 3 分钟。
- 将切片置于 3% 过氧化氢溶液中并孵育 10 分钟。在 PBS 中洗涤样品 3 次,每次 5 分钟。然后,将切片置于 10% 山羊血清中,孵育 30 分钟,并在 PBS 中洗涤 3 次,每次 3 分钟。
- 逐滴加入一抗 IgG (1:100) 和 C3 (1:100),并在湿箱中于 4 °C 孵育过夜。一抗稀释比如 表 2 所示。从冰箱中取出切片,用 TBST 洗涤 3 次,每次 3 分钟。
- 逐滴加入荧光二抗 (1:100),在 37 °C 下孵育 1 小时,然后用 TBST 洗涤 3 次,每次 3 分钟。
注意:此步骤和所有后续步骤应在黑暗中进行27,28. - 在室温下与 4',6-二脒基-2-苯基吲哚 (DAPI) 孵育 5 分钟,避光,用含吐温 20 (TBST) 的 tris 缓冲盐水洗涤 3 次,每次 5 分钟以去除多余的 DAPI。
- 将自发荧光淬灭剂成一个圆圈,孵育 5 分钟,然后用流水冲洗 10 分钟。摇干切片并用抗荧光淬灭密封剂密封。在 200 倍荧光显微镜下观察并收集图像。
- 肾组织的免疫组织化学 (IHC) 分析
- 如步骤 5.3.1 中所述对切片脱蜡并脱水。在高压 (125 °C · 103KPa) 的 0.01M EDTA 缓冲溶液中修复 15 分钟。自然冷却后,用 PBS 洗涤 3 次,每次 3 分钟。
- 如步骤 5.4.2 中所述的封闭内源性过氧化物酶和血清密封作方法。
- 逐滴加入一抗 WT-1 (1:200) 和 Nephrin (1:100),并在 4 °C 冰箱中的湿箱中孵育过夜29。
- 从 4 °C 冰箱中取出切片,用 PBS 洗涤 3 次,每次 5 分钟。滴加二抗 (1:200),在 37 °C 下孵育 30 分钟,然后用 PBS 洗涤 3 次,每次 3 分钟。
- 加入几滴新鲜制备的二氨基联苯胺 (DAB) 显色溶液,并在光学显微镜下以 200 倍观察。阳性信号为棕黄色或棕棕色。当观察到切片颜色变化时,立即用自来水清洗染色液。
- 使用苏木精重新染色 3 分钟,然后加入 1% 盐酸醇进行区分,并用自来水冲洗 10 分钟。
- 如步骤 5.2.4 中所述,对切片进行脱水、透明和密封。在 200 倍光学显微镜下观察并收集图像。
- 末端脱氧核苷酸转移酶介导的肾组织缺口末端标记 (TUNEL) 染色分析
- 使用步骤 5.3.1 对切片进行脱蜡和脱水。使用免疫组织化学笔在组织周围画圆圈,并向每个样品中滴加 100 μL 蛋白酶 K 工作溶液。在 37 °C 下孵育 20 分钟,用 PBS 洗涤 3 次,每次 5 分钟,并将处理过的样品储存在湿盒中。
- 将切片置于 3% 过氧化氢溶液中,孵育 10 分钟,然后用 PBS 洗涤 3 次,每次 5 分钟。
- 向圆圈中滴加平衡缓冲液 (100 μL) 以覆盖组织并在室温下孵育 20 分钟。
- 向每个样品中滴加 50 μL 标记工作溶液(平衡溶液:荧光标记溶液:TDT 酶 = 35 μL:10 μL:5 μL),在 37 °C 湿箱中孵育 60 分钟,避光,并用 PBS 洗涤 3 次,每次 5 分钟。
- 加入 DAPI 并与 DAPI 在室温下光照孵育 5 分钟,用 PBS 洗涤 3 次,每次 5 分钟。
- 将切片摇干并用抗荧光淬灭封闭剂密封后,在 200 倍荧光显微镜下观察并收集图像。
- 肾组织电子显微镜分析的样品制备
- 用 2.5% 戊二醛在 4 °C 下固定肾组织 2-4 小时,并在 PBS 中洗涤 3 次,每次 15 分钟。
- 在室温下避光在锇酸 (1%) 中固定 2 小时,并用 PBS 洗涤 3 次,每次 15 分钟。
- 使用丙酮和包埋剂分别以 1:1、1:2 和 1:31 梯度浸入 2 小时、4 小时和 8 小时,进行梯度酒精和丙酮脱水。在此之后,使用纯包埋剂并将样品在 37 °C 下包埋过夜。
- 8 小时后,将包埋板置于 60 °C 烘箱中聚合 48 小时。在超薄切片机中将上面加工的树脂块切片,切片厚度设置为 60-80 nm;使用铜网去除切片。
- 使用 2% 过氧化氢乙酸氢和酒精溶液染色 8 分钟,然后用 70% 乙醇和超纯水洗涤 3 次。用 2.6% 乙醇和超纯水洗涤完成。
- 在透射电子显微镜下观察和获取图像。
- 定量实时聚合酶链反应 (qRT-PCR) 分析分析
- 将 20 mg 冷冻肾组织加入微量离心管中,并用高速组织研磨机彻底研磨,直到没有可见的组织块。
- 以 15,984 x g 离心 10 分钟后收集上清液。加入 250 μL 氯仿,倒置试管 15 秒;将溶液充分混合。在室温下静置 3 分钟,然后在 4 °C 下以 15,984 x g 离心 10 分钟。
- 收集上层水相并转移到新的无 RNase 离心管中。加入等体积的 70% 乙醇(不含 RNase 的水制剂),倒置并混合。
- 将溶液添加到加载到收集管中的吸附柱中,用于 RNA 洗涤。缓冲液 RW 洗涤后,将色谱柱在室温下放置 5 分钟以干燥。
- 将色谱柱放入新的无 RNase 离心管中,向色谱柱中间加入 30-50 μL 不含 RNase 的水,在室温下放置 1 分钟,然后以 15,984 x g 离心 1 分钟。收集 RNA 溶液并将其储存在 -80 °C。
- 从冰箱中取出 RNA 溶液,在 90 °C 下预变性 10 分钟,然后进行 40 次循环,即 95 °C 15 秒、60 °C 35 秒和 72 °C 25 秒,最后以 95 °C 15 秒、60 °C 60 秒、95 °C 15 秒的顺序裂解(补充表 1)。
- 使用 β-肌动蛋白作为内部参比,根据每个样品的 Ct 值(ΔΔCt = 靶基因的 Ct 值 - 内部参基因的 Ct 值),使用 2¬-ΔΔCt 方法计算 WT-1 和 Nephrin 的相对表达30。有关引物的详细信息如 表 3 所示。
- 蛋白质印迹 (WB) 分析
- 根据蛋白酶抑制剂:磷酸酶抑制剂:RIPA= 1:1:100 的比例制备裂解物,并将 500 μL 裂解物加入微量离心管中。
- 将 100 mg 冷冻肾组织加入微量离心管中,并用高速组织研磨机彻底研磨,直到没有可见的组织块。
- 取出微量离心管,在冰上裂解 30 分钟,然后以 15,984 x g 离心 10 分钟。吸出上清液并将其储存在 -80 °C。
- 根据二辛可宁酸 (BCA) 蛋白浓度测定试剂盒的说明检测蛋白质浓度,并逐滴加入 PBS 溶液以确保每组中的蛋白质浓度一致。
- 向微量离心管中加入 5x 蛋白质上采样缓冲液,在 100 °C 下孵育 15 分钟使其完全变性,冷却后取出。
- 通过 12.5% SDS-PAGE 凝胶电泳分离蛋白质,首先使用 80 V,使所有样品压成一条平坦的蓝色线,然后将电压调节到 130 V,直到溴酚蓝从凝胶板底部流出。停止电泳。
- 去除凝胶。用膜转移缓冲液润湿滤纸。在甲醇中活化聚偏二氟乙烯 (PVDF) 膜 30 秒。然后,按以下顺序排列所有内容:海绵网/滤纸/凝胶/PVDF 膜/滤纸/滤纸/海绵网在用于转移膜的夹子中。
- 将凝胶置于负极,将 PVDF 膜置于正极,然后以 200 MA 的电流转移膜 90 分钟。
- 去除 PVDF 膜并用 TBST 洗涤一次 5 分钟。在室温下加入封闭溶液,同时摇动 90 分钟。用 TBST 洗涤 3 次,每次 5 分钟。
- 添加一抗 PI3K (1:1000)、PIK3CA (1:1000)、AKT (1:1000)、P-AKT (1:1000)、BAD (1:1000)、P-BAD (1:1000)、BCL-2 (1:1000)、bax (1:4000) 和 c-caspase3 (1:1000),并在湿箱中于 4 °C 在冰箱31,32 中孵育过夜。
- 从 4 °C 冰箱中取出 PVDF 膜,用 TBST 洗涤 3 次,每次 5 分钟。滴加二抗 (1:10,000),在 37 °C 下孵育 90 分钟,然后用 TBST 洗涤 3 次,每次 3 分钟。
- 根据比例 (A: B=1:1) 制备显影液,并按照说明在机器上显影。
结果
KMF 组件的分析结果
在通过 LC-MS/MS 分析的正离子和负离子模式下,分别鉴定出 147 种和 120 种化合物(图 1A-B)。一些化合物及其 MF 计算的分子量、m/z 值、保留时间和母离子如补充表 2 所示。
KMF 改善 MN 大鼠脂质代谢紊乱及肝肾损伤
使用 SD 大鼠和 C-BSA,我们建立了一个 MN 模型。尾静脉注射 C-BSA 1 周后,MN 大鼠出现不同程度的精神疲劳、食欲下降、生长缓慢、毛色暗淡、皮毛蓬松、反应迟缓、体重减轻,部分大鼠出现阴囊水肿。给药 4 周后,不同剂量的 KMF 显着降低 24 h 尿总蛋白 (24 h-UTP) 、 Scr 和 BUN 的表达水平,增强肾功能(图 2A-C);ALT 和 AST 表达水平降低,TP 和 ALB 表达水平升高,增强肝功能(图 2D-G);降低 TC 和 TG 的表达水平,改善脂质调节功能 (图 2H-I)。这些结果表明 KMF 对肾功能具有保护作用;然而,其具体作用机制尚不清楚。
KMF 改善 MN 大鼠肾组织的组织病理学损伤
为了测试 KMF 是否能改善 MN 大鼠的肾损伤,使用 H&E 、 PAS 、 Masson 和 IF 检测肾组织的组织病理学损伤。H&E 和 PAS 染色显示 MOD 组肾小球肥大、系膜细胞轻度增殖、肾小管扩张和肾小管上皮细胞空泡变性(图 3A)。Masson 染色显示 MOD 组肾纤维化面积显着增加(图 3B-C)。免疫荧光显示,MOD 组 IgG 和 C3 的相对荧光强度显著高于 CON 组(图 3D-F)。给予 KMF 、 BEN 或 PI3K 抑制剂 + KM-M 后,肾小球肥大程度以及栓系细胞增殖程度降低,肾纤维化面积明显减少,IgG 和 C3 的相对荧光强度显著降低。这些结果表明,KMF 可以减轻 MN 大鼠的肾脏病理损伤。
KMF 通过激活 PI3K/AKT 信号通路减轻足细胞损伤
使用此处描述的方法,即 IHC、PCR、TUNEL 和 TEM,也观察到 MN 中关键足细胞的损伤。IHC 和 PCR 结果显示,与 CON 组相比,MOD 组足细胞特异性和功能标志蛋白 WT-1 和 Nephrin的表达水平显著降低,提示足细胞损伤,而 KMF 处理增加 WT-1、Nephrin 的表达水平并减轻足细胞损伤(图 4A-E).TUNEL 染色结果显示 MOD 组足细胞严重凋亡,而 KMF 处理显着降低荧光强度并降低细胞凋亡发生率(图 4F-G)。TEM 结果显示,MOD 组肾小球基底膜增厚明显不均匀,足细胞线粒体表现严重肿胀、基质稀疏、基质空轰击,嵴减少或缺失。施用 KMF 后,肾小球基底膜增厚明显减少,足细胞线粒体形态明显恢复(图 4H)。这些结果表明,KMF 可以减轻 MN 大鼠的足细胞损伤。
WB 进一步检测 PI3K/AKT 信号通路相关蛋白26,27 的表达结果显示,与 CON 组相比,MOD 组 PI3K、PIK3CA、AKT、P-AKT、BAD、BAX 和 C-caspase3 的表达水平显著升高,而 P-BAD 和 BCL-2 的表达水平显著降低。虽然 KMF 处理降低了 PI3K、PIK3CA、AKT、P-AKT、BAD、BAX 和 C-caspase3 的表达水平,但它增加了 P-BAD 和 BCL-2 的表达水平(图 4I-J)。这些结果进一步表明,KMF 可以通过激活 PI3K/AKT 信号通路来改善 MN 大鼠的足细胞损伤。
基于转录组学探讨 KMF 治疗 MN 的可能机制
为了进一步揭示 KMF 治疗 MN 的靶点和潜在机制,基于串联质量标签 (TMT) 进行了转录组学分析。结果显示,CON 组和 MOD 组之间有 898 个差异表达基因 (DEGs),其中 372 个上调基因和 526 个下调基因 (图 5A-B)。同样,KM-L 和 MOD 组之间有 360 个 DEGs,包括 202 个上调和 158 个下调基因(图 5C-D)。为了确定可能受影响的基因和信号通路,进行了基因本体论 (GO) 和京都基因与基因组百科全书 (KEGG) 富集功能分析(图 5E-H)。结果表明,DEG 的生物过程主要集中在细胞过程和生物调控上,而 DEG 的功能主要集中在神经活性配体-受体相互作用上,如 CAMP、PPAR、PI3K-AKT 和 p53 信号通路。这些结果表明,KMF 可能通过影响这些信号通路来治疗 MN,PI3K/AKT 信号通路已在实验中得到验证。最后,按度值顺序选择前 100 个 DEGs 来构建蛋白质-蛋白质相互作用 (PPI) 网络(图 5I-J)。
图 1:LC-MS/MS 峰离子色谱图。 (A) 正离子模式。(B) 负离子模式。 请单击此处查看此图的较大版本。
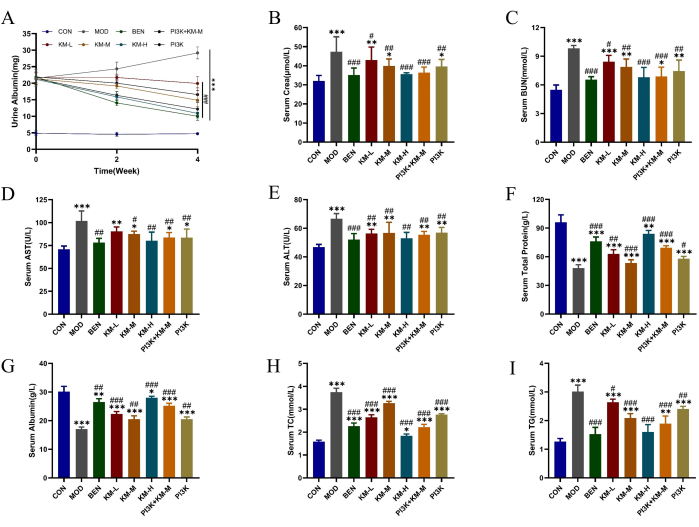
图 2:KMF 改善 MN 大鼠脂质代谢紊乱和肝肾损伤。(A-C) 可蒙方对肾功能的影响,包括 24 h 尿白蛋白、血清 Cera 和血清 BUN。(D-G)可蒙方对肝功能的影响包括丙氨酸氨基转移酶 (ALT)、天冬氨酸转氨酶 (AST)、总蛋白和血清白蛋白。(H-I)可孟方对血脂代谢调节的影响,包括甘油三酯 (TG) 和总胆固醇 (TC)。数据表示为 3-6 个独立样本的标准差均值±,使用 T 检验中的单向方差分析,与空白组 *p<0.05、**p<0.01、***p<0.001 进行比较,并与模型组相比,#p < 0.05,##p < 0.01,###p < 0.001。请单击此处查看此图的较大版本。
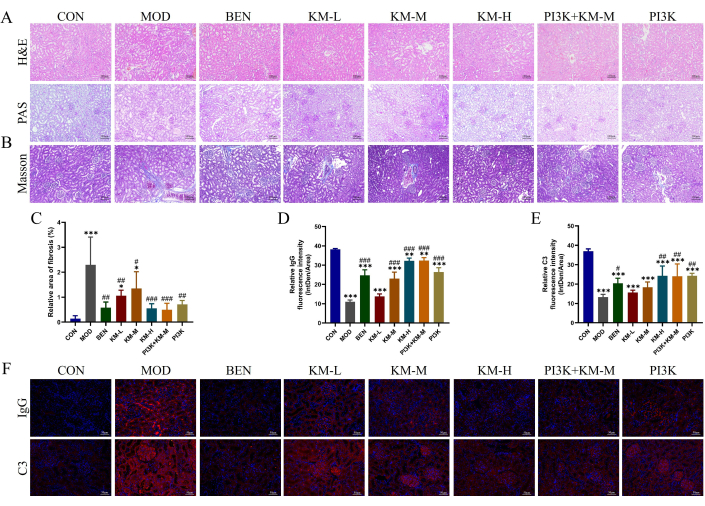
图 3:Kemeng Fang 改善了 MN 大鼠肾脏的组织病理学损伤。 (A) 肾脏组织学检查,包括 H&E 和 PAS (200x)。(B-C)使用 Masson 染色和 Image J 软件对肾纤维化(蓝色胶原纤维)相对面积进行半定量分析。(D-F)使用 IF 和 Image J 软件对肾组织中 IgG 和 C3 的相对荧光强度(Intden/Area ;其中 Intden 是总区域荧光强度,面积是区域面积)进行半定量分析。请单击此处查看此图的较大版本。
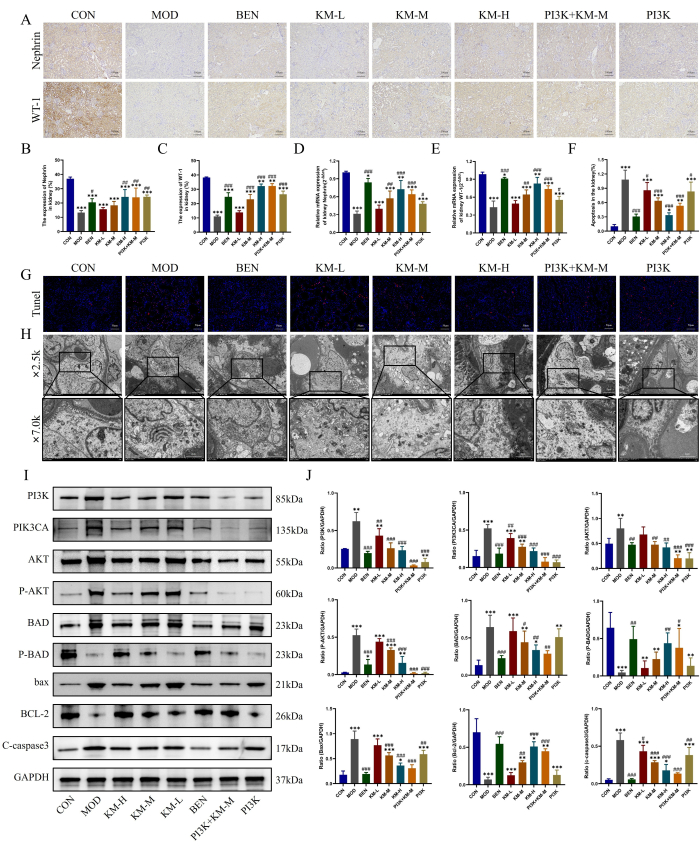
图 4:Kemeng Fang 通过激活 PI3K/AKT 信号通路减轻足细胞损伤。(A-C) IHC 用于检测肾组织中两种足细胞标志蛋白 WT-1 和 Nephrin 的相对表达水平。(D-E)PCR 检测肾组织中两种足细胞标志蛋白 WT-1 和肾素的相对 mRNA 表达。(F-G)采用 TUNEL 染色检测肾组织细胞凋亡的发生率。(H) 使用 TEM 观察肾小球基底膜和足细胞线粒体结构 (2,500x,bar=5 μM;7,000x,bar=2 μM)。(I-J)WB 检测肾组织中 PI3K、PIK3CA、AKT、P-AKT、BAD、P-BAD、BCL-2、bax 和 C-caspase3 的相对蛋白表达水平。请单击此处查看此图的较大版本。
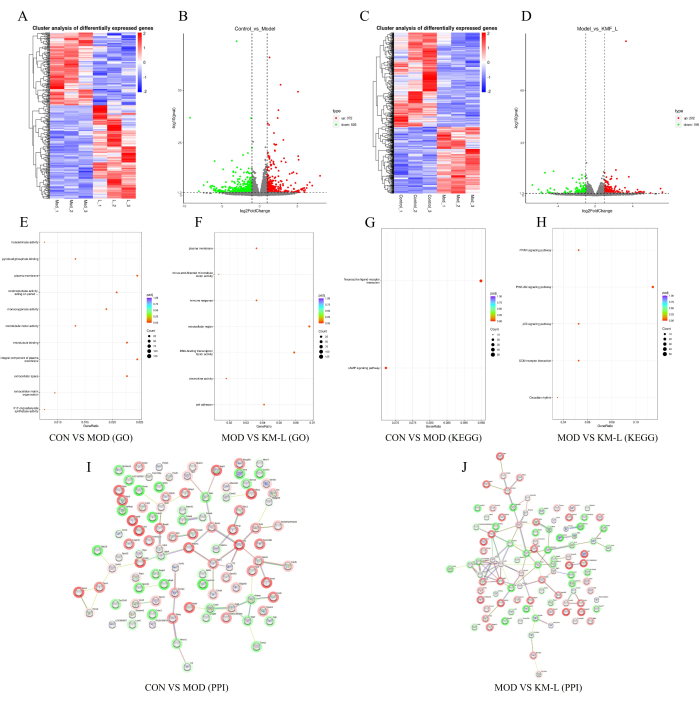
图 5:基于转录组学探索 Kemeng Fang 治疗 MN 的可能机制。(AB) CON 和 MOD 组之间的差异基因热图和火山图,蓝色代表下调,红色代表上调。(C-D)MOD 和 KM-L 组之间的差异基因热图和火山图,蓝色代表下调,红色代表上调。(E) CON 和 MOD 组之间的 GO 富集。(F) MOD 和 KM-L 组之间的 GO 富集。(G) CON 和 MOD 组之间的 KEGG 富集。(H) MOD 和 KM-L 组之间的 KEGG 富集。(I) CON 和 MOD 组之间前 100 个差异表达基因的蛋白质-蛋白质相互作用 (PPI) 图表。(J) MOD 和 KM-L 组之间前 100 度值的 PPI 图表。请单击此处查看此图的较大版本。
| 不。 | 中文名称 | 拉丁名 | 家庭 | 使用的零件 | 剂量(g) |
| 1 | 唐申 (DS) | 党 参 (Franch.)南夫。 | 桔梗科 | 根 | 20 |
| 2 | 黄琦 (总部) | 黄芪 (Fisch.)邦吉。 | 豆科 | 根 | 30 |
| 3 | 黄连 (HL) | 黄连 弗兰奇。 | 毛茛科 | 根和块茎 | 3 |
| 4 | 苏叶 (SY) | 紫苏 (L.) Britt | 唇形科 | 叶 | 6 |
| 5 | 书地黄 (SDH) | 地黄 (Gaertn.)直流。 | 玄参科 | 根和块茎 | 15 |
| 6 | 川雄 (CX) | 川芎园 (Ligusticum chuanxiong Hort.) | 伞形科 | 根和块茎 | 15 |
| 7 | 千石 (QS) | Euryale ferox 萨利斯布。 | 睡莲科 | 种子 | 15 |
| 8 | 秦风腾 (QFT) | 日本栗 格言。 | Sabiaceae | 根、块茎和叶 | 10 |
| 9 | 乌北子 (WBZ) | 中华大黄 磨。 | 漆树科 | 叶 | 3 |
| 10 | 班边利亚语 (BBL) | 半边莲 洛尔。 | 桔梗科 | 块茎和叶子 | 15 |
| 11 | 百花舍舍草 (BHSSC) | Oldenlandia diffusa (Willd.)罗克斯布。 | 茜草科 | 块茎和叶子 | 15 |
表 1:可盟方 (KMF) 的组成。
| 抗体 | 稀释倍数 |
| IgG 抗体 | 1:100 |
| C3 系列 | 1:100 |
| WT-1 系列 | 1:200 |
| 肾素 | 1:100 |
| PI3K | 1:1000 |
| PI3K3CA | 1:1000 |
| AKT | 1:1000 |
| P-AKT | 1:1000 |
| 坏 | 1:1000 |
| P 坏 | 1:1000 |
| BCL-2 型 | 1:1000 |
| 巴克斯 | 1:4000 |
| c-半胱天冬酶3 | 1:1000 |
| GAPDH | 1:1000 |
表 2:抗体稀释倍数。
| 基因 | 底漆 | 序列 (5'-3') | PCR 产品 | |
| 大鼠 GAPDH | 向前 | ACAGCAACAGGGTGGTGGAC | 253 基点 | |
| 反向 | TTTGAGGGTGCAGCGAACTT | |||
| 大鼠 WT-1 | 向前 | AATGGACAGAAGGGCAGAGCA | 209 基点 | |
| 反向 | TGGGTACGCACACATGAAAGG | |||
| 大鼠肾素 | 向前 | CGGAGAACAAGAACGTGACC | 177 基点 | |
| 反向 | ATTGTCTTCTCTCCGCACCA | |||
表 3:qRT-PCR 引物的详细信息。
补充表 1:PCR 反应。请点击此处下载此文件。
补充表 2:代谢物鉴定的定量列表。 ID:一级分子量序列号;名称:鉴定结果;Mz: 质核比;Rt: 保留时间 (S);精确质量:准确的分子量;ppm:检测到的分子量与理论分子量之间的误差,以 ppm 为单位;precursor_type:电离模式,[M+H]+为正离子模式,[M-H]-为负离子模式;class: HMDB 数据库中的三重分类;sub_class:HMDB 数据库中的四级分类;KEGG: KEGG 化合物数;KEGG_Pathway: KEGG 信号通路;CAS:化学文摘社注册号;HMDB:HMDB 数据库编号;库: 数据库;分子式:理论分子式;KEGG: KEGG 化合物数;库: 数据库;水平: 代谢物鉴定水平;pos: 正离子模式;neg: 负离子模式;KMF_1/2/3: 三个实验的总离子强度。 请点击此处下载此文件。
讨论
本研究旨在观察 KMF 的药理作用,并探讨其抑制 MN 大鼠足细胞凋亡的特异性机制。首先,它在 体内 证明 KMF 可以通过激活 PI3K/AKT 信号通路来缓解足细胞凋亡并延缓 MN 进展。其次,转录组学结果表明,KMF 可能通过 PPAR、PI3K/AKT 和 p53 信号通路、ECM 受体相互作用等发挥作用。其中,PI3K/AKT 信号通路已在实验中得到验证。这些发现可能为临床使用 KMF 作为 MN 患者的潜在治疗选择提供科学依据。
研究表明,足细胞凋亡是导致 MN 逐渐进展的关键因素之一。此外,MN 限制足细胞的分裂和增殖能力;因此,一旦受损或丢失,这种后遗症会严重影响肾功能。当足细胞数量减少到不能完全覆盖 GBM 的程度时,GBM 完全暴露并粘附在 Bowman 囊上,导致肾小球毛细血管袢受压甚至塌陷,最终促进 MN 发展为 ESRD 33,34,35,36。因此,进一步研究足细胞凋亡的具体机制以及阻断或抑制足细胞凋亡的方法是延缓 MN 进展的关键。研究表明,PI3K/AKT 信号通路在调节细胞凋亡、氧化应激和炎症反应方面具有多种功能,在 MN 的发生发展中发挥重要的调节作用。WT-1 和 Nephrin 是在足细胞上表达的孔膜蛋白,不仅在维持孔膜的正常结构和功能中起重要作用,而且还启动 PI3K/AKT 依赖性信号通路并参与足细胞信号传导。这些蛋白质表达水平的降低通常表明足细胞受损 37,38,39。
PI3K 是一种二聚体,由调节亚基 p85 和催化亚基 p110 组成,可被各种生长因子和复合物激活。它是该途径的关键和启动因素40。PIK3CA 基因位于 3 号染色体上,共有 20 个外显子。它的主要功能是编码 PI3K 酶的催化亚基之一 p110 α 蛋白;因此,PIK3CA 的变化会导致 PI3K 酶保持持续激活状态41。一旦 PI3K 被激活,第二个信使 PIP3 将产生并持续刺激下游 AKT 信号通路,而 p-AKT 促进促凋亡分子 Bad 的磷酸化,使促凋亡复合物 Bad 与 Bcl-2 和 Bcl-xL 解离,与细胞质中的 14-3-3 蛋白形成复合物,从而失去其促凋亡功能。抗凋亡分子 BCL-2 和 Bcl-xL 可以完全解离并对足细胞凋亡产生抑制作用42,43。Caspase-3 是一种蛋白酶,在细胞凋亡的执行阶段起核心作用,通过将 DNA 修复酶 PARP 裂解成小片段,最终导致细胞凋亡44。促凋亡蛋白 Bad 诱导细胞色素 c 从线粒体释放到细胞质是激活半胱天冬酶的关键步骤,P-Bad 与 14-3-3 蛋白结合的复合物抑制这一过程,从而防止凋亡级联反应的发生 45,46,47。
转录组学结果表明,KMF 治疗 MN 与 PI3K/AKT 、 PPAR 和 p53 信号通路密切相关。通过 WB 分析验证了 PI3K/AKT 信号通路。实验结果显示,MN大鼠PI3K/AKT信号通路受到显著抑制,而KMF可显著激活PI3K/AKT信号通路,减少促凋亡分子Bad和Bax的产生,促进抗凋亡分子BCL-2的产生,从而提高足细胞裂孔膜蛋白WT-1和肾素的表达水平。 和降低足细胞凋亡的发生率。因此,KMF 通过激活 PI3K/AKT 信号通路来减少足细胞凋亡,并发现对 MN 模型大鼠具有保护作用。
但是,这项研究有一些局限性。首先,本研究仅在体内动物实验水平探讨了 KMF 抑制足细胞凋亡的机制,需要通过体外细胞实验以及对其机制的深入探索来验证;其次,足细胞损伤也与自噬、免疫炎症和焦亡密切相关,需要进一步探讨 KMF 是否可以通过调节自噬、免疫炎症和焦亡来影响 MN48,49。
PPAR 家族(PPAR α、PPAR β/δ、PPAR γ)是一种依赖于配体激活的核激素受体,具有参与能量代谢、调节细胞凋亡和炎症反应等重要功能50,51。它们通过与视黄酸 X 受体 (RXR) 形成异二聚化来影响基因转录,其中 PPAR γ都调节炎症因子 NF-κB。B 激活的关键在于其保护足细胞免受损伤的功能 52,53,54。多项研究表明,PPAR γ激动剂 (TZD,如吡格列酮) 具有独立于降血糖作用的肾脏保护作用,直接保护足细胞免受损伤并减少各种肾脏疾病动物模型中的蛋白尿和肾小球损伤 55,56,57,58,59。还有报道表明,PPAR 可以通过抑制 Caspase-360 的激活来减少足细胞凋亡。最新研究表明,一种新型的 PPAR γ,即选择性调节因子 GQ-16,在减少蛋白尿和肾病综合征相关并发症方面比 TZD 更有效,这也为肾病的治疗带来了曙光61。KMF 通过激活 PI3K/AKT 信号通路对 MN 大鼠足细胞凋亡具有保护作用。基于 PPAR 信号通路在肾脏中的重要作用,未来需要进一步深入探索 KMF 、 PPAR 和 MN 之间的关系。
披露声明
所有作者都没有需要声明的利益冲突。
致谢
这项工作得到了吉林省自然科学基金 (No.YDZJ202301ZYTS145 和 No.YDZJ202301ZYTS208)。
材料
| Name | Company | Catalog Number | Comments |
| 2-Amino-3-(2-chloro-phenyl)-propionic acid | Aladdin | 103616-89-3 | |
| 30% H2O2 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10011218 | |
| 812 embedding agent | SPI | 90529-77-4 | |
| Acetone | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000418 | |
| Acetonitrile | Thermo | 75-05-8 | |
| Ammonia | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10002118 | |
| Ammonium formate | Sigma | 540-69-2 | |
| Analytical balance | Changzhou Lucky Electronic Equipment Co., Ltd | FA | |
| Anhydrous ethanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10009218 | |
| Anti fluorescence quenching and sealing agent | southernbiotech | 0100-01 | |
| Automatic biochemical analyzer | Rayto Life and Analytical Sciences | Chemray240 | |
| BCA Protein Assay Kit | Solarbio | PC0020 | |
| Benazepril hydrochloride tablets | Xinya Minhang | H20044840 | |
| Blender | Kylin-Bell | BE-2600 | |
| Brick and stone cutting blade | Daitome | Ultra45 | |
| BSA | ZSGB-BIO | ZLI-9027 | |
| Buffer RW | Beijing Baiao Leibo | WK191 | |
| Carbodiimide hydrochloride | Hubei Xinghengye Technology | 25952-53-8 | |
| Cell apoptosis detection kit | Elabscience | E-CK-A322 | |
| Chemiluminescence imaging system | Hangzhou Shenhua Technology Co., Ltd | SH-523 | |
| Chloroform | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10006818 | |
| Constant temperature drying oven | Thermo Fisher | Heto PowerDiy LL3000 | |
| Cover glass slide | Jiangsu Shitai Experimental Equipment Co., Ltd | 10212450C | |
| CY3 Conjugated AffiniPure Goat Anti-rabbit IgG (H+L) | BOSTER | BA1032 | |
| DAB reagent kit | Servicebio | G1212-200T | |
| DAPI | Blue Cloud Sky | C1002 | |
| Decolorization shaker | Wuhan Lingsi Biotechnology Co., Ltd | TSY-B | |
| Dehydration machine | Wuhan Junjie Electronics Co., Ltd | JJ-12J | |
| DL2000 DNA Marker | TIANGEN | MD114 | |
| DMSO | MCE | HY-Y0320 | |
| dNTP | TIANGEN | CD117 | |
| EBlot L1 Rapid Wet Rotation Instrument | Kingsray Biotechnology Co., Ltd | L00686C | |
| ECL substrate solution | affinity | KF8003 | |
| Electric constant temperature water bath pot | Fisaff Instrument (Hebei) Co., Ltd | DK-20000-IIIL | |
| Electrophoresis instrument power supply | Beijing Longfang Technology Co., Ltd | LF-600S | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd | JB-P5 | |
| Equilibrium buffer | Wuhan Lingsi Biotechnology Co., Ltd | E8090 | |
| Ethylenediamine | Ruichengkang Pharmaceutical Technology | 107-15-3 | |
| FA series multifunctional analytical electronic balance | Changzhou Lucky Electronic Equipment Game Company | FA1204 | |
| Filter membrane | Jinteng | Nylon6-0.22μm | |
| Formaldehyde solution | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10010018 | |
| Formic acid | TCI | 64-18-6 | |
| Freezing centrifuge | Xiangyi | H1850-R | |
| Frozen platform | Wuhan Junjie Electronics Co., Ltd | JB-L5 | |
| Glacial acetic acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000218 | |
| Glass bead | Sigma | G8772-500G | |
| Glass slide | Nantong Meiweide Life Science Co., Ltd | PC2-301 | |
| glycine | Biofroxx | 30166428 | |
| Hematoxylin | Wuhan Lingsi Biotechnology Co., Ltd | G1140 | |
| High speed refrigerated centrifuge | Hunan Kecheng Instrument Equipment Co., Ltd | H1-16KR | |
| Horizontal agarose electrophoresis tank | Long Fang | LF-31DS | |
| Horizontal shaker | Jiangsu Haimen Qilin Bell Instrument Manufacturing Co., Ltd | TS-1 | |
| HRP Conjugated AffiniPure Goat Anti-rabbit IgG (H+L) | BOSTER | BA1054 | |
| hydrochloric acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10011028 | |
| Imaging system | Nikon | Nikon DS-U3 | |
| Incomplete Freund's adjuvant | MCE | ISA-51 | |
| Intelligent digital magnetic heating stirrer | Hangzhou Miou Instrument Co., Ltd | TP-350E+ | |
| Isoflurane | Sigma | 26675-46-7 | |
| Isopropanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 80109218 | |
| KCl | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10020318 | |
| KH2PO4 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 1115GR500 | |
| Liquid chromatograph | Thermo | IQLAAAGABHFAPUMBJC | |
| marker(10-250KD) | Mei5bio | MF028-plus-01 | |
| marker(20-120KD) | GenScript | M00521 | |
| Mass spectrometer | Thermo | IQLAAEGAAPFALGMBDK | |
| Masson staining kit | BASO | BA4079B | |
| Methanol | Thermo | 67-56-1 | |
| microscope | Nikon | ECLIPSE Ci | |
| microwave oven | Galanz Microwave Oven Electrical Appliance Co., Ltd | P70D20TL-P4 | |
| Multi sample tissue grinder | Shanghai Jingxin Industrial Development Co., Ltd | Tissuelyser-24L | |
| Multiskan FC ELISA reader | Thermo scientific | 1410101 | |
| Na2HPO4.12H2O | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10017618 | |
| NaCl | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000218 | |
| Neutral resin | Wuhan Lingsi Biotechnology Co., Ltd | G8590 | |
| Normal Goat Serum | Solarbio | SL038 | |
| Organizational spreading machine | Zhejiang Jinhua Kedi Instrument Equipment Co., Ltd | KD-P | |
| Osmic acid | Ted Pella Inc | 18450 | |
| oven | Shanghai Huitai Instrument Manufacturing Co., Ltd | DHG-9140A | |
| Palm centrifuge | Wuhan Lingsi Biotechnology Co., Ltd | D1008E | |
| Paraformaldehyde | Solarbio | P1110 | |
| PAS staining kit | BASO | BA4114B | |
| Pathological slicer | Shanghai Leica Instrument Co., Ltd | RM2016 | |
| PBS | Solarbio | P1020 | |
| PCR instrument | Hangzhou Miou Instrument Co., Ltd | PR-96 | |
| PH meter | Sedolis Scientific Instruments (Beijing) Co., Ltd | PB-10 | |
| PH meter | Sedolis Scientific Instruments (Beijing) Co., Ltd | 2018C132-11 | |
| PI3K inhibitor LY294002 | MCE | HY-10108 | |
| Pipette gun | Dragon | KE0003087/KA0056573 | |
| Protein phosphatase inhibitor complex | Meilunbio | MB12707-1 | |
| PVDF membrane (0.22 μm) | Solarbio | ISEQ00010 | |
| PVDF membrane (0.45 μm) | Solarbio | YA1701 | |
| Quick primary/secondary antibody diluent | Solarbio | A1811 | |
| Rabbit anti-AKT | Affinity | AF0836 | |
| Rabbit anti-BAD | Affinity | AF6471 | |
| Rabbit anti-C3 | Affinity | DF13224 | |
| Rabbit anti-GAPDH | Hangzhou Xianzhi | AB-P-R 001 | |
| Rabbit anti-IgG | CST | 3900S | |
| Rabbit anti-Nephrin | bioss | bs-10233R | |
| Rabbit anti-P-AKT | Affinity | AF0016 | |
| Rabbit anti-p-BAD | invitrogen | PA5-105023 | |
| Rabbit anti-PI3K | Affinity | AF6241 | |
| Rabbit anti-PIK3CA | Bioss | Bs-2067R | |
| Rabbit anti-WT-1 | Affinity | DF6331 | |
| Real-Time PCR System | ABI | QuantStudio 6 | |
| RIPA Lysis Buffer | Meilunbio | MA0151 | |
| SDS | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10019318 | |
| Slide and cover glass | Jiangsu Shitai Experimental Equipment Co., Ltd | 10212432C | |
| Super pure water instrument | Zhiang Instrument (Shanghai) Co., Ltd | Clever-S15 | |
| SYBR Green Master Mix | VAZYME | Q111-02 | |
| Taq Plus DNA Polymerase | TIANGEN | ET105-02 | |
| Tissue grinder | Beautiful Wall | MB-96 | |
| Transmission electron microscope | HITACHI | HT7800/HT7700 | |
| Tris-base | Biofroxx | 10019318 | |
| Trizol | Ambion | 15596-026 | |
| TUNEL Cell Apoptosis Detection Kit (FITC) | Beijing Baiao Leibo | SY0475 | |
| Tween 20 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 30189328 | |
| Ultra micro UV visible spectrophotometer | Hangzhou Miou Instrument Co., Ltd | ND-100 | |
| Ultra thin slicer | Leica | Leica UC7 | |
| Ultrasonic cleaner | shumei | KQ- 800DE | |
| Upright optical microscope | Nikon | Nikon Eclipse CI | |
| Urinary Protein Test Kit | Nanjing Jiancheng Bioengineering Research Institute | C035-2 | |
| Vertical electrophoresis tank | Beijing 61 Instrument Factory | DYCZ-24DN | |
| Vortex mixer | Wuhan Lingsi Biotechnology Co., Ltd | MX-F | |
| Western Blocking Buffer | Solarbio | SW3010 | |
| xylene | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10023418 |
参考文献
- McQuarrie, E. P., Mackinnon, B., Stewart, G. A., Geddes, C. C., Registry, S. R. B. Membranous nephropathy remains the commonest primary cause of nephrotic syndrome in a northern European Caucasian population. Nephrol Dial Transplant. 25 (3), 1009-1011 (2010).
- Ronco, P. H., Debiec, H. Pathophysiological advances in membranous nephropathy: time for a shift in patient's care. Lancet. 385 (9981), 1983-1992 (2015).
- Xu, X., et al. Long-term exposure to air pollution and increased risk of membranous nephropathy in China. J Am Soc Nephrol. 27 (12), 3739-3746 (2016).
- Fogo, A. B., Lusco, M. A., Najafian, B., Alpers, C. E. AJKD atlas of renal pathology: Membranous nephropathy. Am J Kidney Dis. 66 (3), e15-e17 (2015).
- Li, X., Zhang, X. Comments on the 2021 Kidney Disease: Improving Global Outcomes (KDIGO) clinical practice guideline for anticoagulant therapy in patients with membranous nephropathy. Kidney Int. 101 (1), 186-187 (2022).
- Ruggenenti, P., Fervenza, F. C., Remuzzi, G. Treatment of membranous nephropathy: time for a paradigm shift. Nat Rev Nephrol. 13 (9), 563-579 (2017).
- Klomjit, N., Fervenza, F. C., Zand, L. Successful treatment of patients with refractory PLA2R-associated membranous nephropathy with Obinutuzumab: A report of 3 cases. Am J Kidney Dis. 76 (6), 883-888 (2020).
- Podestà, M. A., Ruggiero, B., Remuzzi, G., Ruggenenti, P. Ofatumumab for multirelapsing membranous nephropathy complicated by rituximab-induced serum-sickness. BMJ Case Rep. 13 (1), e232890-e232896 (2020).
- Stehlé, T., et al. Anti-CD38 therapy for PLA2R-positive membranous nephropathy resistant to conventional immunosuppression. Kidney Int. 101 (2), 416-418 (2022).
- Trimarchi, H., Coppo, R. Podocytopathy in the mesangial proliferative immunoglobulin A nephropathy: new insights into the mechanisms of damage and progression. Nephrol Dial Transplant. 34 (8), 1280-1285 (2019).
- Kopp, J. B., et al. Podocytopathies. Nat Rev Dis Primers. 6 (1), 68-72 (2020).
- Hoxha, E., Reinhard, L., Stahl, R. A. K. Membranous nephropathy: new pathogenic mechanisms and their clinical implications. Nat Rev Nephrol. 18 (7), 466-478 (2022).
- Chiou, T. T., et al. Rapamycin attenuates PLA2R activation-mediated podocyte apoptosis via the PI3K/AKT/mTOR pathway. Biomed Pharmacother. 144 (8), 112349-112356 (2021).
- Chen, J., et al. Danshen injection induces autophagy in podocytes to alleviate nephrotic syndrome via the PI3K/AKT/mTOR pathway. Phytomedicine. 107 (7), 154477-154489 (2022).
- Wang, Y., et al. Fangji Huangqi decoction ameliorates membranous nephropathy through the upregulation of BNIP3-mediated mitophagy. J Ethnopharmacol. 324 (13), 117734-117743 (2024).
- Wei, L., et al. Shenqi granule upregulates CD2AP and α-actinin4 and activates autophagy through regulation of mTOR/ULK1 pathway in MPC5 cells. J Ethnopharmacol. 303 (16), 115942-115954 (2023).
- Wang, P., et al. A review of the botany, phytochemistry, traditional uses, pharmacology, toxicology, and quality control of the Astragalus memeranaceus. Front Pharmacol. 14 (2), 1242318-1242325 (2023).
- Wang, Q., et al. Traditional Chinese medicine method of tonifying kidney for hypertension: Clinical evidence and molecular mechanisms. Front Cardiovasc Med. 20229 (16), 1038480-1038487 (2022).
- Tang, X., et al. Experimental models for elderly patients with membranous nephropathy: Application and advancements. Exp Gerontol. 185 (8), 112341-112353 (2024).
- Zhang, J. J., et al. Murine membranous nephropathy: immunization with α3(IV) collagen fragment induces subepithelial immune complexes and FcγR-independent nephrotic syndrome. J Immunol. 188 (7), 3268-3277 (2012).
- Hopfer, H., et al. The importance of cell-mediated immunity in the course and severity of autoimmune anti-glomerular basement membrane disease in mice. FASEB J. 17 (8), 860-868 (2003).
- Fleuren, G., Grond, J., Hoedemaeker, P. J. In situ formation of subepithelial glomerular immune complexes in passive serum sickness. Kidney Int. 17 (5), 631-637 (1980).
- Border, W. A., Ward, H. J., Kamil, E. S., Cohen, A. H. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen. J Clin Invest. 69 (2), 451-461 (1982).
- Border, W. A., Ward, H. J., Kamil, E. S., Cohen, A. H. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen. J Clin Invest. 69 (2), 451-461 (1982).
- Rubio-Navarro, A., et al. Phenotypic characterization of macrophages from rat kidney by flow cytometry. J Vis Exp. (116), e54599 (2016).
- Hou, Y., et al. Longzhibu disease and its therapeutic effects by traditional Tibetan medicine: Ershi-wei Chenxiang pills. J Ethnopharmacol. 249, 112426 (2020).
- Sethi, S., et al. Hematopoietic stem cell transplant-membranous nephropathy is associated with protocadherin FAT1. J Am Soc Nephrol. 33 (5), 1033-1044 (2022).
- Gong, Q., Lai, T., Liang, L., Jiang, Y., Liu, F. Targeted inhibition of CX3CL1 limits podocytes ferroptosis to ameliorate cisplatin-induced acute kidney injury. Mol Med. 29 (1), 140-148 (2023).
- Li, H., et al. IL-23 reshapes kidney resident cell metabolism and promotes local kidney inflammation. J Clin Invest. 131 (12), e142428-e142441 (2021).
- Wang, C., et al. Artificially cultivated Ophiocordyceps sinensis alleviates diabetic nephropathy and its podocyte injury via inhibiting P2X7R expression and NLRP3 inflammasome activation. J Diabetes Res. 356 (11), 1390418-1390431 (2018).
- Cheng, H., et al. PI3K/Akt signaling pathway and Hsp70 activate in hippocampus of rats with chronic manganese sulfate exposure. J Trace Elem Med Biol. 50 (12), 332-338 (2018).
- Ji, K., et al. The immunoreaction and antioxidant capacity of juvenile blunt snout bream (Megalobrama amblycephala) involves the PI3K/Akt/Nrf2 and NF-κB signal pathways in response to dietary methionine levels. Fish Shellfish Immunol. 105 (10), 126-134 (2020).
- Chiou, T. T., et al. Rapamycin attenuates PLA2R activation-mediated podocyte apoptosis via the PI3K/AKT/mTOR pathway. Biomed Pharmacother. 144 (3), 112349-112357 (2021).
- Lv, Q., Yang, F., Chen, K., Zhang, Y. Autophagy protects podocytes from sublytic complement induced injury. Exp Cell Res. 341 (2), 132-138 (2016).
- Mundel, P., Shankland, S. J. Podocyte biology and response to injury. J Am Soc Nephrol. 13 (12), 3005-3015 (2002).
- Sun, Z., Xu, Q., Ma, Y., Yang, S., Shi, J. Circ_0000524/miR-500a-5p/CXCL16 axis promotes podocyte apoptosis in membranous nephropathy. Eur J Clin Invest. 51 (3), e13414-e13422 (2021).
- Huber, T. B., et al. Nephrin and CD2AP associate with phosphoinositide 3-OH kinase and stimulate AKT-dependent signaling. Mol Cell Biol. 23 (14), 4917-4928 (2003).
- Ai, Z., et al. Deciphering the pharmacological mechanisms of Rostellularia procumbens (L) Nees. Extract alleviates adriamycin-induced nephropathy in vivo and in vitro. Phytomedicine. 113 (6), 154736-154742 (2023).
- Wang, X., et al. Nicorandil alleviates apoptosis in diabetic cardiomyopathy through PI3K/Akt pathway. J Cell Mol Med. 23 (8), 5349-5359 (2019).
- Fox, M., Mott, H. R., Owen, D. Class IA PI3K regulatory subunits: p110-independent roles and structures. Biochem Soc Trans. 48 (4), 1397-1417 (2020).
- Miricescu, D., et al. PI3K/AKT/mTOR signaling pathway in breast cancer: From molecular landscape to clinical aspects. Int J Mol Sci. 22 (1), 173-179 (2020).
- Feng, C., et al. Neuroprotective effect of Danhong injection on cerebral ischemia-reperfusion injury in rats by activation of the PI3K-Akt pathway. Front Pharmacol. 11 (4), 298-312 (2020).
- Zhou, Y., et al. 1,3-Dicaffeoylquinic acid targeting 14-3-3 tau suppresses human breast cancer cell proliferation and metastasis through IL6/JAK2/PI3K pathway. Biochem Pharmacol. 172 (12), 113752-113761 (2020).
- Li, J., et al. Tetrandrine inhibits colon carcinoma HT-29 cells growth via the Bcl-2/Caspase 3/PARP pathway and G1/S phase. Biosci Rep. 39 (5), (2019).
- Downward, J. How BAD phosphorylation is good for survival. Nat Cell Biol. 1 (2), E33-E35 (1999).
- Fan, J., et al. A model of ischemia and reperfusion increases JNK activity, inhibits the association of BAD and 14-3-3, and induces apoptosis of rabbit spinal neurocytes. Neurosci Lett. 473 (3), 196-201 (2010).
- Chipuk, J. E., Green, D. R. How do BCL-2 proteins induce mitochondrial outer membrane permeabilization. Trends Cell Biol. 18 (4), 157-164 (2008).
- Yin, L., Yu, L., He, J. C., Chen, A. Controversies in podocyte loss: Death or detachment. Front Cell Dev Biol. 9 (11), 771931-771942 (2021).
- Yang, C., et al. Research progress on multiple cell death pathways of podocytes in diabetic kidney disease. Mol Med. 29 (1), 135-143 (2023).
- Calvier, L., et al. PPARγ links BMP2 and TGFβ1 pathways in vascular smooth muscle cells, regulating cell proliferation and glucose metabolism. Cell Metab. 25 (5), 1118-1134 (2017).
- Dai, Z. W., Cai, K. D., Xu, L. C., Wang, L. L. Perilipin2 inhibits diabetic nephropathy-induced podocyte apoptosis by activating the PPARγ signaling pathway. Mol Cell Probes. 53 (3), 101584-101596 (2020).
- Kota, B. P., Huang, T. H., Roufogalis, B. D. An overview on biological mechanisms of PPARs. Pharmacol Res. 51 (2), 85-94 (2005).
- Wahli, W. Peroxisome proliferator-activated receptors (PPARs): from metabolic control to epidermal wound healing. Swiss Med Wkly. 132 (7-8), 83-91 (2002).
- Agrawal, S., He, J. C., Tharaux, P. L. Nuclear receptors in podocyte biology and glomerular disease. Nat Rev Nephrol. 17 (3), 185-204 (2021).
- Miglio, G., et al. Protective effects of peroxisome proliferator-activated receptor agonists on human podocytes: proposed mechanisms of action. Br J Pharmacol. 167 (3), 641-653 (2012).
- Miglio, G., et al. The subtypes of peroxisome proliferator-activated receptors expressed by human podocytes and their role in decreasing podocyte injury. Br J Pharmacol. 162 (1), 111-125 (2011).
- Agrawal, S., Guess, A. J., Benndorf, R., Smoyer, W. E. Comparison of direct action of thiazolidinediones and glucocorticoids on renal podocytes: protection from injury and molecular effects. Mol Pharmacol. 80 (3), 389-399 (2011).
- Sonneveld, R., et al. Sildenafil prevents podocyte injury via PPAR-γ-mediated TRPC6 inhibition. J Am Soc Nephrol. 28 (5), 1491-1505 (2017).
- Agrawal, S., et al. Pioglitazone enhances the beneficial effects of glucocorticoids in experimental nephrotic syndrome. Sci Rep. 6 (3), 24392-24404 (2016).
- Kanjanabuch, T., et al. PPAR-gamma agonist protects podocytes from injury. Kidney Int. 71 (12), 1232-1239 (2007).
- Bryant, C., et al. Selective modulator of nuclear receptor PPARγ with reduced adipogenic potential ameliorates experimental nephrotic syndrome. iScience. 25 (4), 104001 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。