Method Article
PI3K/AKT 신호전달 경로를 통한 멤브라누스 신병증이 있는 쥐에서 Kemeng Fang의 Podocyte Apoptosis 억제 메커니즘
요약
본 프로토콜은 막성 신병증(MN) 동물 모델의 확립과 Kemeng Fang의 억제가 PI3K/AKT 신호 경로를 활성화하여 MN 쥐 포도세포 자멸사를 감소시키는 방법을 설명합니다.
초록
멤브라누스 신병증(MN)은 성인 신증후군의 흔한 병리학적 유형입니다. MN 환자의 최대 20%가 말기 신장 질환(ESRD)을 앓고 있습니다. Podocytes는 사구체 여과 장벽을 유지하는 데 중요한 기능을 하며 단백뇨 및 MN의 발생 및 발달에 중요한 역할을 합니다. PI3K/AKT 신호전달 경로는 podocyte 성장, 분화 및 세포사멸의 전체 과정에 관여합니다. Kemeng Fang(KMF)은 신장 손상을 지연시키는 데 사용되는 전통 중국 의학 포뮬러입니다. 그러나 MN에서 KMF의 치료 기전은 불분명하다. 여기서, MN 랫트 모델은 양이온화된 소 혈청 알부민(C-BSA)의 겨드랑이, 서혜부 및 꼬리 정맥 주사에 의해 확립된 후 KMF 및 PI3K 억제제(LY294002)를 투여했습니다. 쥐의 간 기능, 신장 기능, 혈중 지질, 신장 병리학, 포도세포 기능, PI3K/AKT 신호전달 경로의 발현 수준, 전사체학 등의 데이터는 KMF가 PI3K/AKT 신호전달 경로를 활성화하여 MN 쥐의 포도세포에 보호 효과가 있으며 MN의 진행을 효과적으로 예방할 수 있음을 입증했습니다.
서문
멤브라누스 신병증(MN)은 성인 신증후군의 흔한 병리학적 유형으로, 연간 발병률은 100,000명당 약 5-10명입니다. 주로 30세에서 50세 사이에 발생하며 어린이에게는 드뭅니다(약 5%). 이 질환은 여성보다 남성에게 훨씬 더 많이 퍼져 있습니다(2:1). 또한, MN 환자의 최대 20%가 말기 신장 질환(ESRD)으로 발병합니다. 또한, MN 환자가 1,2,3년마다 ESRD가 발병하는 추세가 증가하고 있습니다. MN의 병리학적 특징은 과립 면역글로빈 G(IgG)와 보체 시스템 막 공격 복합체(MAC)가 podocytes에 인접한 사구체 기저막(GBM)에 많이 침착되어 있다는 것입니다. 이 침착은 교모세포종(GBM)의 두꺼워짐과 사구체 여과 장벽 무결성의 파괴를 초래하여 궁극적으로 단백뇨를 유발합니다4.
지지 요법, 면역억제제 및 표적 단클론 항체가 MN을 치료하는 주요 방법입니다. 이러한 중재는 단백뇨를 현저히 줄이고 신장 악화의 진행을 지연시킬 수 있지만, 많은 단점도 가지고 있습니다. 첫째, 지지요법은 저위험군 환자에게만 적합하다5. 둘째, 면역억제제는 대퇴골두 괴사, 2차 감염, 골수 조혈 기능 저해와 같은 부작용을 유발할 수 있다6. 셋째, 오파미즈맙(ofamizumab), 오투주맙(otuzumab), 다레토주맙(daretozumab), 이사툭시맙(isatuximab) 7,8,9과 같은 단일클론 항체의 사용에 대한 근거 기반 약물을 제공하기 위해서는 광범위한 무작위 대조 시험 연구가 필요하다. 따라서 MN에 대한 효과적인 치료법을 적극적으로 모색하는 것은 ESRD의 발병을 지연시키고 MN 환자의 삶의 질을 향상시키는 데 큰 의미가 있습니다.
사구체 내장 상피 세포(glomerular visceral epithelial cell)라고도 알려진 Podocyte(족세포)는 교모세포종의 바깥쪽에 부착되어 있으며, GBM 모세혈관 내피는 함께 사구체 혈액 여과 장벽을 형성합니다. 그들은 사구체 단백질 여과 장벽을 유지하고, 정상적인 기저막을 합성하고, 사구체 모세혈관 신경총에 대한 구조적 지지를 제공하는 것과 같은 중요한 기능을 가지고 있습니다10,11. 연구에 따르면 podocytes의 apoptosis는 단백뇨 및 MN의 발생 및 발달에 중요한 역할을 하며, PI3K/AKT 신호 경로는 podocyte 성장, 분화 및 apoptosis의 전체 과정에 관여합니다 12,13,14.
점점 더 많은 연구에서 한의학이 MN 치료에 상당한 이점이 있으며, 이는 혈중 크레아티닌, 단백뇨 및 지연성 신장 손상을 크게 줄일 수 있음을 보여주고 있습니다15,16. KMF는 13가지 식물에서 추출한 성분을 함유한 중국 전통 의학 화합물입니다. 난프. (당셴, DS); 황기 membranaceus (Fisch.) 번지. (Huangqi, HQ); 콥티스 키넨시스 프랜치. (황롄, HL); 들깨 frutescens (L.) Britt. (수예, SY); 지황 glutinosa (Gaertn.) (수디황, SDH); Ligusticum chuanxiong Hort. (촨슝, CX); 에우리얄 페록스 살리스브. (첸시, QS); 사비아 자포니카 격언. (친펑텡, QFT); 루스 키넨시스 밀. (Wubeizi, WBZ); 로벨리아 키넨시스 라우다. (반빌리안, BBL); 올덴란디아 디푸사 (Willd.) 록스비. (Baihuasheshecao, BHSSC; 표 1). KFM은 신장 강화(신장 기능 향상), 기 강화(면역력 강화), 이뇨 촉진, 담보 준설(혈액 순환 촉진) 등 많은 기능을 가지고 있습니다. 그러나 MN에서 KMF의 치료 기전은 불분명하다17,18.
현재 MN 모델을 구성하는 방법은 Heymann 신염 모델, C-BSA 신염 모델, α3NC1 마우스 모델 등 여러 가지가 있으며, Heymann 신염 모델에서는 주요 병원성 항원 메갈린 단백질이 인간 MN에서 발견되지 않아 인간 MN의 발병기전과 다르며, α3NC1 마우스 모델, 마우스 모델의 DBA/1 유전적 배경만 더 높으며, 나머지 쥐는 모델링에 덜 성공적이거나 모델링할 수 없었습니다 19,20,21. C-BSA 신염 모델은 비용 효율적이고 작동이 간편하며, 발병 기전은 인간 MN 동물 모델과 매우 유사합니다19. 기본 원리는 GBM이 음전하를 띠고 C-BSA가 양전하를 띠기 때문에 GBM을 쉽게 교차하여 심은 항원이 될 수 있으며, 이는 순환 항체가 그곳에 축적되어 현장 면역 복합체를 형성하도록 유도하여 MN 모델22,23을 구성하는 것입니다. 본 연구의 목적은 전사체학과 분자생물학을 결합하여 MN에 대한 KMF의 치료 효과와 분자 기전을 관찰하고, KMF를 이용한 MN 치료에 대한 신뢰할 수 있는 과학적 근거를 제공하는 것이었다.
프로토콜
이 연구는 후베이성 질병통제예방센터(Hubei Provincial Center for Disease Control and Prevention)의 실험동물 관리 및 사용 위원회(Experimental Animal Management and Use Committee, ID 번호: 202220144)의 검토 및 승인을 받았습니다. 쥐는 23 ± 1 ° C 및 50 % -60 % 대기 습도의 비 병원성 조건에서 12 시간의 명암 주기를 겪었습니다. 우리는 후베이성 질병통제예방센터(라이선스 번호: SYXK [E] 2022-0065)에서 8주 된 수컷 Sprague-Dawley 쥐 100마리를 조달하여 1주일 동안 특정 병원균이 없는 등급 환경에서 정상적인 유지 사료와 식균 물을 마시며 적응형 먹이를 주었습니다.
1. 약물 제제
- KMF의 준비
- 사용된 한약재는 장춘 중의대학 부속 병원에서 제공한 것으로, 구체적인 조성 및 용량은 표 1에 나와 있습니다. 준비하려면 총 147g의 생약-Codonopsis pilosula (20g), Astragalus membranaceus (30g), Coptis chinensis (3g), Perilla frutescens (6g), Rehmannia glutinosa (15g), Ligusticum chuanxiong (15g), Euryale ferox (15g), Sabia japonica (10g), Rhus chinensis (3g), Lobelia chinensis (15g), Oldenlandia diffusa (15g). 증류수 1470mL를 섞어 30분 동안 담가둡니다.
- 허브 혼합물을 세라믹 냄비에 넣고 달이기 위해 100°C에서 90분 동안 가열합니다. 두 겹의 의료용 거즈를 걸러내고 실온에서 보관하십시오.
- 남은 허브 혼합물에 증류수(1470mL)를 다시 넣고 1.1.2단계에 설명된 대로 위의 달인 작업을 한 번 더 반복합니다. 여과액을 실온에서 보관하십시오.
- 위의 두 여과액을 혼합하고 수용액이 완전히 증발하고 용질만 분말 형태로 유지될 때까지 80°C에서 10시간 동안 오븐 건조합니다.
- 분말의 무게를 달아 식염수에 용해시켜 4mL당 1.323g, 2.646g, 5.292g(농도는 각각 0.331g/mL, 0.662g/mL, 1.323g/mL)을 함유한 용액을 만듭니다. 이는 쥐에게 투여된 약물의 일일 복용량입니다.
- Benadryl hydrochloride의 제조
- 식염수 100mL에 베나드릴염산염 정제(90g)를 넣고 잘 흔들어 완전히 녹입니다.
- PI3K 억제제 LY294002의 제조
- DMSO 1.1mL에 LY294002 분말 82.3mg을 넣고 잘 흔들어 완전히 녹입니다. 다음으로 식염수 198.9mL를 첨가하여 희석하여 0.41mg/mL의 농도를 얻습니다.
- C-BSA 유화제의 제조
- 이중 증류수 500mL에 무수 에틸렌디아민 67mL를 넣고 섞습니다. 350mL의 6M 염산을 천천히 첨가하고 pH를 4.75로 조정합니다. 최종 용액의 온도를 25°C로 유지합니다.
- 천연 소 혈청 알부민 5g을 이중 증류수 25mL에 녹이고 용액을 25°C의 일정한 온도에서 일정한 교반으로 유지합니다. 2시간 후 1.8g의 카르보디이미드 하이드로클로라이드와 30mL의 4M 아세트산 완충액을 pH 4.75로 첨가하여 C-BSA 용액을 얻습니다.
- 얻어진 용액을 4 °C에서 72 시간 동안 (물은 3-5 시간마다 변경) 셀레 나이트 종이를 사용하여 투석하고 동결 건조하여 C-BSA 동결 건조 분말을 얻고 -80 ° C24에서 보관한다.
- 식염수 50mL에 C-BSA 건조 분말 100mg을 첨가하여 C-BSA 용액을 형성합니다. 이것을 완전한 유화를 위해 동일한 부피의 Incomplete Freund's adjuvant와 혼합하십시오. 농도는 1mg/mL입니다.
- C-BSA 용액의 제조
- PBS 100mL에 C-BSA 건조 분말 640mg을 넣고 잘 흔들어 완전히 녹입니다. 농도는 6.4mg/mL입니다.
2. MN 동물모델 확립
참고: 실험은 정상 대조군(CON), 모델 그룹(MOD), 베나제프릴 하이드로클로라이드 그룹(BEN), KMF 저용량 그룹(KM-L), KMF 중간 용량 그룹(KM-M), KMF 고용량 그룹(KM-H), PI3K 억제제 그룹(PI3K) 및 PI3K 억제제 + KMF 중간 용량 그룹(PI3K + KM-M)의 8개 그룹으로 나뉩니다. 정상 대조군을 제외한 모든 그룹은 MN 모델을 생성하기 위해 C-BSA를 투여했습니다.
- 9주째에는 사전 면역 접종을 실시합니다: 겨드랑이와 사타구니에 C-BSA 유화제를 여러 차례 피하 주사합니다.
참고: 목덜미(견갑골)는 C-BSA 유화제의 피하 투여를 위한 대체 부위입니다.- 왼손으로 쥐의 뒷 피부를 잡고 복부 피부를 조인 상태에서 복부를 위로 돌립니다. C-BSA 유화제를 쥐의 겨드랑이와 사타구니에 2.5 mL 주사기를 사용하여 1 주일 동안 격일로 1 일 한 번씩 주사합니다.
- 공식 면역 : C-BSA 용액의 꼬리 정맥 주사
- 10주가 되면 새장에서 쥐를 꺼내 꼬리가 실험자를 향하도록 철사 막대 뚜껑에 놓습니다.
- 알코올 면봉으로 쥐의 꼬리를 닦고 왼손의 엄지와 검지로 쥐의 꼬리 양쪽을 꼬집어 정맥을 채우고 정맥이 위를 향하도록 합니다.
- 바늘이 꼬리 정맥에 대해 30°가 되도록 오른손에 1mL 주사기를 잡습니다. 피부를 부드럽게 찔러본 직후 바늘 끝을 위쪽으로 비스듬하게 하고 바늘을 혈관과 평행하게 유지하십시오. 주삿바늘에서 혈액이 다시 나오면 C-BSA 투여량인 2.5mL/kg과 함께 4주 동안 주 3회 주사합니다.
- 주입 완료 후 마른 면봉을 사용하여 주입 부위를 약 1분 동안 눌러 출혈을 멈춥니다. 이모빌라이저에서 쥐를 제거하고 케이지로 돌아갑니다.
3. KMF 분석
- 2mL 원심분리 튜브에 샘플 1g의 무게를 측정하고 600μL의 MeOH(2-Amino-3-(2-chloro-phenyl)-propionic acid(4ppm)를 포함하는 -20°C에서 보관)를 첨가하고 혼합물을 30초 동안 와류로 회전시킵니다.
- 약 100mg의 유리 구슬을 넣고 혼합물을 티슈 그라인더에 60Hz에서 90초 동안 넣습니다.
- 실온에서 40kHz 동안 15분 동안 초음파를 수행합니다.
- 15,984 x g, 4°C에서 10분 동안 원심분리기를 하고 0.22μm 멤브레인을 통해 상층액을 여과합니다. LC-MS 검출을 위해 검출 병을 옮깁니다.
4. 약물 치료
참고: 성인 남성은 하루에 147g KMF가 필요합니다. 실험용 쥐와 인간 약물 투여량의 변환 공식에 따르면, 쥐(g/kg) = 인간 투여량(g)/체중(70kg) x 6.3에 대한 등가 실험 용량은 쥐의 일일 투여량은 약 13.23g/kg이었습니다.
- 14주가 되면 왼손으로 쥐의 등 피부를 잡고 복부를 위로 돌려 복부 피부를 조입니다. 10mL 주사기의 바늘을 오른손에 잡고 한쪽에서 입으로 삽입하면서 입천장과 인두 후벽을 따라 미끄러지면서 삼키는 동작을 사용하여 위를 따라 더 멀리 이동합니다.
- 오른손의 검지를 사용하여 천천히 약물을 투여하고 투여가 완료된 후 위 바늘을 당겨 빼냅니다. 투여된 약물의 투여량은 10mL/kg이며 총 4주 동안 투여됩니다.
- CON 및 MOD 그룹의 경우 간으로 10mL/kg/일 식염수를 투여합니다.
- BEN 그룹의 경우 위층으로 9mg/kg/day Benadryl hydrochloride 수용액을 투여합니다.
- KM-L 그룹의 경우 위층에 의해 KMF의 3.3075g/kg/day 수성 추출물을 투여합니다. KM-M 그룹의 경우 6.615g/kg/day의 KMF 수성 추출물을 위층으로 투여합니다. KM-H 그룹의 경우 13.23g/kg/일의 KMF 수성 추출물을 위(gavage)로 투여합니다.
- PI3K 그룹의 경우 2.1mg/kg/일 LY294002 위장으로 투여합니다.
- PI3K+KM-M 그룹의 경우 2.1mg/kg/day LY294002(5mL/kg) + 6.615g/kg/day KMF 수성 추출물(5mL/kg)을 위별로 투여합니다.
5. KMF 효능 평가
- 혈액 및 소변 생화학적 지수 검출
- 14주부터는 실험 시작 후 2주마다 소변을 채취합니다. 쥐 한 마리를 대사 케이지에 24시간 동안 넣습니다. 식단을 제한하고 식수를 무료로 이용할 수 있도록 합니다. 대사 케이지 아래에 놓인 50mL 원심분리 튜브를 사용하여 소변을 수집합니다.
- 소변을 15,984 x g 에서 10분 동안 원심분리하고 상층액을 사용하여 소변 단백질 테스트 키트의 지침에 따라 소변 단백질 수치를 추정합니다.
- 18주에 쥐에게 5% 이소플루란을 흡입하여 안락사시킵니다. 건조함을 방지하기 위해 수의사 연고를 눈에 사용하십시오. 경추 탈구법을 사용하여 사망을 확인합니다. 왼손으로 쥐의 등 피부를 잡고 가위로 쥐의 수염을 다듬습니다.
- 안구 주위의 피부를 에탄올로 소독하고 지혈 겸자를 사용하여 안구를 빠르게 제거합니다. 원심분리기 튜브에 떨어뜨린 혈액을 모으고 실온에서 30분 동안 방치한 후 15,984 x g 에서 10분 동안 원심분리기를 합니다. 상층액을 수집합니다.
- 자동 생화학 분석기를 사용하여 알라닌 아미노전이효소(ALT), 아스파르테이트 트랜스아미나제(AST), 알부민(ALB), 트리글리세리드(TG), 총 콜레스테롤(TC), 혈액 요소 질소(BUN), 혈청 크레아티닌(Scr), 토탈단백질(TP) 및 기타 혈액 지수를 검출합니다.
- 신장 조직의 분리
- 쥐의 피를 채취한 후 수술판에 고정하고 복부 정중선의 털과 근육층을 천천히 잘라내고 장관을 밀어 열어 복부 대동맥과 신장을 노출시킨다25.
- 수술용 동맥 클램프를 사용하여 오른쪽 신장 위의 복부 대동맥을 차단합니다. 두피 바늘을 5mL 주사기에 연결하여 블록 아래에 구멍을 뚫고 PBS 완충액을 관류하여 양쪽 신장이 흰색이나 창백한 색이 될 때까지 신장을 세척합니다.
- 신장을 제거하고 골막을 뭉툭하게 분리한다. 올바른 신장을 냉동 보관 튜브에 나누어 -80°C의 냉장고에 보관합니다. 왼쪽 신장을 4% 파라포름알데히드 용액에 고정합니다.
- 고정 24시간 후 신장을 제거합니다. 탈수, 투명도 및 파라핀 임베딩을 수행합니다. 왁스 블록이 응고된 후 3μm 두께의 티슈 슬라이서로 자르고, 탈리 방지 슬라이드로 낚시를 하고, 98°C에서 20분 동안 슬라이스를 굽고, 여분의26개를 위해 보관합니다.
- 신장 조직병리학적 분석
- 단면을 구배 자일렌 탈왁스 및 무수 에탄올 탈수로 처리하고 증류수를 사용하여 헹굽니다. 크실렌을 15분 동안 투여한 후 신선한 크실렌 용액을 15분 동안 투여합니다. 5분 동안 무수 에탄올로 전환하고 5분 동안 새로운 무수 에탄올로 변경한 다음 5분 동안 90% 에탄올, 5분 동안 80% 에탄올, 5분 동안 70% 에탄올로 변경하고 마지막으로 증류수로 플러시합니다.
- 샘플 염색을 위한 hematoxylin-eosin staining(H&E), periodic acid-Schiff(PAS) 및 Masson 염색 키트에 대한 지침을 따릅니다.
- 그라디언트 무수 에탄올 탈수 및 자일렌 클리어를 다시 수행합니다.
- 슬라이스를 일정한 온도의 인큐베이터에 넣고 온도를 90°C로 설정하고 20분 동안 굽습니다. 구운 후 조각을 제거하고 중성 껌을 떨어뜨립니다. 커버 유리로 덮으십시오.
- 광학 현미경으로 200배 배율로 관찰하고 이미지를 수집합니다.
- 신장 조직의 면역형광(IF) 분석
- Dewax 절편을 만들고 5.3.1단계에 설명된 대로 탈수합니다. 고압, 고열(103KPa에서 125°C) 고정을 위해 0.01M EDTA 버퍼 용액에 샘플을 15분 동안 놓습니다. 샘플을 자연적으로 식히고 PBS에서 각각 3분씩 3회 세척합니다.
- 섹션을 3% 과산화수소 용액에 넣고 10분 동안 배양합니다. PBS에서 각각 5분 동안 샘플을 3회 세척합니다. 그런 다음 절편을 10% 염소 세럼에 넣고 30분 동안 배양한 다음 PBS에서 각각 3분씩 3회 세척합니다.
- 1차 항체 IgG(1:100) 및 C3(1:100)를 적가하고 4°C의 습식 상자에서 밤새 배양합니다. 1차 항체 희석 비율은 표 2에 나와 있습니다. 냉장고에서 부분을 제거하고 TBST 3x로 각각 3분씩 세탁하세요.
- 형광 2차 항체(1:100)를 적가하고 37°C에서 1시간 동안 배양한 후 TBST 3x로 각각 3분 동안 세척합니다.
참고: 이 단계와 모든 후속 단계는 어두운 곳에서 수행해야 합니다27,28. - 실온에서 4',6-디아미디노-2-페닐린돌(DAPI)으로 5분 동안 배양하고 빛을 피하고 여분의 DAPI를 제거하기 위해 각각 5분 동안 트윈 20(TBST)이 있는 트리스 완충 식염수로 세척합니다.
- 자가형광 소광제를 원형으로 넣고 5분 동안 배양한 다음 흐르는 물로 10분 동안 헹굽니다. 섹션을 흔들어 말리고 형광 담금질 실러로 밀봉합니다. 형광 현미경으로 200배로 관찰하고 이미지를 수집합니다.
- 신장 조직의 면역조직화학(IHC) 분석
- Dewax 절편을 만들고 5.3.1단계에 설명된 대로 탈수합니다. 0.01M EDTA 완충 용액에서 15 분 동안 고압 (125 °C · 103KPa)에서 수리합니다. 자연 냉각 후 PBS 3x로 각각 3분 동안 세탁하십시오.
- 5.4.2단계에서 설명한 대로 내인성 과산화효소 및 혈청 밀봉 작업 방법을 차단합니다.
- 1차 항체 WT-1(1:200)과 네프린(1:100)을 적가하고 4°C의 냉장고에 있는 젖은 상자에 넣어 밤새 배양합니다29.
- 4°C 냉장고에서 섹션을 제거하고 PBS 3x로 각각 5분 동안 세척합니다. 2차 항체(1:200)를 적가하고 37°C에서 30분 동안 배양한 다음 PBS 3x로 각각 3분 동안 세척합니다.
- 갓 준비한 디아미노벤지딘(DAB) 발색 용액 한 방울을 넣고 광학 현미경으로 200x로 관찰합니다. 양의 신호는 갈색을 띤 노란색 또는 갈색을 띤 갈색입니다. 단면의 색상 변화가 관찰되면 즉시 수돗물로 염색 용액을 씻으십시오.
- 헤마톡실린을 사용하여 3분 동안 다시 염색한 다음 1% 염산 알코올을 첨가하여 구별하고 수돗물로 10분 동안 헹굽니다.
- 5.2.4단계에 설명된 대로 섹션을 투명하게 탈수하고 밀봉합니다. 광학 현미경으로 200x로 관찰하고 이미지를 수집합니다.
- 신장 조직의 말단 데옥시뉴클레오티딜트랜스퍼라제 매개 dUTP 흉단 라벨링(TUNEL) 염색 분석
- 5.3.1단계를 사용하여 단면을 파라핀화하고 탈수합니다. 면역조직화학 펜을 사용하여 조직 주위에 원을 그리고 각 샘플에 100μL의 Proteinase K 작업 용액을 적게씩 추가합니다. 37°C에서 20분 동안 배양하고 PBS 3x로 각각 5분 동안 세척한 다음 처리된 샘플을 젖은 상자에 보관하십시오.
- 섹션을 3% 과산화수소 용액에 넣고 10분 동안 배양한 다음 PBS 3x로 각각 5분 동안 세척합니다.
- 조직을 덮기 위해 원에 평형 완충액(100μL)을 적가롭게 추가하고 실온에서 20분 동안 배양합니다.
- 각 샘플에 50μL의 라벨링 작업 용액(평형 용액: 형광 라벨링 용액: TDT 효소 = 35μL:10μL:5μL)을 적가하고 37°C의 습식 상자에서 60분 동안 배양하고 빛으로부터 보호한 다음 PBS 3x로 각각 5분 동안 세척합니다.
- DAPI를 추가하고 빛 아래 실온에서 5 분 동안 DAPI로 배양하고 PBS 3x로 각각 5 분 동안 세척합니다.
- 절편을 흔든 건조시키고 항형광 담금질 실러로 밀봉한 후 200배의 형광 현미경으로 관찰하고 이미지를 수집합니다.
- 신장 조직의 전자 현미경 분석을 위한 시료 준비
- 2.5% 글루타르알데히드로 신장 조직을 4°C에서 2-4시간 동안 고정하고 PBS에서 각각 15분 동안 3회 세척합니다.
- 빛을 피하고 실온에서 오스뮴산(1%)을 2시간 동안 고정하고 PBS 3x로 각각 15분 동안 세척합니다.
- 아세톤과 임베딩제 Immerse를 사용하여 각각 2시간, 4시간, 8시간 동안 1:1, 1:2, 1:31 그래디언트에 담그면서 그라디언트 알코올 및 아세톤 탈수를 수행합니다. 그 후, 순수 포매제를 사용하고 밤새 37 °C에서 샘플을 포매딩합니다.
- 8시간 후, 내장된 플레이트를 60°C 오븐에 넣고 48시간 동안 중합합니다. 위에서 가공한 수지 블록을 초박형 슬라이서에서 슬라이스 두께를 60-80nm로 설정합니다. 구리 메쉬를 사용하여 슬라이스를 제거합니다.
- 2% 과산화수소 아세테이트와 알코올 용액을 사용하여 8분 동안 염색한 다음 70% 에탄올과 초순수를 3회 세척합니다. 2.6% 에탄올과 초순수로 세척하여 완성합니다.
- 투과 전자 현미경으로 이미지를 관찰하고 획득합니다.
- 정량적 실시간 중합효소연쇄반응(qRT-PCR) 분석 분석
- 마이크로 원심분리기 튜브에 냉동 신장 조직 20mg을 추가하고 조직 덩어리가 보이지 않을 때까지 고속 조직 분쇄기로 철저히 분쇄합니다.
- 15,984 x g 에서 10분 동안 원심분리 후 상층액을 수집합니다. 클로로포름 250μL를 넣고 튜브를 15초 동안 뒤집습니다. 용액이 완전히 혼합됩니다. 실온에서 3분 동안 그대로 두었다가 15,984 x g 에서 4°C에서 10분 동안 원심분리합니다.
- 상부 수성상을 수집하고 새로운 RNase Free 원심분리기 튜브로 옮깁니다. 동일한 부피의 70% 에탄올(RNase-free 물 제제)을 넣고 뒤집어 섞습니다.
- RNA 세척을 위해 수집 튜브에 적재된 흡착제 컬럼에 용액을 추가합니다. 버퍼 RW 세척 후 컬럼을 실온에서 5분 동안 건조시킵니다.
- 새로운 RNase-free 원심분리 튜브에 컬럼을 배치하고 컬럼 중앙에 RNase-free 물 30-50μL를 추가하고 실온에서 1분 동안 방치한 다음 15,984 x g에서 1분 동안 원심분리합니다. RNA 용액을 수집하여 -80°C에서 보관합니다.
- RNA 용액을 냉동고에서 제거하고 90°C에서 10분 동안 전변성시킨 후 95°C에서 15초, 60°C에서 35초, 72°C에서 25초 동안 40회 변성시킨 후 95°C에서 15초, 60°C에서 60초, 95°C에서 15초 순으로 최종적으로 용해시켰다(보충표 1).
- β-actin을 내부 참조로 사용하여 각 샘플의 Ct 값(ΔΔCt = 대상 유전자의 Ct 값 - 내부 참조 유전자의 Ct 값)을 기반으로 2¬-ΔΔCt 방법을 사용하여 WT-1 과 Nephrin 의 상대 발현을 계산합니다.30. 프라이머에 대한 자세한 정보는 표 3에 나와 있습니다.
- 웨스턴 블롯(WB) 분석
- 프로테아제 억제제:인산가수분해효소 억제제:RIPA= 1:1:100의 비율에 따라 용해물을 준비하고 마이크로 원심분리 튜브에 용해물 500μL를 첨가합니다.
- 마이크로 원심분리기 튜브에 냉동 신장 조직 100mg을 추가하고 눈에 보이는 조직 덩어리가 없을 때까지 고속 조직 분쇄기로 철저히 분쇄합니다.
- 마이크로 원심분리기 튜브를 제거하고 얼음에 30분 동안 용해한 다음 15,984 x g 에서 10분 동안 원심분리합니다. 상등액을 흡입하고 -80 °C에서 보관하십시오.
- 비신코닌산(BCA) 단백질 농도 분석 키트의 지침에 따라 단백질 농도를 검출하고 PBS 용액을 적가화하여 각 그룹에서 일관된 단백질 농도를 보장합니다.
- 마이크로 원심분리 튜브에 5x 단백질 업샘플링 버퍼를 추가하고, 100°C에서 15분 동안 배양하여 완전히 변성시킨 다음 냉각 후 제거합니다.
- 12.5% SDS-PAGE 젤 전기 이동법으로 단백질을, 첫째로 80 볼트를 사용하여, 모든 표본이 편평한 파란 선으로 눌러지는 원인이 되고, 그 후에 130 V에 전압을 조정하, bromophenol 파랑이 젤 판의 바닥에서 다 달아날 때까지, 분리하십시오. 전기영동을 중지합니다.
- 젤을 제거합니다. 여과지를 멤브레인 전달 버퍼로 적십니다. 메탄올의 폴리비닐리덴 플루오라이드(PVDF) 멤브레인을 30초 동안 활성화합니다. 그런 다음 멤브레인을 옮기는 데 사용되는 클립에 스폰지 메쉬/여과지/젤/PVDF 멤브레인/여과지/여과지/스폰지 메쉬의 순서로 모든 것을 정렬합니다.
- 겔을 음극에 놓고 PVDF 멤브레인을 양극에 놓고 200MA의 전류로 멤브레인을 90분 동안 전송합니다.
- PVDF 멤브레인을 제거하고 TBST로 5분 동안 한 번 세척합니다. 마개 용액을 실온에서 90분 동안 흔들면서 추가합니다. TBST로 3회씩 5분씩 세탁합니다.
- 1차 항체 PI3K(1:1000), PIK3CA(1:1000), AKT(1:1000), P-AKT(1:1000), BAD(1:1000), P-BAD(1:1000), BCL-2(1:1000), bax(1:4000) 및 c-caspase3(1:1000)를 추가하고31,32 냉장고에서 4°C의 습식 상자에 넣어 하룻밤 동안 배양합니다.
- 4°C 냉장고에서 PVDF 멤브레인을 제거하고 TBST 3x로 각각 5분 동안 세척합니다. 2차 항체(1:10,000)를 적가하고 37°C에서 90분 동안 배양한 후 TBST 3x로 각각 3분 동안 세척합니다.
- 비율(A: B=1:1)에 따라 현상 용액을 준비하고 지침에 따라 기계에서 현상합니다.
결과
KMF 구성 요소의 분석 결과
LC-MS/MS로 분석한 양이온 및 음이온 모드에서 각각 147개 및 120개의 화합물이 확인되었습니다(그림 1A-B). 일부 화합물 및 MF로 계산된 분자량, m/z 값, 머무름 시간 및 모 이온은 보충 표 2에 나와 있습니다.
KMF는 MN 쥐의 지질 대사 장애와 간 및 신장 손상을 개선했습니다.
SD 랫과 C-BSA를 사용하여 MN 모델을 구축했습니다. C-BSA의 꼬리 정맥 주사 1주일 후, MN 쥐는 다양한 정도의 정신적 피로, 식욕 감소, 느린 성장, 둔한 머리 색깔, 푹신한 털, 지연 반응 및 체중 감소를 보였으며 일부 쥐는 음낭 부종을 발병했습니다. 투여 4주 후, KMF의 다양한 용량은 24시간 총 요단백(24h-UTP), Scr 및 BUN의 발현 수준을 유의하게 감소시켜 신장 기능을 향상시켰습니다(그림 2A-C). ALT 및 AST 발현 수준이 감소하고 TP 및 ALB 발현 수준이 증가하여 간 기능이 향상됩니다(그림 2D-G). TC 및 TG의 발현 수준을 감소시키고 지질 조절 기능을 개선했습니다(그림 2H-I). 이러한 결과는 KMF가 신장 기능에 보호 효과가 있음을 시사합니다. 그러나 구체적인 작용 기전은 아직 명확하지 않습니다.
KMF는 MN 쥐에서 신장 조직의 조직병리학적 손상을 개선합니다.
KMF가 MN 쥐의 신장 손상을 개선할 수 있는지 여부를 테스트하기 위해 H&E, PAS, Masson 및 IF를 사용하여 신장 조직의 조직병리학적 손상을 감지했습니다. H&E 및 PAS 염색은 MOD 그룹에서 사구체 비대, 중간막 세포의 경미한 증식, 신장 세뇨관 확장 및 신장 세뇨관 상피 세포의 액포 변성을 보여주었습니다(그림 3A). Masson 염색은 MOD 그룹에서 신장 섬유증 면적이 크게 증가한 것으로 나타났습니다(그림 3B-C). 면역형광은 MOD 그룹에서 IgG 및 C3의 상대 형광 강도가 CON 그룹보다 유의하게 높다는 것을 보여주었습니다(그림 3D-F). KMF, BEN 또는 PI3K 억제제+KM-M을 투여한 후 사구체 비대 정도와 묶인 세포의 증식 정도가 감소하고 신장 섬유증 면적이 현저히 감소했으며 IgG 및 C3의 상대 형광 강도가 현저히 낮아졌습니다. 이러한 결과는 KMF가 MN 쥐의 신장 병리학적 손상을 완화할 수 있음을 나타냅니다.
KMF는 PI3K/AKT 신호 경로를 활성화하여 포도사이트 손상을 완화합니다.
MN에서 주요 podocytes의 손상은 여기에 설명된 방법, 즉 IHC, PCR, TUNEL 및 TEM을 사용하여 관찰되었습니다. IHC 및 PCR 결과는 CON 그룹에 비해 MOD 그룹이 포도사이트 특이적 및 기능적 마커 단백질인 WT-1 및 Nephrin의 발현 수준이 현저히 감소하여 포도사이트 손상을 나타내는 반면, KMF 처리는 WT-1, Nephrin의 발현 수준을 증가시키고 포도사이트 손상을 완화하는 것으로 나타났습니다(그림 4A-E). TUNEL 염색 결과는 MOD 그룹에서 podocytes의 심각한 apoptosis를 보여주었으며, KMF 처리는 형광 강도를 현저히 감소시키고 apoptosis의 발생률을 감소시켰습니다(그림 4F-G). TEM 결과는 MOD 그룹에서 사구체의 기저막이 상당히 불균일하게 두꺼워졌으며 podocytes의 미토콘드리아는 심한 팽창, 희박한 기질 및 기질의 빈 폭격을 보였으며 cristae가 감소하거나 부재하는 것으로 나타났습니다. KMF를 투여한 후, 사구체 기저막의 두꺼워짐이 현저히 감소하였고, podocyte 미토콘드리아의 형태가 유의하게 회복되었습니다(그림 4H). 이러한 결과는 KMF가 MN 쥐의 포도사이트 손상을 완화할 수 있음을 나타냅니다.
WB에 의한 PI3K/AKT 신호전달 경로 관련 단백질26,27의 발현에 대한 추가 검출은 CON 그룹에 비해 MOD 그룹이 PI3K, PIK3CA, AKT, P-AKT, BAD, BAX 및 C-caspase3의 발현 수준이 유의하게 증가한 반면 P-BAD 및 BCL-2의 발현 수준은 현저히 감소한 것으로 나타났습니다. KMF 처리는 PI3K, PIK3CA, AKT, P-AKT, BAD, BAX 및 C-caspase3의 발현 수준을 감소시키는 반면, P-BAD 및 BCL-2의 발현 수준은 증가시킵니다(그림 4I-J). 이러한 결과는 KMF가 PI3K/AKT 신호 경로를 활성화하여 MN 쥐의 포도사이트 손상을 개선할 수 있음을 나타냅니다.
전사체학을 기반으로 MN에 대한 KMF 치료의 가능한 메커니즘 탐색
MN 치료에 있어 KMF의 표적 및 잠재적 기전을 추가로 밝히기 위해 TMT(Tandem Mass Tag)를 기반으로 전사체 분석을 수행했습니다. 그 결과, CON과 MOD 그룹 사이에는 898개의 차등 발현 유전자(DEG)가 있는 것으로 나타났으며, 이 중 372개는 상향 조절된 유전자와 526개의 하향 발현 유전자는 포함되었습니다(그림 5A-B). 마찬가지로, KM-L과 MOD 그룹 사이에는 202개의 상향 조절 유전자와 158개의 하향 조절 유전자를 포함하여 360개의 DEG가 있었습니다(그림 5C-D). 영향을 받을 수 있는 유전자 및 신호 경로를 확인하기 위해 유전자 온톨로지(GO) 및 KEGG(Kyoto Encyclopedia of Genes and Genomes) 농축 기능 분석을 수행했습니다(그림 5E-H). 그 결과, DEG의 생물학적 과정은 주로 세포 과정과 생물학적 조절에 초점을 맞추는 반면, DEG의 기능은 주로 CAMP, PPAR, PI3K-AKT 및 p53 신호 경로와 같은 신경활성 리간드-수용체 상호 작용에 초점을 맞추는 것으로 나타났습니다. 이러한 결과는 KMF가 실험에서 검증된 PI3K/AKT 신호 경로와 함께 이러한 신호 경로에 영향을 미쳐 MN을 치료할 수 있음을 시사합니다. 마지막으로, 단백질-단백질 상호 작용(PPI) 네트워크를 구성하기 위해 학위 값 순으로 상위 100°C를 선택했습니다(그림 5I-J).
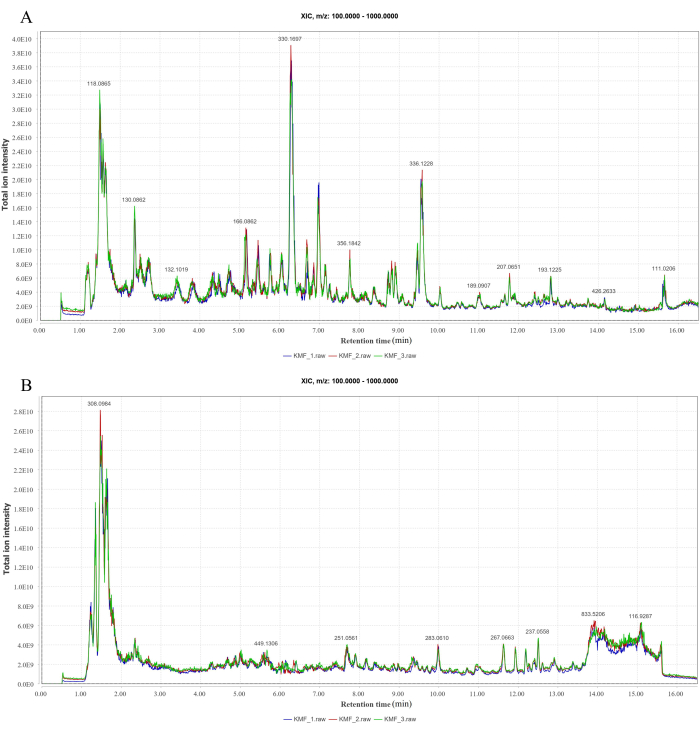
그림 1: LC-MS/MS 피크 이온 크로마토그램. (A) 양이온 모드. (B) 음이온 모드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
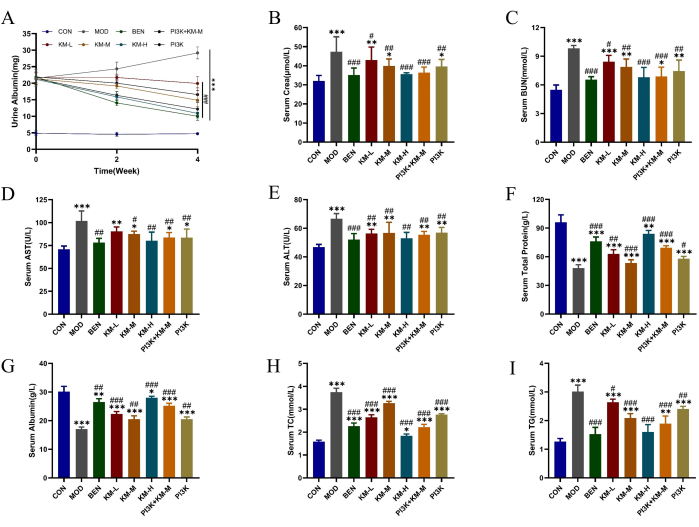
그림 2: KMF는 MN 쥐에서 지질 대사 장애와 간 및 신장 손상을 개선합니다.(A-C) 24시간 소변 알부민, 혈청 Cera 및 혈청 BUN을 포함한 Kemeng Fang이 신장 기능에 미치는 영향. (민주당) Kemeng Fang이 간 기능에 미치는 영향에는 알라닌 아미노전이효소(ALT), 아스파르테이트 트랜스아미나제(AST), 총 단백질 및 혈청 알부민이 포함됩니다. (H-I) Kemeng Fang이 트리글리세리드(TG) 및 총 콜레스테롤(TC)을 포함한 혈중 지질 대사 조절에 미치는 영향. 데이터는 T-test에서 일원 분산 분석을 사용하여 3-6개의 독립 표본의 평균± 표준 편차로 표현되며, 빈 그룹 *p<0.05, **p<0.01, ***p<0.001과 비교하고, 모델 그룹 #p < 0.05, ##p < 0.01, ###p < 0.001과 비교합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
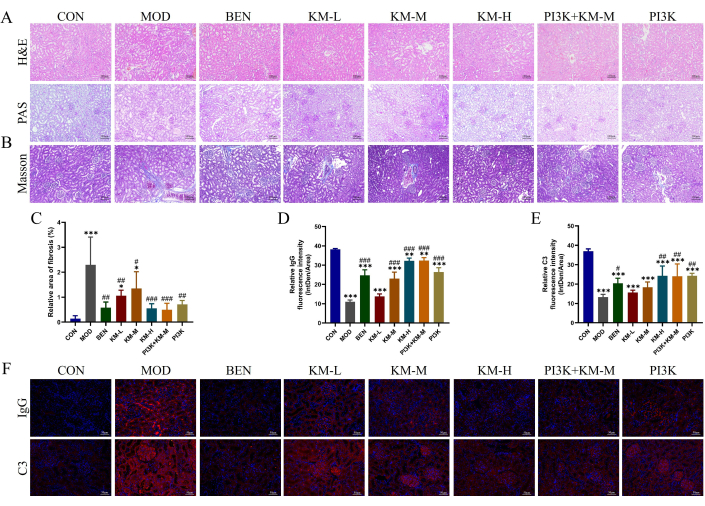
그림 3: Kemeng Fang은 MN 쥐의 신장에 대한 조직병리학적 손상을 개선합니다. (A) H&E 및 PAS를 포함한 신장 조직학적 검사(200회). (BC) Masson 염색 및 Image J 소프트웨어를 사용한 신장 섬유증(파란색 콜라겐 섬유) 상대 면적의 반정량 분석. (D-F) IF 및 Image J 소프트웨어를 사용하여 신장 조직에서 IgG 및 C3의 상대 형광 강도(Intden/Area, 여기서 Intden은 총 지역 형광 강도, 영역은 지역 영역)의 반정량 분석. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
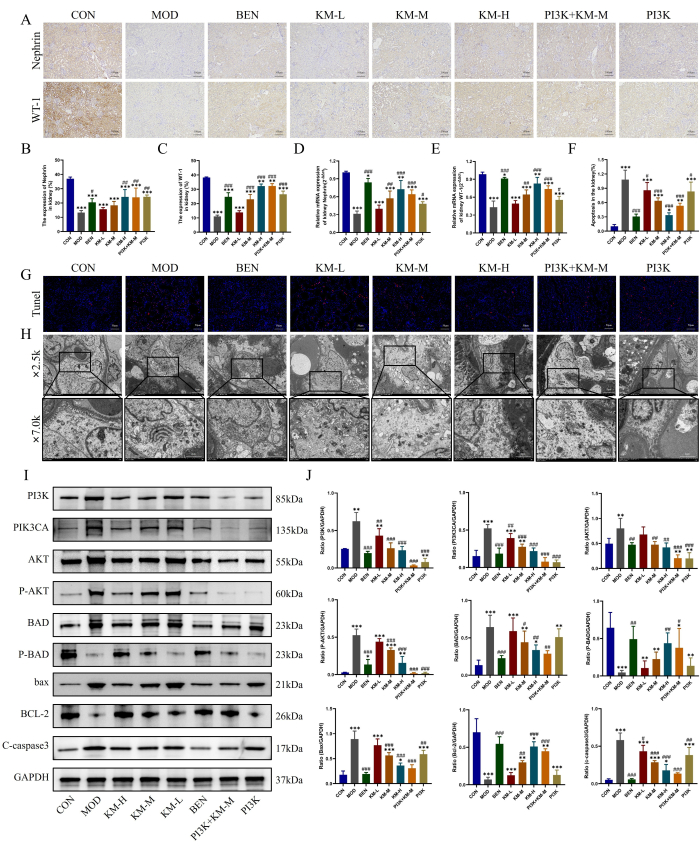
그림 4: Kemeng Fang은 PI3K/AKT 신호 경로를 활성화하여 포도사이트 손상을 완화합니다.(A-C) IHC는 신장 조직에서 두 개의 포도사이트 마커 단백질인 WT-1 및 Nephrin의 상대적 발현 수준을 검출하는 데 사용되었습니다. (D-E) 신장 조직에서 두 개의 podocyte 마커 단백질인 WT-1 및 Nephrin의 상대 mRNA 발현에 대한 PCR 검출. (F-G) TUNEL 염색은 신장 조직에서 세포사멸의 발생률을 감지하는 데 사용되었습니다. (H) TEM(2,500x, bar=5 μM, 7,000x, bar=2 μM)을 이용한 사구체 기저막 및 포도카이트 미토콘드리아 구조 관찰. (나-제이) 신장 조직에서 PI3K, PIK3CA, AKT, P-AKT, BAD, P-BAD, BCL-2, bax 및 C-caspase3의 상대 단백질 발현 수준에 대한 WB 검출. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
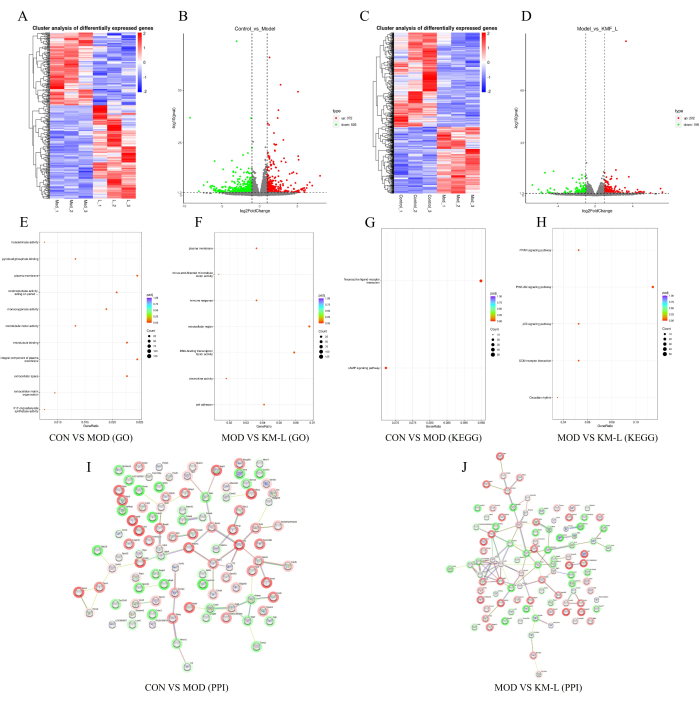
그림 5: 전사체학을 기반으로 MN을 치료하는 Kemeng Fang의 가능한 메커니즘 탐색.(A-B) CON과 MOD 그룹 간의 차등 유전자 히트맵 및 화산 플롯, 파란색은 하향 조절을 나타내고 빨간색은 상향 조절을 나타냅니다. (C-D) MOD와 KM-L 그룹 간의 차등 유전자 히트맵과 화산 플롯, 파란색은 하향 조절을 나타내고 빨간색은 상향 조절을 나타냅니다. (E) CON과 MOD 그룹 간의 GO 강화. (F) MOD와 KM-L 그룹 간의 GO 강화. (G) CON과 MOD 그룹 간의 KEGG 농축. (H) MOD와 KM-L 그룹 간의 KEGG 농축. (I) CON과 MOD 그룹 간에 차등적으로 발현된 상위 100개 유전자의 단백질-단백질 상호 작용(PPI) 차트. (J) MOD와 KM-L 그룹 간의 상위 100도 값의 PPI 차트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 아니요. | 중국어 이름 | 라틴어 이름 | 가족 | 사용된 부품 | 투여량(g) |
| 1 | 당셴 (DS) | Codonopsis pilosula (프랜치) 난프. | 캄파눌레이스과 | 뿌리 | 20 |
| 2 | 황치(HQ) | 황기 membranaceus (Fisch.) 번지. | 레구미노사과 | 뿌리 | 30 |
| 3 | 황롄 (HL) | 콥티스 키넨시스 프랜치. | 라눈큘라과(Ranunculaceae) | 뿌리와 괴경 | 3 |
| 4 | 수예 (SY) | Perilla frutescens (L.) 브릿 | 라비아타에 | 잎 | 6 |
| 5 | 수디황(SDH) | 지황 glutinosa (Gaertn.) 직류. | Scrophulariaceae | 뿌리와 괴경 | 15 |
| 6 | 촨슝 (CX) | Ligusticum chuanxiong Hort. | 움벨리페래과 | 뿌리와 괴경 | 15 |
| 7 | 첸스(QS) | 에우리얄 페록스 살리스브. | 님프파과(Nymphaeaceae) | 씨 | 15 |
| 8 | 친펑텡 (QFT) | 사비아 자포니카 격언. | 사비과(Sabiaceae) | 뿌리, 괴경 및 잎 | 10 |
| 9 | 우베이쯔 (WBZ) | 루스 키넨시스 방앗간. | 과심기과 | 잎 | 3 |
| 10 | 반뱌니안(BBL) | 로벨리아 키넨시스 라우다. | 캄파눌레이스과 | 괴경과 잎 | 15 |
| 11 | 바이후아셰셰카오(BHSSC) | 올덴란디아 디푸사 (Willd.) 록스비. | 루비과(Rubiaceae) | 괴경과 잎 | 15 |
표 1: Kemeng Fang(KMF)의 구성.
| 항체 | 희석 배수 |
| 이그지(IgG) | 1:100 |
| C3 | 1:100 |
| WT-1 | 1:200 |
| 네프린 | 1:100 |
| 파이3K | 1:1000 |
| PI3K3CA | 1:1000 |
| AKT (한국어판) | 1:1000 |
| P-AKT | 1:1000 |
| 나쁘다 | 1:1000 |
| P-나쁜 | 1:1000 |
| BCL-2 (영어) | 1:1000 |
| 백스 | 1:4000 |
| C-카스파제3 | 1:1000 |
| 갭디(GAPDH) | 1:1000 |
표 2: 항체 희석 배수.
| 유전자 | 입문서 | 시퀀스 (5'-3') | PCR 제품 | |
| 쥐 GAPDH | 전달 | 아카그트 | 253 bp | |
| 후진 | TTTGAGGGTGCAGCGAACTT | |||
| 쥐 WT-1 | 전달 | 아 | 209 bp | |
| 후진 | TGGGTACGCACACATGAAAGG | |||
| 랫 네프린 | 전달 | CGGAGAACAAGAACGTGACC | 177 bp | |
| 후진 | ATTGTCTTCTCTCCGCACCA | |||
표 3: qRT-PCR 프라이머의 상세 정보.
보충 표 1: PCR 반응. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 2: 대사 산물 식별의 정량적 목록. ID: 1차 분자량 일련 번호; 이름: 식별 결과; Mz: 질량 대 핵 비율; Rt: 머무름 시간(S); 정확한 질량 : 정확한 분자량; Ppm: ppm으로 측정된 검출된 분자량과 이론적 분자량 사이의 오차; precursor_type: 이온화 모드, [M+H]+는 양이온 모드, [M-H]-는 음이온 모드입니다. class: HMDB 데이터베이스의 삼중 분류; sub_class: HMDB 데이터베이스의 4단계 분류; KEGG: KEGG 화합물 번호; KEGG_Pathway: KEGG 신호 경로; CAS: Chemical Abstracts Service 등록 번호; HMDB: HMDB 데이터베이스 번호; 라이브러리: 데이터베이스; 공식: 이론적인 분자 공식; KEGG: KEGG 화합물 번호; 라이브러리: 데이터베이스; 수준: 대사 산물 식별 수준; pos: 양이온 모드; 네그: 음이온 모드; KMF_1/2/3: 세 가지 실험의 총 이온 강도. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
본 연구는 KMF의 약리학적 효과를 관찰하고 MN 랫트 포도세포의 세포사멸을 억제하는 KMF의 구체적인 기전을 탐구하는 것을 목표로 했습니다. 첫째, KMF가 PI3K/AKT 신호전달 경로를 활성화하여 podocyte apoptosis를 완화하고 MN 진행을 지연시킬 수 있음을 in vivo 에서 입증했습니다. 둘째, 전사체 결과는 KMF가 PPAR, PI3K/AKT 및 p53 신호 경로, ECM 수용체 상호 작용 등을 통해 효과를 발휘할 수 있음을 보여주었습니다. 그 중 PI3K/AKT 신호전달 경로는 실험에서 검증되었습니다. 이러한 발견은 MN 환자를 위한 잠재적 치료 옵션으로서 KMF의 임상적 사용에 대한 과학적 근거를 제공할 수 있습니다.
연구에 따르면 podocyte apoptosis는 MN의 점진적인 진행으로 이어지는 핵심 요인 중 하나입니다. 또한, MN은 podocytes의 분열 및 증식 능력을 제한합니다. 결과적으로, 일단 손상되거나 손실되면 이 후유증은 신장 기능에 심각한 영향을 미칩니다. 교모세포종을 완전히 덮을 수 없을 정도로 podocytes의 수가 감소하면 GBM이 완전히 노출되어 Bowman's capsule에 부착되어 사구체 모세혈관 루프의 압박 또는 붕괴를 유발하여 궁극적으로 MN이 ESRD 33,34,35,36으로 발달하도록 촉진합니다. 따라서 podocyte apoptosis의 특정 메커니즘과 podocyte apoptosis를 차단하거나 억제하는 방법에 대한 추가 연구가 MN의 진행을 지연시키는 열쇠입니다. 연구에 따르면 PI3K/AKT 신호전달 경로는 세포 사멸, 산화 스트레스 및 염증 반응을 조절하는 데 여러 기능을 가지고 있으며 MN의 발생 및 발달에 중요한 조절 역할을 합니다. WT-1 및 Nephrin은 podocytes에서 발현되는 공극 막 단백질로, 공극 막의 정상적인 구조와 기능을 유지하는 데 중요한 역할을 할 뿐만 아니라 PI3K/AKT 의존 신호 경로를 시작하고 podocyte 신호에 참여합니다. 이러한 단백질의 발현 수준의 감소는 종종 podocytes 37,38,39의 손상을 나타냅니다.
PI3K는 조절 소단위체 p85와 촉매 소단위 p110으로 구성된 이량체로, 다양한 성장 인자 및 복합체에 의해 활성화될 수 있습니다. 이는 이 경로의 핵심이자 시작 요인이다40. PIK3CA 유전자는 3번 염색체에 위치하며 총 20개의 엑손을 가지고 있습니다. 주요 기능은 PI3K 효소의 촉매 소단위 중 하나인 p110 α 단백질을 암호화하는 것입니다. 따라서, PIK3CA의 변화는 PI3K 효소가 지속적인 활성화 상태를 유지하게 할 수 있다41. PI3K가 활성화되면, 두 번째 메신저인 PIP3는 다운스트림 AKT 신호전달 경로를 생성하고 지속적으로 자극하는 반면, p-AKT는 pro-apoptotic 분자인 Bad의 인산화를 촉진하여 Bad의 pro-apoptotic 복합체를 Bcl-2 및 Bcl-xL과 해리하고, 세포질의 14-3-3 단백질과 복합체를 형성하여 pro-apoptotic 기능을 상실합니다. 항세포사멸 분자인 BCL-2 및 Bcl-xL은 완전히 해리될 수 있으며 podocyte apoptosis에 억제 효과를 발휘할 수 있습니다42,43. 카스파제-3(Caspase-3)는 세포자멸사(cell apoptosis)의 실행 단계에서 핵심적인 역할을 하는 프로테아제(protease)로, 궁극적으로 DNA 복구 효소 PARP를 작은 단편으로 절단하여 세포 자멸사(cell apoptosis)를 유발합니다44. pro-apoptotic 단백질 Bad에 의해 미토콘드리아에서 세포질로 cytochrome c 방출을 유도하는 것은 caspase를 활성화하는 핵심 단계이며, 14-3-3 단백질에 결합하는 P-Bad 복합체는 이 과정을 억제하여 apoptotic cascade 45,46,47의 발생을 방지합니다.
전사체 결과는 MN에 대한 KMF 치료가 PI3K/AKT, PPAR 및 p53 신호 경로와 밀접한 관련이 있음을 나타냅니다. WB 분석을 통해 PI3K/AKT 신호 경로를 검증했습니다. 실험 결과는 MN 쥐에서 PI3K/AKT 신호 경로가 유의하게 억제된 반면, KMF는 PI3K/AKT 신호 경로를 유의하게 활성화하여 pro-apoptotic 분자 Bad 및 Bax의 생성을 감소시키고 anti-apoptotic 분자 BCL-2의 생성을 촉진하여 podocyte 열공 막 단백질인 WT-1 및 Nephrin의 발현 수준을 증가시킬 수 있음을 보여주었습니다. podocyte apoptosis의 발병률을 줄입니다. 따라서 KMF는 PI3K/AKT 신호경로를 활성화하여 podocyte apoptosis를 감소시키며 MN 모델 쥐에 대한 보호 효과가 있는 것으로 밝혀졌습니다.
그러나 이 연구에는 몇 가지 제한 사항이 있습니다. 첫째, 본 연구는 인체외 세포 실험과 그 메커니즘에 대한 심층적인 탐구를 통해 검증할 필요가 있는 생체 내 동물 실험 수준에서만 KMF의 podocyte apoptosis 억제 메커니즘을 탐구했습니다. 둘째, 포도사이트 손상은 자가포식, 면역 염증 및 파이롭토시스와도 밀접한 관련이 있으며, KMF가 자가포식, 면역 염증 및 파이롭토시스를 조절하여 MN에 영향을 미칠 수 있는지 여부에 대한 추가 연구가 필요합니다48,49.
PPAR 계열(PPAR α, PPAR β/δ, PPAR γ)은 리간드 활성화에 의존하는 핵 호르몬 수용체로 에너지 대사 참여, 세포 자멸사 조절 및 염증 반응50,51 과 같은 중요한 기능을 가지고 있습니다. 이들은 레티노산 X 수용체(RXR)와 이질이합체화를 형성하여 유전자 전사에 영향을 미치며, 여기서 PPAR γ 둘 다 염증 인자 NF-κB를 조절합니다. B 활성화의 핵심은 podocytes를 손상 52,53,54로부터 보호하는 기능에 있습니다. 여러 연구에 따르면 PPAR γ작용제(예: 피오글리타존)는 저혈당 효과와 무관하게 신장 보호 효과가 있으며, 다양한 신장 질환 동물 모델에서 포도사이트를 손상으로부터 직접 보호하고 단백뇨 및 사구체 손상을 감소시키는 것으로 나타났습니다 55,56,57,58,59. PPAR이 Caspase-360의 활성화를 억제함으로써 podocyte apoptosis를 감소시킬 수 있음을 나타내는 보고서도 있습니다. 최신 연구에 따르면 새로운 유형의 PPAR γ인 선택적 조절인자인 GQ-16이 단백뇨 및 신증후군 관련 합병증을 줄이는 데 TZD보다 더 효과적이며, 이는 신장 질환 치료에 새벽을 가져다 줍니다61. KMF는 PI3K/AKT 신호전달 경로를 활성화하여 MN rat podocytes의 세포사멸에 대한 보호 효과가 있습니다. 신장에서 PPAR 신호 경로의 중요한 역할을 기반으로 향후 KMF, PPAR 및 MN 간의 관계에 대한 보다 심층적인 연구가 필요합니다.
공개
모든 저자는 선언할 이해 상충이 없습니다.
감사의 말
이 연구는 길림성 자연과학재단(No.YDZJ202301ZYTS145과 No. YDZJ202301ZYTS208).
자료
| Name | Company | Catalog Number | Comments |
| 2-Amino-3-(2-chloro-phenyl)-propionic acid | Aladdin | 103616-89-3 | |
| 30% H2O2 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10011218 | |
| 812 embedding agent | SPI | 90529-77-4 | |
| Acetone | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000418 | |
| Acetonitrile | Thermo | 75-05-8 | |
| Ammonia | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10002118 | |
| Ammonium formate | Sigma | 540-69-2 | |
| Analytical balance | Changzhou Lucky Electronic Equipment Co., Ltd | FA | |
| Anhydrous ethanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10009218 | |
| Anti fluorescence quenching and sealing agent | southernbiotech | 0100-01 | |
| Automatic biochemical analyzer | Rayto Life and Analytical Sciences | Chemray240 | |
| BCA Protein Assay Kit | Solarbio | PC0020 | |
| Benazepril hydrochloride tablets | Xinya Minhang | H20044840 | |
| Blender | Kylin-Bell | BE-2600 | |
| Brick and stone cutting blade | Daitome | Ultra45 | |
| BSA | ZSGB-BIO | ZLI-9027 | |
| Buffer RW | Beijing Baiao Leibo | WK191 | |
| Carbodiimide hydrochloride | Hubei Xinghengye Technology | 25952-53-8 | |
| Cell apoptosis detection kit | Elabscience | E-CK-A322 | |
| Chemiluminescence imaging system | Hangzhou Shenhua Technology Co., Ltd | SH-523 | |
| Chloroform | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10006818 | |
| Constant temperature drying oven | Thermo Fisher | Heto PowerDiy LL3000 | |
| Cover glass slide | Jiangsu Shitai Experimental Equipment Co., Ltd | 10212450C | |
| CY3 Conjugated AffiniPure Goat Anti-rabbit IgG (H+L) | BOSTER | BA1032 | |
| DAB reagent kit | Servicebio | G1212-200T | |
| DAPI | Blue Cloud Sky | C1002 | |
| Decolorization shaker | Wuhan Lingsi Biotechnology Co., Ltd | TSY-B | |
| Dehydration machine | Wuhan Junjie Electronics Co., Ltd | JJ-12J | |
| DL2000 DNA Marker | TIANGEN | MD114 | |
| DMSO | MCE | HY-Y0320 | |
| dNTP | TIANGEN | CD117 | |
| EBlot L1 Rapid Wet Rotation Instrument | Kingsray Biotechnology Co., Ltd | L00686C | |
| ECL substrate solution | affinity | KF8003 | |
| Electric constant temperature water bath pot | Fisaff Instrument (Hebei) Co., Ltd | DK-20000-IIIL | |
| Electrophoresis instrument power supply | Beijing Longfang Technology Co., Ltd | LF-600S | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd | JB-P5 | |
| Equilibrium buffer | Wuhan Lingsi Biotechnology Co., Ltd | E8090 | |
| Ethylenediamine | Ruichengkang Pharmaceutical Technology | 107-15-3 | |
| FA series multifunctional analytical electronic balance | Changzhou Lucky Electronic Equipment Game Company | FA1204 | |
| Filter membrane | Jinteng | Nylon6-0.22μm | |
| Formaldehyde solution | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10010018 | |
| Formic acid | TCI | 64-18-6 | |
| Freezing centrifuge | Xiangyi | H1850-R | |
| Frozen platform | Wuhan Junjie Electronics Co., Ltd | JB-L5 | |
| Glacial acetic acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000218 | |
| Glass bead | Sigma | G8772-500G | |
| Glass slide | Nantong Meiweide Life Science Co., Ltd | PC2-301 | |
| glycine | Biofroxx | 30166428 | |
| Hematoxylin | Wuhan Lingsi Biotechnology Co., Ltd | G1140 | |
| High speed refrigerated centrifuge | Hunan Kecheng Instrument Equipment Co., Ltd | H1-16KR | |
| Horizontal agarose electrophoresis tank | Long Fang | LF-31DS | |
| Horizontal shaker | Jiangsu Haimen Qilin Bell Instrument Manufacturing Co., Ltd | TS-1 | |
| HRP Conjugated AffiniPure Goat Anti-rabbit IgG (H+L) | BOSTER | BA1054 | |
| hydrochloric acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10011028 | |
| Imaging system | Nikon | Nikon DS-U3 | |
| Incomplete Freund's adjuvant | MCE | ISA-51 | |
| Intelligent digital magnetic heating stirrer | Hangzhou Miou Instrument Co., Ltd | TP-350E+ | |
| Isoflurane | Sigma | 26675-46-7 | |
| Isopropanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 80109218 | |
| KCl | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10020318 | |
| KH2PO4 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 1115GR500 | |
| Liquid chromatograph | Thermo | IQLAAAGABHFAPUMBJC | |
| marker(10-250KD) | Mei5bio | MF028-plus-01 | |
| marker(20-120KD) | GenScript | M00521 | |
| Mass spectrometer | Thermo | IQLAAEGAAPFALGMBDK | |
| Masson staining kit | BASO | BA4079B | |
| Methanol | Thermo | 67-56-1 | |
| microscope | Nikon | ECLIPSE Ci | |
| microwave oven | Galanz Microwave Oven Electrical Appliance Co., Ltd | P70D20TL-P4 | |
| Multi sample tissue grinder | Shanghai Jingxin Industrial Development Co., Ltd | Tissuelyser-24L | |
| Multiskan FC ELISA reader | Thermo scientific | 1410101 | |
| Na2HPO4.12H2O | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10017618 | |
| NaCl | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000218 | |
| Neutral resin | Wuhan Lingsi Biotechnology Co., Ltd | G8590 | |
| Normal Goat Serum | Solarbio | SL038 | |
| Organizational spreading machine | Zhejiang Jinhua Kedi Instrument Equipment Co., Ltd | KD-P | |
| Osmic acid | Ted Pella Inc | 18450 | |
| oven | Shanghai Huitai Instrument Manufacturing Co., Ltd | DHG-9140A | |
| Palm centrifuge | Wuhan Lingsi Biotechnology Co., Ltd | D1008E | |
| Paraformaldehyde | Solarbio | P1110 | |
| PAS staining kit | BASO | BA4114B | |
| Pathological slicer | Shanghai Leica Instrument Co., Ltd | RM2016 | |
| PBS | Solarbio | P1020 | |
| PCR instrument | Hangzhou Miou Instrument Co., Ltd | PR-96 | |
| PH meter | Sedolis Scientific Instruments (Beijing) Co., Ltd | PB-10 | |
| PH meter | Sedolis Scientific Instruments (Beijing) Co., Ltd | 2018C132-11 | |
| PI3K inhibitor LY294002 | MCE | HY-10108 | |
| Pipette gun | Dragon | KE0003087/KA0056573 | |
| Protein phosphatase inhibitor complex | Meilunbio | MB12707-1 | |
| PVDF membrane (0.22 μm) | Solarbio | ISEQ00010 | |
| PVDF membrane (0.45 μm) | Solarbio | YA1701 | |
| Quick primary/secondary antibody diluent | Solarbio | A1811 | |
| Rabbit anti-AKT | Affinity | AF0836 | |
| Rabbit anti-BAD | Affinity | AF6471 | |
| Rabbit anti-C3 | Affinity | DF13224 | |
| Rabbit anti-GAPDH | Hangzhou Xianzhi | AB-P-R 001 | |
| Rabbit anti-IgG | CST | 3900S | |
| Rabbit anti-Nephrin | bioss | bs-10233R | |
| Rabbit anti-P-AKT | Affinity | AF0016 | |
| Rabbit anti-p-BAD | invitrogen | PA5-105023 | |
| Rabbit anti-PI3K | Affinity | AF6241 | |
| Rabbit anti-PIK3CA | Bioss | Bs-2067R | |
| Rabbit anti-WT-1 | Affinity | DF6331 | |
| Real-Time PCR System | ABI | QuantStudio 6 | |
| RIPA Lysis Buffer | Meilunbio | MA0151 | |
| SDS | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10019318 | |
| Slide and cover glass | Jiangsu Shitai Experimental Equipment Co., Ltd | 10212432C | |
| Super pure water instrument | Zhiang Instrument (Shanghai) Co., Ltd | Clever-S15 | |
| SYBR Green Master Mix | VAZYME | Q111-02 | |
| Taq Plus DNA Polymerase | TIANGEN | ET105-02 | |
| Tissue grinder | Beautiful Wall | MB-96 | |
| Transmission electron microscope | HITACHI | HT7800/HT7700 | |
| Tris-base | Biofroxx | 10019318 | |
| Trizol | Ambion | 15596-026 | |
| TUNEL Cell Apoptosis Detection Kit (FITC) | Beijing Baiao Leibo | SY0475 | |
| Tween 20 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 30189328 | |
| Ultra micro UV visible spectrophotometer | Hangzhou Miou Instrument Co., Ltd | ND-100 | |
| Ultra thin slicer | Leica | Leica UC7 | |
| Ultrasonic cleaner | shumei | KQ- 800DE | |
| Upright optical microscope | Nikon | Nikon Eclipse CI | |
| Urinary Protein Test Kit | Nanjing Jiancheng Bioengineering Research Institute | C035-2 | |
| Vertical electrophoresis tank | Beijing 61 Instrument Factory | DYCZ-24DN | |
| Vortex mixer | Wuhan Lingsi Biotechnology Co., Ltd | MX-F | |
| Western Blocking Buffer | Solarbio | SW3010 | |
| xylene | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10023418 |
참고문헌
- McQuarrie, E. P., Mackinnon, B., Stewart, G. A., Geddes, C. C., Registry, S. R. B. Membranous nephropathy remains the commonest primary cause of nephrotic syndrome in a northern European Caucasian population. Nephrol Dial Transplant. 25 (3), 1009-1011 (2010).
- Ronco, P. H., Debiec, H. Pathophysiological advances in membranous nephropathy: time for a shift in patient's care. Lancet. 385 (9981), 1983-1992 (2015).
- Xu, X., et al. Long-term exposure to air pollution and increased risk of membranous nephropathy in China. J Am Soc Nephrol. 27 (12), 3739-3746 (2016).
- Fogo, A. B., Lusco, M. A., Najafian, B., Alpers, C. E. AJKD atlas of renal pathology: Membranous nephropathy. Am J Kidney Dis. 66 (3), e15-e17 (2015).
- Li, X., Zhang, X. Comments on the 2021 Kidney Disease: Improving Global Outcomes (KDIGO) clinical practice guideline for anticoagulant therapy in patients with membranous nephropathy. Kidney Int. 101 (1), 186-187 (2022).
- Ruggenenti, P., Fervenza, F. C., Remuzzi, G. Treatment of membranous nephropathy: time for a paradigm shift. Nat Rev Nephrol. 13 (9), 563-579 (2017).
- Klomjit, N., Fervenza, F. C., Zand, L. Successful treatment of patients with refractory PLA2R-associated membranous nephropathy with Obinutuzumab: A report of 3 cases. Am J Kidney Dis. 76 (6), 883-888 (2020).
- Podestà, M. A., Ruggiero, B., Remuzzi, G., Ruggenenti, P. Ofatumumab for multirelapsing membranous nephropathy complicated by rituximab-induced serum-sickness. BMJ Case Rep. 13 (1), e232890-e232896 (2020).
- Stehlé, T., et al. Anti-CD38 therapy for PLA2R-positive membranous nephropathy resistant to conventional immunosuppression. Kidney Int. 101 (2), 416-418 (2022).
- Trimarchi, H., Coppo, R. Podocytopathy in the mesangial proliferative immunoglobulin A nephropathy: new insights into the mechanisms of damage and progression. Nephrol Dial Transplant. 34 (8), 1280-1285 (2019).
- Kopp, J. B., et al. Podocytopathies. Nat Rev Dis Primers. 6 (1), 68-72 (2020).
- Hoxha, E., Reinhard, L., Stahl, R. A. K. Membranous nephropathy: new pathogenic mechanisms and their clinical implications. Nat Rev Nephrol. 18 (7), 466-478 (2022).
- Chiou, T. T., et al. Rapamycin attenuates PLA2R activation-mediated podocyte apoptosis via the PI3K/AKT/mTOR pathway. Biomed Pharmacother. 144 (8), 112349-112356 (2021).
- Chen, J., et al. Danshen injection induces autophagy in podocytes to alleviate nephrotic syndrome via the PI3K/AKT/mTOR pathway. Phytomedicine. 107 (7), 154477-154489 (2022).
- Wang, Y., et al. Fangji Huangqi decoction ameliorates membranous nephropathy through the upregulation of BNIP3-mediated mitophagy. J Ethnopharmacol. 324 (13), 117734-117743 (2024).
- Wei, L., et al. Shenqi granule upregulates CD2AP and α-actinin4 and activates autophagy through regulation of mTOR/ULK1 pathway in MPC5 cells. J Ethnopharmacol. 303 (16), 115942-115954 (2023).
- Wang, P., et al. A review of the botany, phytochemistry, traditional uses, pharmacology, toxicology, and quality control of the Astragalus memeranaceus. Front Pharmacol. 14 (2), 1242318-1242325 (2023).
- Wang, Q., et al. Traditional Chinese medicine method of tonifying kidney for hypertension: Clinical evidence and molecular mechanisms. Front Cardiovasc Med. 20229 (16), 1038480-1038487 (2022).
- Tang, X., et al. Experimental models for elderly patients with membranous nephropathy: Application and advancements. Exp Gerontol. 185 (8), 112341-112353 (2024).
- Zhang, J. J., et al. Murine membranous nephropathy: immunization with α3(IV) collagen fragment induces subepithelial immune complexes and FcγR-independent nephrotic syndrome. J Immunol. 188 (7), 3268-3277 (2012).
- Hopfer, H., et al. The importance of cell-mediated immunity in the course and severity of autoimmune anti-glomerular basement membrane disease in mice. FASEB J. 17 (8), 860-868 (2003).
- Fleuren, G., Grond, J., Hoedemaeker, P. J. In situ formation of subepithelial glomerular immune complexes in passive serum sickness. Kidney Int. 17 (5), 631-637 (1980).
- Border, W. A., Ward, H. J., Kamil, E. S., Cohen, A. H. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen. J Clin Invest. 69 (2), 451-461 (1982).
- Border, W. A., Ward, H. J., Kamil, E. S., Cohen, A. H. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen. J Clin Invest. 69 (2), 451-461 (1982).
- Rubio-Navarro, A., et al. Phenotypic characterization of macrophages from rat kidney by flow cytometry. J Vis Exp. (116), e54599 (2016).
- Hou, Y., et al. Longzhibu disease and its therapeutic effects by traditional Tibetan medicine: Ershi-wei Chenxiang pills. J Ethnopharmacol. 249, 112426 (2020).
- Sethi, S., et al. Hematopoietic stem cell transplant-membranous nephropathy is associated with protocadherin FAT1. J Am Soc Nephrol. 33 (5), 1033-1044 (2022).
- Gong, Q., Lai, T., Liang, L., Jiang, Y., Liu, F. Targeted inhibition of CX3CL1 limits podocytes ferroptosis to ameliorate cisplatin-induced acute kidney injury. Mol Med. 29 (1), 140-148 (2023).
- Li, H., et al. IL-23 reshapes kidney resident cell metabolism and promotes local kidney inflammation. J Clin Invest. 131 (12), e142428-e142441 (2021).
- Wang, C., et al. Artificially cultivated Ophiocordyceps sinensis alleviates diabetic nephropathy and its podocyte injury via inhibiting P2X7R expression and NLRP3 inflammasome activation. J Diabetes Res. 356 (11), 1390418-1390431 (2018).
- Cheng, H., et al. PI3K/Akt signaling pathway and Hsp70 activate in hippocampus of rats with chronic manganese sulfate exposure. J Trace Elem Med Biol. 50 (12), 332-338 (2018).
- Ji, K., et al. The immunoreaction and antioxidant capacity of juvenile blunt snout bream (Megalobrama amblycephala) involves the PI3K/Akt/Nrf2 and NF-κB signal pathways in response to dietary methionine levels. Fish Shellfish Immunol. 105 (10), 126-134 (2020).
- Chiou, T. T., et al. Rapamycin attenuates PLA2R activation-mediated podocyte apoptosis via the PI3K/AKT/mTOR pathway. Biomed Pharmacother. 144 (3), 112349-112357 (2021).
- Lv, Q., Yang, F., Chen, K., Zhang, Y. Autophagy protects podocytes from sublytic complement induced injury. Exp Cell Res. 341 (2), 132-138 (2016).
- Mundel, P., Shankland, S. J. Podocyte biology and response to injury. J Am Soc Nephrol. 13 (12), 3005-3015 (2002).
- Sun, Z., Xu, Q., Ma, Y., Yang, S., Shi, J. Circ_0000524/miR-500a-5p/CXCL16 axis promotes podocyte apoptosis in membranous nephropathy. Eur J Clin Invest. 51 (3), e13414-e13422 (2021).
- Huber, T. B., et al. Nephrin and CD2AP associate with phosphoinositide 3-OH kinase and stimulate AKT-dependent signaling. Mol Cell Biol. 23 (14), 4917-4928 (2003).
- Ai, Z., et al. Deciphering the pharmacological mechanisms of Rostellularia procumbens (L) Nees. Extract alleviates adriamycin-induced nephropathy in vivo and in vitro. Phytomedicine. 113 (6), 154736-154742 (2023).
- Wang, X., et al. Nicorandil alleviates apoptosis in diabetic cardiomyopathy through PI3K/Akt pathway. J Cell Mol Med. 23 (8), 5349-5359 (2019).
- Fox, M., Mott, H. R., Owen, D. Class IA PI3K regulatory subunits: p110-independent roles and structures. Biochem Soc Trans. 48 (4), 1397-1417 (2020).
- Miricescu, D., et al. PI3K/AKT/mTOR signaling pathway in breast cancer: From molecular landscape to clinical aspects. Int J Mol Sci. 22 (1), 173-179 (2020).
- Feng, C., et al. Neuroprotective effect of Danhong injection on cerebral ischemia-reperfusion injury in rats by activation of the PI3K-Akt pathway. Front Pharmacol. 11 (4), 298-312 (2020).
- Zhou, Y., et al. 1,3-Dicaffeoylquinic acid targeting 14-3-3 tau suppresses human breast cancer cell proliferation and metastasis through IL6/JAK2/PI3K pathway. Biochem Pharmacol. 172 (12), 113752-113761 (2020).
- Li, J., et al. Tetrandrine inhibits colon carcinoma HT-29 cells growth via the Bcl-2/Caspase 3/PARP pathway and G1/S phase. Biosci Rep. 39 (5), (2019).
- Downward, J. How BAD phosphorylation is good for survival. Nat Cell Biol. 1 (2), E33-E35 (1999).
- Fan, J., et al. A model of ischemia and reperfusion increases JNK activity, inhibits the association of BAD and 14-3-3, and induces apoptosis of rabbit spinal neurocytes. Neurosci Lett. 473 (3), 196-201 (2010).
- Chipuk, J. E., Green, D. R. How do BCL-2 proteins induce mitochondrial outer membrane permeabilization. Trends Cell Biol. 18 (4), 157-164 (2008).
- Yin, L., Yu, L., He, J. C., Chen, A. Controversies in podocyte loss: Death or detachment. Front Cell Dev Biol. 9 (11), 771931-771942 (2021).
- Yang, C., et al. Research progress on multiple cell death pathways of podocytes in diabetic kidney disease. Mol Med. 29 (1), 135-143 (2023).
- Calvier, L., et al. PPARγ links BMP2 and TGFβ1 pathways in vascular smooth muscle cells, regulating cell proliferation and glucose metabolism. Cell Metab. 25 (5), 1118-1134 (2017).
- Dai, Z. W., Cai, K. D., Xu, L. C., Wang, L. L. Perilipin2 inhibits diabetic nephropathy-induced podocyte apoptosis by activating the PPARγ signaling pathway. Mol Cell Probes. 53 (3), 101584-101596 (2020).
- Kota, B. P., Huang, T. H., Roufogalis, B. D. An overview on biological mechanisms of PPARs. Pharmacol Res. 51 (2), 85-94 (2005).
- Wahli, W. Peroxisome proliferator-activated receptors (PPARs): from metabolic control to epidermal wound healing. Swiss Med Wkly. 132 (7-8), 83-91 (2002).
- Agrawal, S., He, J. C., Tharaux, P. L. Nuclear receptors in podocyte biology and glomerular disease. Nat Rev Nephrol. 17 (3), 185-204 (2021).
- Miglio, G., et al. Protective effects of peroxisome proliferator-activated receptor agonists on human podocytes: proposed mechanisms of action. Br J Pharmacol. 167 (3), 641-653 (2012).
- Miglio, G., et al. The subtypes of peroxisome proliferator-activated receptors expressed by human podocytes and their role in decreasing podocyte injury. Br J Pharmacol. 162 (1), 111-125 (2011).
- Agrawal, S., Guess, A. J., Benndorf, R., Smoyer, W. E. Comparison of direct action of thiazolidinediones and glucocorticoids on renal podocytes: protection from injury and molecular effects. Mol Pharmacol. 80 (3), 389-399 (2011).
- Sonneveld, R., et al. Sildenafil prevents podocyte injury via PPAR-γ-mediated TRPC6 inhibition. J Am Soc Nephrol. 28 (5), 1491-1505 (2017).
- Agrawal, S., et al. Pioglitazone enhances the beneficial effects of glucocorticoids in experimental nephrotic syndrome. Sci Rep. 6 (3), 24392-24404 (2016).
- Kanjanabuch, T., et al. PPAR-gamma agonist protects podocytes from injury. Kidney Int. 71 (12), 1232-1239 (2007).
- Bryant, C., et al. Selective modulator of nuclear receptor PPARγ with reduced adipogenic potential ameliorates experimental nephrotic syndrome. iScience. 25 (4), 104001 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유