Method Article
تطوير نموذج الأغشية الحيوية للمستعمرة متعددة الميكروبات لاختبار مضادات الميكروبات في التليف الكيسي
In This Article
Summary
تسمح هذه المنهجية بإنشاء نموذج غشاء حيوي متعدد الميكروبات في التليف الكيسي لاختبار حساسية مضادات الميكروبات في المختبرات البحثية والسريرية. يوفر هذا النموذج نتائج دقيقة وموثوقة على مجموعة من المخرجات.
Abstract
توجد مجموعة من نماذج الأغشية الحيوية للبكتيريا لاختبار المضادات الحيوية. ومع ذلك ، فإن العديد من هذه تقتصر على مخرجات تجريبية واحدة ، مثل وحدات تشكيل المستعمرات أو نشاط التمثيل الغذائي. علاوة على ذلك ، لا تعكس العديد من نماذج الأغشية الحيوية الخصائص البيولوجية والكيميائية للبيئة البشرية المضيفة. هذه مشكلة مهمة في العديد من الحالات ، ولكن بشكل ملحوظ في التليف الكيسي (CF). تعاني نسبة كبيرة من الأشخاص المصابين بالتليف الكيسي من العدوى المزمنة والمتقطعة ، وفي المختبر ، يرتبط اختبار الحساسية بالمضادات الحيوية ارتباطا سيئا بنتائج علاج المرضى. تتضمن بعض نماذج الأغشية الحيوية وسائط ذات صلة بالرئة التليفية الكيسية ، بما في ذلك تقليد البلغم الاصطناعي ، ولكنها لا تأخذ في الاعتبار الطبيعة متعددة الميكروبات للبيئة ، مما يغير بنية الأغشية الحيوية وعلم وظائف الأعضاء والطريقة التي تستجيب بها الميكروبات للعلاج. نموذج الأغشية الحيوية لمستعمرة واجهة الهواء الصلب الموصوف هنا قابل للتكيف بدرجة كبيرة ويتضمن كلا من الوسائط ذات الصلة بالتليف الكيسي وسياق متعدد الميكروبات. يمكن أيضا استخدام هذا النموذج للفحص المتوسط لمضادات الميكروبات ودراسة تأثيرها على ديناميكيات الميكروبات. يمكن أن تكون قياسات الإخراج من النموذج عبارة عن وحدات تشكيل مستعمرة ، ونشاط التمثيل الغذائي ، وتحليل المجهر متحد البؤر. يمكن تكييف النموذج بسهولة مع الكائنات الحية الدقيقة المختلفة والوسائط ودرجات الحرارة وظروف الأكسجين المتغيرة ويمكن استخدامه لاختبار مجموعة واسعة من العلاجات الكيميائية والبيولوجية والفيزيائية.
Introduction
التليف الكيسي (CF) هو حالة وراثية تصيب أكثر من 11,000 شخص في المملكة المتحدة و 162,000 شخص على مستوى العالم 1,2. على الرغم من أن التليف الكيسي مرض متعدد الأعضاء ، إلا أن أحد الأعراض الرئيسية التي يعاني منها الأشخاص المصابون بالتليف الكيسي (pwCF) هو تكوين مخاط سميك ومجفف بشكل غير طبيعي داخل الجهازالتنفسي 3. هذا ، إلى جانب انخفاض ضرب الأهداب ، يمكن أن يعزز استعمار الرئتين بواسطة مجموعة واسعة من البكتيريا والفطريات والفيروسات والعتائق4،5. على الرغم من أن رئة التليف الكيسي توفر الظروف والضغوط الانتقائية للحد من نمو الكائنات الحية الدقيقة وبقائها على قيد الحياة ، إلا أن البكتيريا مثل Pseudomonas aeruginosa تتكيف بشكل كبير مع هذه البيئات القاسية6. هذا يسمح بالاستعمار والبقاء على قيد الحياة ، مما يؤدي إلى تكوين التهابات مزمنةمستمرة 7.
العديد من الميكروبات التي تسبب هذه الالتهابات المزمنة تفعل ذلك باستخدام تحول ظاهري من العوالق الأولية إلى نمط نمو الأغشية الحيوية ، إما السطح المرفق أو في الركام7. تتميز هذه الأغشية الحيوية بمجتمعات بكتيرية معبأة بإحكام مغلفة بمصفوفة عديد السكاريد الخارجي (EPS) تتكون من مجموعة متنوعة من المكونات ، بما في ذلك السكريات والبروتينات والدهون والحمض النووي البيئي (eDNA)8. هذه المصفوفة هي سمة مشتركة بين الكائنات الحية الدقيقة. ومع ذلك ، يمكن أن يختلف تكوينه. على سبيل المثال ، المكونات الرئيسية للسكاريد البكتيرية P. aeruginosa المصفوفة هي PSL و Pel و alginate ، على عكس الفطريات المبيضات البيضاء ، التي تتكون مكوناتها الرئيسية من مصفوفة السكريات هي المانان والجلوكان9. في الأغشية الحيوية أحادية النوع ، يمكن أن تؤثر هذه المصفوفة بشكل كبير على تحمل المضادات الحيوية مقارنة بالعوالق عن طريق تقليل تغلغل المضادات الحيوية في الأغشية الحيوية ، مما يقلل من فعاليتها10. يحفز نمط نمو الأغشية الحيوية أيضا تكوين خلايا ثابتة ذات نشاط استقلابي منخفض مقارنة بنظيراتها العوالق ، وبالتالي تقليل القابلية للمضادات الحيوية11. يتميز هذا النمط من النمو أيضا بتنظيم بعض آليات مقاومة المضادات الحيوية ، مثل مضخات التدفق وتلك المطلوبة لنقل الجينات الأفقي ، مما يتيح تبادل جينات المقاومة11،12،13. بالإضافة إلى ذلك ، تؤثر البيئة المرتبطة بالأمراض للمضيف بشكل كبير على فسيولوجيا الميكروبات وطريقة استجابتها للمضادات الحيوية. ويشمل ذلك زيادة الهوائية الدقيقة داخل المخاط السميك بالإضافة إلى توافر مصادر الكربون غير القياسية مثل الأحماض الأمينية والحمض النووي الإلكتروني ، سواء كان مشتقا من المضيف أو من التحلل الميكروبي لمنتجات الرئة14 ، 15 ، 16.
تزداد هذه التفاعلات المحددة تعقيدا بسبب الطبيعة متعددة الميكروبات للأغشية الحيوية ، والتي تقدم طبقة إضافية من التعقيد مع تفاعلات معقدة ليس فقط بين البكتيريا ولكن أيضا بين البكتيريا والفطريات. بالمقارنة مع الأغشية الحيوية البكتيرية ، هناك القليل من المعروف فيما يتعلق ببعض التفاعلات بين الأغشية الحيوية البكتيرية والفطرية ، على الرغم من عزل المطثية البيضاء من أكثر من 75٪ من الأشخاص المصابين بالتليف الكيسي15. بشكل عام ، التفاعلات بين المطثية البيضاء والبكتيريا مثل المتصورة الزنجارية معادية ولكنها يمكن أن تؤدي إلى المزيد من الالتهابات المزمنة والشديدة18. يمكن أن يؤدي الجمع بين التفاعلات الميكروبية ، المسببة للأمراض والمزامنة ، جنبا إلى جنب مع مجموعة من العوامل البيئية المرتبطة بالتليف الكيسي في النهاية إلى زيادة تحمل المضادات الحيوية19،20. لا يتم أخذ العديد من هذه العوامل في الاعتبار في كثير من الأحيان في اختبار المضادات الحيوية قبل السريرية على الرغم من تعزىها إلى زيادة تحمل المضادات الحيوية في النماذج الحالية21.
يصعب أيضا تلخيص هذه الظروف في المختبر ، ونتيجة لذلك ، تفتقر العديد من النماذج إلى وجود عوامل محددة محفزة للتحمل موجودة في pwfl ، مثل تلك التي تزيد من إنتاج بيتا لاكتاماز في P. aeruginosa22 ، وتحريض متغيرات مستعمرة صغيرة في المكورات العنقودية الذهبية وتثبيط الواصلة في C. albicans. وقد ثبت أن كل ذلك يحدث في بلغم التليف الكيسي23،24.
لذلك ، هناك تباين كبير بين الظروف المستخدمة في طرق اختبار حساسية المضادات الحيوية الحالية ، بناء على المزارع المزروعة بالعوالق أو صفائح أجار في وسائط موحدة مثل Mueller-Hinton مع فحوصات الانتشار القرصي ، و Etest ، و CLSI مرق التخفيف الدقيق ، والظروف التي تمت مواجهتها في البيئة المضيفة25. غالبا ما يفشل هذا في تحديد حساسية المضادات الحيويةبدقة 26. تزداد هذه المشكلة تعقيدا بسبب عدم وجود توحيد في اختبار الأغشية الحيوية المضادة للميكروبات ، مما يجعل من الصعب ترجمة فعالية مضادات الميكروبات بدقة من المختبر إلى العيادة27،28.
يوضح النموذج متعدد الميكروبات الذي طورناه هنا تحمل معزز للزائفة الزنجارية لمجموعة من مضادات الميكروبات ، بما في ذلك ميروبينيم وتوبراميسين. يوضح هذا التباين الكبير بين الاختبارات الحالية المضادة للميكروبات باستخدام الأغشية الحيوية أحادية النوع ونموذج الأغشية الحيوية متعددة الميكروبات التي تم تطويرها في هذه الدراسة لتحديد الحد الأدنى من التركيزات المثبطة. يحافظ هذا النموذج أيضا على إنتاجية عالية نسبيا وتكلفة منخفضة مرغوبة لاختبار مضادات الميكروبات. يمكن أيضا استخدام النموذج لدراسة تأثير العلاج بمضادات الميكروبات على ديناميكيات الميكروبات وتحديد ما إذا كان علاج معين قد يؤدي إلى أن يصبح مسببا معينا مهيمنا ، مما يتيح التنبؤ بمزيد من المضاعفات. على الرغم من أن هذا النموذج يسمح ببناء الأغشية الحيوية المعقدة ، إلا أن إعداده لا يتطلب معدات معملية متطورة ويوفر منصة لمجموعة واسعة من المخرجات السريرية والبحثية.
Protocol
1. تحضير التليف الكيسي الاصطناعي media-2 (SCFM2) والأطباق
- اصنع SCFM2 وفقا للوصفة الموضحة في Palmer et al.16 في زجاجة زجاجية من البورسليكات سعة 500 مل بتركيز 2x مع بعض التعديلات.
- قم بوزن وإعداد المخزونات كما هو موضح في الجدول 1. تحضير مخزون الأحماض الأمينية وفقا للجدول 2.
- قم بوزن 5 جم من الميوسين (من معدة الخنازير (النوع الثاني)) و 600 مجم من الحمض النووي الإلكتروني (من المنوية من سمك السلمون) في 100 مل من dH2O في زجاجة زجاجية من البورسليكات سعة 200 مل. يقلب في درجة حرارة 4 درجات مئوية طوال الليل قبل التعقيم عن طريق التعقيم.
- إلى زجاجة معقمة سعة 500 مل ، أضف 0.54 جم جلوكوز و 6.06 جم كلوريد الصوديوم و 2.228 جم كلوريد كلوريد كلوريد ، أضف 10 مل لكل من المخزونات المحضرة في الخطوة 1.1.1. اضبط الرقم الهيدروجيني إلى 6.9 باستخدام 1 M هيدروكسيد الصوديوم أو حمض الهيدروكلوريك.
- أضف 10 مل من dH2O متبوعا ب 10 مل من 0.175 M CaCl2 و 0.0606 م من MgCl2. تحضير وإضافة 10 مل من 0.93 M L-lactic acid. قبل الاستخدام مباشرة ، أضف 10 مل من 0.36 ملي الحديد (III) SO47H2O
- قم بتعقيم SCFM2 باستخدام وحدة الترشيح ومضخة التفريغ ، ثم أضف الميوسين المعقم والحمض النووي الإلكتروني.
ملاحظة: يمكن تخزين SCFM2 المحضر عند 4 درجات مئوية لمدة تصل إلى شهر واحد.
- قم بإعداد ألواح أجار SCFM2 كما هو موضح أدناه.
- سخن 25 مل من 2x SCFM2 في أنبوب سعة 50 مل في حمام مائي 55 درجة مئوية قبل الخلط مع 25 مل من الأجار التقنية المذاب مسبقا بنسبة 3٪ (وزن / حجم) ، مما ينتج عنه مزيج من 1x SCFM2 و 1.5٪ (وزن / حجم) أجار تقني.
- باستخدام ماصة مصلية ، انقل 5 مل من الخليط إلى كل بئر من صفيحة مكونة من 6 آبار.
- قم بإعداد نفس العدد من أقراص البولي كربونات مقاس 13 مم بحجم مسام 0.2 ميكرومتر عن طريق وضعها في قاع طبق بتري وتطبيق الأشعة فوق البنفسجية لمدة 600 ثانية بطول موجي 254 نانومتر وتردد 60 هرتز. اقلب الأقراص وكرر إجراء الأشعة فوق البنفسجية.
- بمجرد ضبط الأجار التقني 1x SCFM2-1.5٪ (وزن / حجم) ، استخدم ملقطا معقما لإضافة قرص بولي كربونات واحد إلى سطح كل بئر من اللوحة المكونة من 6 آبار.
2. تحضير البكتيريا للعدوى
- قبل إعداد النموذج ، قم بإعداد لوحة / أطباق أجار للبكتيريا والسلالات الفطرية المطلوبة وفقا للأجار القياسي المستخدم في المختبر ل P. aeruginosa PAO1 و S. aureus SH1000 و C. albicans SC5314 (على سبيل المثال ، مرق Lysogeny مع 1.2٪ (وزن / حجم) أجار للبكتيريا و Sabouraud dextrose agar ل C. albicans).
ملاحظة: لإنشاء النموذج ، تم استخدام سلالات مرجعية مختبرية محددة. ومع ذلك ، فقد تم استخدام هذا النموذج أيضا مع سلالات أخرى ، بما في ذلك العزلات السريرية ، مع بعض التعديلات ، مثل زيادة وقت إنشاء الأغشية الحيوية قبل علاج السلالات البطيئة النمو. - استخدم حلقة تلقيح 1 ميكرولتر لاختيار مستعمرة واحدة من كل كائن حي دقيق لتلقيح 5 مل من الوسائط السائلة المختبرية القياسية (على سبيل المثال ، مرق Lysogeny ل P. aeruginosa و S. aureus و Yeast peptone dextrose (YPD) ل C. albicans). احتضان هذه المزارع حتى تصل إلى مرحلة النمو الأسي عند 200 دورة في الدقيقة ، و 37 درجة مئوية للبكتيريا ، و 200 دورة في الدقيقة ، و 30 درجة مئوية ل C. albicans.
ملاحظة: ستختلف التهوية اعتمادا على حاضنة الاهتزاز ونصف قطر الدوران
3. إعداد نموذج واجهة الهواء الصلب
ملاحظة: يمكن رؤية التمثيل التخطيطي العام للنموذج في الشكل التكميلي 1.
- انقل 1 مل من كل مزرعة سائلة إلى أنبوب معقم منفصل سعة 1.5 مل وجهاز طرد مركزي لمدة دقيقتين عند 8,000 × جم لحبيبات البكتيريا / الفطريات. قم بتنفيذ هذا وجميع خطوات الطرد المركزي التالية في درجة حرارة الغرفة.
- قم بشفط المادة الطافية باستخدام ماصة وأعد تعليق الكريات في 1 مل من PBS قبل الطرد المركزي ، مرة أخرى ، لمدة دقيقتين عند 8,000 × جم.
- قم بإزالة المادة الطافية كما كان من قبل وأعد تعليق الكريات في 1 مل من PBS. خفف الخلايا المعلقة P. aeruginosa و S. aureus 1:10 في PBS وقياس الكثافة الضوئية باستخدام مقياس الطيف الضوئي بطول موجي 600 نانومتر.
- اضبط العينات المغسولة على 1 × 108 وحدة تشكيل مستعمرات (CFU) / مل بناء على التحقق المسبق من أن OD600 من 0.05 ل P. aeruginosa و 0.1 ل S. aureus يعادل 1 × 108 CFU / مل.
- بالنسبة إلى C. albicans ، قم بتخفيف العينات المغسولة 1:100 في PBS ، وأضف 10 ميكرولتر من كل منها إلى غرفتين فرديتين لمقياس الدم ، واستخدم الأبعاد الثابتة للغرفة والتخفيف المستخدم لحساب CFU / mL. باستخدام مقياس كثافة الدم Neubauer المحسن ، سيكون الحساب على النحو التالي:
عدد الخلايا = متوسط عدد الخلايا × 10,000 / (عامل التخفيف) - تمثل CFUs المحسوبة C. albicans CFU / مل في العينة المخففة مسبقا. اضبط عينة المطثية البيضاء إلى 1 × 108 CFU / مل في PBS كما هو الحال مع الثقافات البكتيرية.
- لتحضير اللقاح لإضافته إلى الأغشية الحيوية ، اضبط لقاح P. aeruginosa إلى 1 × 104 CFU / مل (2x 100 تخفيف) ، C. albicans إلى 1 × 105 CFU / مل (تخفيف 100 أضعاف متبوعا بتخفيف 10 أضعاف) وأخيرا ، S. aureus إلى 1 × 106 CFU / مل (تخفيف 100 ضعف) باستخدام PBS.
- بالنسبة للأغشية الحيوية أحادية النوع ، أضف 10 ميكرولتر من الميكروب المخفف المطلوب إلى مركز قرص البولي كربونات الذي تم وضعه مسبقا على ألواح الأجار التقنية 1x SCFM2-1.5٪ واحتضانها بشكل ثابت عند 37 درجة مئوية لمدة 24 ساعة قبل المعالجة أو التعطيل.
- بالنسبة للأغشية الحيوية متعددة الميكروبات ، أضف 10 ميكرولتر من كل من المكورات العنقودية الذهبية و C. albicans فوق بعضهما البعض على نفس القرص. احتضان القرص الملقح بشكل ثابت لمدة 24 ساعة عند 37 درجة مئوية.
ملاحظة: الترتيب الذي تتم به إضافة لقاح المكورات العنقودية الذهبية و C. albicans لا يؤثر على تطور النموذج ويولد نفس النتائج. - بعد ذلك ، انقل أقراص البولي كربونات إلى ألواح أجار تقنية جديدة 1x SCFM2-1.5٪ مع ملقط معقم وأضف 10 ميكرولتر من تخفيف 1 × 104 CFU / مل من P. aeruginosa فوق المكورات العنقودية الذهبية - C. albicans الأغشية الحيوية. احتضن لمدة 24 ساعة أخرى عند 37 درجة مئوية.
ملاحظة: المتصورة الزنجارية تضاف بعد 24 ساعة من المكورات العنقودية الذهبية و C. albicans لتعكس الترتيب الذي تستعمر به هذه الكائنات بشكل متكرر رئة التليف الكليف الكيسي لدى الأشخاص المصابين بالتليف الكيسي. وهذا يمنع أيضا المتصورة الزنجارية من التفوق على الكائنات الحية الدقيقة الأخرى. بمجرد إضافة P. aeruginosa ، يمكن زراعة الأغشية الحيوية لمدة تزيد عن 24 ساعة. ومع ذلك ، يجب نقل قرص البولي كربونات مع الأغشية الحيوية إلى وسائط جديدة كل 24 ساعة. قبل الاضطراب ، يمكن استخدام الأغشية الحيوية للفحص المجهري باستخدام سلالات تعبر عن بروتينات الفلورسنت أو الأصباغ الفلورية أو الأجسام المضادة الخاصة بالسلالة / الميكروب. ومع ذلك ، تجدر الإشارة إلى أن بعض الأصباغ تلطخ قرص البولي كربونات.
4. تعطيل الأغشية الحيوية
- أضف حبات خزفية بقطر 2.8 مم إلى الألواح وربط الألواح بالأشعة فوق البنفسجية كما هو موضح في الخطوة 1.3. أضف 5 حبات خزفية إلى أنبوب الخالط المعقم سعة 2 مل باستخدام ملقط معقم باللهب. بعد ذلك، قم بإدخال 1 مل من المحلول الملحي المخزن بالفوسفات (PBS) في أنبوب التجانس سعة 2 مل.
- أنابيب الدوامة لمدة 10 ثوان على الأقل أو حتى تتم إزالة الأغشية الحيوية من قرص البولي كربونات ، والتي يتم تحديدها عن طريق الفحص البصري ، وعند هذه النقطة قم بإزالة قرص البولي كربونات.
- ضع الأنابيب مع الخرزات في الخالط واضرب لمدة 2x لمدة 10 ثوان بسرعة 6 م / ث مع فاصل 10 ثوان بين النبضات.
ملاحظة: يؤدي هذا المزيج من الخرز ووقت الضرب واستخدام الخالط إلى تعطيل كاف للأغشية الحيوية مع الحد الأدنى من التحلل على النحو الذي يحدده الفحص المجهري ووحدات تشكيل المستعمرات. قد يختلف هذا اعتمادا على مضرب الخرزة المحدد المستخدم. - صب الأغشية الحيوية المعطلة من أنبوب الخالط في بيجو سعة 7 مل تحتوي على 4 مل من PBS ، مما ينتج عنه حجم نهائي قدره 5 مل.
- تأكد من نقل كل السائل من أنابيب الخالط إلى البيجو عن طريق الطرد المركزي للأنابيب عند 8,000 × جم لمدة دقيقتين ونقل السائل المتبقي إلى 7 مل بيجو.
ملاحظة: من هذا 5 مل من الأغشية الحيوية المعطلة ، يمكن إجراء مجموعة من المقايسات ، ولكن من المهم أن تتذكر لأي حسابات تخفيف PBS بالغ 1 مل في حجم نهائي قدره 5 مل.
5. اختبار النشاط الأيضي
- أضف 200 ميكرولتر من الأغشية الحيوية المعطلة من الخطوة 4 أعلاه إلى صفيحة بئر سوداء 96 ذات قاع شفاف. ثم أضف 10 ميكرولتر من محلول ريزازورين 0.02٪ (وزن / حجم).
- احتضان الأغشية الحيوية المعالجة بالريزازورين باستخدام قارئ لوحة واقرأ نشاط التمثيل الغذائي. احتضان اللوحة عند 37 درجة مئوية ، مع تطبيق الاهتزاز المداري كل 30 دقيقة لمدة 10 ثوان عند 200 دورة في الدقيقة قبل أخذ أي قراءات فلورية.
- قم بقياس التألق باستخدام إثارة 540 نانومتر وانبعاث 590 نانومتر. كرر هذه الدورة التي تبلغ مدتها 30 دقيقة لمدة 4 ساعات باستخدام قارئ لوحة.
ملاحظة: يتم استخدام النقطة الزمنية 4 ساعات لأنها توفر اختلافات أكثر وضوحا بين العينات المعالجة والعينات غير المعالجة وبين العينات ذات تركيزات المضادات الحيوية المتفاوتة.
6. اختبار حساسية مضادات الميكروبات
- لاختبار تحمل مضادات الميكروبات للمضادات الحيوية القياسية ، قم بإذابة المضادات الحيوية المفضلة في المذيبات ذات الصلة وأضفها إلى وسط الأجار التقني 1x SCFM2-1.5٪ (وزن / حجم) بينما لا يزال سائلا قبل نقل 5 مل إلى كل بئر من صفيحة من ستة آبار. بمجرد ضبطه ، انقل الأغشية الحيوية المزروعة على قرص البولي كربونات إلى الجزء العلوي من الوسط المحتوي على المضادات الحيوية باستخدام ملقط معقم وأضف قطرة 10 ميكرولتر من تركيز المضادات الحيوية المقابلة إلى الجزء العلوي من الأغشية الحيوية.
ملاحظة: في هذه الدراسة ، تم استخدام التخفيف التسلسلي ذو الطية ثنائية السجل بين 64 ميكروغرام / مل و 0.125 ميكروغرام / مل من الميروبينيم والتوبرامايسين لتعكس التركيزات ذات الصلة سريريا. يكفي إعطاء المضادات الحيوية أو غيرها من العلاجات المضادة للميكروبات / المضادة للفوعة فقط فوق الأغشية الحيوية ، حيث لوحظت استجابات مماثلة عند إضافتها إلى كل من الوسائط وعلى الأغشية الحيوية. - بعد 24 ساعة من الحضانة عند 37 درجة مئوية مع العلاج ، صورة الأغشية الحيوية وتعطل كما هو موضح في الخطوة 4.
- من 5 مل من الثقافة المعطلة ، خذ حصة وقم بإجراء تخفيف تسلسلي بمقدار 10 أضعاف باستخدام PBS. قم بإخراج 10 ميكرولتر من البقع في ثلاث نسخ على أجار لتحديد وحدات تكوين المستعمرات باستخدام طريقة Miles and Misra30.
ملاحظة: سيؤثر الحجم المضاف إلى لوحات الأجار على حد الكشف ، وستقلل الأحجام الأكبر من حد الكشف ولكنها تتطلب المزيد من العينات وألواح الأجار. - بالنسبة للأغشية الحيوية أحادية النوع ، قم ب P. aeruginosa و S. aureus على ألواح أجار LB و C. albicans على أجار SDA.
- بالنسبة للأغشية الحيوية متعددة الميكروبات ، ضع الحصص على ثلاثة وسائط انتقائية مختلفة تحتوي على مضادات حيوية لعزل كل نوع من الأنواع الثلاثة وتمكين تحديد CFUs. ويشمل ذلك أجار عزل Pseudomonas وأجار ملح مانيتول المحتوي على النيستاتين عند 10 ميكروغرام / مل لعزل المتصورة الزنجارية والمكورات العنقودية الذهبية ، على التوالي ، و Sabouraud dextrose agar مع التتراسيكلين عند 125 ميكروغرام / مل لعزل C. albicans. احتضان صفائح المكورات العنقودية الذهبية عند 37 درجة مئوية بين عشية وضحاها والصفائح المتصورة الزنجارية والمطثية البيضاء عند 30 درجة مئوية.
ملاحظة: احتضان P. aeruginosa ألواح عند 30 درجة مئوية لتقليل فرط نمو المستعمرة وتقليل الاحتشاد.
النتائج
تتيح بساطة نموذج الأغشية الحيوية لواجهة الهواء الصلب فحص عدد كبير من مضادات الميكروبات في ظل ظروف مختلفة ذات صلة سريريا في وقت واحد. يسمح هذا النموذج بتقييم فعالية المضادات الحيوية باستخدام أعداد CFU وفحوصات التمثيل الغذائي في كل من الأغشية الحيوية أحادية ومتعددة الميكروبات ليتم إجراؤها في غضون أسبوع. نظرا لطبيعة النموذج ، فإنه يسمح أيضا بسهولة التلاعب بالظروف البيئية ، مثل تغيير تركيبة الوسائط ووضع الأغشية الحيوية تحت ظروف منخفضة الأكسجين واللاهوائية. باستخدام هذا النموذج ، أظهرنا تغيرات في تحمل اثنين من المضادات الحيوية المستخدمة بشكل شائع في pwex بين P. aeruginosa المزروعة في الأنواع الأحادية والأغشية الحيوية متعددة الميكروبات (الشكل 1). إلى جانب ذلك ، تمكنا من تحديد كيف يمكن للعلاج بمضادات الميكروبات أن يؤثر على ديناميكيات السكان داخل الأغشية الحيوية متعددة الميكروبات (الشكل 2).
لإجراء هذه التجارب ، تم إعداد اللقاح الأولي كما هو محدد في البروتوكول أعلاه ، مما أدى إلى تكوين أنواع أحادية مستقرة وأغشية حيوية متعددة الميكروبات مع CFU / مل قابلة للتكرار وانحرافات معيارية صغيرة على النحو الذي يحدده ANOVA أحادي أو ثنائي الاتجاه. سلط هذا النموذج الضوء أيضا على النمو المتسق والانتعاش CFU ، بالإضافة إلى السماح بإمكانية الجمع بين تقنيات علم الأحياء الدقيقة الكلاسيكية هذه مع التقنيات الأخرى التي لم يتم إجراؤها في هذه الدراسة دون الحاجة إلى معالجة متطورة. وتشمل هذه التصوير مثل الأحياء / الميتات ، وتصور المصفوفة ، والتحليل الجزيئي ، والتي لا تستطيع النماذج ثلاثية الأبعاد الأخرى تقديمها بطريقة يسهل الوصول إليها (الشكل 1) 31. وتجدر الإشارة إلى أن الانحراف المعياري المتوقع ل CFU / mL يزداد عند عرض البيانات كنسبة مئوية للبقاء على قيد الحياة مقارنة ب CFU / mL (الشكل 1). عند مقارنة فعالية العلاج بالمضادات الحيوية بين الأنواع الأحادية والأغشية الحيوية متعددة الميكروبات ، كانت هناك زيادة كبيرة في جميع تركيزات المضادات الحيوية المطلوبة لتحقيق قتل بنسبة 50٪. كانت هناك حاجة إلى زيادة 2 لوغاريتم في تركيز المضادات الحيوية لتحقيق هذا المستوى من قتل الميروبينيم والتوبرامايسين (الشكل 1). كانت هناك أيضا زيادة إجمالية في بقاء المتصورة الزنجارية في وجود المكورات العنقودية الذهبية و C. albicans في الأغشية الحيوية متعددة الميكروبات عند معالجتها ب 64 ميكروغرام / مل توبراميسين ، في حين كان العكس صحيحا بالنسبة للميروبينيم.
تقيس الطريقة المستخدمة لتحديد النشاط الأيضي النشاط الكلي للغشاء الحيوي متعدد الميكروبات بالكامل دون القدرة على تمييز المساهمة الفردية عن كل نوع. لهذا السبب ، يتم عرض التغييرات الأيضية أحادية النوع فقط لإثبات استخدام فحوصات النشاط الأيضي لهذا النموذج. بالنسبة للأغشية الحيوية أحادية الأنواع ، كانت هناك علاقة قوية بين P. aeruginosa البقاء على قيد الحياة والنشاط الأيضي لكل من meropenem و tobramycin (الشكل 2). يتيح استخدام كل من النشاط الأيضي وأعداد CFU من نفس العينات التعرف السهل على كل من التأثيرات المضادة للجراثيم والجراثيم. بالنسبة للأغشية الحيوية متعددة الميكروبات ، قد يشير تحديد النشاط الأيضي إلى كيف يمكن أن يؤدي استهداف نوع واحد إلى زيادة إجمالية في نشاط التمثيل الغذائي للأغشية الحيوية ، وبالتالي ، من المحتمل أن يزيد من النمو الميكروبي للأنواع الأخرى.
على الرغم من أن CFUs هي المعيار الذهبي لاختبار حساسية مضادات الميكروبات ، إلا أنها تسمح أيضا بتقييم تكوين الأنواع داخل الأغشية الحيوية. من خلال علاج P. aeruginosa في الأغشية الحيوية متعددة الميكروبات ، لا يمكننا فقط إظهار زيادة MBEC50 لهذا الكائن الحي ولكن أيضا تحديد تأثير ذلك على الأنواع الأخرى المعزولة بشكل مشترك (الشكل 3). هذا ، على سبيل المثال ، يظهر مع ميروبينيم (مضاد كاذب) ، حيث يكون انخفاض المتصورة الزنجارية مصحوبا بزيادة في المكورات العنقودية الذهبية و C. albicans CFU ، مما يؤدي إلى أن تصبح المكورات العنقودية الذهبية الكائن الحي الأكثر انتشارا عند التعرض لتركيزات معينة من المضادات الحيوية (الشكل 3 أ). هذا يسلط الضوء على أهمية النظر في الطبيعة متعددة الميكروبات للأغشية الحيوية بسبب الزيادة المحتملة في حجم السكان للأنواع الأخرى المسببة للأمراض عند علاج مسببات الأمراض المعينة.
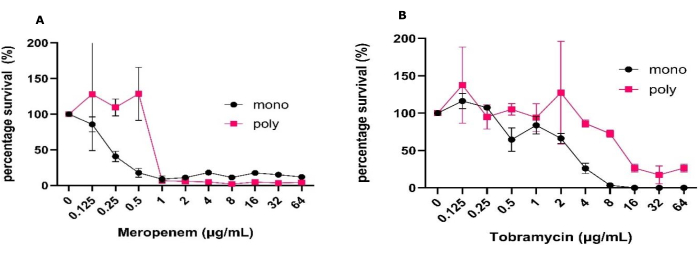
الشكل 1: التباين في تحمل مضادات الميكروبات ل P. aeruginosa إلى meropenem و tobramycin بين الأغشية الحيوية الأحادية والمتعددة الميكروبات المزروعة في نموذج واجهة الهواء الصلب. P. aeruginosa PAO1 يزرع في أغشية حيوية أحادية أو متعددة الميكروبات مع S. aureus و C. albicans تم إنشاؤه باستخدام نماذج واجهة الهواء الصلب لمدة 24 ساعة على SCFM2. عولجت الأغشية الحيوية بمجموعة من تركيزات (A) meropenem أو (B) tobramycin من 0.125 ميكروغرام / مل إلى 64 ميكروغرام / مل إلى جانب عدم وجود تحكم بالمضادات الحيوية. تم تحديد CFU / مل لكل غشاء حيوي. المتصورة الزنجارية تم تحديد CFUs في PIA وتحويلها إلى نسبة مئوية للبقاء على قيد الحياة باستخدام التحكم السلبي كبقاء على قيد الحياة بنسبة 100٪. تشير أشرطة الخطأ إلى الانحراف المعياري ، ويتم اشتقاق كل نقطة بيانات من 3 تكرارات بيولوجية ، لكل منها ثلاثة تكرارات فنية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التباين في النشاط الأيضي ل P. aeruginosa الأغشية الحيوية في وجود meropenem أو tobramycin المزروع في نموذج واجهة الهواء الصلب. المتصورة الزنجارية نمت الأغشية الحيوية PAO1 على SCFM2 في نموذج واجهة الهواء الصلب ، وأضيفت مجموعة من تركيزات (A) meropenem أو (B) tobramycin من 0.125 ميكروغرام / مل إلى 64 ميكروغرام / مل جنبا إلى جنب مع عدم وجود تحكم بالمضادات الحيوية. تمت قراءة اللوحة بالفلورسنت عند إثارة 540 نانومتر وانبعاث 590 نانومتر كل 30 دقيقة. تم حساب النسبة المئوية لنشاط التمثيل الغذائي عن طريق تحديد النسبة المئوية لهذا النشاط في كل عينة معالجة بالمضادات الحيوية مقارنة بالتحكم بدون مضادات حيوية. تشير أشرطة الخطأ إلى الانحراف المعياري ، ويتم اشتقاق كل نقطة بيانات من 3 تكرارات بيولوجية ، لكل منها ثلاثة تكرارات فنية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
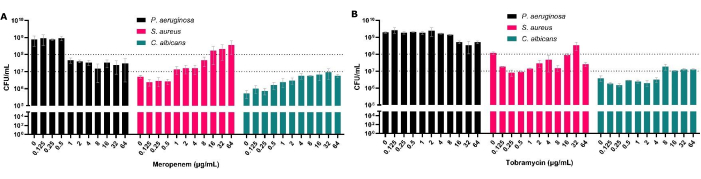
الشكل 3: التأثير على إجمالي عدد CFU ل P. aeurge و S. aureus و C. albicans التي تم استردادها من نموذج واجهة الهواء الصلب متعدد الميكروبات بعد المعالجة المضادة للميكروبات. نمت المكورات العنقودية الذهبية و C. albicans على SCFM2 على نموذج واجهة الهواء الصلب. تمت إضافة المتصورة الزنجارية ، وأضيف نطاق من 0.125 ميكروغرام / مل إلى 64 ميكروغرام / مل من تركيزات (أ) ميروبينيم أو (ب) توبرامايسين إلى الأغشية الحيوية جنبا إلى جنب مع التحكم بدون مضادات حيوية. تم تحديد CFU / مل لكل غشاء حيوي. تشير أشرطة الخطأ إلى الانحراف المعياري ، وتم اشتقاق كل نقطة بيانات من 3 تكرارات بيولوجية ، لكل منها ثلاثة تكرارات فنية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: إنشاء وسير عمل نموذج واجهة الهواء الصلب. التمثيل الرسومي لإنشاء نموذج واجهة الهواء الصلب ، وتعطيل الأغشية الحيوية ، والمخرجات. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
يمكننا نموذج الأغشية الحيوية الموصوف هنا من تقليد بعض جوانب بيئة عدوى الرئة CF من خلال دمج مجموعة من التفاعلات متعددة الميكروبات الشائعة بطريقة يسهل الوصول إليها أكثر من استخدامها حاليا في طرق اختبار مضادات الميكروبات في المختبر مثل مفاعل CDC ونموذج Lubbock biofilm31. هذا مهم عندما يمكن أن تؤثر مجموعة من العوامل ، بما في ذلك الخصائص الفيزيائية للأغشية الحيوية ، وتوافر المغذيات ، والتفاعلات الجزيئية بين الأنواع داخل الأغشية الحيوية ، على كل من نشاط العامل المضاد للميكروبات واستجابة الميكروبات لمضاد الميكروبات21. من خلال دمج هذه العوامل ، تمكنا من تطوير نموذج متعدد الاستخدامات للغاية قد يمكن من التنبؤ بنتائج العلاج بمضادات الميكروبات بشكل أكثر دقة من النماذج الحالية التي لا تأخذ في الاعتبار العوامل المذكورة أعلاه.
المتصورة الزنجارية ، المكورات العنقودية الذهبية ، و C. albicans تم اختيارها كفطريات ممثلة إيجابية الجرام وسالبة الجرام والفطريات المعزولة بشكل شائع في CF32. ومع ذلك ، فقد تمكنا أيضا من إظهار أنه يمكن استخدام هذا النموذج لمجموعة من الميكروبات الأخرى ذات الصلة بالتليف الكيسي ، بما في ذلك Burkholderia cenocepacia و Burkholderia multivoran s و Aspergillus fumigatus ، ويتم تكييفه حاليا للاستخدام مع البكتيريا اللاهوائية مثل Prevotella melaninogenica. يوضح هذا تعدد استخدامات النموذج حيث يمكن دمج مجموعة واسعة من الميكروبات ، مما يسلط الضوء على قدرة هذا النموذج على التكيف مع اختبار مضادات الميكروبات ضد مجموعة واسعة من مسببات الأمراض الميكروبية. يمكن أيضا تكييف النموذج بسهولة مع مجموعة من الظروف البيئية لاختبار حساسية مضادات الميكروبات بشكل أكثر تخصيصا ، بما في ذلك استبدال SCFM2 بالبلغم من المريض.
كما أن النظر في نماذج الأغشية الحيوية متعددة الميكروبات لاختبار مضادات الميكروبات الجديدة أمر بالغ الأهمية ، حيث يمكن أن تغطي فجوة موجودة في خط أنابيب تطوير مضادات الميكروبات قبل استخدامها في الدراسات الحيوانية أو البشرية33،34. إلى جانب ذلك ، يحافظ النموذج على إنتاجية عالية نسبيا ويسمح بمجموعة من المخرجات ذات الصلة بكل من الصناعة والبحث.
على الرغم من أننا قمنا فقط بتوضيح CFUs والنشاط الأيضي في ورقة الطرق هذه ، فقد أظهرنا أيضا فائدة النموذج في تحليل الأيض الخارجي للأغشية الحيوية باستخدام قياس الطيف الكتلي لتحليل سطح الاستخراج السائل (LESA). هذا يسمح بفحص بعض الآليات الجزيئية التي تدعم تحمل مضادات الميكروبات35. بالإضافة إلى هذه المخرجات الأخرى ، أظهرنا أيضا استخدام هذا النموذج لاختبار أنظمة توصيل مضادات الميكروبات الجديدة. وتشمل هذه اقترانات البوليمر والسيبروفلوكساسين لتعزيز تغلغل هذا المضاد الحيوي داخل الأغشية الحيوية مع زيادة نشاطه وتقليل تطور المقاومة36.
الخطوات والاعتبارات الحاسمة
من المهم الحفاظ على العقم ، خاصة عند إنتاج SCFM2 والوسائط ، حيث يمكن أن يؤدي التلوث إلى إدخال أنواع غير طبيعية ، والتي يمكن أن تتداخل مع النتائج. قد تتطلب سلالات مختلفة من نفس الميكروب والميكروبات المختلفة ظروفا بيئية مختلفة للنمو أو قد يكون لها خصائص نمو متفاوتة. لذلك ، يجب تحسين النموذج قبل إجراء أي اختبار لحساسية المضادات الحيوية. نوصي بإجراء دراسة تجريبية صغيرة مدتها 24 ساعة و 48 ساعة للأنواع الأحادية والأغشية الحيوية متعددة الميكروبات لتقييم النمو في ظل ظروف النموذج القياسية. لقد وجدنا أن سلالات مختلفة من P. aeruginosa وتركيزات معينة من المضادات الحيوية يمكن أن تحفز الاحتشاد من قرص البولي كربونات. يمكن التغلب على ذلك بسهولة باستخدام أقراص أكبر حجما متوفرة تجاريا. قد يتطلب تعطيل الأغشية الحيوية أيضا تحسينا اعتمادا على مضرب الخرزة والميكروبات المستخدمة. قمنا بتحسين طريقة التعطيل من خلال تحديد CFU / مل لعينة معروفة قبل وبعد ضرب الخرز. استخدمنا أيضا الفحص المجهري لتصور عينات نبض الخرزة لتصور مدى تعطل الأغشية الحيوية.
أحد قيود نموذج الأغشية الحيوية الذي يحاكي CF هو التعلق بسطح صلب يحتوي على البولي كربونات ، والذي لا يوجد في رئة التليف الكيسي ، بدلا من أن يكون مجاميع عائمة بحرية داخل بلغم التليف الكيسي37 . ومع ذلك ، فإن نموذج الأجار الصلب المقدم هنا يمنع الحاجة إلى غسل الأغشية الحيوية لإزالة ميكروبات العوالق ويضمن أن النتائج تشمل فقط الميكروبات المشتقة من الأغشية الحيوية بدلا من ثقافة الأغشية الحيوية العوالق المختلطة. لقد وجدنا أيضا أنه يمكن تقليل تغلغل بعض المضادات الحيوية في المناطق العميقة من نموذج الأغشية الحيوية هذا ، وقد يكون استخدام DNase مطلوبا لتغيير ريولوجيا المصفوفة خارج الخلية وتقليل التفاعلات الكهروستاتيكية مع eDNA.
نعتقد أن النموذج مناسب للغاية لاختبار مضادات الميكروبات نظرا لتعدد استخداماته وقدرته على التكيف وإدراج العوامل البيئية التي تفشل العديد من النماذج الحالية في أخذها في الاعتبار. يمكن أن يوفر استخدامه في البحوث الأساسية واختبار حساسية مضادات الميكروبات قبل السريرية نهجا أكثر صلة سريريا ب AST للعينات السريرية وتطوير علاجات جديدة.
Disclosures
لا يتم الإعلان عن أي تضارب في المصالح أو مصالح مالية متنافسة لهذا العمل.
Acknowledgements
تم تمويل هذا العمل من قبل المركز الوطني للابتكار في الأغشية الحيوية (NBIC) وهو مركز للابتكار والمعرفة يموله مجلس أبحاث التكنولوجيا الحيوية والعلوم البيولوجية ، وابتكار المملكة المتحدة ومركز هارتري [جوائز BB / R012415 / 1 و BB / X002950 / 1] ومن قبل UK CF Trust ومركز الأبحاث الاستراتيجي لمؤسسة CF الأمريكية: "إطار عمل قبل السريري قائم على الأدلة لتطوير العلاجات المضادة للميكروبات في التليف الكيسي" (PIPE-CF) [جائزة SRC022].
Materials
| Name | Company | Catalog Number | Comments |
| 1 µL inoculation loops | |||
| 13 mm 0.2 µm pore size polycarbonate discs | Isopore | GTTP01300 | Larger discs are also available |
| 2 mL reinforced tubes | Thermofisher | 15545809 | |
| 2.5 mL ceramic beads | Qiagen | 13114-325 | |
| 500 mL borosilicate glass Duran bottle | Sigma Aldrich | Z305197 | larger bottles available in larger volumes are desired |
| 6-well culture plates | Greiner | 657165 | |
| 7 mL Bijou | Thermofisher | 129B | |
| 96-well plates | Thermofisher | 167008 | for serial dilutions in CFU assay |
| Agar plates for preparing plates of P. aerugnisa, S. aureus, and C. albicans | LB miller for P. aeruginosa and S. aureus and Sabouraud dextrose agar for C. albicans | ||
| Bead beater - suitable for 2 mL tubes | Fisherbrand | 15515799 | Thermofisher bead mill 24 |
| bench top centrifuge | must be capable of at least 8000 x g | ||
| Black clear bottom 96 well plates | Costar | 3603 | |
| Bunsen Burner | |||
| Containers for disposing of contaminated equipment and material according to the institutes health and safety regulations. | |||
| deionised water | |||
| eDNA | Sigma Aldrich | 31149 | |
| Filter unit | Fisherbrand | FB12566504 | Interchangeable depending on the vacuum pump used but must have a pore size of 0.2 µm |
| Haemocytometer and cover slip | Hawksley | HC001 | Haemocytometers may differ in size and volume. Double check and adjust CFU calculations accordingly |
| LB broth | oxoid | 1.46813 | |
| Mannitol salt agar | Oxoid | CM0085B | |
| meropenem | abcr | Ab243429 | |
| Mucin from porcine stomach Type II | Sigma Aldrich | M2378 | |
| Nystatin | Millipore | 1003352658 | |
| petri dishes | SLS | SLS2000 | |
| Phosphate buffered saline | |||
| Pseudomonas isolation agar | Millipore | 17208 | |
| Resazurin sodium salt | Sigma Aldrich | 199303 | |
| Sabouraud dextrose agar | Oxoid | CM0041 | |
| selection of forceps | fine tipped and tissue forceps with teeth for transferring ceramic beads | ||
| serological pipette | |||
| shaking and static incubators | must be temperature controlled | ||
| Sparks microtitre plate reader | Tecan | For Resazurin assay the microtitre plate reader must have the appropriate filters or be a monochromator for detecting flourescence. | |
| spectrophotometer | |||
| Technical agar (Agar Technical No.2 ) | Oxoid | LP0012B | |
| tetracycline | Sigma Aldrich | T7660 | |
| UV crosslinker | Spectroline | 11-992-89 | |
| vacuum pump/ flask | Fisherbrand | FB12566504 | |
| water bath | must be capable of maintaining 55 °C | ||
| YPD broth | Millipore | Y1375 | Can be bought pre-made or made using the base ingredients |
References
- . 2021 Cf foundation patient registry highlights report Available from: https://cysticfibrosis.msu.edu/index.php/welcome/news-and-events/39-2021-cf-foundation-patient-registry-highlights-report (2022)
- Guo, J., Garratt, A., Hill, A. Worldwide rates of diagnosis and effective treatment for cystic fibrosis. J Cyst Fibros. 21 (3), 456-462 (2022).
- Mandal, V., Ghosh, N. N., Mitra, P. K., Mandal, S., Mandal, V. Production and characterization of a broad-spectrum antimicrobial 5-butyl-2-pyridine carboxylic acid from Aspergillus fumigatus nhf-01. Sci Rep. 12 (1), 6006 (2022).
- Françoise, A., Héry-Arnaud, G. The microbiome in cystic fibrosis pulmonary disease. Genes. 11 (5), 536 (2020).
- Grasemann, H., Ratjen, F. Cystic fibrosis. New Engl J Med. 389 (18), 1693-1707 (2023).
- Camus, L., Vandenesch, F., Moreau, K. From genotype to phenotype: Adaptations of pseudomonas aeruginosa to the cystic fibrosis environment. Microb Genom. 7 (3), mgen000513 (2021).
- Rossi, E., et al. Pseudomonas aeruginosa adaptation and evolution in patients with cystic fibrosis. Nat Rev Microbiol. 19 (5), 331-342 (2021).
- Flemming, H. -. C., Wingender, J. The biofilm matrix. Nat Rev Microbiol. 8 (9), 623-633 (2010).
- Grainha, T., Jorge, P., Alves, D., Lopes, S. P., Pereira, M. O. Unraveling pseudomonas aeruginosa and candida albicans communication in coinfection scenarios: Insights through network analysis. Front Cell Infect Microbiol. 10, 550505 (2020).
- Flemming, H. C., et al. Biofilms: An emergent form of bacterial life. Nat Rev Microbiol. 14 (9), 563-575 (2016).
- Høiby, N., Bjarnsholt, T., Givskov, M., Molin, S., Ciofu, O. Antibiotic resistance of bacterial biofilms. Int J Antimicrob Agents. 35 (4), 322-332 (2010).
- Lorusso, A. B., Carrara, J. A., Barroso, C. D. N., Tuon, F. F., Faoro, H. Role of efflux pumps on antimicrobial resistance in Pseudomonas aeruginosa. Int J Mol Sci. 23 (24), 15779 (2022).
- Michaelis, C., Grohmann, E. Horizontal gene transfer of antibiotic resistance genes in biofilms. Antibiotics .(Basel). 12 (2), 328 (2023).
- Worlitzsch, D., et al. Effects of reduced mucus oxygen concentration in airway pseudomonas infections of cystic fibrosis patients. J Clin Invest. 109 (3), 317-325 (2002).
- König, J., Schreiber, R., Voelcker, T., Mall, M., Kunzelmann, K. The cystic fibrosis transmembrane conductance regulator (CFTR) inhibits ENaC through an increase in the intracellular Cl- concentration. EMBO Reps. 2 (11), 1047-1051 (2001).
- Palmer, K. L., Mashburn, L. M., Singh, P. K., Whiteley, M. Cystic fibrosis sputum supports growth and cues key aspects of Pseudomonas aeruginosa physiology. J Bacteriol. 187 (15), 5267-5277 (2005).
- Valenza, G., et al. Prevalence and antimicrobial susceptibility of microorganisms isolated from sputa of patients with cystic fibrosis. J Cyst Fibros. 7 (2), 123-127 (2008).
- Alam, F., Catlow, D., Di Maio, A., Blair, J. M. A., Hall, R. A. Candida albicans enhances meropenem tolerance of Pseudomonas aeruginosa in a dual-species biofilm. J Antimicrob Chemother. 75 (4), 925-935 (2020).
- Burmølle, M., Ren, D., Bjarnsholt, T., Sørensen, S. J. Interactions in multispecies biofilms: Do they actually matter. Trends Microbiol. 22 (2), 84-91 (2014).
- Lories, B., Belpaire, T. E. R., Smeets, B., Steenackers, H. P. Competition quenching strategies reduce antibiotic tolerance in polymicrobial biofilms. NPJ Biofilms Microbiomes. 10 (1), 23 (2024).
- Nabb, D. L., et al. Polymicrobial interactions induce multidrug tolerance in Staphylococcus aureus through energy depletion. Front Microbiol. 10, 2803 (2019).
- Cornforth, D. M., et al. Pseudomonas aeruginosa transcriptome during human infection. Proc Natl Acad Sci U S A. 115 (22), E5125-E5134 (2018).
- Wolter, D. J., et al. Staphylococcus aureus small-colony variants are independently associated with worse lung disease in children with cystic fibrosis. Clin Infect Dis. 57 (3), 384-391 (2013).
- Takagi, J., et al. Mucin o-glycans are natural inhibitors of Candida albicans pathogenicity. Nat Chem Biol. 18 (7), 762-773 (2022).
- Cinical and Laboratory Standard Institute. . Methods for dilution susceptibility tests for bacteria that grow aerobically. 35 (2), (2015).
- Roberts, A. E., Kragh, K. N., Bjarnsholt, T., Diggle, S. P. The limitations of in vitro experimentation in understanding biofilms and chronic infection. J Mol Biol. 427 (23), 3646-3661 (2015).
- Macia, M. D., Rojo-Molinero, E., Oliver, A. Antimicrobial susceptibility testing in biofilm-growing bacteria. Clin Microbiol Infect. 20 (10), 981-990 (2014).
- Coenye, T., Goeres, D., Van Bambeke, F., Bjarnsholt, T. Should standardized susceptibility testing for microbial biofilms be introduced in clinical practice. Clin Microbiol Infect. 24 (6), 570-572 (2018).
- Turner, K. H., Wessel, A. K., Palmer, G. C., Murray, J. L., Whiteley, M. Essential genome of Pseudomonas aeruginosa in cystic fibrosis sputum. Proc Natl Acad Sci U S A. 112 (13), 4110-4115 (2015).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. J Hyg. 38 (6), 732-749 (1938).
- Robertson, S. N., Romero, M., Fenn, S., Kohler Riedi, P. L., Cámara, M. Development, characterization, and evaluation of a simple polymicrobial colony biofilm model for testing of antimicrobial wound dressings. J Appl Microbiol. 135 (3), lxae042 (2024).
- Rumpf, C., Lange, J., Schwartbeck, B., Kahl, B. C. Staphylococcus aureus and cystic fibrosis-a close relationship. What can we learn from sequencing studies. Pathogens. 10 (9), 1177 (2021).
- Tay, W. H., Chong, K. K. L., Kline, K. A. Polymicrobial-host interactions during infection. J Mol Biol. 428 (17), 3355-3371 (2016).
- Orazi, G., O'toole, G. A. "It takes a village": Mechanisms underlying antimicrobial recalcitrance of polymicrobial biofilms. J Bacteriol. 202 (1), e00530-e00519 (2019).
- Arjes, H. A., et al. Three-dimensional biofilm colony growth supports a mutualism involving matrix and nutrient sharing. eLife. 10, e64145 (2021).
- Kasza, K., et al. Ciprofloxacin poly(β-amino ester) conjugates enhance antibiofilm activity and slow the development of resistance. ACS Appl Mater Interf. 16 (5), 5412-5425 (2024).
- Martin, I., Waters, V., Grasemann, H. Approaches to targeting bacterial biofilms in cystic fibrosis airways. Int J Mol Sci. 22 (4), 2155 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved