Method Article
Разработка модели биопленки полимикробной колонии для тестирования противомикробных препаратов при муковисцидозе
В этой статье
Резюме
Эта методология позволяет создать модель полимикробной биопленки при муковисцидозе для тестирования чувствительности к противомикробным препаратам в исследовательских и клинических лабораториях. Эта модель обеспечивает точные и надежные результаты по целому ряду выходных данных.
Аннотация
Существует ряд моделей биопленок бактерий для тестирования антибиотиков. Однако многие из них ограничены одним экспериментальным результатом, таким как колониеобразующие единицы или метаболическая активность. Кроме того, многие модели биопленки не отражают биологические и физико-химические свойства окружающей среды человека-хозяина. Это важная проблема при многих заболеваниях, но наиболее заметно при муковисцидозе (МВ). Большая часть людей с муковисцидозом страдает как хроническими, так и интермиттирующими инфекциями, и in vitro тестирование на чувствительность к антибиотикам плохо коррелирует с результатами лечения пациентов. Некоторые модели биопленки включают среды, связанные с МВ в легких, в том числе синтетические имитации мокроты, но не учитывают полимикробную природу окружающей среды, которая изменяет архитектуру биопленки, физиологию и реакцию микробов на лечение. Описанная здесь модель биопленки колонии на границе раздела твердого воздуха обладает высокой адаптивностью и включает в себя как среды, связанные с муковисцидозом, так и полимикробный контекст. Эта модель также может быть использована для среднепроизводительного скрининга противомикробных препаратов и для изучения их влияния на динамику полимикробов. Выходными измерениями модели могут быть колониеобразующие единицы, метаболическая активность и анализ конфокальной микроскопии. Модель может быть легко адаптирована к различным микроорганизмам, средам, температурам и переменным условиям кислорода, а также может использоваться для тестирования широкого спектра химических, биологических и физических обработок.
Введение
Муковисцидоз (МВ) — это генетическое заболевание, которым страдают более 11 000 человек в Великобритании и 162 000 человек во всем мире. Несмотря на то, что муковисцидоз является полиорганным заболеванием, ключевым симптомом, с которым сталкиваются люди с муковисцидозом (pwCF), является образование аномально густой, обезвоженной слизи в дыхательных путях. Это, наряду с уменьшением биения ресничек, может усилить колонизацию легких широким спектром бактерий, грибков, вирусов и архей 4,5. Несмотря на то, что легкие муковисцидоза создают условия и селективное давление для ограничения роста и выживания микроорганизмов, бактерии, такие как Pseudomonas aeruginosa, хорошо приспособлены к этим суровым условиям6. Это позволяет как колонизировать, так и выживать, что приводит к формированию стойких хронических инфекций7.
Многие микробы, вызывающие эти хронические инфекции, делают это с помощью фенотипического сдвига от исходного планктонного к биопленочному типу роста, либоприкрепленному к поверхности, либо в агрегатах. Эти биопленки характеризуются плотно упакованными бактериальными сообществами, заключенными в матрицу экзополисахаридов (EPS), состоящую из различных компонентов, включая полисахариды, белки, липиды и экологическую ДНК (eDNA)8. Эта матрица является общей чертой для микроорганизмов; Однако его состав может отличаться. Например, основными полисахаридными компонентами бактериального матрикса P. aeruginosa являются Psl, Pel и альгинат, в отличие от грибов Candida albicans, основными полисахаридными компонентами матрицы которых являются маннаны и глюканы. В моновидовых биопленках эта матрица может сильно влиять на толерантность к антибиотикам по сравнению с планктонной за счет уменьшения проникновения антибиотиков в биопленку, снижая их эффективность. Биопленочный тип роста также индуцирует образование персистентных клеток со сниженной метаболической активностью по сравнению с их планктонными аналогами и, следовательно, еще больше снижает чувствительность кантибиотикам. Этот тип роста также характеризуется активацией некоторых механизмов устойчивости к антибиотикам, таких как насосы оттока и те, которые необходимы для горизонтального переноса генов, что позволяет обмениваться генами устойчивости 11,12,13. В дополнение к этому, связанная с заболеванием среда хозяина очень сильно влияет на физиологию микробов и то, как они реагируют на антибиотики. Это включает в себя повышенный микроаэробиоз в густой слизи, а также доступность нестандартных источников углерода, таких как аминокислоты и эДНК, либо полученных от хозяина, либо в результате микробной деградации продуктов легких 14,15,16.
Эти специфические взаимодействия еще больше осложняются полимикробной природой биопленок, что вносит дополнительный уровень сложности со сложными взаимодействиями не только между бактериями, но и между бактериями и грибами. По сравнению с бактериальными биопленками, менее известно о некоторых взаимодействиях между бактериальными и грибковыми биопленками, несмотря на то, что C. albicans был выделен у более чем 75% людей с CF15. Как правило, взаимодействие между C. albicans и бактериями, такими как P. aeruginosa, является антагонистическим, но может приводить к более хроническим и тяжелым инфекциям18. Сочетание микробных взаимодействий, как патогенных, так и комменсальных , наряду с рядом факторов окружающей среды, связанных с муковисцидозом, может в конечном итоге привести к повышению толерантности к антибиотикам19,20. Многие из этих факторов не часто учитываются в доклинических испытаниях антибиотиков, несмотря на то, что они связаны с повышенной толерантностью к антибиотикам в существующих моделях.
Эти условия также трудно воспроизвести in vitro, и в результате во многих моделях отсутствуют специфические факторы, вызывающие толерантность, присутствующие при pwCF, такие как увеличение продукции бета-лактамазы у P. aeruginosa22, индукция небольших вариантов колонии у Staphylococcus aureus и ингибирование переноса у C. albicans; все они, как было показано, встречаются в мокроте23,24 МВ.
Таким образом, существует большое расхождение между условиями, используемыми в современных методах тестирования чувствительности к антибиотикам, основанных на планктонных культурах или культурах, выращенных на агаровых пластинах в стандартизированных средах, таких как анализ Мюллера-Хинтона с дисковой диффузией, Etest и микроразведением бульона CLSI, и условиями, встречающимисяв окружающей среде хозяина. Это часто не позволяет точно определить чувствительность к антибиотикам26. Эта проблема еще больше осложняется отсутствием стандартизации в тестировании антимикробной биопленки, что затрудняет точный перенос антимикробной эффективности из лаборатории в клинику27,28.
Разработанная нами полимикробная модель демонстрирует повышенную толерантность Pseudomonas aeruginosa к ряду противомикробных препаратов, включая меропенем и тобрамицин. Это иллюстрирует большие различия между текущими испытаниями антимикробных препаратов с использованием моновидовых биопленок и моделью полимикробной биопленки, разработанной в данном исследовании для определения минимальных ингибирующих концентраций. Эта модель также поддерживает относительно высокую производительность и недорогую желательную для тестирования противомикробных препаратов. Модель также может быть использована для изучения влияния антимикробной терапии на динамику полимикробной терапии и установления того, может ли конкретное лечение привести к тому, что тот или иной патоген станет доминирующим, что позволит прогнозировать дальнейшие осложнения. Несмотря на то, что эта модель позволяет создавать сложные биопленки, ее настройка не требует сложного лабораторного оборудования и обеспечивает платформу для широкого спектра клинических и исследовательских результатов.
протокол
1. Получение синтетических сред для муковисцидоза-2 (SCFM2) и планшетов
- Приготовьте SCFM2 в соответствии с рецептурой, описанной в Palmer et al.16 в бутылке из боросиликатного стекла объемом 500 мл в 2-кратной концентрации с некоторыми модификациями.
- Взвесьте и подготовьте запасы, как указано в таблице 1. Подготовьте запасы аминокислот в соответствии с таблицей 2.
- Взвесьте 5 г муцина (из желудка свинины (тип II)) и 600 мг эДНК (из спермы лосося) в 100 мл dH2O в бутылке из боросиликатного стекла объемом 200 мл. Перемешать при 4 °C в течение ночи перед стерилизацией автоклавированием.
- В стерилизованный флакон объемом 500 мл добавьте 0,54 г глюкозы, 6,06 г NaCl и 2,228 г KCl. Добавьте по 10 мл каждого из запасов, приготовленных на шаге 1.1.1. Отрегулируйте pH до 6,9 с помощью 1 М NaOH или HCl.
- Добавьте 10 мл dH2O, затем 10 мл 0,175 М CaCl2 и 0,0606 М MgCl2. Приготовьте и добавьте 10 мл 0,93 М L-молочной кислоты. Непосредственно перед применением добавьте 10 мл 0,36 мМ Fe(III)SO47H2O
- Простерилизуйте SCFM2 фильтром с помощью фильтрующего блока и вакуумного насоса, затем добавьте автоклавный муцин и эДНК.
ПРИМЕЧАНИЕ: Приготовленный SCFM2 можно хранить при температуре 4 °C до 1 месяца.
- Подготовьте агаровые пластины SCFM2, как описано ниже.
- Предварительно нагрейте 25 мл 2x SCFM2 в пробирке объемом 50 мл на водяной бане при температуре 55 °C перед смешиванием с 25 мл предварительно расплавленного 3% технического агара, в результате чего получится смесь 1x SCFM2 и 1,5% (w/v) технического агара.
- С помощью серологической пипетки перелейте по 5 мл смеси в каждую лунку 6-луночного планшета.
- Приготовьте такое же количество 13-миллиметровых поликарбонатных дисков с размером пор 0,2 мкм, поместив их на дно чашки Петри и применив УФ-С в течение 600 с с длиной волны 254 нм и частотой 60 Гц. Переверните диски и повторите процедуру УФ-С.
- После того, как технический агар 1x SCFM2-1,5 % (w/v) схватится, используйте стерильные щипцы для добавления одного поликарбонатного диска на поверхность каждой лунки 6-луночного планшета.
2. Подготовка бактерий к инфекции
- Перед настройкой модели подготовьте агаровые пластины для требуемых штаммов бактерий и грибков в соответствии со стандартным агаром, используемым в лаборатории для P. aeruginosa PAO1, S. aureus SH1000 и C. albicans SC5314 (например, бульон Lysogeny с 1,2% (w/v) агаром для бактерий и агар декстрозы Сабуро для C. albicans).
ПРИМЕЧАНИЕ: Для создания модели были использованы специальные лабораторные эталонные штаммы. Тем не менее, эта модель также использовалась с другими штаммами, включая клинические изоляты, с некоторыми модификациями, такими как увеличение времени создания биопленки перед лечением более медленно растущими штаммами. - Используйте петлю инокуляции объемом 1 мкл, чтобы выбрать одну колонию каждого микроорганизма для инокулирования 5 мл стандартных лабораторных жидких сред (например, бульона Lysogeny для P. aeruginosa, S. aureus и пептона декстрозы дрожжей (YPD) для C. albicans). Инкубируйте эти культуры до тех пор, пока они не достигнут фазы экспоненциального роста при 200 об/мин, 37 °C для бактерий, и 200 об/мин, 30 °C для C. albicans.
ПРИМЕЧАНИЕ: Аэрация будет отличаться в зависимости от встряхивающего инкубатора и радиуса вращения
3. Настройка модели твердотельного воздушного интерфейса
ПРИМЕЧАНИЕ: Общее схематическое представление модели можно увидеть на дополнительном рисунке 1.
- Перелейте по 1 мл каждой жидкой культуры в отдельную стерильную пробирку объемом 1,5 мл и центрифугируйте в течение 2 минут при давлении 8 000 x g для гранулирования бактерий и грибков. Выполните этот и все последующие этапы центрифугирования при комнатной температуре.
- Отасканируйте надосадочную жидкость с помощью пипетки и повторно суспендируйте гранулы в 1 мл PBS перед центрифугированием, еще раз, в течение 2 минут при 8000 x g.
- Удалите надосадочную жидкость, как и раньше, и снова суспендируйте гранулы в 1 мл PBS. Развести ресуспендированные клетки P. aeruginosa и S. aureus в соотношении 1:10 в PBS и измерить оптическую плотность с помощью спектрофотометра на длине волны 600 нм.
- Отрегулируйте промытые образцы до 1 x 108 колониеобразующих единиц (КОЕ)/мл на основании предварительной проверки того, что наружный диаметр600 0,05 для P. aeruginosa и 0,1 для S. aureus эквивалентен 1 x 108 КОЕ/мл.
- Для C. albicans разведите промытые образцы в соотношении 1:100 в PBS, добавьте по 10 мкл каждого в две отдельные камеры гемоцитометра и используйте фиксированные размеры камеры и используемое разведение для расчета КОЕ/мл. С помощью усовершенствованного гемоцитометра Нейбауэра расчет будет следующим:
Количество клеток = среднее количество клеток × 10 000 / (коэффициент разбавления) - Рассчитанные КОЕ представляют собой КОЕ/мл C. albicans в предварительно разбавленной пробе. Отрегулируйте образец C. albicans до 1 x 108 КОЕ/мл в PBS, как и в случае с бактериальными культурами.
- Чтобы подготовить инокулюм для добавления в биопленку, отрегулируйте инокулюм P. aeruginosa до 1 x 104 КОЕ/мл (2 100-кратных разведения), C. albicans до 1 x 105 КОЕ/мл (100-кратное разведение с последующим 10-кратным разведением) и, наконец, S. aureus до 1 x 106 КОЕ/мл (100-кратное разведение) с использованием PBS.
- Для моновидовых биопленок добавьте 10 мкл разбавленного нужного микроба в центр поликарбонатного диска, предварительно помещенного на шестилуночные планшеты с 1x SCFM2-1,5 % техническим агаром, и статически инкубируйте при 37 °C в течение 24 ч перед обработкой или разрушением.
- Для полимикробных биопленок добавьте по 10 мкл S. aureus и C. albicans друг на друга на одном диске. Инокулированный диск инкубировать статически в течение 24 ч при 37 °C.
ПРИМЕЧАНИЕ: Порядок добавления инокулятов S. aureus и C. albicans не влияет на разработку модели и дает те же результаты. - После этого переложите поликарбонатные диски на свежие 1x SCFM2-1,5% технические агаровые пластины стерильными щипцами и добавьте 10 мкл 1 x 104 КОЕ /мл разведения P. aeruginosa поверх предварительно созданной биопленки S. aureus - C. albicans . Инкубировать еще 24 ч при 37 °C.
Примечание: P. aeruginosa добавляется через 24 ч после S. aureus и C. albicans , чтобы отразить порядок, в котором эти организмы часто колонизируют легкие муковисцидоза у людей с муковисцидозом. Это также предотвращает перерастание P. aeruginosa двух других микроорганизмов. После добавления P. aeruginosa биопленку можно выращивать дольше 24 часов; Тем не менее, поликарбонатный диск с биопленкой необходимо переносить на свежую среду каждые 24 часа. Перед разрушением биопленки можно использовать для микроскопии с использованием штаммов, экспрессирующих флуоресцентные белки, флуоресцентные красители или штамм/микробно-специфические антитела. Однако стоит отметить, что некоторые красители окрашивают поликарбонатный диск.
4. Разрушение биопленки
- Добавьте к пластинам керамические шарики диаметром 2,8 мм и сшивайте пластины ультрафиолетовым излучением, как описано в пункте 1.3. Добавьте 5 керамических шариков в стерильную трубку гомогенизатора объемом 2 мл с помощью стерилизованных пламенем щипцов. Затем пипеткой нанесите 1 мл фосфатно-солевого буфера (PBS) в гомогенизационную пробирку объемом 2 мл.
- Вихревые трубки в течение не менее 10 с или до тех пор, пока биопленка не будет удалена с поликарбонатного диска, определенного визуальным осмотром, после чего удалите поликарбонатный диск.
- Поместите трубки с шариками в гомогенизатор и взбивайте 2 раза в течение 10 с со скоростью 6 м/с с интервалом 10 секунд между ударами.
ПРИМЕЧАНИЕ: Эта комбинация гранул, времени взбивания и использования гомогенизатора приводит к достаточному разрушению биопленки с минимальным лизисом, как это определено с помощью микроскопии и колониеобразующих единиц. Это может варьироваться в зависимости от конкретного используемого бисера. - Вылейте разрушенную биопленку из трубки гомогенизатора в бижутерию объемом 7 мл, содержащую 4 мл PBS, в результате чего конечный объем составит 5 мл.
- Убедитесь, что вся жидкость из трубок гомогенизатора была перенесена в бижутерию, центрифугируя пробирки при 8 000 x g в течение 2 минут и передавая оставшуюся жидкость в бижутерию объемом 7 мл.
ПРИМЕЧАНИЕ: Из этих 5 мл разрушенной биопленки можно провести целый ряд анализов, но важно помнить при любых расчетах о разведении биопленки PBS на 1 мл до конечного объема 5 мл.
5. Тестирование метаболической активности
- Добавьте 200 мкл разрушенной биопленки из шага 4 выше в 96-луночный лабораторный планшет с прозрачным дном. Затем добавьте 10 μL 0,02% (w/v) раствора резазурина.
- Инкубируйте обработанную резазурином биопленку с помощью планшетного ридера и измеряйте метаболическую активность. Инкубируйте планшет при температуре 37 °C, применяя орбитальное встряхивание каждые 30 минут в течение 10 с при 200 об/мин, прежде чем снимать какие-либо флуоресцентные показания.
- Измерьте флуоресценцию с помощью возбуждения 540 нм и излучения 590 нм. Повторяйте этот 30-минутный цикл в течение 4 часов с помощью считывателя пластин.
ПРИМЕЧАНИЕ: Используется временная точка 4 часа, поскольку она обеспечивает более четкие различия между обработанными и необработанными образцами, а также между образцами с различными концентрациями антибиотиков.
6. Тестирование чувствительности к противомикробным препаратам
- Чтобы проверить толерантность стандартных антибиотиков к противомикробным препаратам, солюбилизируйте выбранные антибиотики в соответствующем растворителе и добавьте его в 1x SCFM2-1,5% (w/v) техническую агаровую среду в еще жидком состоянии перед тем, как перекачать по 5 мл в каждую лунку шестилуночного планшета. После схватывания перенесите биопленку, выращенную на поликарбонатном диске, в верхнюю часть среды, содержащей антибиотики, с помощью стерильных щипцов и добавьте каплю 10 мкл соответствующей концентрации антибиотика на верхнюю часть биопленки.
Примечание: Для данного исследования было использовано 2-кратное серийное разведение меропенема и тобрамицина в 2 логарифм между 64 мкг/мл и 0,125 мкг/мл для отражения клинически значимых концентраций. Достаточно введения антибиотиков или других противомикробных/антивирулентных препаратов исключительно поверх биопленки, так как аналогичные реакции наблюдались при добавлении как в среду, так и на биопленку. - После 24 ч инкубации при 37 °C с обработкой визуализируйте биопленки и разрушайте, как описано на этапе 4.
- Из 5 мл разрушенной культуры возьмите аликвоту и проведите 10-кратное серийное разведение с помощью PBS. Выделите 10 мкл пятен в трех экземплярах на агаре, чтобы определить колониеобразующие единицы с помощью метода Майлза и Мисры30.
ПРИМЕЧАНИЕ: Объем, добавленный к агаровым пластинам, повлияет на предел обнаружения, большие объемы уменьшат предел обнаружения, но потребуют больше образцов и агаровых пластин. - Для моновидовых биопленок полосы P. aeruginosa и S. aureus наносятся на пластины LB-агара, а C. albicans — на агар SDA.
- Для получения полимикробных биопленок поместите аликвоты на три различные селективные среды, содержащие антибиотики, чтобы изолировать каждый из трех видов и определить КОЕ. К ним относятся изоляционный агар Pseudomonas и солевой агар маннита, содержащие нистатин в концентрации 10 мкг/мл для выделения P. aeruginosa и S. aureus соответственно, и агар декстрозы Сабуро с тетрациклином в концентрации 125 мкг/мл для выделения C. albicans. Инкубируйте планшеты S. aureus при 37 °C в течение ночи, а планшеты P. aeruginosa и C. albicans — при 30 °C.
ПРИМЕЧАНИЕ: Инкубируйте планшеты P. aeruginosa при температуре 30 °C, чтобы свести к минимуму чрезмерный рост колонии и уменьшить роение.
Результаты
Простота модели биопленки на границе между твердым телом и воздухом позволяет одновременно проводить скрининг большого количества противомикробных препаратов в различных клинически значимых условиях. Эта модель позволяет оценить эффективность антибиотиков с использованием подсчета КОЕ и метаболических анализов как в мономикробных, так и в полимикробных биопленках в течение недели. Благодаря особенностям модели она также позволяет легко манипулировать условиями окружающей среды, такими как изменение состава среды и помещение биопленок в анаэробные условия с пониженным содержанием кислорода. Используя эту модель, мы показали изменения толерантности к двум антибиотикам, обычно используемым при pwCF, между P. aeruginosa, выращенными в моновидах, и полимикробными биопленками (рис. 1). Наряду с этим нам удалось определить, как антимикробная обработка может повлиять на динамику популяции в полимикробных биопленках (рис. 2).
Для проведения этих экспериментов готовили исходный инокулюм, как указано в вышеуказанном протоколе, что приводило к образованию стабильных моновидов и полимикробных биопленок с воспроизводимыми КОЕ/мл и малыми стандартными отклонениями, определяемыми с помощью одностороннего или двустороннего ANOVA. Эта модель также показала постоянный рост и восстановление КОЕ, а также возможность комбинировать эти классические методы микробиологии с другими методами, не выполненными в этом исследовании, без необходимости сложной обработки. К ним относятся визуализация, например, живой/мертвый, матричная визуализация и молекулярный анализ, которые другие трехмерные модели не могут предложить в такой доступной форме (рис. 1)31. Следует отметить, что ожидаемое стандартное отклонение для КОЕ/мл увеличивается, когда данные отображаются в виде процента выживаемости по сравнению с КОЕ/мл (рис. 1). При сравнении эффективности лечения антибиотиками между моновидами и полимикробными биопленками наблюдалось значительное увеличение всех концентраций антибиотиков, необходимых для достижения 50% уничтожения. Для достижения такого уровня уничтожения меропенема и тобрамицина необходимо было увеличить концентрацию антибиотиков на 2 log (Рисунок 1). Также наблюдалось общее увеличение выживаемости P. aeruginosa в присутствии S. aureus и C. albicans в полимикробной биопленке при обработке тобрамицином в дозе 64 мкг/мл, в то время как для меропенема наблюдалось обратное.
Метод, используемый для определения метаболической активности, измеряет общую активность всей полимикробной биопленки, не имея возможности различить индивидуальный вклад каждого вида. По этой причине показано, что только моновидовые метаболические изменения демонстрируют использование анализов метаболической активности для данной модели. Для моновидовых биопленок выявлена сильная связь между выживаемостью P. aeruginosa и метаболической активностью как меропенема, так и тобрамицина (рис. 2). Использование как метаболической активности, так и количества КОЕ из одних и тех же образцов позволяет легко идентифицировать как бактериостатические, так и бактерицидные эффекты. Для полимикробных биопленок определение метаболической активности может указывать на то, как нацеливание на один вид может индуцировать общее увеличение метаболической активности биопленки и, следовательно, потенциально увеличить рост микроорганизмов других видов.
Несмотря на то, что КОЕ являются золотым стандартом для тестирования чувствительности к противомикробным препаратам, в полимикробных биопленках они также позволяют оценить видовой состав биопленки. Рассматривая P. aeruginosa в полимикробных биопленках, мы можем не только показать повышенный MBEC50 для этого организма, но и установить эффект, который он оказывает на другие совместно изолированные виды (рис. 3). Это наблюдается, например, при меропенеме (антисинегнойном), где снижение P. aeruginosa сопровождается увеличением КОЕ S. aureus и C. albicans , в результате чего S. aureus становится наиболее распространенным организмом при воздействии определенных концентраций антибиотиков (рис. 3A). Это подчеркивает важность учета полимикробной природы биопленки из-за потенциального увеличения размера популяции других болезнетворных видов при лечении конкретного патогена.
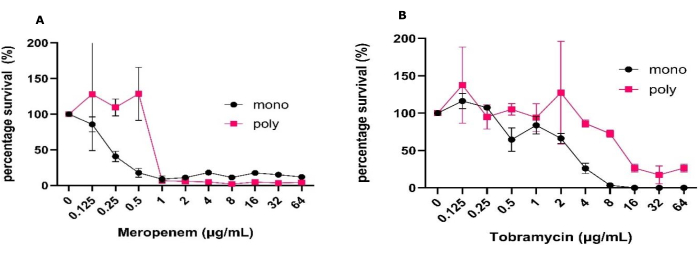
Рисунок 1: Вариация толерантности P. aeruginosa к меропенему и тобрамицину между моно- и полимикробными биопленками, выращенными в модели твердотельного и воздушного интерфейса. P. aeruginosa PAO1, выращенной в моно- или полимикробных биопленках с S. aureus и C. albicans , была установлена с использованием моделей соприкосновения твердого тела и воздуха в течение 24 ч на SCFM2. Биопленки обрабатывали диапазоном концентраций (А)меропенем или (В)тобрамицина в диапазоне концентраций от 0,125 мкг/мл до 64 мкг/мл вместе с контролем без антибиотиков. Определяли КОЕ/мл каждой биопленки. P. aeruginosa КОЕ определяли по ПИА и пересчитывали в процент выживаемости с использованием отрицательного контроля в качестве 100% выживаемости. Полосы погрешностей обозначают стандартное отклонение, и каждая точка данных получается из 3 биологических повторов, каждый из которых имеет три технических повтора. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Изменение метаболической активности биопленок P. aeruginosa в присутствии меропенема или тобрамицина, выращенных в модели раздела твердый воздух. P. aeruginosa Биопленки PAO1 выращивали на SCFM2 в модели сопряжения твердого тела с воздухом, и добавляли диапазон концентраций (А) меропенема или (В) тобрамицина от 0,125 мкг/мл до 64 мкг/мл вместе с контролем без антибиотиков. Пластина считывалась флуоресцентно с волнением 540 нм и излучением 590 нм каждые 30 минут. Процент метаболической активности рассчитывали путем определения процента этой активности на каждом образце, обработанном антибиотиками, по сравнению с контролем без антибиотиков. Полосы погрешностей обозначают стандартное отклонение, и каждая точка данных получается из 3 биологических повторов, каждый из которых имеет три технических повтора. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
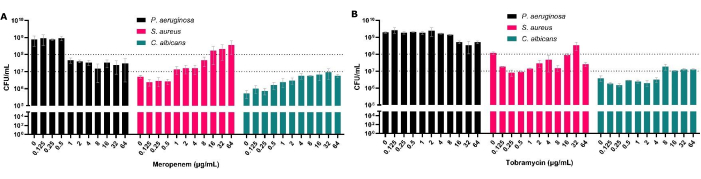
Рисунок 3: Влияние на общее количество КОЕ P. aeruginosa, S. aureus и C. albicans , восстановленных с помощью полимикробной модели твердотопливного и воздушного интерфейса после антимикробной обработки. S. aureus и C. albicans выращивали на SCFM2 по модели твердотельного воздушного интерфейса. Добавляли P. aeruginosa , и в биопленки добавляли концентрации (А) меропенема или (В) тобрамицина в диапазоне от 0,125 мкг/мл до 64 мкг/мл наряду с контролем без антибиотиков. Определяли КОЕ/мл каждой биопленки. Полосы погрешностей обозначают стандартное отклонение, и каждая точка данных была получена из 3 биологических повторов, каждый из которых содержит три технических повтора. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный рисунок 1: Создание и рабочий процесс модели интерфейса между твердым телом и воздухом. Графическое представление создания модели интерфейса между твердым телом и воздухом, разрушения биопленки и выходных данных. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Описанная здесь модель биопленки позволяет нам имитировать некоторые аспекты среды легочной инфекции при муковисцидозе, включая ряд распространенных полимикробных взаимодействий более доступным способом, чем это используется в настоящее время в методах тестирования противомикробных препаратов in vitro , таких как реактор CDC и модель биопленки Лаббока31. Это важно, когда ряд факторов, включая физические свойства биопленки, доступность питательных веществ и молекулярные взаимодействия между видами внутри биопленки, могут влиять как на активность антимикробного агента, так и на реакцию микробов напротивомикробный препарат. Включив эти факторы, мы смогли разработать очень универсальную модель, которая может более точно прогнозировать результаты антимикробного лечения, чем существующие модели, которые не учитывают вышеупомянутые факторы.
P. aeruginosa, S. aureus и C. albicans были выбраны в качестве репрезентативных грамположительных, грамотрицательных и грибов, обычно выделяемых при CF32. Тем не менее, мы также смогли показать, что эта модель может быть использована для ряда других микробов, связанных с муковисцидозом, включая Burkholderia cenocepacia, Burkholderia multivorans, Aspergillus fumigatus, и в настоящее время адаптируется для использования с анаэробными бактериями, такими как Prevotella melaninogenica. Это демонстрирует универсальность модели, поскольку в нее может быть включен широкий спектр микробов, что подчеркивает ее адаптивность для тестирования противомикробных препаратов против широкого спектра микробных патогенов. Модель также может быть легко адаптирована к различным условиям окружающей среды для более персонализированного тестирования чувствительности к противомикробным препаратам, включая замену SCFM2 мокротой пациента.
Рассмотрение моделей полимикробной биопленки для тестирования новых противомикробных препаратов также имеет первостепенное значение, поскольку они могут заполнить существующий пробел в процессе разработки противомикробных препаратов до их использования в исследованиях на животных или людях33,34. Наряду с этим, модель поддерживает относительно высокую производительность и позволяет получать ряд результатов, актуальных как для промышленности, так и для исследований.
Несмотря на то, что в данной статье мы продемонстрировали только КОЕ и метаболическую активность, мы также продемонстрировали полезность модели при анализе экзометаболома биопленки с помощью масс-спектрометрии поверхностного анализа жидкой экстракции (LESA). Это позволяет исследовать некоторые молекулярные механизмы, лежащие в основе толерантности к противомикробным препаратам35. В дополнение к этим другим результатам, мы также продемонстрировали использование этой модели для тестирования новых систем доставки противомикробных препаратов. К ним относятся полимер-ципрофлоксациновые конъюгаты для усиления проникновения этого антибиотика внутрь биопленки при одновременном повышении его активности и снижении развития резистентности36.
Важные шаги и рекомендации
Важно поддерживать стерильность, особенно при производстве SCFM2 и сред, так как загрязнение может привести к внедрению невстречающихся в природе веществ, что может повлиять на результаты. Разные штаммы одного и того же микроба и разные микробы могут требовать разных условий окружающей среды для роста или могут иметь разные характеристики роста. Поэтому модель должна быть оптимизирована перед проведением любого тестирования чувствительности к антибиотикам. Мы рекомендуем провести небольшое пилотное исследование в течение 24 ч и 48 ч для моновидов и полимикробной биопленки для оценки роста в стандартных модельных условиях. Мы обнаружили, что различные штаммы P. aeruginosa и определенные концентрации антибиотиков могут вызывать роение поликарбонатного диска. Это можно легко преодолеть, используя диски большего размера, которые имеются в продаже. Разрушение биопленки также может потребовать оптимизации в зависимости от взбивателя гранул и используемых микробов. Мы оптимизировали метод разрушения, определив КОЕ/мл известного образца до и после биения бусин. Мы также использовали микроскопию для визуализации образцов биения бусин, чтобы визуализировать, насколько хорошо была разрушена биопленка.
Одним из ограничений этой модели биопленки, имитирующей муковисцидоз, является прикрепление к твердой поверхности, содержащей поликарбонат, который не обнаруживается в легких при муковисцидозе, а не в виде свободно плавающих агрегатов в мокроте муковисцидоза37 . Тем не менее, представленная здесь модель твердого агара исключает необходимость промывки биопленок для удаления планктонных микробов и гарантирует, что результаты включают только микробы, полученные из биопленки, в отличие от смешанной планктонной культуры биопленки. Мы также обнаружили, что проникновение некоторых антибиотиков в более глубокие области этой биопленочной модели может быть снижено, а использование ДНКазы может потребоваться для изменения реологии внеклеточного матрикса и уменьшения электростатических взаимодействий с эДНК.
Мы считаем, что модель очень подходит для тестирования противомикробных препаратов благодаря своей универсальности, адаптивности и включению факторов окружающей среды, которые многие существующие модели не учитывают. Его использование в фундаментальных исследованиях и доклинических испытаниях чувствительности к противомикробным препаратам может обеспечить более клинически значимый подход к АСТ клинических образцов и разработке новых методов лечения.
Раскрытие информации
В связи с этой работой не декларируется конфликт интересов или конкурирующие финансовые интересы.
Благодарности
Эта работа была профинансирована Национальным инновационным центром биопленок (NBIC), который является центром инноваций и знаний, финансируемым Исследовательским советом по биотехнологии и биологическим наукам, Innovate UK и Hartree Centre [Награды BB/R012415/1 и BB/X002950/1], а также Британским фондом CF Trust и Стратегическим исследовательским центром США CF: «Научно обоснованная доклиническая основа для разработки антимикробной терапии при муковисцидозе» (PIPE-CF) [Премия SRC022].
Материалы
| Name | Company | Catalog Number | Comments |
| 1 µL inoculation loops | |||
| 13 mm 0.2 µm pore size polycarbonate discs | Isopore | GTTP01300 | Larger discs are also available |
| 2 mL reinforced tubes | Thermofisher | 15545809 | |
| 2.5 mL ceramic beads | Qiagen | 13114-325 | |
| 500 mL borosilicate glass Duran bottle | Sigma Aldrich | Z305197 | larger bottles available in larger volumes are desired |
| 6-well culture plates | Greiner | 657165 | |
| 7 mL Bijou | Thermofisher | 129B | |
| 96-well plates | Thermofisher | 167008 | for serial dilutions in CFU assay |
| Agar plates for preparing plates of P. aerugnisa, S. aureus, and C. albicans | LB miller for P. aeruginosa and S. aureus and Sabouraud dextrose agar for C. albicans | ||
| Bead beater - suitable for 2 mL tubes | Fisherbrand | 15515799 | Thermofisher bead mill 24 |
| bench top centrifuge | must be capable of at least 8000 x g | ||
| Black clear bottom 96 well plates | Costar | 3603 | |
| Bunsen Burner | |||
| Containers for disposing of contaminated equipment and material according to the institutes health and safety regulations. | |||
| deionised water | |||
| eDNA | Sigma Aldrich | 31149 | |
| Filter unit | Fisherbrand | FB12566504 | Interchangeable depending on the vacuum pump used but must have a pore size of 0.2 µm |
| Haemocytometer and cover slip | Hawksley | HC001 | Haemocytometers may differ in size and volume. Double check and adjust CFU calculations accordingly |
| LB broth | oxoid | 1.46813 | |
| Mannitol salt agar | Oxoid | CM0085B | |
| meropenem | abcr | Ab243429 | |
| Mucin from porcine stomach Type II | Sigma Aldrich | M2378 | |
| Nystatin | Millipore | 1003352658 | |
| petri dishes | SLS | SLS2000 | |
| Phosphate buffered saline | |||
| Pseudomonas isolation agar | Millipore | 17208 | |
| Resazurin sodium salt | Sigma Aldrich | 199303 | |
| Sabouraud dextrose agar | Oxoid | CM0041 | |
| selection of forceps | fine tipped and tissue forceps with teeth for transferring ceramic beads | ||
| serological pipette | |||
| shaking and static incubators | must be temperature controlled | ||
| Sparks microtitre plate reader | Tecan | For Resazurin assay the microtitre plate reader must have the appropriate filters or be a monochromator for detecting flourescence. | |
| spectrophotometer | |||
| Technical agar (Agar Technical No.2 ) | Oxoid | LP0012B | |
| tetracycline | Sigma Aldrich | T7660 | |
| UV crosslinker | Spectroline | 11-992-89 | |
| vacuum pump/ flask | Fisherbrand | FB12566504 | |
| water bath | must be capable of maintaining 55 °C | ||
| YPD broth | Millipore | Y1375 | Can be bought pre-made or made using the base ingredients |
Ссылки
- . 2021 Cf foundation patient registry highlights report Available from: https://cysticfibrosis.msu.edu/index.php/welcome/news-and-events/39-2021-cf-foundation-patient-registry-highlights-report (2022)
- Guo, J., Garratt, A., Hill, A. Worldwide rates of diagnosis and effective treatment for cystic fibrosis. J Cyst Fibros. 21 (3), 456-462 (2022).
- Mandal, V., Ghosh, N. N., Mitra, P. K., Mandal, S., Mandal, V. Production and characterization of a broad-spectrum antimicrobial 5-butyl-2-pyridine carboxylic acid from Aspergillus fumigatus nhf-01. Sci Rep. 12 (1), 6006 (2022).
- Françoise, A., Héry-Arnaud, G. The microbiome in cystic fibrosis pulmonary disease. Genes. 11 (5), 536 (2020).
- Grasemann, H., Ratjen, F. Cystic fibrosis. New Engl J Med. 389 (18), 1693-1707 (2023).
- Camus, L., Vandenesch, F., Moreau, K. From genotype to phenotype: Adaptations of pseudomonas aeruginosa to the cystic fibrosis environment. Microb Genom. 7 (3), mgen000513 (2021).
- Rossi, E., et al. Pseudomonas aeruginosa adaptation and evolution in patients with cystic fibrosis. Nat Rev Microbiol. 19 (5), 331-342 (2021).
- Flemming, H. -. C., Wingender, J. The biofilm matrix. Nat Rev Microbiol. 8 (9), 623-633 (2010).
- Grainha, T., Jorge, P., Alves, D., Lopes, S. P., Pereira, M. O. Unraveling pseudomonas aeruginosa and candida albicans communication in coinfection scenarios: Insights through network analysis. Front Cell Infect Microbiol. 10, 550505 (2020).
- Flemming, H. C., et al. Biofilms: An emergent form of bacterial life. Nat Rev Microbiol. 14 (9), 563-575 (2016).
- Høiby, N., Bjarnsholt, T., Givskov, M., Molin, S., Ciofu, O. Antibiotic resistance of bacterial biofilms. Int J Antimicrob Agents. 35 (4), 322-332 (2010).
- Lorusso, A. B., Carrara, J. A., Barroso, C. D. N., Tuon, F. F., Faoro, H. Role of efflux pumps on antimicrobial resistance in Pseudomonas aeruginosa. Int J Mol Sci. 23 (24), 15779 (2022).
- Michaelis, C., Grohmann, E. Horizontal gene transfer of antibiotic resistance genes in biofilms. Antibiotics .(Basel). 12 (2), 328 (2023).
- Worlitzsch, D., et al. Effects of reduced mucus oxygen concentration in airway pseudomonas infections of cystic fibrosis patients. J Clin Invest. 109 (3), 317-325 (2002).
- König, J., Schreiber, R., Voelcker, T., Mall, M., Kunzelmann, K. The cystic fibrosis transmembrane conductance regulator (CFTR) inhibits ENaC through an increase in the intracellular Cl- concentration. EMBO Reps. 2 (11), 1047-1051 (2001).
- Palmer, K. L., Mashburn, L. M., Singh, P. K., Whiteley, M. Cystic fibrosis sputum supports growth and cues key aspects of Pseudomonas aeruginosa physiology. J Bacteriol. 187 (15), 5267-5277 (2005).
- Valenza, G., et al. Prevalence and antimicrobial susceptibility of microorganisms isolated from sputa of patients with cystic fibrosis. J Cyst Fibros. 7 (2), 123-127 (2008).
- Alam, F., Catlow, D., Di Maio, A., Blair, J. M. A., Hall, R. A. Candida albicans enhances meropenem tolerance of Pseudomonas aeruginosa in a dual-species biofilm. J Antimicrob Chemother. 75 (4), 925-935 (2020).
- Burmølle, M., Ren, D., Bjarnsholt, T., Sørensen, S. J. Interactions in multispecies biofilms: Do they actually matter. Trends Microbiol. 22 (2), 84-91 (2014).
- Lories, B., Belpaire, T. E. R., Smeets, B., Steenackers, H. P. Competition quenching strategies reduce antibiotic tolerance in polymicrobial biofilms. NPJ Biofilms Microbiomes. 10 (1), 23 (2024).
- Nabb, D. L., et al. Polymicrobial interactions induce multidrug tolerance in Staphylococcus aureus through energy depletion. Front Microbiol. 10, 2803 (2019).
- Cornforth, D. M., et al. Pseudomonas aeruginosa transcriptome during human infection. Proc Natl Acad Sci U S A. 115 (22), E5125-E5134 (2018).
- Wolter, D. J., et al. Staphylococcus aureus small-colony variants are independently associated with worse lung disease in children with cystic fibrosis. Clin Infect Dis. 57 (3), 384-391 (2013).
- Takagi, J., et al. Mucin o-glycans are natural inhibitors of Candida albicans pathogenicity. Nat Chem Biol. 18 (7), 762-773 (2022).
- Cinical and Laboratory Standard Institute. . Methods for dilution susceptibility tests for bacteria that grow aerobically. 35 (2), (2015).
- Roberts, A. E., Kragh, K. N., Bjarnsholt, T., Diggle, S. P. The limitations of in vitro experimentation in understanding biofilms and chronic infection. J Mol Biol. 427 (23), 3646-3661 (2015).
- Macia, M. D., Rojo-Molinero, E., Oliver, A. Antimicrobial susceptibility testing in biofilm-growing bacteria. Clin Microbiol Infect. 20 (10), 981-990 (2014).
- Coenye, T., Goeres, D., Van Bambeke, F., Bjarnsholt, T. Should standardized susceptibility testing for microbial biofilms be introduced in clinical practice. Clin Microbiol Infect. 24 (6), 570-572 (2018).
- Turner, K. H., Wessel, A. K., Palmer, G. C., Murray, J. L., Whiteley, M. Essential genome of Pseudomonas aeruginosa in cystic fibrosis sputum. Proc Natl Acad Sci U S A. 112 (13), 4110-4115 (2015).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. J Hyg. 38 (6), 732-749 (1938).
- Robertson, S. N., Romero, M., Fenn, S., Kohler Riedi, P. L., Cámara, M. Development, characterization, and evaluation of a simple polymicrobial colony biofilm model for testing of antimicrobial wound dressings. J Appl Microbiol. 135 (3), lxae042 (2024).
- Rumpf, C., Lange, J., Schwartbeck, B., Kahl, B. C. Staphylococcus aureus and cystic fibrosis-a close relationship. What can we learn from sequencing studies. Pathogens. 10 (9), 1177 (2021).
- Tay, W. H., Chong, K. K. L., Kline, K. A. Polymicrobial-host interactions during infection. J Mol Biol. 428 (17), 3355-3371 (2016).
- Orazi, G., O'toole, G. A. "It takes a village": Mechanisms underlying antimicrobial recalcitrance of polymicrobial biofilms. J Bacteriol. 202 (1), e00530-e00519 (2019).
- Arjes, H. A., et al. Three-dimensional biofilm colony growth supports a mutualism involving matrix and nutrient sharing. eLife. 10, e64145 (2021).
- Kasza, K., et al. Ciprofloxacin poly(β-amino ester) conjugates enhance antibiofilm activity and slow the development of resistance. ACS Appl Mater Interf. 16 (5), 5412-5425 (2024).
- Martin, I., Waters, V., Grasemann, H. Approaches to targeting bacterial biofilms in cystic fibrosis airways. Int J Mol Sci. 22 (4), 2155 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены