Method Article
פיתוח מודל ביופילם של מושבה פולימיקרוביאלית לבדיקת אנטי-מיקרוביאלים בסיסטיק פיברוזיס
In This Article
Summary
מתודולוגיה זו מאפשרת הקמת מודל ביופילם פולימיקרוביאלי בסיסטיק פיברוזיס לבדיקת רגישות מיקרוביאלית במעבדות מחקר וקליניות. מודל זה מספק תוצאות מדויקות ואמינות על פני מגוון תפוקות.
Abstract
קיימים מגוון מודלים של ביופילם חיידקים לבדיקת אנטיביוטיקה. עם זאת, רבים מהם מוגבלים לפלט ניסיוני יחיד, כגון יחידות יוצרות מושבה או פעילות מטבולית. יתר על כן, מודלים רבים של ביופילם אינם משקפים את התכונות הביולוגיות והפיסיוכימיות של הסביבה המארחת האנושית. זהו נושא חשוב במצבים רבים, אך בעיקר בסיסטיק פיברוזיס (CF). חלק גדול מהאנשים עם CF סובלים הן מזיהומים כרוניים והן מזיהומים לסירוגין, ובמבחנה, בדיקות רגישות לאנטיביוטיקה בקורלציה נמוכה עם תוצאות הטיפול בחולים. חלק מדגמי הביופילם משלבים מדיה רלוונטית לריאות CF, כולל חיקויי כיח סינתטיים, אך אינם לוקחים בחשבון את הטבע הרב-מיקרוביאלי של הסביבה, אשר משנה את ארכיטקטורת הביופילם, הפיזיולוגיה והאופן שבו מיקרובים מגיבים לטיפול. מודל הביופילם של מושבת ממשק האוויר המוצק המתואר כאן הוא בעל יכולת התאמה גבוהה ומשלב הן מדיה רלוונטית ל-CF והן הקשר פולימיקרוביאלי. מודל זה יכול לשמש גם לסינון בתפוקה בינונית של אנטי-מיקרוביאלים ולחקר השפעתם על דינמיקה רב-מיקרוביאלית. מדידות פלט מהמודל יכולות להיות יחידות יוצרות מושבה, פעילות מטבולית וניתוח מיקרוסקופיה קונפוקלית. ניתן להתאים את המודל בקלות למיקרואורגניזמים שונים, מדיה, טמפרטורות ותנאי חמצן משתנים וניתן להשתמש בו כדי לבחון מגוון רחב של טיפולים כימיים, ביולוגיים ופיזיים.
Introduction
סיסטיק פיברוזיס (CF) היא מצב גנטי המשפיע על יותר מ -11,000 אנשים בבריטניה ו -162,000 אנשים ברחבי העולם 1,2. למרות CF היא מחלה מרובת איברים, סימפטום מרכזי שחווים אנשים עם סיסטיק פיברוזיס (pwCF) הוא היווצרות של ריר סמיך ומיובש באופן חריג בתוך מערכת הנשימה שלהם3. זה, יחד עם הפחתת מכות ריסונים, יכול לשפר את ההתיישבות של הריאות על ידי מגוון רחב של חיידקים, פטריות, וירוסים, ארכאה 4,5. למרות שריאות CF מספקות תנאים ולחצים סלקטיביים להגבלת הצמיחה וההישרדות של מיקרואורגניזמים, חיידקים כגון Pseudomonas aeruginosa מותאמים מאוד לסביבות קשות אלה6. זה מאפשר גם נשאות והישרדות, וכתוצאה מכך היווצרות של זיהומים כרוניים מתמשכים7.
רבים מהמיקרובים הגורמים לזיהומים כרוניים אלה עושים זאת באמצעות מעבר פנוטיפי מפלנקטוניקה ראשונית לסגנון צמיחה של ביופילם, בין אם מחוברים לפני השטח או בצברים7. ביופילמים אלה מאופיינים בקהילות חיידקים צפופות העטופות במטריצה אקסופוליסכרידית (EPS) המורכבת ממגוון רכיבים, כולל רב-סוכרים, חלבונים, ליפידים ודנ"א סביבתי (eDNA)8. מטריצה זו היא תכונה משותפת בין מיקרואורגניזמים; עם זאת, הרכבו יכול להיות שונה. לדוגמה, המרכיבים הרב-סוכריים העיקריים של מטריצת P. aeruginosa החיידקית הם Psl, Pel ו-alginate, בניגוד לפטריות Candida albicans, שמרכיביהן העיקריים של מטריצת הרב-סוכר הם mannans ו-glucans9. בביופילמים חד-מינים, מטריצה זו יכולה להשפיע מאוד על סבילות לאנטיביוטיקה בהשוואה לפלקטוניק על ידי הפחתת חדירת אנטיביוטיקה לביופילם, הפחתת יעילותם10. סגנון הגידול של הביופילם גורם גם להיווצרות תאים מתמידים עם פעילות מטבולית מופחתת בהשוואה לעמיתיהם הפלנקטוניים, ולכן ירידה נוספת ברגישות לאנטיביוטיקה11. סגנון גידול זה מאופיין גם בהגברת הרגולציה של כמה מנגנוני עמידות לאנטיביוטיקה, כגון משאבות אפלוקס ואלה הדרושים להעברת גנים אופקית, המאפשרים חילופי גנים עמידים 11,12,13. בנוסף לאלה, הסביבה הקשורה למחלות של המארח משפיעה מאוד על הפיזיולוגיה המיקרוביאלית ועל האופן שבו הם מגיבים לאנטיביוטיקה. זה כולל מיקרו-אירוביוזה מוגברת בתוך הריר הסמיך, כמו גם את הזמינות של מקורות פחמן לא סטנדרטיים כגון חומצות אמינו ודנ"א סביבתי, בין אם נגזר מארח או פירוק מיקרוביאלי של תוצרי ריאות 14,15,16.
אינטראקציות ספציפיות אלה מסובכות עוד יותר על ידי האופי הפולימיקרוביאלי של ביופילמים, אשר מציג שכבה נוספת של מורכבות עם אינטראקציות מורכבות לא רק בין חיידקים אלא גם בין חיידקים ופטריות. בהשוואה לביופילמים חיידקיים, ידוע פחות על חלק מהאינטראקציות בין ביופילמים חיידקיים ופטרייתיים, למרות ש-C. albicans בודד מיותר מ-75% מהאנשים עם CF15. באופן כללי, יחסי הגומלין בין C. albicans לבין חיידקים כמו P. aeruginosa הם אנטגוניסטיים, אך יכולים לגרום לזיהומים כרוניים וחמורים יותר18. השילוב של אינטראקציות מיקרוביאליות, הן פתוגניות והן קומנסליות, לצד מגוון גורמים סביבתיים הקשורים ל-CF יכול בסופו של דבר לגרום לסבילות מוגברת לאנטיביוטיקה19,20. רבים מגורמים אלה אינם נלקחים בחשבון לעתים קרובות בבדיקות אנטיביוטיות פרה-קליניות, למרות שהם מיוחסים לסבילות מוגברת לאנטיביוטיקה במודלים קיימים21.
תנאים אלה גם קשים לשחזור במבחנה, וכתוצאה מכך, מודלים רבים חסרים נוכחות של גורמים ספציפיים מעוררי סובלנות נוכחים pwCF, כגון אלה המגבירים את ייצור בטא-לקטמאז ב P. aeruginosa22, השראת גרסאות מושבה קטנות ב Staphylococcus aureus ועיכוב מיקוף ב C. albicans; כל אלה הוכחו כמתרחשים בכיח CF23,24.
יש, אם כן, פער גדול בין התנאים המשמשים בשיטות בדיקת רגישות לאנטיביוטיקה הנוכחיות, המבוססות על תרביות פלנקטוניות או אגר-פלטות שגדלו במדיה סטנדרטית כגון מולר-הינטון עם דיפוזיית דיסק, Etest, ובדיקות מיקרודילוציה של מרק CLSI, לבין התנאים שבהם נתקלים בסביבה המארחת25. לעתים קרובות זה לא מצליח לקבוע במדויק את הרגישות לאנטיביוטיקה26. בעיה זו מסובכת עוד יותר בשל היעדר סטנדרטיזציה בבדיקות ביופילם אנטי-מיקרוביאליות, מה שמקשה על תרגום מדויק של יעילות אנטי-מיקרוביאלית מהמעבדה למרפאה27,28.
המודל הרב-מיקרוביאלי שפיתחנו כאן מדגים סבילות משופרת של Pseudomonas aeruginosa למגוון אנטי-מיקרוביאליים, כולל מרופנם וטוברמיצין. זה ממחיש את השונות הגדולה בין הבדיקות האנטי-מיקרוביאליות הנוכחיות באמצעות ביופילמים חד-מינים לבין מודל הביופילם הרב-מיקרוביאלי שפותח במחקר זה כדי לקבוע ריכוזים מעכבים מינימליים. מודל זה גם שומר על תפוקה גבוהה יחסית ועלות נמוכה רצויה לבדיקות מיקרוביאליות. המודל יכול לשמש גם כדי לחקור את ההשפעה של טיפול מיקרוביאלי על דינמיקה מיקרוביאלית ולקבוע אם טיפול מסוים עשוי להוביל לכך שפתוגן מסוים יהפוך לדומיננטי, מה שיאפשר חיזוי של סיבוכים נוספים. למרות שמודל זה מאפשר הצטברות של ביופילמים מורכבים, הקמתו אינה דורשת ציוד מעבדה מתוחכם ומספקת פלטפורמה למגוון רחב של תפוקות קליניות ומחקריות.
Protocol
1. הכנת סיסטיק פיברוזיס מדיה-2 סינתטי (SCFM2) וצלחות
- הכינו SCFM2 על פי המתכון המתואר בפאלמר ואחרים 16 בבקבוק זכוכית בורוסיליקט 500 מ"ל בריכוז פי 2 עם כמה שינויים.
- לשקול ולהכין מלאי כמצוין בטבלה 1. הכינו מלאי חומצות אמינו לפי טבלה 2.
- שקלו 5 גרם מוצין (מקיבה חזירית (סוג II)) ו-600 מ"ג דנ"א סביבתי (מזרע סלמון) ב-100 מ"ל של dH2O בבקבוק זכוכית בורוסיליקט של 200 מ"ל. יש לערבב בטמפרטורה של 4°C למשך הלילה לפני העיקור על ידי autoclaving.
- לבקבוק מעוקר של 500 מ"ל, הוסף 0.54 גרם גלוקוז, 6.06 גרם NaCl ו- 2.228 גרם KCl. הוסף 10 מ"ל כל אחד מהמלאי שהוכן בשלב 1.1.1. כוונן את רמת החומציות ל-6.9 באמצעות 1M NaOH או HCl.
- הוסף 10 מ"ל של dH2O ואחריו 10 מ"ל של 0.175 M CaCl2 ו- 0.0606 M של MgCl2. להכין ולהוסיף 10 מ"ל של 0.93 M L- חומצה לקטית. מיד לפני השימוש, יש להוסיף 10 מ"ל של 0.36 mM Fe(III)SO47H2O
- סנן את SCFM2 באמצעות יחידת מסנן ומשאבת ואקום, ולאחר מכן הוסף את המוצין והדנ"א הסביבתי האוטומטיים.
הערה: ניתן לאחסן את SCFM2 המוכן בטמפרטורה של 4°C למשך עד חודש אחד.
- הכינו צלחות אגר SCFM2 כמתואר להלן.
- חממו מראש 25 מ"ל של 2x SCFM2 בצינור של 50 מ"ל באמבט מים של 55°C לפני ערבוב עם 25 מ"ל של אגר טכני 3% (w/v) מותך מראש, והתוצאה היא תערובת של 1x SCFM2 ו-1.5% (w/v) אגר טכני.
- באמצעות פיפטה סרולוגית, להעביר 5 מ"ל של התערובת לתוך כל באר של צלחת 6 באר.
- הכינו את אותו מספר של דיסקי פוליקרבונט בקוטר 13 מ"מ בגודל נקבוביות של 0.2 מיקרומטר על ידי הנחתם בתחתית צלחת פטרי והחלת UV-C למשך 600 שניות באורך גל של 254 ננומטר ובתדר של 60 הרץ. הפוך את הדיסקים וחזור על הליך UV-C.
- לאחר הגדרת האגר הטכני 1x SCFM2-1.5% (w/v), השתמש במלקחיים סטריליים כדי להוסיף דיסק פוליקרבונט יחיד לפני השטח של כל באר של צלחת 6 בארות.
2. הכנת חיידקים לזיהום
- לפני הגדרת הדגם, הכינו צלחות אגר עבור זני החיידקים והפטריות הדרושים בהתאם לאגר הסטנדרטי המשמש במעבדה עבור P. aeruginosa PAO1, S. aureus SH1000 ו - C. albicans SC5314 (למשל, מרק ליזוגני עם 1.2% (w/v) אגר עבור חיידקים ואגר דקסטרוז Sabouraud עבור C. albicans).
הערה: כדי לבסס את המודל, נעשה שימוש בזני ייחוס מעבדתיים ספציפיים. עם זאת, מודל זה שימש גם עם זנים אחרים, כולל מבודדים קליניים, עם כמה שינויים, כגון הגדלת הזמן להקמת ביופילם לפני הטיפול בזנים הגדלים לאט יותר. - השתמש בלולאת חיסון של 1 μL כדי לבחור מושבה אחת של כל מיקרואורגניזם כדי לחסן 5 מ"ל של מדיה נוזלית סטנדרטית במעבדה (למשל, מרק ליזוגני עבור P. aeruginosa, S. aureus ושמרים פפטון דקסטרוז (YPD) עבור C. albicans). לדגור על תרביות אלה עד שהן מגיעות לשלב הגידול המעריכי ב 200 סל"ד, 37 ° C עבור החיידקים, ו 200 סל"ד, 30 ° C עבור C. albicans.
הערה: האוורור ישתנה בהתאם לאינקובטור הרעידה ולרדיוס הסיבוב
3. הגדרת מודל ממשק האוויר המוצק
הערה: ייצוג סכמטי כולל של המודל ניתן לראות באיור משלים 1.
- מעבירים 1 מ"ל מכל תרבית נוזלית לצינור סטרילי נפרד של 1.5 מ"ל וצנטריפוגה למשך 2 דקות במהירות של 8,000 x גרם כדי לגרוף את החיידקים/פטריות. בצע שלב זה ואת כל שלבי הצנטריפוגה הבאים בטמפרטורת החדר.
- שאפו את הסופרנאטנט באמצעות פיפטה והשעו מחדש את הכדוריות ב-1 מ"ל PBS לפני הצנטריפוגה, שוב, למשך 2 דקות ב-8,000 x גרם.
- הסר את supernatant כמו קודם והשהה מחדש את הכדורים ב 1 מ"ל של PBS. לדלל את התאים P. aeruginosa ו - S. aureus 1:10 ב- PBS ולמדוד צפיפות אופטית באמצעות ספקטרופוטומטר באורך גל של 600 ננומטר.
- התאם דגימות שטופות ל- 1 x 108 colony forming unit (CFU)/mL בהתבסס על אימות מוקדם ש- OD600 של 0.05 עבור P. aeruginosa ו- 0.1 עבור S. aureus שווה ערך ל- 1 x 108 CFU/mL.
- עבור C. albicans, לדלל דגימות שטופות 1:100 ב- PBS, להוסיף 10 μL של כל אחד לשני חדרים בודדים של המוציטומטר, ולהשתמש בממדים הקבועים של החדר ואת הדילול המשמש לחישוב CFU/mL. באמצעות ההמוציטומטר המשופר של נויבאואר החישוב יהיה כדלקמן:
מספר התאים = ספירת תאים ממוצעת × 10,000 / (גורם דילול) - CFUs המחושבים מייצגים C. albicans CFU/ mL במדגם המדולל מראש. התאימו את דגימת C. albicans ל-1 x 108 CFU/mL ב-PBS כמו בתרביות החיידקים.
- כדי להכין את החיסון לתוספת לביופילם, התאימו את P. aeruginosa inoculum ל-1 x 104 CFU/mL (דילול פי 2 פי 100), C. albicans ל-1 x 105 CFU/mL (דילול פי 100 ואחריו דילול פי 10) ולבסוף, S. aureus ל-1 x 106 CFU/mL (דילול פי 100) באמצעות PBS.
- עבור ביופילמים חד-מינים, יש להוסיף 10 μL של החיידק הרצוי המדולל למרכז דיסק הפוליקרבונט שהונח קודם לכן על צלחות שש בארות אגר טכני 1x SCFM2-1.5% ולדגור סטטית ב-37°C במשך 24 שעות לפני טיפול או הפרעה.
- עבור ביופילמים פולימיקרוביאליים, הוסף 10 μL של כל S. aureus ו - C. albicans זה על גבי זה על אותו דיסק. לדגור על הדיסק המחוסן באופן סטטי במשך 24 שעות ב 37 ° C.
הערה: הסדר שבו מוסיפים חיסונים S. aureus ו - C. albicans אינו משפיע על התפתחות המודל ומייצר את אותן תוצאות. - לאחר מכן, העבר את דיסקיות הפוליקרבונט ללוחות אגר טכניים טריים 1x SCFM2-1.5% עם מלקחיים סטריליים והוסף 10 μL של דילול 1 x 104 CFU/mL של P. aeruginosa על גבי ביופילם S. aureus - C. albicans שנקבע מראש. לדגור עוד 24 שעות ב 37 מעלות צלזיוס.
הערה: P. aeruginosa מתווסף 24 שעות אחרי S. aureus ו - C. albicans כדי לשקף את הסדר שבו אורגניזמים אלה מאכלסים לעתים קרובות את הריאה CF אצל אנשים עם CF. זה גם מונע P . aeruginosa מלגדול יותר משני מיקרואורגניזמים אחרים. לאחר הוספת P. aeruginosa , ניתן לגדל את הביופילם במשך יותר מ -24 שעות; עם זאת, דיסק פוליקרבונט עם ביופילם צריך להיות מועבר מדיה טרייה כל 24 שעות. לפני השיבוש, ניתן להשתמש בביופילמים למיקרוסקופיה באמצעות זנים המבטאים חלבונים פלואורסצנטיים, צבעים פלואורסצנטיים או נוגדנים ספציפיים לזן/מיקרוב. עם זאת, ראוי לציין כי כמה צבעים להכתים את דיסק פוליקרבונט.
4. שיבוש ביופילם
- הוסף חרוזי קרמיקה בקוטר של 2.8 מ"מ ללוחות ו- UV-crosslink את הלוחות כמתואר בשלב 1.3. מוסיפים 5 חרוזי קרמיקה לצינור הומוגנייזר סטרילי בנפח 2 מ"ל באמצעות מלקחיים מעוקרים בלהבה. לאחר מכן, פיפטה 1 מ"ל של מלוחים חוצצים פוספט (PBS) לתוך צינור הומוגניזציה 2 מ"ל.
- צינורות מערבולת למשך 10 שניות לפחות או עד להסרת הביופילם מדיסק הפוליקרבונט, שנקבע על ידי בדיקה חזותית, ואז מוציאים את דיסק הפוליקרבונט.
- מניחים צינורות עם החרוזים בהומוגנייזר ומקציפים במשך 2x במשך 10 שניות ב 6 m/s עם מרווח של 10 שניות בין פעימות.
הערה: שילוב זה של חרוזים, זמן פעימה ושימוש בהומוגנייזר גורם להפרעה מספקת של הביופילם עם ליזה מינימלית כפי שנקבע על ידי מיקרוסקופיה ויחידות יוצרות מושבה. זה עשוי להשתנות בהתאם למקציף החרוזים הספציפי שבו נעשה שימוש. - שפכו ביופילם משובש מצינור ההומוגנייזר לתוך ביז'ו 7 מ"ל המכיל 4 מ"ל PBS, וכתוצאה מכך נפח סופי של 5 מ"ל.
- ודא שכל הנוזלים מצינורות ההומוגנייזר הועברו לביז'ו על ידי צנטריפוגה של הצינורות ב 8,000 x גרם למשך 2 דקות והעברת הנוזל הנותר לביז'ו 7 מ"ל.
הערה: מתוך 5 מ"ל זה של ביופילם משובש, ניתן לבצע מגוון של בדיקות, אך חשוב לזכור עבור כל חישוב את דילול PBS ביופילם של 1 מ"ל לנפח סופי של 5 מ"ל.
5. בדיקת פעילות מטבולית
- הוסף 200 μL של הביופילם המשובש משלב 4 לעיל לצלחת באר 96 שחורה בעלת תחתית ברורה. לאחר מכן, הוסף 10 μL של 0.02% (w/v) תמיסת resazurin.
- דגרו על הביופילם שטופל בראזורין בעזרת קורא צלחות וקראו את הפעילות המטבולית. יש לדגור על הצלחת בטמפרטורה של 37°C, תוך הפעלת רעידות מסלוליות כל 30 דקות במשך 10 שניות ב-200 סל"ד לפני ביצוע קריאות פלואורסצנטיות כלשהן.
- למדוד את הפלואורסצנטיות באמצעות עירור של 540 ננומטר ופליטה של 590 ננומטר. חזור על מחזור זה של 30 דקות במשך 4 שעות באמצעות קורא לוחות.
הערה: נקודת הזמן של 4 שעות משמשת מכיוון שהיא מספקת וריאציות ברורות יותר בין דגימות מטופלות לעומת דגימות לא מטופלות ובין דגימות עם ריכוזי אנטיביוטיקה משתנים.
6. בדיקת רגישות מיקרוביאלית
- כדי לבדוק את הסבילות האנטי-מיקרוביאלית של אנטיביוטיקה סטנדרטית, יש להמיס את האנטיביוטיקה המועדפת בממס הרלוונטי שלה ולהוסיף אותה למדיום אגר טכני 1x SCFM2-1.5% (w/v) בעודו נוזלי לפני העברת 5 מ"ל לכל באר של צלחת בעלת שש בארות. לאחר ההגדרה, העבירו את הביופילם שגדל על דיסק הפוליקרבונט לחלק העליון של המדיה המכילה אנטיביוטיקה באמצעות מלקחיים סטריליים והוסיפו טיפה של 10 μL מריכוז האנטיביוטיקה המתאים לחלק העליון של הביופילם.
הערה: במחקר זה נעשה שימוש בדילול סדרתי של 2 לוגים בין 64 מיקרוגרם/מ"ל ל-0.125 מק"ג/מ"ל של מרופנם וטוברמיצין כדי לשקף ריכוזים רלוונטיים מבחינה קלינית. מתן אנטיביוטיקה או טיפולים אנטי-מיקרוביאליים / אנטי-אלימים אחרים אך ורק על גבי הביופילם מספיק, שכן תגובות דומות נצפו כאשר הוסיפו אותן הן למדיה והן לביופילם. - לאחר 24 שעות של דגירה ב 37 מעלות צלזיוס עם הטיפול, תמונה ביופילמים לשבש כמתואר בשלב 4.
- מ 5 מ"ל של תרבות משובשת, לקחת aliquot ולבצע דילול טורי פי 10 באמצעות PBS. לוחית החוצה 10 μL כתמים במשולש על אגר כדי לקבוע יחידות יוצרות מושבה באמצעות שיטת מיילס ומצרה30.
הערה: הנפח שיתווסף ללוחות אגר ישפיע על גבול הזיהוי, נפחים גדולים יותר יפחיתו את מגבלת הגילוי אך ידרשו יותר דגימה וצלחות אגר. - עבור ביופילמים חד-מינים, פסים P. aeruginosa ו - S. aureus על לוחות אגר LB ו - C. albicans על אגר SDA.
- עבור ביופילמים רב-מיקרוביאליים, הניחו אליציטוטים על שלוש מדיות סלקטיביות שונות המכילות אנטיביוטיקה כדי לבודד כל אחד משלושת המינים ולאפשר את קביעת CFUs. זה כולל אגר בידוד Pseudomonas ואגר מלח מניטול המכיל nystatin ב 10 מיקרוגרם / מ"ל כדי לבודד P. aeruginosa ו S. aureus, בהתאמה, ו Sabouraud דקסטרוז אגר עם טטרציקלין ב 125 מיקרוגרם / מ"ל כדי לבודד C. albicans. לדגור על לוחות S. aureus ב 37 ° C בלילה ו P. aeruginosa ו C. albicans צלחות ב 30 °C (75 °F).
הערה: יש לדגור על לוחות P. aeruginosa בטמפרטורה של 30°C כדי למזער צמיחת יתר של מושבות ולהפחית נחילים.
תוצאות
הפשטות של מודל הביופילם של ממשק אוויר מוצק מאפשרת סריקה של מספר רב של אנטי-מיקרוביאלים בתנאים קליניים שונים בו זמנית. מודל זה מאפשר להעריך את היעילות של אנטיביוטיקה באמצעות ספירות CFU ובדיקות מטבוליות בביופילמים מונו ופולימיקרוביאליים להתבצע בתוך שבוע. בשל אופיו של המודל, הוא מאפשר גם מניפולציה קלה של תנאי הסביבה, כגון שינוי הרכב המדיה והצבת הביופילמים בתנאים מופחתי חמצן ואנאירוביים. באמצעות המודל הזה הראינו שינויים בסבילות לשתי אנטיביוטיקות שנמצאות בשימוש נפוץ ב-pwCF בין P. aeruginosa שגדל בביופילמים חד-מינים וביופילמים רב-מיקרוביאליים (איור 1). לצד זאת, הצלחנו לקבוע כיצד טיפול אנטי-מיקרוביאלי יכול להשפיע על דינמיקת האוכלוסייה בתוך ביופילמים רב-מיקרוביאליים (איור 2).
כדי לבצע ניסויים אלה, החיסון הראשוני הוכן כמפורט בפרוטוקול לעיל, מה שהוביל להיווצרות של מיני מונו יציבים וביופילמים פולימיקרוביאליים עם CFU/mL הניתנים לשחזור וסטיות תקן קטנות כפי שנקבעו על ידי ANOVA בכיוון אחד או דו-כיווני. מודל זה הדגיש גם צמיחה עקבית והתאוששות CFU, כמו גם מאפשר את האפשרות לשלב טכניקות מיקרוביולוגיה קלאסיות אלה עם טכניקות אחרות שלא בוצעו במחקר זה ללא צורך בעיבוד מתוחכם. אלה כוללים הדמיה כגון חיים/מתים, הדמיית מטריצה ואנליזה מולקולרית, שמודלים תלת-ממדיים אחרים אינם מסוגלים להציע באופן כה נגיש (איור 1)31. יש לציין כי סטיית התקן הצפויה עבור CFU/mL עולה כאשר הנתונים מוצגים כאחוז ההישרדות בהשוואה ל-CFU/mL (איור 1). כאשר השוו את יעילות הטיפול האנטיביוטי בין מיני מונו לבין ביופילמים פולימיקרוביאליים, חלה עלייה משמעותית בכל ריכוזי האנטיביוטיקה הדרושים להשגת 50% הריגה. היה צורך בעלייה של 2 לוגים בריכוז האנטיביוטיקה כדי להשיג רמה כזו של הרג עבור מרופנם וטוברמיצין (איור 1). הייתה גם עלייה כללית בהישרדות P . aeruginosa בנוכחות S. aureus ו - C. albicans בביופילם הפולימיקרוביאלי כאשר טופלו בטוברמיצין 64 מיקרוגרם/מ"ל, בעוד שההפך היה נכון עבור מרופנם.
השיטה המשמשת לקביעת הפעילות המטבולית מודדת את הפעילות הכוללת של כל הביופילם הפולימיקרוביאלי מבלי להיות מסוגל להבחין בין התרומה האינדיבידואלית מכל מין. מסיבה זו, רק שינויים מטבוליים חד-מינים מוצגים כדי להדגים את השימוש במבחני פעילות מטבולית עבור מודל זה. עבור ביופילמים של מינים מונו היה קשר חזק בין הישרדות P. aeruginosa לבין פעילות מטבולית הן עבור מרופנם והן עבור טוברמיצין (איור 2). השימוש הן בפעילות מטבולית והן בספירות CFU מאותן דגימות מאפשר זיהוי קל של השפעות בקטריוסטטיות וקוטלי חיידקים. עבור ביופילמים רב-מיקרוביאליים, קביעת הפעילות המטבולית עשויה להצביע על האופן שבו מיקוד של מין אחד עשוי לגרום לעלייה כוללת בפעילות המטבולית של ביופילם, ולכן עשוי להגביר את הצמיחה המיקרוביאלית של מינים אחרים.
למרות ש-CFUs הם תקן הזהב לבדיקת רגישות מיקרוביאלית, בביופילמים רב-מיקרוביאליים הם מאפשרים גם להעריך את הרכב המינים בתוך הביופילם. על-ידי טיפול ב-P. aeruginosa בביופילמים רב-מיקרוביאליים, אנו לא רק מסוגלים להראות את ה-MBEC50 המוגבר עבור האורגניזם הזה, אלא גם לקבוע את ההשפעה שיש לכך על מינים אחרים שבודדו יחד (איור 3). זה נראה, למשל, עם meropenem (antipseudomonal), שם הירידה של P. aeruginosa מלווה בעלייה ב-S. aureus וב-C. albicans CFU, וכתוצאה מכך S. aureus הופך לאורגניזם הנפוץ ביותר לאחר חשיפה לריכוזים מסוימים של אנטיביוטיקה (איור 3A). זה מדגיש את החשיבות של התחשבות באופי הרב-מיקרוביאלי של הביופילם בשל הגידול הפוטנציאלי בגודל האוכלוסייה של מינים גורמי מחלות אחרים בעת טיפול בפתוגן מסוים.
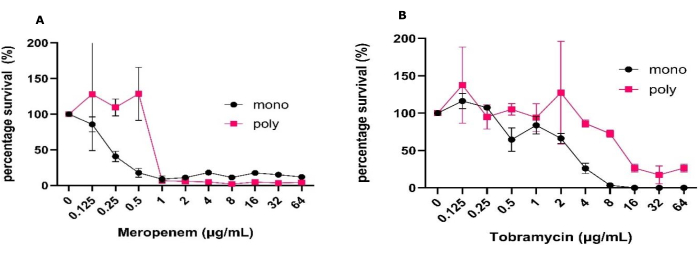
איור 1: שונות בסבילות האנטי-מיקרוביאלית של P. aeruginosa למרופנם וטוברמיצין בין ביופילמים מונו-מיקרוביאליים ופולימיקרוביאליים שגדלו במודל ממשק אוויר מוצק. P. aeruginosa PAO1 שגדל בביופילמים מיקרוביאליים מונו או פולי עם S. aureus ו-C. albicans הוקם באמצעות מודלים של ממשק אוויר מוצק במשך 24 שעות על SCFM2. ביופילמים טופלו בטווח של ריכוזי (A) מרופנם או (B) טוברמיצין מ-0.125 מיקרוגרם/מ"ל עד 64 מק"ג/מ"ל יחד עם בקרה ללא אנטיביוטיקה. נקבע ה-CFU/mL של כל ביופילם. פ. ארוגינוסה CFUs נקבעו ב-PIA והומרו לאחוזי הישרדות על ידי שימוש בבקרה השלילית כ-100% הישרדות. קווי שגיאה מציינים סטיית תקן, וכל נקודת נתונים נגזרת מ-3 חזרות ביולוגיות, שבכל אחת מהן שלוש חזרות טכניות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: שונות בפעילות המטבולית של ביופילמים של P. aeruginosa בנוכחות מרופנם או טוברמיצין שגדלו במודל ממשק האוויר המוצק. פ. ארוגינוסה ביופילמים PAO1 גודלו על SCFM2 במודל ממשק אוויר מוצק, ונוספו טווח של ריכוזי (A) מרופנם או (B) טוברמיצין מ-0.125 מיקרוגרם/מ"ל עד 64 מק"ג/מ"ל יחד עם בקרה ללא אנטיביוטיקה. הצלחת נקראה באופן פלואורסצנטי בעירור של 540 ננומטר ופליטה של 590 ננומטר כל 30 דקות. אחוז הפעילות המטבולית חושב על ידי קביעת אחוז פעילות זו בכל דגימה שטופלה באנטיביוטיקה בהשוואה לבקרה ללא אנטיביוטיקה. קווי שגיאה מציינים סטיית תקן, וכל נקודת נתונים נגזרת מ-3 חזרות ביולוגיות, שבכל אחת מהן שלוש חזרות טכניות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
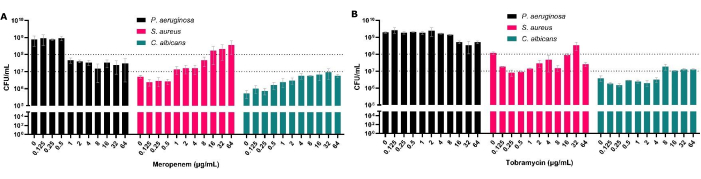
איור 3: השפעה על הספירה הכוללת של CFU של P. aeruginosa, S. aureus ו-C. albicans שהתאוששו ממודל ממשק אוויר מוצק רב-מיקרוביאלי לאחר טיפול אנטי-מיקרוביאלי. S. aureus ו - C. albicans גודלו על SCFM2 בדגם ממשק האוויר המוצק. P. aeruginosa נוסף, וטווח של 0.125 מיקרוגרם/מ"ל עד 64 מיקרוגרם/מ"ל ריכוזים של (A) מרופנם או (B) טוברמיצין נוספו לביופילמים לצד בקרה ללא אנטיביוטיקה. נקבע ה-CFU/mL של כל ביופילם. קווי שגיאה מציינים סטיית תקן, וכל נקודת נתונים נגזרת מ-3 חזרות ביולוגיות, כל אחת עם שלוש חזרות טכניות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תרשים משלים 1: הקמה וזרימת עבודה של מודל ממשק אוויר מוצק. ייצוג גרפי של הקמת מודל ממשק אוויר מוצק, שיבוש ביופילם ותפוקות. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
מודל הביופילם המתואר כאן מאפשר לנו לחקות היבטים מסוימים של סביבת זיהום ריאות CF על ידי שילוב מגוון של אינטראקציות פולימיקרוביאליות נפוצות בדרך נגישה יותר מזו המשמשת כיום בשיטות בדיקה אנטי-מיקרוביאליות במבחנה , כגון כור CDC ומודלביופילם לובוק 31. זה חשוב כאשר מגוון גורמים, כולל התכונות הפיזיקליות של הביופילם, זמינות חומרי מזון ואינטראקציות מולקולריות בין המינים בתוך הביופילם, יכולים להשפיע הן על הפעילות של החומר האנטי-מיקרוביאלי והן על התגובה של המיקרובים לאנטי-מיקרוביאלית21. על ידי שילוב גורמים אלה, הצלחנו לפתח מודל רב-תכליתי ביותר שעשוי לאפשר חיזוי מדויק יותר של תוצאות טיפול מיקרוביאלי מאשר מודלים נוכחיים שאינם לוקחים בחשבון את הגורמים הנ"ל.
P. aeruginosa, S. aureus ו-C. albicans נבחרו כמייצגים גראם-חיובי, גראם-שלילי ופטריות שבודדו בדרך כלל ב-CF32. עם זאת, הצלחנו גם להראות כי מודל זה יכול לשמש למגוון של חיידקים אחרים הרלוונטיים ל-CF, כולל Burkholderia cenocepacia, Burkholderia multivorans, Aspergillus fumigatus, והוא מותאם כעת לשימוש עם חיידקים אנאירוביים כגון Prevotella melaninogenica. זה מדגים את הרבגוניות של המודל כאשר ניתן לשלב מגוון רחב של חיידקים, מה שמדגיש את יכולת ההסתגלות של מודל זה לבדיקות מיקרוביאליות כנגד מגוון רחב של פתוגנים מיקרוביאליים. ניתן גם להתאים את המודל בקלות למגוון תנאים סביבתיים לצורך בדיקות רגישות אנטי-מיקרוביאליות מותאמות אישית יותר, כולל החלפת SCFM2 בכיח מהמטופל.
השיקול של מודלים ביופילמים רב-מיקרוביאליים לבדיקה של אנטי-מיקרוביאלים חדשים הוא גם בעל חשיבות עליונה, שכן הם יכולים לכסות פער קיים בצנרת הפיתוח האנטי-מיקרוביאלית לפני השימוש בהם במחקרים בבעלי חיים או בבני אדם33,34. לצד זאת, המודל שומר על תפוקה גבוהה יחסית ומאפשר מגוון תפוקות רלוונטיות הן לתעשייה והן למחקר.
למרות שהדגמנו רק CFUs ופעילות מטבולית במאמר שיטות זה, הדגמנו גם את התועלת של המודל בניתוח של ביופילם exo-metabolome באמצעות ספקטרומטריית מסה של ניתוח משטח מיצוי נוזלי (LESA). זה מאפשר לחקור חלק מהמנגנונים המולקולריים העומדים בבסיס סבילות מיקרוביאלית35. בנוסף לתפוקות אחרות אלה, הדגמנו גם את השימוש במודל זה לבדיקת מערכות העברה אנטי-מיקרוביאליות חדשניות. אלה כוללים ציפרופלוקסצין פולימרי מצומד כדי לשפר את החדירה של אנטיביוטיקה זו לתוך הביופילם תוך הגברת פעילותו והפחתת התפתחות עמידות36.
צעדים ושיקולים קריטיים
חשוב לשמור על סטריליות, במיוחד בעת ייצור SCFM2 ומדיה, שכן זיהום יכול לגרום להכנסת מינים שאינם טבעיים, אשר יכול להפריע לתוצאות. זנים שונים של אותו מיקרואורגניזם ומיקרובים שונים עשויים לדרוש תנאים סביבתיים שונים לגדילה או עשויים להיות בעלי מאפייני גדילה שונים. לכן, יש לייעל את המודל לפני ביצוע כל בדיקת רגישות לאנטיביוטיקה. אנו ממליצים לבצע מחקר פיילוט קטן של 24 שעות ו-48 שעות עבור מיני מונו וביופילם רב-מיקרוביאלי כדי להעריך את הצמיחה בתנאי מודל סטנדרטיים. מצאנו כי זנים שונים של P. aeruginosa וריכוזים אנטיביוטיים מסוימים יכולים לגרום לנחיל מדיסק הפוליקרבונט. ניתן להתגבר על כך בקלות באמצעות דיסקים גדולים יותר הזמינים באופן מסחרי. הפרעה בביופילם עשויה גם לדרוש אופטימיזציה בהתאם למקציף החרוזים ולחיידקים שבהם נעשה שימוש. ביצענו אופטימיזציה של שיטת השיבוש על ידי קביעת CFU/mL של דגימה ידועה לפני ואחרי מכות חרוזים. השתמשנו גם במיקרוסקופ כדי להמחיש את דגימות פעימות החרוזים כדי לדמיין עד כמה הביופילם שובש.
אחת המגבלות של מודל ביופילם מחקה CF זה היא החיבור למשטח מוצק המכיל פוליקרבונט, שאינו נמצא בריאה של CF, במקום להיות אגרגטים צפים חופשיים בתוך כיח CF37 . עם זאת, מודל האגר המוצק המוצג כאן מונע את הצורך לשטוף את הביופילמים כדי להסיר מיקרובים פלנקטוניים ומבטיח שהתוצאות יכללו רק מיקרובים שמקורם בביופילם, בניגוד לתרבית ביופילם פלנקטונית מעורבת. מצאנו גם כי החדירה של כמה אנטיביוטיקה לאזורים העמוקים יותר של מודל ביופילם זה יכולה להיות מופחתת, והשימוש ב- DNase עשוי להידרש כדי לשנות את הריאולוגיה של המטריצה החוץ תאית ולהפחית את האינטראקציות האלקטרוסטטיות עם דנ"א סביבתי.
אנו מאמינים כי המודל מתאים מאוד לבדיקות אנטי-מיקרוביאליות בשל הרבגוניות, יכולת ההסתגלות וההכללה של גורמים סביבתיים שמודלים קיימים רבים אינם לוקחים בחשבון. השימוש בו במחקר בסיסי ובבדיקות רגישות מיקרוביאלית פרה-קליניות יכול לספק גישה רלוונטית יותר מבחינה קלינית עבור AST של דגימות קליניות ופיתוח טיפולים חדשניים.
Disclosures
לא מוצהר ניגוד עניינים או אינטרס כלכלי מתחרה בעבודה זו.
Acknowledgements
עבודה זו מומנה על ידי המרכז הלאומי לחדשנות ביופילמים (NBIC) שהוא מרכז חדשנות וידע הממומן על ידי מועצת המחקר לביוטכנולוגיה ומדעי הביולוגיה, Innovate UK ומרכז Hartree [פרסים BB/R012415/1 ו- BB/X002950/1] ועל ידי קרן CF הבריטית ומרכז המחקר האסטרטגי של קרן CF בארה"ב: "מסגרת פרה-קלינית מבוססת ראיות לפיתוח טיפולים מיקרוביאליים בסיסטיק פיברוזיס" (PIPE-CF) [פרס SRC022].
Materials
| Name | Company | Catalog Number | Comments |
| 1 µL inoculation loops | |||
| 13 mm 0.2 µm pore size polycarbonate discs | Isopore | GTTP01300 | Larger discs are also available |
| 2 mL reinforced tubes | Thermofisher | 15545809 | |
| 2.5 mL ceramic beads | Qiagen | 13114-325 | |
| 500 mL borosilicate glass Duran bottle | Sigma Aldrich | Z305197 | larger bottles available in larger volumes are desired |
| 6-well culture plates | Greiner | 657165 | |
| 7 mL Bijou | Thermofisher | 129B | |
| 96-well plates | Thermofisher | 167008 | for serial dilutions in CFU assay |
| Agar plates for preparing plates of P. aerugnisa, S. aureus, and C. albicans | LB miller for P. aeruginosa and S. aureus and Sabouraud dextrose agar for C. albicans | ||
| Bead beater - suitable for 2 mL tubes | Fisherbrand | 15515799 | Thermofisher bead mill 24 |
| bench top centrifuge | must be capable of at least 8000 x g | ||
| Black clear bottom 96 well plates | Costar | 3603 | |
| Bunsen Burner | |||
| Containers for disposing of contaminated equipment and material according to the institutes health and safety regulations. | |||
| deionised water | |||
| eDNA | Sigma Aldrich | 31149 | |
| Filter unit | Fisherbrand | FB12566504 | Interchangeable depending on the vacuum pump used but must have a pore size of 0.2 µm |
| Haemocytometer and cover slip | Hawksley | HC001 | Haemocytometers may differ in size and volume. Double check and adjust CFU calculations accordingly |
| LB broth | oxoid | 1.46813 | |
| Mannitol salt agar | Oxoid | CM0085B | |
| meropenem | abcr | Ab243429 | |
| Mucin from porcine stomach Type II | Sigma Aldrich | M2378 | |
| Nystatin | Millipore | 1003352658 | |
| petri dishes | SLS | SLS2000 | |
| Phosphate buffered saline | |||
| Pseudomonas isolation agar | Millipore | 17208 | |
| Resazurin sodium salt | Sigma Aldrich | 199303 | |
| Sabouraud dextrose agar | Oxoid | CM0041 | |
| selection of forceps | fine tipped and tissue forceps with teeth for transferring ceramic beads | ||
| serological pipette | |||
| shaking and static incubators | must be temperature controlled | ||
| Sparks microtitre plate reader | Tecan | For Resazurin assay the microtitre plate reader must have the appropriate filters or be a monochromator for detecting flourescence. | |
| spectrophotometer | |||
| Technical agar (Agar Technical No.2 ) | Oxoid | LP0012B | |
| tetracycline | Sigma Aldrich | T7660 | |
| UV crosslinker | Spectroline | 11-992-89 | |
| vacuum pump/ flask | Fisherbrand | FB12566504 | |
| water bath | must be capable of maintaining 55 °C | ||
| YPD broth | Millipore | Y1375 | Can be bought pre-made or made using the base ingredients |
References
- . 2021 Cf foundation patient registry highlights report Available from: https://cysticfibrosis.msu.edu/index.php/welcome/news-and-events/39-2021-cf-foundation-patient-registry-highlights-report (2022)
- Guo, J., Garratt, A., Hill, A. Worldwide rates of diagnosis and effective treatment for cystic fibrosis. J Cyst Fibros. 21 (3), 456-462 (2022).
- Mandal, V., Ghosh, N. N., Mitra, P. K., Mandal, S., Mandal, V. Production and characterization of a broad-spectrum antimicrobial 5-butyl-2-pyridine carboxylic acid from Aspergillus fumigatus nhf-01. Sci Rep. 12 (1), 6006 (2022).
- Françoise, A., Héry-Arnaud, G. The microbiome in cystic fibrosis pulmonary disease. Genes. 11 (5), 536 (2020).
- Grasemann, H., Ratjen, F. Cystic fibrosis. New Engl J Med. 389 (18), 1693-1707 (2023).
- Camus, L., Vandenesch, F., Moreau, K. From genotype to phenotype: Adaptations of pseudomonas aeruginosa to the cystic fibrosis environment. Microb Genom. 7 (3), mgen000513 (2021).
- Rossi, E., et al. Pseudomonas aeruginosa adaptation and evolution in patients with cystic fibrosis. Nat Rev Microbiol. 19 (5), 331-342 (2021).
- Flemming, H. -. C., Wingender, J. The biofilm matrix. Nat Rev Microbiol. 8 (9), 623-633 (2010).
- Grainha, T., Jorge, P., Alves, D., Lopes, S. P., Pereira, M. O. Unraveling pseudomonas aeruginosa and candida albicans communication in coinfection scenarios: Insights through network analysis. Front Cell Infect Microbiol. 10, 550505 (2020).
- Flemming, H. C., et al. Biofilms: An emergent form of bacterial life. Nat Rev Microbiol. 14 (9), 563-575 (2016).
- Høiby, N., Bjarnsholt, T., Givskov, M., Molin, S., Ciofu, O. Antibiotic resistance of bacterial biofilms. Int J Antimicrob Agents. 35 (4), 322-332 (2010).
- Lorusso, A. B., Carrara, J. A., Barroso, C. D. N., Tuon, F. F., Faoro, H. Role of efflux pumps on antimicrobial resistance in Pseudomonas aeruginosa. Int J Mol Sci. 23 (24), 15779 (2022).
- Michaelis, C., Grohmann, E. Horizontal gene transfer of antibiotic resistance genes in biofilms. Antibiotics .(Basel). 12 (2), 328 (2023).
- Worlitzsch, D., et al. Effects of reduced mucus oxygen concentration in airway pseudomonas infections of cystic fibrosis patients. J Clin Invest. 109 (3), 317-325 (2002).
- König, J., Schreiber, R., Voelcker, T., Mall, M., Kunzelmann, K. The cystic fibrosis transmembrane conductance regulator (CFTR) inhibits ENaC through an increase in the intracellular Cl- concentration. EMBO Reps. 2 (11), 1047-1051 (2001).
- Palmer, K. L., Mashburn, L. M., Singh, P. K., Whiteley, M. Cystic fibrosis sputum supports growth and cues key aspects of Pseudomonas aeruginosa physiology. J Bacteriol. 187 (15), 5267-5277 (2005).
- Valenza, G., et al. Prevalence and antimicrobial susceptibility of microorganisms isolated from sputa of patients with cystic fibrosis. J Cyst Fibros. 7 (2), 123-127 (2008).
- Alam, F., Catlow, D., Di Maio, A., Blair, J. M. A., Hall, R. A. Candida albicans enhances meropenem tolerance of Pseudomonas aeruginosa in a dual-species biofilm. J Antimicrob Chemother. 75 (4), 925-935 (2020).
- Burmølle, M., Ren, D., Bjarnsholt, T., Sørensen, S. J. Interactions in multispecies biofilms: Do they actually matter. Trends Microbiol. 22 (2), 84-91 (2014).
- Lories, B., Belpaire, T. E. R., Smeets, B., Steenackers, H. P. Competition quenching strategies reduce antibiotic tolerance in polymicrobial biofilms. NPJ Biofilms Microbiomes. 10 (1), 23 (2024).
- Nabb, D. L., et al. Polymicrobial interactions induce multidrug tolerance in Staphylococcus aureus through energy depletion. Front Microbiol. 10, 2803 (2019).
- Cornforth, D. M., et al. Pseudomonas aeruginosa transcriptome during human infection. Proc Natl Acad Sci U S A. 115 (22), E5125-E5134 (2018).
- Wolter, D. J., et al. Staphylococcus aureus small-colony variants are independently associated with worse lung disease in children with cystic fibrosis. Clin Infect Dis. 57 (3), 384-391 (2013).
- Takagi, J., et al. Mucin o-glycans are natural inhibitors of Candida albicans pathogenicity. Nat Chem Biol. 18 (7), 762-773 (2022).
- Cinical and Laboratory Standard Institute. . Methods for dilution susceptibility tests for bacteria that grow aerobically. 35 (2), (2015).
- Roberts, A. E., Kragh, K. N., Bjarnsholt, T., Diggle, S. P. The limitations of in vitro experimentation in understanding biofilms and chronic infection. J Mol Biol. 427 (23), 3646-3661 (2015).
- Macia, M. D., Rojo-Molinero, E., Oliver, A. Antimicrobial susceptibility testing in biofilm-growing bacteria. Clin Microbiol Infect. 20 (10), 981-990 (2014).
- Coenye, T., Goeres, D., Van Bambeke, F., Bjarnsholt, T. Should standardized susceptibility testing for microbial biofilms be introduced in clinical practice. Clin Microbiol Infect. 24 (6), 570-572 (2018).
- Turner, K. H., Wessel, A. K., Palmer, G. C., Murray, J. L., Whiteley, M. Essential genome of Pseudomonas aeruginosa in cystic fibrosis sputum. Proc Natl Acad Sci U S A. 112 (13), 4110-4115 (2015).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. J Hyg. 38 (6), 732-749 (1938).
- Robertson, S. N., Romero, M., Fenn, S., Kohler Riedi, P. L., Cámara, M. Development, characterization, and evaluation of a simple polymicrobial colony biofilm model for testing of antimicrobial wound dressings. J Appl Microbiol. 135 (3), lxae042 (2024).
- Rumpf, C., Lange, J., Schwartbeck, B., Kahl, B. C. Staphylococcus aureus and cystic fibrosis-a close relationship. What can we learn from sequencing studies. Pathogens. 10 (9), 1177 (2021).
- Tay, W. H., Chong, K. K. L., Kline, K. A. Polymicrobial-host interactions during infection. J Mol Biol. 428 (17), 3355-3371 (2016).
- Orazi, G., O'toole, G. A. "It takes a village": Mechanisms underlying antimicrobial recalcitrance of polymicrobial biofilms. J Bacteriol. 202 (1), e00530-e00519 (2019).
- Arjes, H. A., et al. Three-dimensional biofilm colony growth supports a mutualism involving matrix and nutrient sharing. eLife. 10, e64145 (2021).
- Kasza, K., et al. Ciprofloxacin poly(β-amino ester) conjugates enhance antibiofilm activity and slow the development of resistance. ACS Appl Mater Interf. 16 (5), 5412-5425 (2024).
- Martin, I., Waters, V., Grasemann, H. Approaches to targeting bacterial biofilms in cystic fibrosis airways. Int J Mol Sci. 22 (4), 2155 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved