Method Article
تصوير وقياس مورفولوجيا الميتوكوندريا في C. ايليجانس أثناء الشيخوخة
In This Article
Summary
يوفر هذا البروتوكول نهجا موحدا لتصوير مورفولوجيا الميتوكوندريا في أنسجة متعددة من C. ايليجانس أثناء الشيخوخة.
Abstract
الميتوكوندريا ، العضيات الخلوية المهمة الموجودة في معظم الخلايا حقيقية النواة ، هي مواقع رئيسية لإنتاج الطاقة من خلال التنفس الهوائي. بالإضافة إلى هذا الدور المعروف باسم "القوة الخلوية" ، تشارك الميتوكوندريا أيضا في العديد من العمليات الخلوية الأساسية الأخرى ، بما في ذلك تنظيم التمثيل الغذائي الخلوي ، والانتشار ، والإشارات المناعية ، والإشارات الهرمونية. غالبا ما يتميز التدهور في وظيفة الميتوكوندريا أثناء الشيخوخة أو تحت إجهاد الميتوكوندريا بتغيرات واضحة في مورفولوجيا الميتوكوندريا وحجمها. الديدان الخيطية C. ايليجانس هو نموذج مثالي لدراسة هذه التغييرات نظرا لجسمها الشفاف وعمرها القصير ، مما يسهل الفحص المجهري الحي طوال حياته. ومع ذلك ، حتى داخل C. ايليجانس ، تتوفر العديد من التركيبات والطرق المعدلة وراثيا لتصوير الميتوكوندريا ، ولكل منها حدودها الخاصة. هنا ، يتم تقديم تركيبات GFP أحادية النسخة المترجمة بالمصفوفة كطريقة قوية وموثوقة لتصوير مورفولوجيا الميتوكوندريا في C. ايليجانس. تركز هذه الدراسة بشكل خاص على العوامل التي يمكن التحكم فيها تجريبيا لتقليل الأخطاء وتقليل التباين بين التكرارات وعبر الدراسات عند إجراء تصوير الميتوكوندريا أثناء عملية الشيخوخة. بالإضافة إلى ذلك ، يوصى باستخدام mitoMAPR كطريقة قوية لتحديد التغيرات في مورفولوجيا الميتوكوندريا عبر أنواع الأنسجة أثناء الشيخوخة.
Introduction
الميتوكوندريا هي عضيات خلوية محاطة بغشاء فوسفوليبيد مزدوج وتلعب دورا مهما في الحفاظ على الطاقة الحيوية الخلوية كموقع رئيسي لعملية التمثيل الغذائي وإنتاجالطاقة 1. يولد عدد كبير من الميتوكوندريا الطاقة باستمرار في شكل ATP لتلبية المتطلبات الخلوية2. بالإضافة إلى هذه الأدوار المهمة ، تشارك الميتوكوندريا أيضا في العمليات الخلوية المعقدة مثل نقل الإشارات ، والالتهام الذاتي ، والمناعة الفطرية ، ودورة الخلية ، ومسارات موت الخلايا2،3. تظهر الميتوكوندريا أشكالا متنوعة ، تتراوح من العضيات الفردية الصغيرة إلى الشبكات الأنبوبية المترابطة الواسعة ، اعتمادا على متطلبات الطاقة المتغيرة وصحة الميتوكوندريا4.
السمة الرئيسية للميتوكوندريا هي طبيعتها الديناميكية حيث يمكن أن تتناوب بين هذه الأشكال المختلفة من خلال تسلسل منسق ومستمر بإحكام لأحداث الانشطار والاندماج4. ينظم التوازن الدقيق بين هذه العمليات المتعارضة مورفولوجيا الميتوكوندريا وعددها وحجمها وموقعها داخل السيتوبلازم5. بالإضافة إلى ذلك ، تعتبر عمليات الاندماج والانشطار هذه مهمة للحفاظ على مراقبة جودة الميتوكوندريا5. على سبيل المثال ، يعد انشطار الميتوكوندريا مكونا أساسيا لإزالة الميتوكوندريا التالفة من خلال الانقسام والإزالة الانتقائية للميتوكوندريا من خلال الالتهام الذاتي2. تلعب ديناميكيات الميتوكوندريا أيضا دورا مهما في انقسام الخلايا ، وتطورها ، ومقاومة الضغوطات المختلفة ، والحفاظ على التمثيل الغذائي الخلوي6.
يتورط اضطراب ديناميكيات الميتوكوندريا في العديد من الأمراض ، بما في ذلك الاضطرابات التنكسية العصبية وأمراض التمثيل الغذائي وأمراض القلب والأوعية الدموية والسرطانات4. بالإضافة إلى ذلك ، ترتبط الشيخوخة بإعادة تشكيل الميتوكوندريا بشكل كبير ، ويرجع ذلك إلى حد كبير إلى التغيرات في ديناميكيات الانشطار الاندماج7. لذلك ، فإن تصور ومراقبة التغييرات في مورفولوجيا الميتوكوندريا في ظل ظروف الإجهاد أو المرض المختلفة وطوال عملية الشيخوخة يقدم رؤى قيمة حول فهم الوظيفة الخلوية وآلية المرض والاستراتيجيات العلاجية المحتملة.
مثل العديد من المسارات الجزيئية ، يتم أيضا الحفاظ على ديناميكيات الميتوكوندريا ووظيفتها بشكل كبير عبر حقيقيات النوى ، بما في ذلك الكائنات الحية النموذجية مثل الديدان الخيطية Caenorhabditis elegans. على غرار الخلايا البشرية ، فإن اندماج الميتوكوندريا في C. ايليجانس يتحقق من خلال وظيفة بروتينات الجوانين ثلاثي الفوسفاتيز (GTPase) المرتبطة بالدينامين ، بما في ذلك FZO-1 (تقويم العظام للثدييات Mfn1 / 2) و EAT-3 (تقويم العظام ل Opa1 للثدييات) التي تتحكم في اندماج غشاء الميتوكوندريا الخارجي (OMM) وغشاء الميتوكوندريا الداخلي (IMM) ، على التوالي8. يتم تنظيم انشطار الميتوكوندريا بواسطة البروتين المرتبط بالدينامينة (DRP-1 ، تقويم العظام ل Drp1 البشري) ، والذي يعزز انشطار الميتوكوندريا عن طريق تكوين مجمعات تشبه الحلقة حول الغشاء الخارجي للميتوكوندريا التي تنقبض وتفصل أغشية الميتوكوندريافي النهاية 9. يلعب اندماج الميتوكوندريا دورا محوريا في مراقبة جودة الميتوكوندريا من خلال السماح بخلط محتويات الميتوكوندريا ، بما في ذلك الحمض النووي للميتوكوندريا والبروتينات والدهون ، مما يسمح باستكمال الميتوكوندريا التالفة جزئيا بمحتويات من الميتوكوندرياالصحية 9. من ناحية أخرى ، يسمح انشطار الميتوكوندريا للميتوكوندريا بالانقسام ، مما يؤدي إلى إنشاء ميتوكوندريا جديدة وتسهيل توزيعها ليس فقط داخل السيتوبلازم ولكن أيضا على الخلايا الوليدة أثناء انقسام الخلية ، مما يضمن وراثة الميتوكوندريا المناسبة ووظيفتها9. هذا الحدث ضروري أيضا لفصل أجزاء الميتوكوندريا التالفة أو المختلة وظيفيا ، والتي يمكن بعد ذلك استهدافها للتحلل من خلال الانقسام9.
C. ايليجانس يعتبر منذ فترة طويلة أحد أقوى أنظمة النماذج الجينية بسبب الجينوم الكامل ، وتوافر مجموعة متنوعة من الأدوات الجينية ، بما في ذلك CRISPR / Cas9 التي تسهل التعديلات الجينية10 ، والعديد من الطرق للإفراط في التعبير عن الجينات ، وطريقة بكتيرية قائمة على الغذاء لتداخل الحمض النووي الريبي (RNAi) 11. بالإضافة إلى ذلك ، يسمح تشريحها الشفاف بالتصوير المجهري في الكائنات الحية12. أخيرا ، فإن عمرها القصير نسبيا ، وتكاليف الصيانة المنخفضة ، وسهولة إنتاج عدد كبير من المطابقة للعمر تجعلها نظاما نموذجيا ممتازا لبيولوجيا الشيخوخة13. هذه الفوائد ، الممزوجة بالحفظ المعروف للمسارات التنظيمية الرئيسية للميتوكوندريا ، تجعل C. ايليجانس نظاما نموذجيا جذابا للغاية لدراسة ديناميكيات الميتوكوندريا أثناء الشيخوخة.
تستخدم علامات الفلورسنت على نطاق واسع في البحوث البيولوجية لتصور ودراسة المكونات الخلوية ، بما في ذلك الميتوكوندريا. هناك أصباغ محددة منفذة للخلايا مثل MitoTracker و tetramethylrhodamine ethyl ester (TMRE) شائعةالاستخدام 14. يستخدم الأول لصبغ مصفوفة الميتوكوندريا سالبة الشحنةالإجمالية 15 ، بينما يستخدم الأخير لتقييم إمكانات غشاء الميتوكوندريا النسبية من خلال أيون ثلاثي فينيل فوسفونيوم موجبالشحنة 16. في حين أنها تستفيد من عدم الحاجة إلى جينات معدلة وراثيا ، فإن بشرة الديدان السميكة التي تتغير في التركيب والنفاذية أثناء الشيخوخة وتباين تسلل الصبغة عبر الأنسجة المختلفة تجعل الأساليب القائمة على الصبغة صعبة في C. ايليجانس17. علاوة على ذلك ، فإن تقييم مورفولوجيا الميتوكوندريا مربك من خلال التأثيرات المحتملة غير المستهدفة للأصباغ ، مثل تجميع الصبغة17. بدلا من ذلك ، تستخدم الطرق الجينية للتعبير عن الفلوروفورات الموضعية في الميتوكوندريا بشكل شائع في نموذج الدودة.
هنا ، تركز هذه الدراسة على تسليط الضوء على السلالات التي تعبر عن مصفوفة الميتوكوندريا المترجمة GFP (يشار إليها من الآن فصاعدا باسم MLS:: GFP) تحت محفزات محددة من نوع الخلية. الأهم من ذلك ، تم صنع هذه الخطوط المعدلة وراثيا باستخدام طريقة MosSCI لضمان التعبير عن نسخة واحدة للمراسل في موضع جيني معروف ، والذي يتجنب المشكلات المتعلقة بالسلالات الأخرى المتاحة. على سبيل المثال ، يؤدي التعبير عالي النسخ لبعض البروتينات المستهدفة للميتوكوندريا إلى تباين في مستويات التعبير بسبب تكامل مصفوفات البلازميد خارج الكروموسومات في موضع عشوائي برقم نسخةغير معروف 18. بالإضافة إلى ذلك ، فقد ثبت سابقا أنها تسبب ضررا للميتوكوندريا لأنها تشكل عبئا كبيرا على الخلايا لتوطين بروتينات الميتوكوندريا المعبر عنها بشكل صحيح19. لذلك ، فإن التعبير الجيني الدقيق والمستقر والمنخفض وسهولة العبور إلى المواقع المعروفة تجعل هذه الجينات المعدلة وراثيا MosSCI الطريقة المفضلة. باستخدام هذه السلالات ، توحد هذه الدراسة طرق تصوير الميتوكوندريا في العضلات والأمعاء وتحت الجلد من C. ايليجانس. علاوة على ذلك ، فإنه يسلط الضوء على التطبيقات التقنية المهمة وطرق استكشاف الأخطاء وإصلاحها التي تعتبر مهمة للنظر فيها وضمان التحليل التجريبي القابل للتكرار للميتوكوندريا أثناء الشيخوخة في C. ايليجانس.
Protocol
وترد تفاصيل الكواشف والمعدات المستخدمة في هذه الدراسة في جدول المواد.
1. نمو وصيانة C. ايليجانس
- تحضير لوحات وسائط نمو الديدان الخيطية (NGM)
- لزراعة C. ايليجانس، استخدم ألواح أجار قياسية بنسبة 2٪ تحتوي على NGM تحتوي على 1 ملي مولار من كلوريدالكالسيوم 2 ، و 12.93 ميكرومتر (5 ميكروغرام / مل) من الكوليسترول ، و 25 ملي مولار من KPO4 (درجة الحموضة 6.0) ، و 1 ملي مولار من MgSO4 ، و 2.5 ملي مولار (0.25٪ وزن / حجم) من البيبتون ، و 51.3 ملي مولار من كلوريد الصوديوم. انظر الطريقة التفصيلية لصب ألواح NGM الموضحة في Castro Torres et al.20.
ملاحظة: بالنسبة لتجارب تداخل الحمض النووي الريبي (RNAi) ، أضف 1 مل من 1 M IPTG و 1 مل من 100 مجم / مل كاربينيسيلين لألواح NGM-agar سعة 1 لتر. - بعد أن تصلب صفائح NGM ، قم بزراعة مزرعة OP50 في مرق lysogeny (LB) لمدة 24-48 ساعة في درجة حرارة الغرفة أو قم بزراعة ثقافة HT115 تحمل بلازميد ناقل فارغ pL4440 في LB مع المضادات الحيوية (أمبيسلين / كاربينيسيلين 100 ميكروغرام / مل + التتراسيكلين 5 ميكروغرام / مل) مع الاهتزاز عند 37 درجة مئوية لمدة 12-16 ساعة.
ملاحظة: هذا البلازميد متاح من مصادر تجارية (انظر جدول المواد). - قم بزرع 200 ميكرولتر من ثقافة OP50 أو HT115 على ألواح 60 مم ، أو 1 مل على ألواح 100 مم.
- جفف الأطباق حتى تختفي من البلل وقم بتخزين الأطباق في حاويات محكمة الغلق عند 4 درجات مئوية لمدة تصل إلى شهرين.
- اختياري: أضف 100 ميكرولتر من 10 مجم / مل 5-fluoro-2'-deoxyuridine (FUDR) مباشرة على ألواح NGM-agar التي يتم زرعها بالبكتيريا لتعقيم الديدان L4 / الديدان البالغة كيميائيا ومنع تطور الديدان الأصغر سنا.
ملاحظة: السلالات التي تم تطويرها واستخدامها في هذه الدراسة هي:
(1) RHS191 - uthSi17 [myo3p :: MLS :: GFP :: unc-54 3'UTR :: cb-unc-119 (+)] أنا
(2) RHS192 - uthSi83 [col19p :: MLS :: GFP :: unc-54 3'UTR :: cb-unc-119 (+)] أنا
(3) RHS193 - uthSi80 [vha-6p :: MLS :: GFP :: unc-54 3'UTR :: cb-unc-119 (+)] رابعا
- لزراعة C. ايليجانس، استخدم ألواح أجار قياسية بنسبة 2٪ تحتوي على NGM تحتوي على 1 ملي مولار من كلوريدالكالسيوم 2 ، و 12.93 ميكرومتر (5 ميكروغرام / مل) من الكوليسترول ، و 25 ملي مولار من KPO4 (درجة الحموضة 6.0) ، و 1 ملي مولار من MgSO4 ، و 2.5 ملي مولار (0.25٪ وزن / حجم) من البيبتون ، و 51.3 ملي مولار من كلوريد الصوديوم. انظر الطريقة التفصيلية لصب ألواح NGM الموضحة في Castro Torres et al.20.
- مزامنه C. elegans عن طريق التبييض
- للحصول على فحص واسع النطاق يتطلب عددا كبيرا من الديدان الخيطية ، قم بتقطيع صفيحة NGM-agar مقاس 60 مم مليئة بالحيوانات إلى قطع صغيرة وقم بتقطيعها إلى ألواح 100 مم مغطاة بالبكتيريا للتوسع. اترك 2-3 أيام حتى تمتلئ الألواح مقاس 100 مم بالديدان عند نموها عند 20 درجة مئوية بعد التقطيع. لمزيد من التوصيات التفصيلية لتوسيع ، راجع Castro Torres et al.20.
- لجمع الديدان من أجل التزامن ، صب 5-10 مل من محلول M9 (22 ملي مولار من KH2PO4 أحادي القاعدة ، 42.3 ملي مولار من Na2HPO4 ، 85.6 ملي مولار من كلوريد الصوديوم ، 1 ملي مولار من MgSO4) على ألواح NGM-agar مقاس 100 مم مع الديدان ، وقم بتدوير محلول M9 برفق لتفكيك الديدان من المروج البكتيرية.
- ارسم الديدان بماصة مصلية وانقلها إلى أنابيب مخروطية سعة 15 مل.
ملاحظة: يوصى باستخدام الماصات المصلية الزجاجية لأن الماصات المصلية البلاستيكية تميل إلى جعل الديدان تلتصق بالجدار الداخلي للماصات البلاستيكية. - جهاز طرد مركزي لمدة 30 ثانية عند 1,100 × جم في درجة حرارة الغرفة لتكبيل الديدان وشفط المادة الطافية باستخدام مضخة تفريغ.
- تحضير 5 مل من محلول التبييض الذي يحتوي على 1.5 مل من هيبوكلوريت الصوديوم 6٪ ، و 0.75 مل من 5 M هيدروكسيد الصوديوم أو KOH ، و 2.75 مل من dH2O. صب 5 مل من محلول التبييض في حبيبات الدودة.
تنبيه: يوصى بارتداء القفازات ومعطف المختبر في هذه الخطوة لأن محاليل هيبوكلوريت الصوديوم والهيدروكسيد مسببة للتآكل. - احتضان مزيج محلول التبييض + الدودة لمدة ~ 4-6 دقائق حتى تذوب جميع أجسام تماما ويبقى البيض فقط. رج المزيج بقوة للمساعدة في عملية الذوبان.
ملاحظة: افحص الديدان كل دقيقة تحت مجهر تشريح. تقصير أو تمديد وقت التبييض بناء على مقدار إذابة أجسام الديدان البالغة. سيؤدي ترك البيض داخل محلول التبييض لفترة طويلة إلى تلف البيض ويؤثر على صلاحية الديدان الخيطية. - قم بالطرد المركزي لمزيج البيض / محلول التبييض لمدة 30 ثانية عند 1,100 × جم في درجة حرارة الغرفة لحبيبات البيض ثم شفط المادة الطافية بعناية باستخدام مضخة تفريغ ، مع التأكد من عدم شفط حبيبات البيض.
ملاحظة: يوصى بإجراء عمليات الغسيل بسرعة لمنع تعرض البيض لمحلول التبييض لفترات طويلة. - اغسل البيض ب 5-10 مل من محلول M9 4 مرات.
- أعد تعليق البيض في حجم صغير من محلول M9 وقم بوضعه على ألواح NGM المغطاة بالبكتيريا عن طريق سحب ما يصل إلى 50 ميكرولتر. احسب تقديرا تقريبيا لعدد البيض عن طريق سحب 3-5 ميكرولتر من خليط البيض على طبق وعد عدد البيض في هذا المجلد. أضف M9 لتخفيف خليط البيض إلى عدد لا يحصى من البيض في هذا المجلد.
ملاحظة: يوصى بطلاء أقل من 100 دودة لكل طبق لأن الديدان يمكن أن تتضور جوعا قبل اليوم الأول من مرحلة البلوغ عندما يكون هناك الكثير من المطلية. لمزيد من التوصيات التفصيلية لطلاء أعداد ، راجع Castro Torres et al.20. - بدلا من ذلك ، L1- إيقاف الديدان الخيطية من أجل تزامن العمر بشكل أكثر إحكاما. لاعتقال L1 ، أضف الحجم المناسب من محلول M9 إلى حبيبات البيض في أنبوب مخروطي سعة 15 مل بحجم 10-12 مل. دع الديدان تدور في محور دوار لمدة 16-24 ساعة عند 20 درجة مئوية. جهاز الطرد المركزي (كما في الخطوة 1.2.7) ويستنشق المادة الطافية. احسب تركيز L1 وقم بوضعها على ألواح NGM كما هو موضح للبيض في الخطوة 1.2.9.
- عمر C. ايليجانس إلى العمر المطلوب: انقل L4 / البالغة إلى أطباق تحتوي على 5-fluoro-2'-deoxyuridine (FUDR) كما هو موضح في الخطوة 1.1.6 لمنع النسل والقضاء على أي ذرية تم إنتاجها بالفعل. للحصول على طرق بديلة لشيخوخة الديدان بدون FUDR ، راجع Castro Torres et al.20.
ملاحظة: يجب مراعاة بعض العوامل المهمة قبل اختيار التبييض كطريقة لمزامنة الديدان في مرحلة اليرقات الأولى. كما أوضحنا سابقا ، يمكن أن يؤدي التعرض المفرط للتبييض إلى إتلاف الأجنة ، وتقليل معدلات الفقس ، وخلق ضغط اختيار للسلالات المقاومة للتبييض ، مما قد يؤدي إلى تغيير علم الوراثة لدى السكان. بالإضافة إلى ذلك ، إذا تركت الأجنة دون تغذية لفترات طويلة من الزمن ، يمكن أن يؤدي استنفاد المغذيات إلى إضعاف عملية التمثيل الغذائي والتطور. لذلك ، يمكن استخدام طرق وضع البيض أو NemaSync كبديل لطرق التبييض. تم وصف طريقة إجراء وضع البيض تدريجيا في الدراسة المشار إليها بواسطة Castro Torres et al.20. NemaSync هي طريقة تجارية أحدث وأكثر تكلفة ، حيث يتم استخدام مزامن الدودة اليدوي لمزامنة الديدان دون استخدام المواد الكيميائية21.
2. تصوير الميتوكوندريا في C. ايليجانس
- تحضير شرائح لتصوير C. ايليجانس
- أضف 10-20 ميكرولتر من محلول M9 على شرائح زجاجية وانقل العدد المطلوب من الديدان البالغة في الأعمار المحددة إلى المحلول الموجود على الشريحة. يوصى باستخدام ما يقرب من 25 دودة.
ملاحظة: قد يؤدي استخدام الطرق التقليدية لشل الديدان (على سبيل المثال ، رباعي التتراميزول أو أزيد الصوديوم) إلى تجزئة الميتوكوندريا في ظل ظروف معينة (انظر أدناه). بدلا من ذلك ، يوصى هنا باستخدام شرائح HistoBond ، والتي لها سطح بشحنة سطحية موجبة دائمة ، ستقلل من حركة الديدان دون استخدام الأدوية التي قد تدخل القطع الأثرية. من المهم وضع نسبة مناسبة من الديدان إلى محلول M9 ، حيث قد تتسبب الأحجام المنخفضة في سحق بين الشريحة والغطاء ، في حين أن الأحجام الكبيرة ستؤدي إلى تحرك أثناء الحصول على الصورة. يمكن الاطلاع على التوصيات في الجدول 1. - بدلا من ذلك ، لاستخدام الأدوية التي تشل الديدان ، راجع النتائج التمثيلية لهذه المخطوطة لمجموعة من التركيز والنقاط الزمنية التي يمكن استخدامها مع تجزئة محدودة للميتوكوندريا.
ملاحظة: على الرغم من عدم وجود تجزئة كبيرة في البرية السليمة ، فمن المهم أن تتذكر أن بعض الطفرات أو الحالات قد تتعرض لتجزئة الميتوكوندريا بنفس تركيز هذه الأدوية ، لذلك يلزم إجراء بعض الاختبارات عند استخدام هذه الأدوية. - قم بتغطية الديدان بمحلول M9 على الشريحة بغطاء زجاجي واستخدم طلاء الأظافر لإغلاق الجوانب ومنع تبخر محلول M9.
- اختياري: لتصوير العضلات ، قم بلف الديدان عن طريق دفع زلة الغطاء برفق. يسمح ذلك لعضلات جدار الجسم على جانبي الديدان بالمحاذاة بشكل أفضل مع المستوى البؤري للحصول على صور عالية الجودة.
- أضف 10-20 ميكرولتر من محلول M9 على شرائح زجاجية وانقل العدد المطلوب من الديدان البالغة في الأعمار المحددة إلى المحلول الموجود على الشريحة. يوصى باستخدام ما يقرب من 25 دودة.
- تصوير الميتوكوندريا باستخدام المجهر المركب
- استخدم مجهرا قياسيا واسع المجال للميتوكوندريا العضلية وتحت الجلد (myo-3p :: MLS :: GFP و col-19p :: MLS :: GFP).
ملاحظة: تم استخدام جهاز تصوير متوفر تجاريا مزود بهدف 63x / 1.4 Plan Aprochromat ، ومرشح GFP (11525314) ، وكاميرا DFC9000 GT ، ومصدر ضوء LED5 ، وتم استخدام برنامج مجهر متوافق. - قم بتحسين إعدادات التصوير لكل مجهر وإعداد تجريبي.
ملاحظة: ومع ذلك ، كنقطة انطلاق ، فإن معلمات التصوير باستخدام المصور المستخدم في هذه المخطوطة هي كما يلي: الأبعاد هي 2048 (x) * 2048 (y) بكسل بحجم خطوة 0.50 ميكرومتر للميتوكوندريا تحت الجلد و "النظام الأمثل" يتم حسابه تلقائيا بواسطة البرنامج للميتوكوندريا العضلية. وقت التعرض هو 50 مللي ثانية للميتوكوندريا العضلية و 50 مللي ثانية للميتوكوندريا تحت الجلد. تم ضبط LED 475 نانومتر على طاقة 50٪ ، وتم ضبط مرشح الكثافة المحايدة على 30٪ للعضلات و 17٪ للميتوكوندريا تحت الجلد. يبدأ نطاق Z من حيث تكون إشارة GFP مرئية إلى حيث تنتهي. لتقليل الضوضاء في الإسقاط الأقصى ، يمكن للمرء تقليل عدد المستويات z المستخدمة في الإسقاط الأقصى. - لتصوير الميتوكوندريا المعوية (vha-6p :: MLS :: GFP) ، استخدم المجهر متحد البؤر.
ملاحظة: تم إجراء التصوير على مجهر متحد البؤر متاح تجاريا ومجهز بهدف 63x / 1.4 Plan ApoChromat ، وليزر الضوء الأبيض (WLL) ، وفاصل الشعاع Acousto-Optical ، وكاشفات HyD S ، ويعمل على برنامج المجهر. كما ذكرنا سابقا ، يجب على المرء تحسين كل إعداد تجريبي فردي ، ولكن كنقطة انطلاق ، فإن معلمات التصوير باستخدام Stellaris المستخدمة في هذه الدراسة هي كما يلي: تم ضبط WLL على 85.00٪ طاقة قصوى وبخط ليزر 485 نانومتر بكثافة 3.00٪. تم ضبط كاشف HyD S على 490-590 نانومتر مع كسب 25 في الإعداد التناظري. قمنا بمسح مساحة 1024 (x) * 1024 (y) أو 82.01 ميكرومتر (x) * 82.01 ميكرومتر (y) مع 5 (z) بكسل بحجم خطوة يبلغ 0.495 ميكرومتر (البعد z متغير حسب حجم الديدان أو الأنسجة) بسرعة مسح 1,000 هرتز ، تكبير 2.25 ، متوسط خط 2 ، وثقب 1 AU (95.5 ميكرومتر). يبدأ نطاق Z من حيث تكون إشارة GFP مرئية إلى حيث تنتهي. لتقليل الضوضاء في الإسقاط الأقصى ، يمكن للمرء تقليل عدد المستويات z المستخدمة في الإسقاط الأقصى.
- استخدم مجهرا قياسيا واسع المجال للميتوكوندريا العضلية وتحت الجلد (myo-3p :: MLS :: GFP و col-19p :: MLS :: GFP).
- القياس الكمي لمورفولوجيا الميتوكوندريا
ملاحظة: للحصول على التفاصيل ، راجع Schindelin et al.22 وانظر الشكل التكميلي 1A-D.- قم بتنزيل وتثبيت برنامج FIJI (Fiji هي مجرد ImageJ ، https://fiji.sc/). ثم افتح فيجي.
- لتنزيل وتثبيت ماكرو MitoMAPR ، قم بتنزيل الكود المصدري 1 من https://doi.org/10.7554/eLife.49158.033. ثم انسخ كل التعليمات البرمجية المذكورة ضمن "أ.). رمز IJM ل MitoMAPR-1.0." بعد ذلك ، افتح فيجي ، وانتقل إلى المكونات الإضافية > New > Macro ، والصق الكود المنسوخ مسبقا في نافذة الماكرو. انتقل إلى ملف > حفظ باسم الخيار واحفظ الماكرو لاستخدامه في المستقبل.
- افتح صورة مجهرية ثلاثية الأبعاد باستخدام مكدسات Z في فيجي عن طريق سحب الملفات وإفلاتها إلى شريط أدوات فيجي أو بالانتقال إلى > فتح الملف.
- قم بإنشاء عرض أقصى للصورة بالانتقال إلى Image > Stacks > Z Project، ثم تحديد نطاق الشرائح التي تحتوي على صور في التركيز البؤري ليتم عرضها إلى الحد الأقصى وتحديد الحد الأقصى للكثافة كنوع العرض.
- احفظ الصورة كملف TIFF بالانتقال إلى ملف > حفظ باسم > tiff.
- اقتصاص مناطق الاهتمام (ROIs) من الصور الكاملة باستخدام أداة "المستطيل" ، ورسم عائد استثمار ، ثم الانتقال إلى اقتصاص > الصورة.
- احفظ الصورة بتنسيق TIFF بالانتقال إلى ملف > حفظ باسم > tiff.
- قم بتشغيل ماكرو MitoMAPR المحفوظ مسبقا عن طريق سحب ملف الماكرو وإفلاته في شريط أدوات فيجي ، ثم انقر فوق تشغيل. ستطالب نافذة جديدة بتحديد المجلد حيث تم حفظ ملف Tiff في 2.3.6.
- ستطالب نافذة جديدة بتحديد منطقة. قم بإنشاء مستطيل في الصورة باستخدام أداة المستطيل كما هو مذكور سابقا في الخطوة 2.3.4 واضغط على موافق.
ملاحظة: يمكن تحديد الصورة بأكملها إذا تم اقتصاصها مسبقا كما هو موضح في الخطوة 2.3.6. احفظ نافذة "البيانات" مع جميع القيم المتعلقة بمورفولوجيا الميتوكوندريا كملف Excel بالانتقال إلى ملف > حفظ باسم > حفظ.
- المعالجة الدفعية للعينات باستخدام وحدات ماكرو فيجي
- قم بإنشاء ماكرو لتحديد منطقة الصور المراد تحليلها. افتح فيجي وانتقل إلى الإضافات > New > Macro. الصق الكود التالي في مربع النص واحفظ الماكرو كما هو موضح في 2.3.2 (الشكل التكميلي 1E-H).
ملاحظة: اصنع مستطيلا (100 ، 100 ، 200 ، 200) ؛ تشغيل (تحديد ...، العرض = 100 ، الارتفاع = 100 ، x = 100 ، y = 100 مصغر). - قم بإنشاء ماكرو لحفظ جميع الصور المفتوحة كملفات TIFF. داخل نافذة الماكرو ، انتقل إلى ملف > جديد والصق الكود التالي في مربع النص. احفظ الماكرو كما هو موضح في 2.3.2.
ملاحظة: dir = getDirectory("تحديد مجلد"); ids=newArray(nImages); ل (i = 0 ؛ i - قم بإنشاء ماكرو للدفعة MitoMAPR. انتقل إلى https://doi.org/10.7554/eLife.49158.033 شفرة المصدر 1 وانسخ جميع الرموز المذكورة ضمن B.). رمز IJM ل MitoMAPR-1.0_Batch". داخل نافذة الماكرو ، انتقل إلى ملف > جديد ، والصق التعليمات البرمجية من الكود المصدري 1 في مربع النص ، واحفظ الماكرو كما هو موضح في الخطوة 2.3.2.
- قم بإنشاء ماكرو للاقتصاص التكراري. انتقل إلى https://doi.org/10.7554/eLife.49158.033 الكود المصدري 1 وانسخ جميع الرموز المذكورة تحت C.) كود IJM ل CropR ". داخل نافذة الماكرو ، انتقل إلى ملف > جديد ، والصق التعليمات البرمجية من التعليمات البرمجية المصدر 1 في مربع النص ، واحفظ الماكرو كما هو موضح في الخطوة 2.3.2.
- لبدء المعالجة المجمعة، قم أولا بحفظ جميع الصور المراد معالجتها بتنسيق TIFF عن طريق فتح كافة الصور وتشغيل الماكرو المحفوظ في الخطوة 2.4.2. سيتم حفظ جميع الصور بتنسيق TIFF في المجلد المحدد. أغلق جميع الصور بمجرد حفظها.
- إذا كانت الصور المحفوظة في الخطوة 2.4.5 عبارة عن صور ثلاثية الأبعاد (صور تحتوي على z-stacks) ، فقم بتحويلها إلى صور ثنائية الأبعاد عن طريق جعلها إسقاطات Z. لعرض الصور على شكل Z ، افتح نافذة معالجة الدفعات بالانتقال إلى معالجة > دفعة > الماكرو في نافذة FIJI الرئيسية.
- بالنسبة إلى "الإدخال" ، حدد موقع المجلد الذي يحتوي على جميع الصور ثلاثية الأبعاد المراد معالجتها من 2.4.5. بالنسبة إلى "الإخراج" ، حدد الموقع المطلوب للصور المحفوظة بعد المعالجة. حدد تنسيق الإخراج ك TIFF. الصق الكود التالي في مربع النص الكبير في النافذة واضغط على زر العملية : run ("Z Project...", "projection=[Max Intensity]").
- اقتصاص عائد الاستثمار بأبعاد متطابقة من جميع الصور ثنائية الأبعاد المراد معالجتها باستخدام ماكرو الاقتصاص التكراري من الخطوة 2.4.4 بالاشتراك مع ماكرو المنطقة المحددة من الخطوة 2.4.3. قم بتشغيل ماكرو الاقتصاص التكراري من الخطوة 2.4.4. ستظهر نافذة تطلب دليل.
- حدد المجلد الذي يحتوي على صور ثنائية الأبعاد فقط من الخطوة 2.4.5 أو الصور المعروضة 2D Z من الخطوة 2.4.6 واضغط على الزر تحديد . سيفتح الماكرو إحدى الصور في المجلد المحدد ، وستظهر نافذة بعنوان "إجراء تحديد" بزرين.
- قم بتشغيل ماكرو التحديد المحدد من الخطوة 2.4.3. قم بتعديل قيم العرض والارتفاع في مربع نص الماكرو هذا كما هو مطلوب لتغيير بعد التحديد واضغط على تشغيل لمراقبة التحديد الجديد. سيؤدي تغيير قيم X و Y في الماكرو إلى تعديل موضع الزاوية العلوية اليسرى للتحديد.
- بمجرد أن تصبح أبعاد التحديد مرضية ، اسحب المستطيل إلى المنطقة المطلوبة ثم اضغط على الزر "موافق " في نافذة "إجراء تحديد". سيتم حفظ المنطقة التي تم اقتصاصها في المجلد المحدد في الخطوة 2.4.7.
- سيتكرر الماكرو من خلال جميع الصور المتبقية في المجلد. لكل صورة، قم بتشغيل الماكرو من الخطوة 2.4.8 دون تغيير قيم الأبعاد لضمان اقتصاص نفس الأبعاد لجميع الصور. لكل صورة ، اسحب مستطيل التحديد إلى الموقع المطلوب واضغط على الزر "موافق " في نافذة "إجراء تحديد".
- افتح المجلد الذي يحتوي على الصور التي تم اقتصاصها من الخطوات 2.4.8-2.4.9 وانقل جميع الصور التي تم اقتصاصها إلى مجلد جديد.
- قم بتحليل جميع الصور التي تم اقتصاصها عن طريق تشغيل الماكرو MitoMAPR الدفعي من الخطوة 2.4.3. ستطلب منك نافذة جديدة تحديد دليل. حدد المجلد الذي يحتوي على جميع الصور التي تم اقتصاصها من الخطوة 2.4.10. بمجرد الانتهاء ، ستظهر نافذة تسمى "البيانات" تحتوي على جميع القيم المتعلقة بمورفولوجيا الميتوكوندريا. احفظ كافة البيانات كملف Excel كما هو موضح في الخطوة 2.3.9.
- قم بإنشاء ماكرو لتحديد منطقة الصور المراد تحليلها. افتح فيجي وانتقل إلى الإضافات > New > Macro. الصق الكود التالي في مربع النص واحفظ الماكرو كما هو موضح في 2.3.2 (الشكل التكميلي 1E-H).
النتائج
C. elegans هو نموذج رائع لتصوير الميتوكوندريا نظرا لجسمه الشفاف ، والذي يسمح بتصوير الديدان الكاملة بسهولة دون إعداد العينة بشكل مفرط. بالإضافة إلى ذلك ، يمكن تصور مورفولوجيا الميتوكوندريا في الأنسجة المختلفة بسهولة باستخدام محفزات خاصة بالأنسجة للتعبير عن بروتينات الفلورسنت التي تستهدف الميتوكوندريا. هنا ، تم استخدام myo-3p (للميتوكوندريا العضلات) و vha-6p (للميتوكوندريا المعوية) و col-19p (للميتوكوندريا تحت الجلد) لدفع التعبير عن GFP المستهدف بالميتوكوندريا (تسلسل توطين الميتوكوندريا لبروتين ATP-1). الميتوكوندريا في عضلات جدار الجسم من C. ايليجانس تظهر مورفولوجيا أنبوبية ، محاذاة على طول ألياف العضلات (اللييفات العضلية) (الشكل 1 أ) ؛ أظهرت الميتوكوندريا المعوية هياكل مترابطة للغاية تشبه الويب ، مع محاذاة أقل اتساقا (الشكل 1 ب) ؛ وتحت الجلد له ميتوكوندريا أنبوبية تبدو أكثر تقريبا أو بيضاوية الشكل مقارنة بالأمعاء أو العضلات (الشكل 1 ج). يتسق مورفولوجيا الميتوكوندريا بشكل عام عبر طول الدودة في العضلات والأمعاء ، لكن تحت الجلد يظهر بعض الاختلافات الطفيفة في الترابط بين الميتوكوندريا بين الأطراف القريبة والبعيدة من الدودة. وبالتالي ، لتحقيق نتائج تجريبية قابلة للتكرار ، يوصى بالتركيز على منطقة معينة من أجسامهم. هنا ، يتم تصوير المنطقة الواقعة بين البلعوم والفرج ~ 100-200 ميكرومتر أسفل البلعوم باستمرار.
بالنسبة للميتوكوندريا العضلية وتحت الجلد ، يوفر تصويرها تحت المجهر المركب دقة كافية بسبب تسطيح الخلايا وانخفاض مستويات الضوء خارج نطاق التركيز. ومع ذلك ، يصعب ملاحظة الميتوكوندريا المعوية بالمجهر المركب ، حيث أن الحجم الكبير للأمعاء يحد من الدقة بسبب كمية كبيرة من الضوء خارج التركيز من أقسام أخرى من الأمعاء (الشكل 2). لذلك ، يوصى بتصوير الميتوكوندريا المعوية تحت مجهر متحد البؤر لتقليل الضوء خارج نطاق التركيز وتصور مورفولوجيا الميتوكوندريا المناسبة.
شكل الميتوكوندريا ديناميكي للغاية ويتغير بناء على البيئة الأيضية للحيوانات23 أو حتى بسبب التعرض لصلابة الركيزة المتغيرة24. لذلك ، فإن ترك على شرائح المجهر لفترات طويلة من الزمن في حالة عدم وجود مصدر غذائي وعلى الركيزة الصلبة للزجاج يمكن أن يؤثر على مورفولوجيا الميتوكوندريا. هنا ، وجدت هذه الدراسة أن الميتوكوندريا من الديدان تتجزأ بعد حوالي 30 دقيقة على شريحة في محلول M9 ، مع ظهور الميتوكوندريا تحت الجلد معظم التجزئة (الشكل 3). لذلك ، يجب إجراء تصوير الميتوكوندريا بسرعة بعد تحضير العينة.
تستخدم المواد الكيميائية التي تقيد حركة الديدان ، بما في ذلك أزيد الصوديوم والرباعي ، بشكل شائع للتصوير الحي ل C. ايليجانس ، حيث أن الديدان الثابتة مطلوبة لالتقاط مقاطع Z متعددة من للتصوير ثلاثي الأبعاد. أظهرت الدراسات السابقة أن التعرض لأزيد الصوديوم أو التتراميسول يمكن أن يؤدي إلى تجزئة الميتوكوندريا25. والمثير للدهشة أنه وجد أن أزيد الصوديوم - حتى بتركيزات عالية - كان له تأثير محدود على مورفولوجيا الميتوكوندريا في العضلات أو الأمعاء. ومع ذلك ، أظهر تحت الجلد تجزئة الميتوكوندريا في وقت مبكر من عناصر التحكم M9 (الشكل 3). الأهم من ذلك ، أن التركيزات العالية من التتراميسول (100 مليمتر) أدت إلى تجزئة كبيرة للميتوكوندريا مباشرة بعد التعرض في جميع أنواع الخلايا. وبالمقارنة ، أدت التركيزات المتوسطة (10 ملي مولار) إلى تجزئة أسرع مقارنة بعنصر تحكم M9. كان للتركيزات المنخفضة (1 ملليمتر) تأثير محدود على مورفولوجيا الميتوكوندريا. تشير هذه البيانات إلى أن استخدام أزيد الصوديوم يمكن أن يكون خيارا قابلا للتطبيق للتصوير السريع للميتوكوندريا ، بينما يجب تجنب التتراميسول بشكل عام.
كما هو متوقع ، فإن الميتوكوندريا لجميع أنسجة C. ايليجانس تظهر تجزئة أثناء عملية الشيخوخة الطبيعية (الشكل 4 أ). يمكن تصور التجزئة على أنها الميتوكوندريا تقدم على أنها هياكل أكثر اقتطاعا وكروية ، والتي تختلف اختلافا كبيرا عن الميتوكوندريا الأنبوبية الخطية المعروضة في الصغيرة. من المهم ملاحظة أن الأمعاء تزداد في الهياكل الفلورية الذاتية الكروية في سن متأخرة ، لذلك يجب الحرص على عدم الخلط بين التألق الذاتي وهياكل الميتوكوندريا الفعلية. نظرا لأنه يمكن أن يكون هناك تباين في التغييرات في بنية الميتوكوندريا عبر الديدان ، فمن المهم إجراء القياس الكمي لمورفولوجيا الميتوكوندريا على حجم عينة كبير بدلا من مجرد تصوير عدد قليل من الديدان. هنا ، تم استخدام mitoMAPR ، والذي يسمح بالقياس الكمي الآلي لمورفولوجيا الميتوكوندريا باستخدام مجموعة متنوعة من المقاييس ، بما في ذلك الكائنات والشبكات والتقاطعات لكل شبكة ونقاط التوصيل وطول الكائن وبصمة الميتوكوندريا وتغطية الميتوكوندريا ومساحة الكائن (الجدول التكميلي 1 والجدول التكميلي 2). تزيل الأتمتة التحيز الذاتي من المستخدم. هنا ، نبلغ أن مقياس طول الكائن هو الأمثل لقياس التغيرات في مورفولوجيا الميتوكوندريا في العضلات والأمعاء أثناء الشيخوخة كميا ، ومقاييس نقاط التقاطع لقياس التغيرات في مورفولوجيا الميتوكوندريا تحت الجلد أثناء الشيخوخة (الشكل 4 ب).
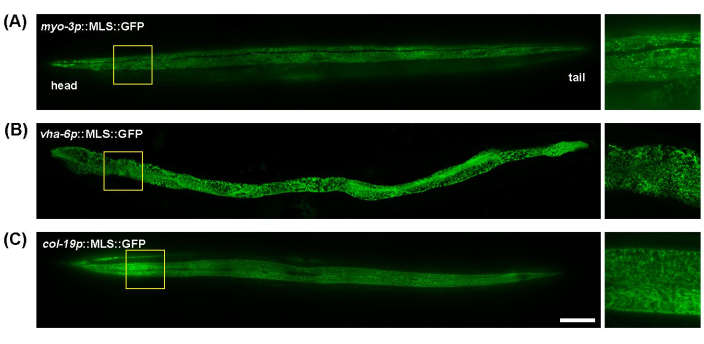
الشكل 1: صور الميتوكوندريا في جميع أنحاء جسم C. ايليجانس. تم إجراء تصوير الميتوكوندريا طوال اليوم 5 للحيوانات البالغة التي نمت على EV من مرحلة L1 في المعدلة وراثيا مع تعبير MLS :: GFP في العضلات (A) والأمعاء (B) وتحت الجلد (C). شريط المقياس: 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
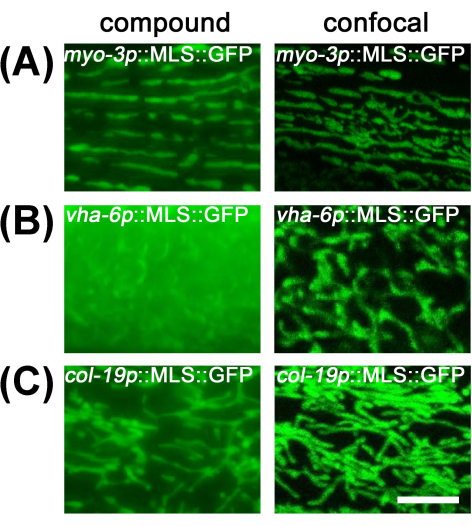
الشكل 2: مقارنة تصوير الميتوكوندريا بين المجهر المركب والمجهر متحد البؤر. تم إجراء تصوير الميتوكوندريا في اليوم الأول للحيوانات البالغة التي نمت على EV من المرحلة L1 في المعدلة وراثيا مع MLS:: تعبير GFP في العضلات (A) والأمعاء (B) وتحت الجلد (C). شريط المقياس: 5 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
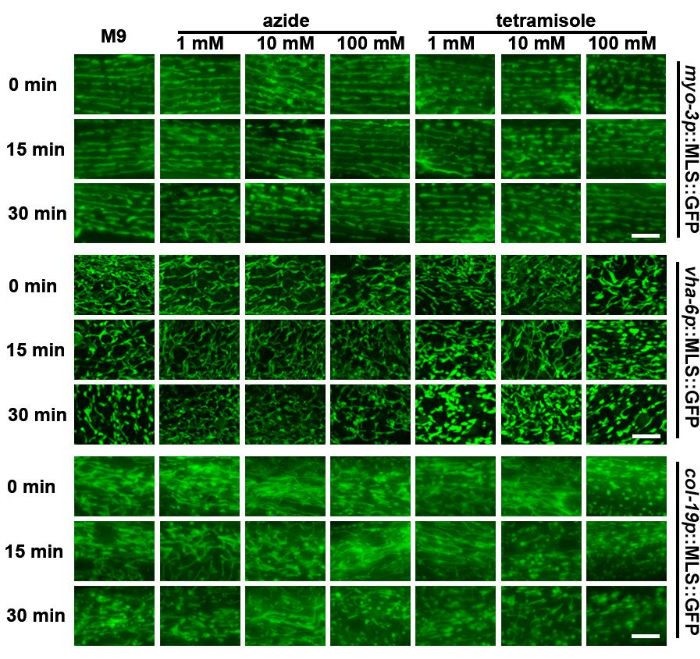
الشكل 3: تقييم تجزئة الميتوكوندريا للأنسجة المختلفة بعد العلاج ب M9 وأزيد الصوديوم والرباعي. تم إجراء تصوير الميتوكوندريا في اليوم الأول للحيوانات البالغة مع التعبير عن MLS :: GFP في العضلات والأمعاء وتحت الجلد. نمت على EV من مرحلة L1. تم وضع على شرائح تحتوي على M9 أو أزيد الصوديوم (1 ملي مولار ، 10 ملي مولار ، و 100 ملم) ، أو رباعي التتراميزول (1 ملم ، 10 ملم ، و 100 مليمتر) وتم إجراء التصوير مباشرة بعد تحضير الشريحة (0 دقيقة) أو 15 دقيقة أو 30 دقيقة بعد تحضير الشريحة. يتم عرض الصور التمثيلية ل n > 5 لكل سلالة ل 2 مكررات بيولوجية. قضبان المقياس: 5 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
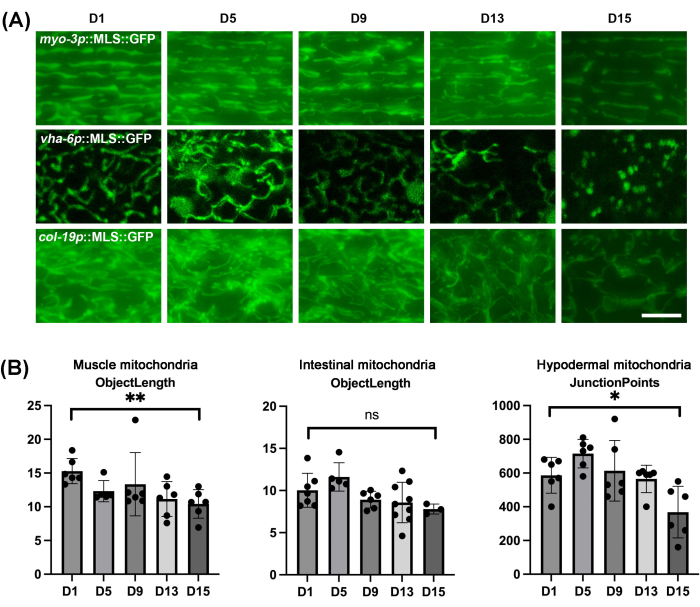
الشكل 4: تصوير الميتوكوندريا ل C. ايليجانس أثناء الشيخوخة في الأنسجة المختلفة والقياس الكمي لمورفولوجيا الميتوكوندريا باستخدام MitoMAPR. (أ) تم إجراء تصوير الميتوكوندريا في البالغة في الأيام 1 و 5 و 9 و 13 و 15 من مرحلة البلوغ مع التعبير عن MLS :: GFP في العضلات والأمعاء وتحت الجلد. نمت على EV من المرحلة L1 وانتقلت إلى لوحات EV التي تحتوي على FUDR من مرحلة البالغين في اليوم الأول. تمثل الصور n ≥ 5 لكل سلالة ل ≥ 3 مكررات بيولوجية. شريط المقياس: 5 ميكرومتر. (ب) القياس الكمي لطول الجسم للميتوكوندريا العضلية والميتوكوندريا المعوية للديدان في الأيام 1 و 5 و 9 و 13 و 15 ، والقياس الكمي لنقاط تقاطع الميتوكوندريا تحت الجلد للديدان في الأيام 1 و 5 و 9 و 13 و 15. تم رسم جميع نقاط البيانات الفردية جنبا إلى جنب مع متوسط ± SD. تم رسم الرسوم البيانية وتحليلها إحصائيا باستخدام اختبار t للطالب. ns = غير معتد ، * ص < 0.03 ؛ ** ص < 0.002 ؛ ص < 0.0002; ص < 0.0001. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| أيام الديدان | عدد الديدان | حجم المخزن المؤقت (مل) |
| 1 | 25 | 13 |
| 5 | 25 | 14 |
| 9 | 20 | 15 |
| 13 | 20 | 15 |
الجدول 1: الأعداد الموصى بها من الديدان وأحجام المخزن المؤقت عند إعداد الشرائح.
الشكل التكميلي 1: سير عمل تطبيق القياس الكمي لصورة واحدة باستخدام MitoMAPR ومعالجة الدفعات لصور متعددة. (أ) سير عمل تحديد مورفولوجيا الميتوكوندريا من صورة واحدة باستخدام ماكرو MitoMAPR. (ب) إسقاط Z لملف صورة ثلاثي الأبعاد خام باستخدام فيجي (الإسقاط الأقصى). (ج) اقتصاص منطقة الاهتمام من الصورة المعروضة Z. (د) صور الهيكل العظمي المأخوذة من ماكرو MitoMAPR. قضبان المقياس: 5 ميكرومتر. (ه) سير عمل القياس الكمي لمورفولوجيا الميتوكوندريا من صور متعددة باستخدام عملية مجمعة باستخدام ماكرو MitoMAPR. (و) لقطة شاشة لماكرو الاقتصاص. (ز) لقطة شاشة لعملية دفعة لإسقاط Z. (ح) لقطة شاشة لنافذة تأكيد الاختيار لماكرو اقتصاص الدفعات. الرجاء النقر هنا لتنزيل هذا الملف.
الجدول التكميلي 1: التحليل الكمي لمقاييس مورفولوجيا الميتوكوندريا في C. ايليجانس الأنسجة العضلية. تشمل المقاييس المسجلة الكائنات والشبكات والتقاطعات لكل شبكة ونقاط التوصيل وطول الكائن وبصمة الميتوكوندريا ومساحة الكائن وتغطية الميتوكوندريا ، والتي تم قياسها عبر أيام مختلفة. توفر البيانات أساسا لتقييم التغيرات في مورفولوجيا الميتوكوندريا مع تقدم العمر. الرجاء النقر هنا لتنزيل هذا الملف.
الجدول التكميلي 2: آثار المواد الكيميائية المشمولة على مورفولوجيا الميتوكوندريا في C. ايليجانس. تتضمن البيانات قياسات مثل الكائنات والشبكات والتقاطعات لكل شبكة ونقاط التوصيل وطول الجسم وبصمة الميتوكوندريا ومساحة الجسم وتغطية الميتوكوندريا عبر تركيزات ونقاط زمنية متفاوتة بعد تحضير العينة باستخدام المخزن المؤقت M9 أو تركيزات مختلفة من رباعي التتراميزول وأزيد الصوديوم. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
التصوير الفلوري لمورفولوجيا الميتوكوندريا هو الطريقة الأكثر شيوعا لتحديد التغيرات في الميتوكوندريا. في حين أن تقنيات الفحص المجهري المتقدمة مثل المجهر الإلكتروني الناقل (TEM) ، والفحص المجهري للقوة الذرية ، والفحص المجهري الإلكتروني بالتبريد توفر دقة أعلى ، يظل الفحص المجهري الفلوري ميسور التكلفة ويمكن لمعظم الباحثين الوصول إليه. بالإضافة إلى ذلك ، يمكن إجراء الفحص المجهري الفلوري في الخلايا الحية ، وفي الكائنات الحية النموذجية الواضحة مثل C. ايليجانس ، يمكن إجراء التصوير في كاملة26،27. يعد تصوير C. ايليجانس المعدل وراثيا أمرا بسيطا للغاية ، وتسمح علامات الفلورسنت المشفرة وراثيا بتصوير أكثر موثوقية وقوة للميتوكوندريا لأنها لا تتطلب معالجة معقدة للعينات أو تعاني من تلطيخ متغير عبر أنواع الخلايا أو الظروف من أصباغ الميتوكوندريا التقليدية مثل MitoTracker أو TMRE28،29،30. عادة ما تتضمن علامات الفلورسنت المشفرة وراثيا وضع علامات مباشرة على بروتينات الميتوكوندريا بالفلوروفورات أو اقتران الفلوروفورات مع الحد الأدنى من تسلسل توطين الميتوكوندريا. غالبا ما تكون هذه التركيبات مدفوعة بمحفزات خاصة بالأنسجة ، مما يتيح تصور الميتوكوندريا في أنسجة مختلفة مثل أنسجة العضلات أو الأمعاء أو تحت الجلد31. بشكل عام ، يتم التعبير عن هذه البروتينات الموسومة بالفلورسنت بشكل مفرط ، والتي يمكن أن يكون لها تأثيرات فسيولوجية غير مرغوب فيها إذا تم الإفراط في التعبير عن بروتينات الميتوكوندريا كاملة الطول. وبالتالي ، فإن الحد الأدنى من تسلسلات MLS هو الخيارالأفضل 32. ومع ذلك ، حتى مع الإفراط في التعبير عن الحد الأدنى من اندماجات البروتين الفلوري MLS ، يجب تجنب الإفراط في التعبير العالي ، لأن استيراد كمية كبيرة من البروتين إلى الميتوكوندريا يمكن أن يؤدي إلى انهيار إمكانات غشاء الميتوكوندريا والتأثير على صحة33. في حين أن التوصيف الشامل لجميع سلالات C. ايليجانس المتاحة حاليا خارج نطاق هذه المخطوطة ، يمكن العثور على تحليل مقارن مفصل للعديد من مراسلي الميتوكوندريا وإيجابيات وسلبيات كل منها هنا31.
بالنسبة لتصوير الخلايا الحية للميتوكوندريا في C. ايليجانس، قد يكون الفحص المجهري المركب القياسي أو واسع المجال خيارا مفضلا نظرا للسرعة العالية وسهولة هذه الطرق عبر الفحص المجهري متحد البؤر. في هذه الدراسة ، تبين أن الخلايا المسطحة مثل العضلات وتحت الجلد تستفيد بشكل ضئيل من الفحص المجهري متحد البؤر ، ويسمح الفحص المجهري المركب بالاكتساب بدقة كافية لتصور مورفولوجيا الميتوكوندريا المناسبة. تجعل الخلايا الأكبر حجما مثل الأمعاء الفحص المجهري المركب أمرا صعبا بسبب الضوء خارج نطاق التركيز. لذلك ، يلزم إجراء فحص مجهري متحد البؤر للتصوير الموثوق به لمورفولوجيا الميتوكوندريا المعوية.
أحد الاعتبارات المهمة للتصوير ثلاثي الأبعاد عبر سمك الأنسجة بالكامل في الحية هو منع حركة الديدان أثناء الحصول على الصور. غالبا ما يستخدم الباحثون طرقا لشل الديدان ، مثل رباعي الميزول أو أزيدالصوديوم 34. يثبط أزيد الصوديوم السيتوكروم سي أوكسيديز (المركب الرابع) ، وهو إنزيم مهم في سلسلة نقل الإلكترون للميتوكوندريا ، مما يؤدي إلى شلل عام بسبب نقص ATP اللازم لتقلصات العضلات والوظائف الخلويةالأخرى 34،35. يعمل التتراميسول عن طريق تقليد الأسيتيل كولين عند التقاطعات العصبية العضلية ، مما يتسبب في إزالة الاستقطاب المستمر وتقلص العضلات36. ومع ذلك ، فإن التعرض لهذه الأدوية يمكن أن يؤدي إلى تجزئة الميتوكوندريا عن طريق التسبب في الإجهاد التأكسدي23. في هذه الدراسة ، وجد أن التتراميسول تسبب بسرعة كبيرة في تجزئة الميتوكوندريا ، لكن أزيد الصوديوم كان له تأثير محدود للغاية.
C. ايليجانس يقدم طريقة بسيطة وسهلة للغاية لدراسة تأثير الشيخوخة على مورفولوجيا الميتوكوندريا نظرا لعمرها القصير وسهولة شيخوخة. هنا ، اخترنا استخدام التعرض ل FUDR ، وهي طريقة قوية لتعقيم كيميائيا عن طريق منع تكرار الحمض النووي20،37،38. ومع ذلك ، قد يكون ل FUDR تأثيرات غير مرغوب فيها على معايير شيخوخة محددة ، وبالنسبة لأولئك الذين يهتمون بالتأثيرات غير المستهدفة ل FUDR ، يمكن استخدام استراتيجيات أخرى لإزالة النسل39. على سبيل المثال ، هناك طفرات معقمة ، بما في ذلك طفرة السلالة الجرثومية الحساسة لدرجة الحرارة glp-4 ، أو الطفرات التي تعاني من نقص المنوية ، مثل CF51240،41،42. كبديل ، يمكن أيضا أن تتقدم في العمر بشكل طبيعي عن طريق انتقاء البالغين يدويا من ذريتها يوميا.
يعد القياس الكمي للتغيرات في مورفولوجيا الميتوكوندريا أيضا اعتبارا مهما للغاية ، حيث قد يكون هناك تباين كبير في مورفولوجيا الميتوكوندريا عبر. لذلك ، يعد إجراء التحليل والكائنات الكمية عبر حجم عينة كاف أمرا ضروريا للتوصل إلى استنتاجات مهمة حول التغييرات في مورفولوجيا الميتوكوندريا. ومع ذلك ، يمكن أن يعاني تحليل الصور وقياسها بشكل كبير من التحيز الذاتي والتحديات الناجمة عن تصوير الهياكل المعقدة للغاية مثل الميتوكوندريا المترابطة. تحقيقا لهذه الغاية ، إليك ملخص لطريقة آلية لتحديد مورفولوجيا الميتوكوندريا باستخدام العديد من المقاييس التي طورها مختبر ماير. يسمح MitoMAPR بالقياس الكمي الموضوعي والآلي لمورفولوجيا الميتوكوندريا ، وقياس جوانب مختلفة من الميتوكوندريا ، بما في ذلك شبكة الميتوكوندريا ، وطول الكائن ، والتوزيع ، وتغطية الشبكة ، وبصمة الميتوكوندريا. MitoMAPR هو ماكرو مجاني ل ImageJ وبالتالي فهو متاح لجميع المختبرات المزودة بجهاز كمبيوتر وظيفي. يتمثل أحد الجوانب المهمة لاستخدام MitoMAPR في إجراء القياس الكمي عبر حجم عينة كبير لتحديد مقياس مورفولوجيا الميتوكوندريا الأكثر قوة لتحديد التغييرات في الظروف التجريبية التي يتماختبارها 43،44. هنا ، وجد أن طول الجسم ونقاط التقاطع هي أفضل المقاييس لتحديد التغيرات أثناء الشيخوخة في العضلات والأمعاء وتحت الجلد. النهج البديل لتحليل التغيرات في مورفولوجيا الميتوكوندريا هو توليد تمثيلات ثلاثية الأبعاد للميتوكوندريا من صور z-stack ، متبوعة بتحليل ثلاثي الأبعاد16،45. يمكن تحقيق ذلك باستخدام البرامج المتاحة تجاريا ، مثل Image-Pro Plus مع وحدات SharpStack Total Deconvolution و 3D Constructor. ثبت أن القياس الكمي لتمثيلات الميتوكوندريا ثلاثية الأبعاد يوفر رؤى أكثر دقة حول شكل الميتوكوندريا وخصائصالشبكة 46. ومع ذلك ، فإن هذه الطريقة أكثر تعقيدا وتكلفة من الناحية الفنية مقارنة بالنهج شبه ثلاثي الأبعاد ، والذي يتضمن انهيار أقسام صور متعددة من مكدس z واسع المجال أو متحد البؤر في إسقاط ثنائي الأبعاد واحد وتحليلها باستخدام أدوات مثل mitoMAPR. تلخص هذه الدراسة استخدام التعبير أحادي النسخة من GFP المستهدف بمصفوفة الميتوكوندريا وتوضح بالتفصيل بعض المزالق التي يجب تجنبها أثناء التصوير.
القيود والاعتبارات الزمنية
على الرغم من أن الفحص المجهري متحد البؤر موصى به للأنسجة الكبيرة والسميكة ، مثل الأنسجة المعوية ، إلا أن تقنيات الفحص المجهري متحد البؤر القياسية لمسح الخط قد تكون بطيئة جدا لإجراء التصوير السريع للميتوكوندريا. هذا صحيح بشكل خاص بالنظر إلى بياناتنا التي تظهر أن الاحتفاظ بالديدان على الشرائح لفترات طويلة من الزمن يمكن أن يؤدي إلى تجزئة الميتوكوندريا. على الرغم من أن تقنية الفحص المجهري متحد البؤر قد تقدمت بشكل كبير ، إلا أن المجاهر التي يمكنها إجراء التصوير السريع ، مثل القرص الدوار أو Airyscan أو تلك المستخدمة في هذه الدراسة ، يمكن أن تكون باهظة التكلفة لبعض المختبرات. في هذه الحالات ، يمكن دمج الفحص المجهري المركب مع طرق التخليص الحسابي لإزالة الضوء خارج نطاق التركيز ، مثل الالتفاف47.
أيضا ، كما هو موضح ، فإن MitoMAPR هو ماكرو آلي قوي لقياس طول الميتوكوندريا والتوصيل البيني لشبكة الميتوكوندريا كميا. ومع ذلك ، يجب استخدامه بعناية مع مراعاة القيود المذكورة هنا. أولا ، يلاحظ استخدام GFP المستهدف بالمصفوفة فقط تجزئة الميتوكوندريا للغشاء الداخلي ، والذي قد لا يلخص بشكل كامل مورفولوجيا الميتوكوندريا للغشاء الخارجي ، حيث يمكن أن تحدث أحداث انشطار الغشاء الداخلي في حالة عدم وجود انشطار الغشاء الخارجي. وبالتالي ، من أجل تصوير أكثر دقة لكلا الغشاءين ، يجب استخدام كل من الفلوروفور المستهدف بالمصفوفة والأغشية الخارجية المستهدفة للميتوكوندريا. نظرا لأن علامات غشاء الميتوكوندريا الخارجية يمكن أن تعاني من نفس عواقب البروتينات الموضعية المصفوفة إذا تم الإفراط في التعبير عنها بشكل كبير ، يوصى باستخدام علامات أحادية النسخة ، خاصة تلك التي تستخدم الحد الأدنى من تسلسل توطين الميتوكوندريا بدلا من البروتينات الكاملة مثل تلك المستخدمة هنا31.
كما هو موضح في الشكل 3 ، يمكن أن تتفتت الميتوكوندريا بسرعة تحت المجهر ، ويمكن أن تؤثر الطرق المختلفة لإعداد شرائح العينة إلى حد كبير على التشكل اعتمادا على المخزن المؤقت المستخدم. تظهر البيانات التمثيلية الموضحة في هذه المخطوطة أن الميتوكوندريا للديدان تخضع للحد الأدنى من التجزئة تحت M9 وتركيزات منخفضة من أزيد الصوديوم. رباعي الميزول ، وهو مادة كيميائية أخرى تستخدم على نطاق واسع لشل الديدان ، يقوم بتجزئة الميتوكوندريا بسرعة ، مما يشير إلى أنه يجب تجنب استخدامه بشكل عام. على الرغم من أن M9 وأزيد الصوديوم لم يظهرا تجزئة كبيرة في الميتوكوندريا ، فمن المهم ملاحظة أن السلالات المختلفة قد تستجيب بشكل مختلف عن النتائج الموضحة هنا. بينما أظهرت دراسات أخرى أن أزيد الصوديوم يمكن أن يجزئ الميتوكوندريا ، فمن المحتمل أن سلالنا لا تظهر تجزئة كبيرة في الميتوكوندريا مع التعرض لأزيد الصوديوم بسبب انخفاض مستوى التعبير عن تركيباتنا. يمكن أن يؤدي التعبير العالي للبروتينات الموضعية في الميتوكوندريا إلى انهيار إمكانات الغشاء ، وبالتالي ، فإن السلالات المختلفة المستخدمة في دراسات أخرى قد تجعل الميتوكوندريا أكثر عرضة للتجزئة من نفس تركيزات أزيد الصوديوم المستخدمة في هذه الدراسة. بغض النظر ، يجب توخي الحذر للتأكد من أن المواد الكيميائية التي تشل الديدان لا تسبب تجزئة الميتوكوندريا في ظروف محددة ليتم اختبارها قبل استخدامها في جميع الدراسات ، حيث أن طفرات أو حالات معينة قد تكون أكثر عرضة لتجزئة الميتوكوندريا التي يسببها الدواء. علاوة على ذلك ، حتى الاحتفاظ بالديدان في M9 يمكن أن يؤدي إلى تغييرات في مورفولوجيا الميتوكوندريا الطبيعية ونشاطها حيث ثبت سابقا أن نشاط السباحة في المخزن المؤقت M9 قد ثبت سابقا أنه يؤثر على انشطار الميتوكوندريا وديناميكيات الاندماج. بالإضافة إلى ذلك ، يمكن أن يؤدي ترك الديدان في M9 لفترات طويلة من الزمن إلى تنشيط استجابات نقص الأكسجة التي تؤثر بشكل كبير على الميتوكوندريا عن طريق التسبب في اضطرابات البروتينات في الميتوكوندريا48،49.
أخيرا ، هناك اعتبار مهم آخر وهو أنه في حين أن التغييرات في مورفولوجيا الميتوكوندريا غالبا ما ترتبط بالتغيرات في وظيفة الميتوكوندريا ، إلا أنه لا يوجد دائما ارتباط مباشر بين الاثنين. وبالتالي ، يوصى بإجراء تحليل أكثر شمولا لوظيفة الميتوكوندريا. على سبيل المثال ، يمكن قياس معدل استهلاك الأكسجين باستخدام أداة Seahorse50 ، ويمكن قياس إمكانات غشاء الميتوكوندريا باستخدام أصباغ الغشاء المحتملة مثل JC9 أو TMRE51 ، ويمكن قياس حالة تأكسد الميتوكوندريا باستخدام أصباغ حساسة للأكسدة والاختزال مثل roGFP52 ، ويمكن قياس مرونة إجهاد الميتوكوندريا باستخدام الحساسية للضغوطات مثل الروتينون53. نظرا لأن تصوير الميتوكوندريا يمكن أن يكون سريعا جدا ، فإننا نقدم الطرق هنا كتمريرة أولى سهلة لتحديد ما إذا كانت الظروف التجريبية تؤثر على مورفولوجيا الميتوكوندريا. هذه الأساليب قابلة للتطبيق حتى بالنسبة للفحص على نطاق واسع للأدوية أو الجينات ، مع متابعة تحليل الميتوكوندريا الأكثر شمولا باستخدام مقاييس إضافية موصى بها. إجمالا ، نراجع هنا ما يعتقد أنه أبسط الطرق لتصوير مورفولوجيا الميتوكوندريا في C. ايليجانس مع الحد الأدنى من الأخطاء التجريبية.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
JK مدعوم من قبل زمالة USC Provost. يدعم T32AG052374 ماجستير و جي جي. M.V. مدعوم من قبل 1R25AG076400 ؛ و R.H.S. مدعوم من قبل R01AG079806 من المعهد الوطني للشيخوخة و 2022-A-010-SUP من مؤسسة Larry L. Hillblom. تم توفير بعض السلالات من قبل CGC ، والتي يتم تمويلها من قبل مكتب المعاهد الوطنية للصحة لبرامج البنية التحتية البحثية منحة P40 OD010440. تم إجراء بعض التحليلات الجينية باستخدام Wormbase ، والتي يتم تمويلها من HG002223 منحة U41.
Materials
| Name | Company | Catalog Number | Comments |
| 5-fluoro-2'-deoxyuridine (FUDR) | Spectrum Chemical | F2026-10GMBL | for proliferation inhibition |
| APEX IPTG | Genesee | 18-242 | for RNAi |
| Bacto Agar | VWR | 90000-764 | for NGM plates |
| Bacto Peptone | VWR | 97064-330 | for NGM plates |
| Calcium chloride dihydrate | VWR | 97061-904 | for NGM plates |
| Carbenicillin | VWR | 76345-522 | for RNAi |
| Cholesterol | VWR | 80057-932 | for NGM plates |
| Confocal microscope | Stellaris 5 | ||
| DMSO | VWR | BDH1115-1LP | solvent for drugs |
| HistoBond microscope slides | VWR | 16005-110 | for slides preparation |
| LB Broth | VWR | 95020-778 | for LB |
| LEICA S7E Dissecting Scope | Leica | 10450840 | Standard dissecting microscope |
| LEICA STELLARIS 5 | Leica | 158101100 | Confocal Microscope |
| LEICA THUNDER | Leica | 11525679 | Compound Microscope |
| Magnesium sulfate heptahydrate | VWR | 97062-132 | for NGM plates, M9 |
| pL4440 empty vector plasmid | addgene | plasmid #1654 | for empty vector plasmid |
| Potassium Chloride | VWR | 97061-566 | for bleach soluton |
| Potassium phosphate dibasic | VWR | EM-PX1570-2 | for NGM plates |
| Potassium phosphate monobasic | VWR | EM-PX1565-5 | for M9 |
| Sodium azide | VWR | 97064-646 | for paralyzing worms |
| Sodium Chloride | VWR | EM-SX0420-5 | for NGM plates, M9 |
| Sodium hypochlorite | VWR | RC7495.7-32 | for bleach solution |
| Sodium phosphate dibasic | VWR | 71003-472 | for M9 |
| Tetracycline hydrochloride | VWR | 97061-638 | for RNAi |
| WOB-L® Dry Vacuum Pumps, Standard-Duty, Welch® | VWR | 80077-612 | for aspiration |
References
- Protasoni, M., Zeviani, M. Mitochondrial structure and bioenergetics in normal and disease conditions. Int J Mol Sci. 22 (2), 586 (2021).
- Wang, Y., et al. The role of mitochondrial dynamics in disease. MedComm. 4 (6), e462 (2023).
- Kamer, K. J., Mootha, V. K. The molecular era of the mitochondrial calcium uniporter. Nat Rev Mol Cell Biol. 16 (9), 545-553 (2015).
- Chen, W., Zhao, H., Li, Y. Mitochondrial dynamics in health and disease: mechanisms and potential targets. Signal Transduct Target Ther. 8 (1), 333 (2023).
- Adebayo, M., Singh, S., Singh, A. P., Dasgupta, S. Mitochondrial fusion and fission: The fine-tune balance for cellular homeostasis. FASEB J. 35 (6), e21620 (2021).
- Madan, S., Uttekar, B., Chowdhary, S., Rikhy, R. Mitochondria lead the way: mitochondrial dynamics and function in cellular movements in development and disease. Front Cell Dev Biol. 9, 781933 (2021).
- Sharma, A., Smith, H. J., Yao, P., Mair, W. B. Causal roles of mitochondrial dynamics in longevity and healthy aging. EMBO Rep. 20 (12), e48395 (2019).
- Rolland, S. G., Lu, Y., David, C. N., Conradt, B. The BCL-2-like protein CED-9 of C. elegans promotes FZO-1/Mfn1,2- and EAT-3/Opa1-dependent mitochondrial fusion. J Cell Biol. 186 (4), 525-540 (2009).
- Labrousse, A. M., Zappaterra, M. D., Rube, D. A., van der Bliek, A. M. C. elegans dynamin-related protein DRP-1 controls severing of the mitochondrial outer membrane. Mol Cell. 4 (5), 815-826 (1999).
- Dickinson, D. J., Pani, A. M., Heppert, J. K., Higgins, C. D., Goldstein, B. Streamlined genome engineering with a self-excising drug selection cassette. Genetics. 200 (4), 1035-1049 (2015).
- Bosher, J. M., Labouesse, M. RNA interference: Genetic wand and genetic watchdog. Nat Cell Biol. 2 (2), E31-E36 (2000).
- Yu, C. C. J., et al. Expansion microscopy of C. elegans. eLife. 9, e46249 (2020).
- Zhang, S., Li, F., Zhou, T., Wang, G., Li, Z. Caenorhabditis elegans as a useful model for studying aging mutations. Front Endocrinol. 11, 554994 (2020).
- Dingley, S., et al. Mitochondrial respiratory chain dysfunction variably increases oxidant stress in Caenorhabditis elegans. Mitochondrion. 10 (2), 125-136 (2010).
- Presley, A. D., Fuller, K. M., Arriaga, E. A. MitoTracker Green labeling of mitochondrial proteins and their subsequent analysis by capillary electrophoresis with laser-induced fluorescence detection. J Chromatogr B Anal Technol Biomed Life Sci. 793 (1), 141-150 (2003).
- Mitra, K., Lippincott-Schwartz, J. Analysis of mitochondrial dynamics and functions using imaging approaches. Curr Protoc Cell Biol. Chapter 4, Unit 4.25.1-Unit 4.25.21 (2010).
- Valera-Alberni, M., Yao, P., Romero-Sanz, S., Lanjuin, A., Mair, W. B. Novel imaging tools to study mitochondrial morphology in Caenorhabditis elegans. Life Sci Alliance. 7 (11), e202402918 (2024).
- Benedetti, C., Haynes, C. M., Yang, Y., Harding, H. P., Ron, D. Ubiquitin-like protein 5 positively regulates chaperone gene expression in the mitochondrial unfolded protein response. Genetics. 174 (1), 229-239 (2006).
- Begelman, D. V., et al. An aco-2::gfp knock-in enables the monitoring of mitochondrial morphology throughout C. elegans lifespan. microPublication Biol. 2022, (2022).
- Castro Torres, T., et al. Surveying low-cost methods to measure lifespan and healthspan in Caenorhabditis elegans. J Vis Exp. 183, e64091 (2022).
- Rasmussen, N. R., Reiner, D. J. Nuclear translocation of the tagged endogenous MAPK MPK-1 denotes a subset of activation events in C. elegans development. J Cell Sci. 134 (17), jcs258456 (2021).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Luz, A. L., et al. Mitochondrial morphology and fundamental parameters of the mitochondrial respiratory chain are altered in Caenorhabditis elegans strains deficient in mitochondrial dynamics and homeostasis processes. PLoS One. 10 (6), e0130940 (2015).
- Oorloff, M., et al. Mechanical stress through growth on stiffer substrates impacts animal health and longevity in C. elegans. bioRxiv. , (2024).
- Chu, X., Wu, S., Raju, R. NLRX1 regulation following acute mitochondrial injury. Front Immunol. 10, 2431 (2019).
- Shah, P., Bao, Z., Zaidel-Bar, R. Visualizing and quantifying molecular and cellular processes in Caenorhabditis elegans using light microscopy. Genetics. 221 (4), iyac068 (2022).
- Wang, Y., Wang, P., Li, C. Fluorescence microscopic platforms imaging mitochondrial abnormalities in neurodegenerative diseases. Adv Drug Deliv Rev. 197, 114841 (2023).
- Ding, J., et al. An expanded GCaMP reporter toolkit for functional imaging in Caenorhabditis elegans. G3 (Bethesda, Md). 13 (10), jkad183 (2023).
- Sarasija, S., Norman, K. R. Analysis of mitochondrial structure in the body wall muscle of Caenorhabditis elegans. Bio-Protocol. 8 (7), e2801 (2018).
- Chaweeborisuit, P., Suriyonplengsaeng, C., Suphamungmee, W., Sobhon, P., Meemon, K. Nematicidal effect of plumbagin on Caenorhabditis elegans: A model for testing a nematicidal drug. Z Naturforsch C J Biosci. 71 (5-6), 121-131 (2016).
- Valera-Alberni, M., Yao, P., Romero-Sanz, S., Lanjuin, A., Mair, W. B. . Novel imaging tools to study mitochondrial dynamics in Caenorhabditis elegans. 7, 11 (2024).
- Bolognesi, B., Lehner, B. Reaching the limit. eLife. 7, e39804 (2018).
- Jishi, A., Qi, X. Altered mitochondrial protein homeostasis and proteinopathies. Front Mol Neurosci. 15, 867935 (2022).
- Morton, K. S., Wahl, A. K., Meyer, J. N. The effect of common paralytic agents used for fluorescence imaging on redox tone and ATP levels in Caenorhabditis elegans. PLoS One. 19 (4), e0292415 (2024).
- Noumi, T., Maeda, M., Futai, M. Mode of inhibition of sodium azide on H+-ATPase of Escherichia coli. FEBS Lett. 213 (2), 381-384 (1987).
- Siete, C., Xiong, R., Khalid, A., Hsieh, Y. -. W., Chuang, C. -. F. Immobilization of C. elegans with different concentrations of an anesthetic for time-lapse imaging of dynamic protein trafficking in neurons. microPublication Biology. 2024, (2024).
- Mitchell, D. H., Stiles, J. W., Santelli, J., Sanadi, D. R. Synchronous growth and aging of Caenorhabditis elegans in the presence of fluorodeoxyuridine. J Gerontol. 34 (1), 28-36 (1979).
- Santi, D. V., McHenry, C. S. 5-Fluoro-2'-deoxyuridylate: covalent complex with thymidylate synthetase. Proc Natl Acad Sci U S A. 69 (7), 1855-1857 (1972).
- Wang, H., Zhao, Y., Zhang, Z. Age-dependent effects of floxuridine (FUdR) on senescent pathology and mortality in the nematode Caenorhabditis elegans. Biochem Biophys Res Commun. 509 (3), 694-699 (2019).
- Beanan, M. J., Strome, S. Characterization of a germ-line proliferation mutation in C. elegans. Development (Cambridge, England). 116 (3), 755-766 (1992).
- Austin, J., Kimble, J. glp-1 is required in the germ line for regulation of the decision between mitosis and meiosis in C. elegans. Cell. 51 (4), 589-599 (1987).
- Garigan, D., et al. Genetic analysis of tissue aging in Caenorhabditis elegans: A role for heat-shock factor and bacterial proliferation. Genetics. 161 (3), 1101-1112 (2002).
- Zhang, Y., et al. Neuronal TORC1 modulates longevity via AMPK and cell nonautonomous regulation of mitochondrial dynamics in C. elegans. eLife. 8, e49158 (2019).
- Dutta, N., et al. Investigating impacts of the mycothiazole chemotype as a chemical probe for the study of mitochondrial function and aging. GeroScience. 46 (6), 6009-6028 (2024).
- Tronstad, K., et al. Regulation and quantification of cellular mitochondrial morphology and content. Curr Pharm Des. 20 (35), 5634-5652 (2014).
- Nikolaisen, J., et al. Automated quantification and integrative analysis of 2D and 3D mitochondrial shape and network properties. PLoS One. 9 (7), e101365 (2014).
- Lee, J. S., Wee, T. L. E., Brown, C. M. Calibration of wide-field deconvolution microscopy for quantitative fluorescence imaging. J Biomol Tech. 25 (1), 31-40 (2014).
- Hong, M., Kwon, J. Y., Shim, J., Lee, J. Differential hypoxia response of hsp-16 genes in the nematode. J Mol Biol. 344 (2), 369-381 (2004).
- Yan, J., Sun, C. L., Shin, S., Van Gilst, M., Crowder, C. M. Effect of the mitochondrial unfolded protein response on hypoxic death and mitochondrial protein aggregation. Cell Death Dis. 12 (7), 711 (2021).
- Koopman, M., et al. A screening-based platform for the assessment of cellular respiration in Caenorhabditis elegans. Nat Protoc. 11 (10), 1798-1816 (2016).
- Shpilka, T., et al. UPRmt scales mitochondrial network expansion with protein synthesis via mitochondrial import in Caenorhabditis elegans. Nat Comm. 12 (1), 479 (2021).
- Braeckman, B. P., Smolders, A., Back, P., De Henau, S. In vivo detection of reactive oxygen species and redox status in Caenorhabditis elegans. antioxidants & redox signaling. 25 (10), 577-592 (2016).
- Bar-Ziv, R., et al. Measurements of physiological stress responses in C. elegans. J Vis Exp. 159, e61001 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved