A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
المقايسات السلوكية للتلاعب البصري الوراثي للدوائر العصبية في ذبابة الفاكهة السوداء
* These authors contributed equally
In This Article
Summary
تقدم هذه الورقة طرقا للتلاعب البصري الوراثي في ذبابة الفاكهة السوداء ، باستخدام CsChrimson و GtACR2 لتنشيط وإسكات الخلايا العصبية المحددة. تم وصف أربع تجارب لاستخدام علم البصريات الوراثي لاستكشاف السلوكيات الحرارية والذوقية ، مما يوفر نظرة ثاقبة للآليات العصبية الأساسية التي تحكم هذه العمليات.
Abstract
أصبح علم الوراثة البصرية أسلوبا أساسيا في علم الأعصاب ، مما يتيح التحكم الدقيق في النشاط العصبي من خلال التحفيز الضوئي. تقدم هذه الدراسة إعدادات سهلة التنفيذ لتطبيق طرق البصريات الوراثية في ذبابة الفاكهة السوداء. تم استخدام أداتين بصريتين ، CsChrimson ، قناة كاتيونية تنشط بالضوء الأحمر ، و GtACR2 ، قناة أنيون يتم تنشيطها بالضوء الأزرق ، في أربعة طرق تجريبية. تتضمن ثلاثة من هذه الأساليب تجارب ذبابة واحدة: (1) مقايسة تفضيل موضعي بصري وراثي للضوء الأزرق يستهدف خلايا التسخين الحساسة لدرجة الحرارة ، (2) مقايسة تفضيل موضعي بصري وراثي للضوء الأحمر ينشط الخلايا العصبية للاستشعار المر ، و (3) مقايسة استجابة تمديد خرطوم تنشط الخلايا العصبية ذات الاستشعار الحلو. الطريقة الرابعة (4) هي إعداد متاهة الذباب لتقييم سلوكيات التجنب باستخدام ذباب متعدد. توفر القدرة على معالجة النشاط العصبي زمانيا ومكانيا رؤى قوية في المعالجة الحسية واتخاذ القرار ، مما يؤكد إمكانات علم البصريات الوراثي لتعزيز معرفتنا بالوظيفة العصبية. توفر هذه الأساليب إطارا قويا ويمكن الوصول إليه للبحث المستقبلي في علم الأعصاب لتعزيز فهم المسارات العصبية المحددة ونتائجها السلوكية.
Introduction
برزت علم البصريات الوراثي كتقنية قوية تجمع بين البصريات وعلم الوراثة في علم الأعصاب ، مما يوفر تحكما دقيقا وغير جراحي في النشاط العصبي من خلال تحفيز الضوء1. في ذبابة الفاكهة السوداء ، وهو كائن حي نموذجي يستخدم على نطاق واسع ، تتيح أدوات الوراثة البصرية تنشيط وتثبيط خلايا عصبية معينة ، مما يسمح للباحثين بتعديل الدوائر العصبية. من بين الأدوات المستخدمة ، يوفر CsChrimson و GtACR (Guillardia theta anion channel rhodopsins) طرقا تكميلية لاستهداف الخلايا العصبية. CsChrimson channelrhodopsin ، وهي قناة كاتيونية حساسة للضوء الأحمر من الطحالب الخضراء ، تسهل تنشيط الخلايا العصبية من خلال إزالة الاستقطاب عند تعرضها للضوء الأحمر ، مع ذروة التنشيط عند حوالي 590 نانومتر2. يوفر CsChrimson اختراقا أفضل للأنسجة من القنوات السابقةرودوبسين ويقلل من القطع الأثرية السلوكية التي يسببها الضوء في دراسات ذبابة الفاكهة 2. في المقابل ، فإن GtACR ، التي تتضمن متغيرات مثل GtACR2 ، هي قناة كلوريد ذات بوابات ضوئية تسكت الخلايا العصبية من خلال فرط الاستقطاب3،4. يقوم GtACR2 بتوصيل الأنيونات ويتم تنشيطه بواسطة الضوء الأزرق مع ذروة تنشيط حوالي 470 نانومتر4. يتم تنشيط CsChrimson و GtACR2 بواسطة أطوال موجية مميزة من الضوء ، مما يضمن تحكما دقيقا ومستقلا في النشاط العصبي دون التنشيط المتقاطع5.
ذبابة الفاكهة هي نموذج فعال لأبحاث علم الأعصاب نظرا لفعاليتها من حيث التكلفة وسهولة تربيتها واستجاباتها السلوكية القوية للمنبهات البيئية ، بما في ذلك السلوكيات الجذابة والتجنبية6. يعمل حجمها الصغير وبشرته شبه الشفافة على تعزيز تغلغل الضوء ، وخاصة الضوء الأحمر ذو الطول الموجي الطويل ، مما يتيح التلاعب البصري الوراثيالفعال 7،8. في حين أن خلايا ذبابة الفاكهة لا يمكنها إنتاج ما يكفي من الشبكية ، إلا أن عاملا مساعدا حاسما لوظيفة channelrhodopsins ، فإن إضافة شبكية العين إلى نظامهم الغذائي يعوض هذا القيد ، مما يضمن التنشيط الفعال للأدوات البصريةالوراثية 9.
لاستكشاف آثار التلاعب البصري الوراثي في ذبابة الفاكهة ، نصف أربع تجارب تستهدف دوائر وسلوكيات عصبية مختلفة ، كل منها يستخدم طرائق مميزة لتقييم الاستجابات التجنب أو الجذابة ، بدءا من فحوصات الذبابة الواحدة إلى التقييمات القائمة على المجموعة. خلايا التسخين (HC) في ذبابة الفاكهة هي خلايا عصبية حسية حرارية تقع في الأريستا ، وتستجيب للزيادات في درجة الحرارة10. تعبر هذه الخلايا العصبية عن القنوات الأيونية الحساسة للحرارة التي تؤدي إلى سلوك التجنب ، وتوجه الذباب بعيدا عن مصادر الحرارة10،11. في النهج 1 ، استخدمنا مقايسة تفضيل موضعي بصري وراثي للضوء الأزرق أحادي الذبابة لمعالجة الخلايا العصبية HC. من خلال التعبير عن GtACR2 في هذه الخلايا العصبية ، قمنا بتثبيط نشاطها عند التعرض للضوء الأزرق. تعرض الذباب لخيارين لدرجة الحرارة: 25 درجة مئوية و 31 درجة مئوية. تحت ضوء الغرفة ، تجنب الذباب الجانب 31 درجة مئوية ، مما يدل على استجابة حرارية نموذجية. ومع ذلك ، أدى تنشيط الضوء الأزرق ل GtACR2 إلى إسكات الخلايا العصبية HC. نتيجة لذلك ، لم يظهر الذباب أي تفضيل كبير لدرجة الحرارة ، مما يشير إلى تثبيط بصري ناجح. بالإضافة إلى تقييم وظيفة الخلايا العصبية الحسية ، فإن التعبير عن GtACR2 في الخلايا العصبية الحسية النهائية يمكن من التلاعب البصري الوراثي المماثل لدراسة الدوائر العصبية اللازمة لطرائق حسية محددة5.
يتم التعبير عن المستقبل الذوقي GR66a في ذبابة الفاكهة في ملامسات الشفرين في الطرف البعيد من خرطوم وفي الساقين ، مما يتوسط في اكتشاف الطعم المر12،13. تؤدي هذه الخلايا العصبية إلى سلوكيات التجنب استجابة للمواد المريرة. في النهج 2 ، استخدمنا مقايسة تفضيل موضعي البصري الوراثي للضوء الأحمر أحادي الذبابة لمعالجة الخلايا العصبية التي تعبر عن GR66a. من خلال التعبير عن CsChrimson في هذه الخلايا العصبية ، قمنا بتنشيطها عند التعرض للضوء الأحمر. تم وضع الذباب في ساحة نصفها يتعرض للضوء الأحمر والنصف الآخر يقوم بتصفية الضوء الأحمر. في غياب الضوء الأحمر ، لم يظهر الذباب أي تفضيل. ومع ذلك ، فإن تنشيط الضوء الأحمر ل CsChrimson حفز الخلايا العصبية المستشعرة للمرة ، مما أدى إلى تجنب كبير للمنطقة المضيئة ، مما يؤكد التنشيط البصري الناجح للخلايا العصبية GR66a. تم استخدام طرق مماثلة لتحديد الدوائر النهائية لخلايا التسخين الكافية لسلوكالتجنب 5.
ركزنا على التنشيط البصري الوراثي للسلوك الفاتح للشهية في النهج 3. الخلايا العصبية التي تعبر عن GR5a ، الموجودة في حسية التذوق على الملصق والساقين ، تكتشف السكريات وتدفع سلوك التغذية. يؤدي تنشيط هذه الخلايا العصبية إلى استجابة تمديد خرطوم (PER) 14. استخدمنا مقايسة استجابة تمديد خرطوم البصري الوراثي للضوء الأحمر لتنشيط الخلايا العصبية GR5a. من خلال التعبير عن CsChrimson في هذه الخلايا العصبية ، قمنا بتحفيزها بالضوء الأحمر. لم يمتد الذباب خرطومه في ظل ظروف إضاءة الغرفة. ومع ذلك ، أدى تنشيط الضوء الأحمر ل CsChrimson إلى تمديد خرطوم بدون محفز حلو ، مما يدل على التنشيط البصري الناجح للخلايا العصبية GR5a. تم استخدام هذا النهج للتحقيق في الدائرة العصبية ، بما في ذلك الخلايا العصبية الحسية الذوقية ، والخلايا العصبية لإسقاط التذوق ، والخلايا العصبية الحركية للخرطوم15،16.
في النهج 4 ، قمنا بالتحقيق في التنشيط البصري الوراثي لسلوكيات التجنب في مجموعات الذباب ، باستخدام مقايسة متاهة الذبابة البصرية ذات الضوء الأحمر التي تستهدف الخلايا العصبية GR66a. تم وضع الذباب عند تقاطع أنبوبين: أحدهما مضاء بالضوء الأحمر والآخر مظلل. أدى تعبير CsChrimson في الخلايا العصبية GR66a إلى التجنب. في حالة عدم وجود ضوء أحمر ، لم يظهر الذباب أي تفضيل ، لكن تنشيط الضوء الأحمر أدى إلى إطلاق الذباب الذي يعبر عن GR66a لتجنب الضوء الأحمر ، مما يشير إلى التنشيط الناجح للمسار. تم استخدام فحوصات متاهة الذباب على نطاق واسع لدراسة الطرائق الحسية المختلفة ، بما في ذلك درجة الحرارة والرطوبة والشم. عند دمجه مع علم البصريات الوراثي ، يكون هذا النهج قويا للتحقيق في كل من السلوكيات الجذابة والتجنب17،18،19.
توفر هذه الطرق إطارا قابلا للتكرار لدراسة التنشيط البصري الوراثي وتثبيط ذبابة الفاكهة العصبية. من خلال استخدام مزيج من القنوات المختلفة والمقايسات السلوكية التي يمكن الوصول إليها ، توضح دراسة إثبات المفهوم هذه فعالية التلاعب البصري الوراثي ، مما يوفر طرقا مباشرة لمعالجة وظائف الدوائر العصبية مع تطبيقات محتملة أوسع في أبحاث علم الأعصاب.
Protocol
1. سلالات ، تربية الذباب ، وشفاط الطيران
- الإجهاد والصيانة
- تشمل السلالات المستخدمة في التجارب HC-Gal410 و Gr5a-Gal420 (مركز بلومنجتون ذبابة الفاكهة (BDSC): 57592) ، Gr66a-Gal421 (BDSC: 57670) ، UAS-GtACR23 ، UAS-CsChrimson2 (BDSC: 55136). يطير الخلفي عند 25 درجة مئوية على وسط دقيق الذرة القياسي تحت ضوء 12 ساعة: دورة مظلمة مدتها 12 ساعة.
ملاحظة: يحتوي 1 لتر من دقيق الذرة على 1 لتر من دقيق الذرة2 O ،و 79 جم من سكر العنب ، و 7.5 جم من أجار ، و 24 جم من الخميرة المقشرة ، و 57 جم من دقيق الذرة ، و 2.1 جم من ميثيل -4-هيدروكسي بنزوات (مذاب في 11.1 مل من الإيثانول) ، و 6 جم من رباعي هيدرات طرطرات البوتاسيوم الصوديوم ، و 0.9 جم من كلوريد الكالسيوم.
- تشمل السلالات المستخدمة في التجارب HC-Gal410 و Gr5a-Gal420 (مركز بلومنجتون ذبابة الفاكهة (BDSC): 57592) ، Gr66a-Gal421 (BDSC: 57670) ، UAS-GtACR23 ، UAS-CsChrimson2 (BDSC: 55136). يطير الخلفي عند 25 درجة مئوية على وسط دقيق الذرة القياسي تحت ضوء 12 ساعة: دورة مظلمة مدتها 12 ساعة.
- تربية الذباب والتحضير التجريبي
- فرز الذباب البالغ من العمر 0 إلى 3 أيام. بحلول وقت التجربة ، سيكون عمر الذباب من 3 إلى 6 أيام ، مما يضمن الاتساق المرتبط بالعمر (الشكل 1 أ).
- قسم كل نمط جيني إلى أربع مجموعات قبل 3 أيام من إجراء التجارب: ضوء الغرفة ATR - ، ضوء الغرفة ATR + ، الأحمر أو الأزرق الضوء ATR - ، والضوء الأحمر أو الأزرق ATR +.
- قم بإعداد محلول مخزون ATR 80 ملي مولار عن طريق إذابة ATR في 100٪ من الإيثانول. استكمل الطعام ب 400 ميكرومتر ATR لمجموعات ATR +.
- استكمل الطعام بنفس تركيز الإيثانول ولكن بدون ATR لمجموعات ATR.
- دعم جميع المجموعات في الظلام22.
- يطير Starve Gr5a>CsChrimson لمدة 16-24 ساعة في قوارير تحتوي على أنسجة رطبة فقط. تحتوي قوارير ATR + على 400 ميكرومتر ATR ممزوجة بالماء ، بينما تحتوي قوارير ATR على dH2O ممزوج بنفس تركيز الإيثانول.
- شفاط الطيران
- قم بتجميع شفاط الذباب (الشكل 1 ب) باستخدام أنابيب بلاستيكية وشبكة حشرات وماصتين لنقل 3 مل.
- قم بقص أطراف ومصابيح ماصات النقل ، مما يضمن أن طرف شفط الذبابة يسمح بالمرور المريح للذبابة. يتيح هذا التصميم شفطا لطيفا للذباب من خلال الاستنشاق ، مما يقلل من الضرر ويسهل جمع الذباب الفردي ونقله بكفاءة.
- ثنى شبكة الحشرات فوق الأنبوب البلاستيكي وقم بتأمين نهايات لمبة الماصة بالأنبوب باستخدام Parafilm.
2. مقايسة تفضيل الموضعي الحراري الوراثي للضوء الأزرق ذبابة واحدة
- ذبابة الفاكهة سلالات وتربية الذباب
- اعبر خط تشغيل HC-Gal410 إلى UAS-GtACR23 ، مما أدى إلى النمط الجيني التجريبي HC>GtACR2. يعبر ذباب HC>GtACR2 عن GtACR2 في خلايا التسخين.
ملاحظة: تأكد من استخدام عدد متساو من الذباب من الذكور والإناث لكل حالة.
- اعبر خط تشغيل HC-Gal410 إلى UAS-GtACR23 ، مما أدى إلى النمط الجيني التجريبي HC>GtACR2. يعبر ذباب HC>GtACR2 عن GtACR2 في خلايا التسخين.
- إعداد الفحص التجريبي وتنفيذه
- قم بمحاذاة لوحين فولاذيين على ألواح تسخين منفصلة حتى تلتقي حوافهما. ضع واقيا من الألواح البلاستيكية في الأعلى ، وثبته بشريط لاصق لتقليل الحركة. ضع قطعة من الورق الأبيض على واقي الورقة لتقليل إشارات ضوضاء الخلفية (الشكل 1C).
ملاحظة: استبدل المستند التعريفي التمهيدي في بداية كل تجربة أو عند اتساخه. - ضع غطاء بلاستيكي شفاف (ارتفاع 2 مم × عرض 58 مم × طول 83 مم) أعلى الورق الأبيض. يسمح هذا الغطاء للذبابة بالمشي بحرية مع منعها من الطيران.
- قم بقطع ثقب في الجزء السفلي من صندوق رغوة البوليسترين (ارتفاع 27 سم × عرض 22 سم × طول 16 سم) للالتصاق بالكاميرا والضوء الأزرق (1,000 مللي أمبير) على ارتفاع 12 سم تقريبا فوق سطح التجربة.
- ضع الكاميرا والضوء الأزرق لتقليل الوهج مع تمكين التنشيط.
ملاحظة: قد تكون هناك حاجة إلى اختبار مسبق لتحديد نطاق تنشيط الضوء الأزرق. - اضبط الكاميرا للتسجيل باستخدام الإعدادات التالية: 1 ثانية بفاصل زمني ، مجال ضيق ، 4000 × 3000 بكسل.
- اضبط إعدادات اللوح الساخن للحفاظ على درجة حرارة سطح 25 ± 1 درجة مئوية و 31 ± 1 درجة مئوية على الألواح الفولاذية المعنية.
ملاحظة: بالنسبة للظروف التي تتطلب درجات حرارة أقل من 25 درجة مئوية ، فإن طرق التبريد البديلة ، مثل أجهزة بلتيير أو الثلج ، ضرورية. إذا تجاوزت درجات حرارة الألواح الفولاذية المستويات المرغوبة ، رش السطح بالماء المقطر لتحقيق الظروف المطلوبة والحفاظ عليها. ثم استخدم منديلا لامتصاص الرطوبة الزائدة من واقي الألواح البلاستيكية. - قبل وبعد كل تجربة ، راقب درجات الحرارة باستخدام مسبار درجة حرارة السطح.
ملاحظة: يعد التحكم الدقيق في درجة الحرارة أمرا بالغ الأهمية ، حيث يمكن أن تؤثر التقلبات على النتائج. - ضع الغطاء البلاستيكي على جانب 25 درجة مئوية. باستخدام شفاط الذبابة ، حرر ذبابة واحدة برفق تحت الغطاء. ضع الصندوق فوق المنطقة التجريبية لإنشاء ضوء خافت (<10 لوكس) والسماح للذبابة بالتأقلم لمدة دقيقة واحدة.
- بعد فترة التأقلم ، ارفع الصندوق واضبط الغطاء البلاستيكي بسرعة ، ووضعه مع محاذاة مركز الغطاء مع حدود الصفيحة الفولاذية لضمان تغطية متساوية للجانبين 25 درجة مئوية و 31 درجة مئوية.
ملاحظة: خلال هذه العملية ، تزداد درجة حرارة الهواء ودرجة الحرارة داخل الغطاء على الجانب 31 درجة مئوية إلى حوالي 27 درجة مئوية في غضون 5 ثوان (الشكل التكميلي 1) ، وهو ما يكفي لتنشيط خلايا التسخين11. - ابدأ التجربة عن طريق تشغيل الكاميرا والضوء الأزرق (20 كيلو لوكس).
ملاحظة: لا تقم بتشغيل الضوء الأزرق في ظروف إضاءة الغرفة. قم بتشغيل الكاميرا وتسجيل بعض الإطارات قبل تشغيل الضوء الأزرق في حالة الحركة. - بعد أكثر من دقيقتين ، قم بإنهاء الإصدار التجريبي عن طريق إيقاف تشغيل الكاميرا والضوء. تخلص من الذباب باستخدام الشفاطة.
ملاحظة: سجل بعض الإطارات الإضافية في حالة الحركة عند إيقاف تشغيل الكاميرا.
- قم بمحاذاة لوحين فولاذيين على ألواح تسخين منفصلة حتى تلتقي حوافهما. ضع واقيا من الألواح البلاستيكية في الأعلى ، وثبته بشريط لاصق لتقليل الحركة. ضع قطعة من الورق الأبيض على واقي الورقة لتقليل إشارات ضوضاء الخلفية (الشكل 1C).
- التحليل السلوكي والإحصائي
- قم فقط بتحليل البيانات من الذباب الذي يبقى على الجانب 25 درجة مئوية في بداية التجربة.
ملاحظة: تجاهل البيانات من الذباب الذي يبدأ التجارب على جانب 31 درجة مئوية ، والذي غالبا ما يظهر تفضيلات متغيرة23. تجاهل التجارب التي تنطوي على ذباب لا يقترب من حافة الجانب 31 درجة مئوية ، مما يضمن أنه قد اختار بين درجات الحرارة. تجاهل البيانات من الذباب الذي يظل ثابتا لأكثر من 30 ثانية. - تحليل النتائج باستخدام الإجراءات الموضحة سابقا23. احسب مؤشر التفضيل (PI) كنسبة الفرق في الوقت الذي تقضيه الذبابة في كل منطقة درجة حرارة إلى الوقت الإجمالي ، كما هو موضح في الصيغة التالية:
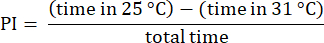
ملاحظة: يتم توفير التفاصيل الإحصائية للتجارب في وسائل الإيضاح الشكلية. يتم إجراء تحليل البيانات باستخدام برنامج تحليل البيانات المناسب.
- قم فقط بتحليل البيانات من الذباب الذي يبقى على الجانب 25 درجة مئوية في بداية التجربة.
3. مقايسة تفضيل الموضعي البصري الوراثي للضوء الأحمر ذبابة واحدة
- ذبابة الفاكهة سلالات وتربية الذباب
- اعبر خط السائق Gr66a-Gal421 إلى UAS-CsChrimson2 ، مما ينتج عنه النمط الجيني التجريبي Gr66a>CsChrimson. Gr66a>CsChrimson الذباب يعبر عن CsChrimson في الخلايا العصبية ذات الذوق المر.
ملاحظة: تأكد من استخدام عدد متساو من الذباب من الذكور والإناث لكل حالة.
- اعبر خط السائق Gr66a-Gal421 إلى UAS-CsChrimson2 ، مما ينتج عنه النمط الجيني التجريبي Gr66a>CsChrimson. Gr66a>CsChrimson الذباب يعبر عن CsChrimson في الخلايا العصبية ذات الذوق المر.
- إعداد الفحص التجريبي وتنفيذه
- قم بإجراء الفحص في غرفة مظلمة أو بيئة مظلمة لضمان التنشيط المتحكم فيه ل CsChrimson (الشكل 1 د).
- ضع كاميرا فيديو على ارتفاع 45 سم تقريبا فوق سطح التجربة.
- استخدم كاميرا فيديو بدون مرشح الأشعة تحت الحمراء. إذا كانت كاميرا الفيديو تحتوي على مرشح داخلي للأشعة تحت الحمراء قصير التمرير يحجب الأطوال الموجية التي تزيد عن 700 نانومتر، فقم بإزالتها.
- قم بلصق مرشح تمرير طويل 830 نانومتر فوق العدسة باستخدام الغراء الفائق لالتقاط الأطوال الموجية للأشعة تحت الحمراء. هذا التعديل ضروري لتسجيل حركة الذبابة في ظل ظروف ضوء الأشعة تحت الحمراء.
- ضع مصدر الضوء الأحمر24 على ارتفاع 45 سم تقريبا فوق سطح التجربة ، مما يضمن شدة ضوء تبلغ حوالي 2.5 كيلو لوكس (1,000 مللي أمبير).
ملاحظة: يوصى باستخدام حماية مناسبة للعين يمكنها تصفية الليزر / الضوء الأحمر. تساعد نظارات السلامة بالليزر على منع تلف العين المحتمل من التعرض المباشر للضوء الأحمر الشديد. - استخدم ضوء الأشعة تحت الحمراء لتصور الذباب داخل الإعداد. استمر في تشغيله طوال التجربة.
ملاحظة: تجنب الوهج في المنطقة التجريبية الناجم عن ضوء الأشعة تحت الحمراء ؛ يمكن أن يؤدي الوهج إلى تعقيد تحليل البيانات. - استخدم الغراء لتوصيل مرشح التمرير الطويل بالأشعة تحت الحمراء 780 نانومتر بنصف الغطاء البلاستيكي.
ملاحظة: استخدم أي مرشح تمرير طويل يحجب الأطوال الموجية التي تقل عن 780 نانومتر. يسمح الجانب غير المصفى بمرور الضوء الأحمر والأشعة تحت الحمراء ، بينما يسمح الجانب المفلتر فقط بمرور ضوء الأشعة تحت الحمراء. - ضع مادة سوداء غير لامعة أسفل المنطقة التجريبية لتقليل ضوضاء الخلفية.
- ضع ذبابة واحدة تحت غطاء بلاستيكي شفاف (ارتفاع 2 مم × عرض 58 مم × طول 83 مم) باستخدام شفاط ذبابة واتركها تتأقلم لمدة 1 دقيقة.
- انتظر حتى تظهر الذبابة على الجانب غير المصفى. ابدأ الإصدار التجريبي بتشغيل كاميرا الفيديو والضوء الأحمر.
ملاحظة: كاميرا الفيديو عرضة للحركة فور بدء التشغيل. قم بتأمين الكاميرا جيدا أثناء التسجيل وقم بتشغيل الكاميرا قبل التسجيل بعدة ثوان لتجنب الحركة الشاذة التي قد تعقد التحليل. لا تقم بتشغيل الضوء الأحمر حتى بدء التجربة. - سجل حركة الذبابة لمدة 1 دقيقة.
ملاحظة: تجاهل التجارب التي لا تقترب فيها الذبابة من خط الوسط أو لا تتحرك لأكثر من 15 ثانية. - بعد 1 دقيقة ، قم بإنهاء الإصدار التجريبي عن طريق إيقاف تشغيل كاميرا الفيديو والضوء. تخلص من الذباب باستخدام الشفاطة.
ملاحظة: سجل بعض الإطارات الإضافية لتجنب تأثيرات الحركة عند إيقاف تشغيل الكاميرا.
- التحليل السلوكي والإحصائي
- تحليل النتائج باستخدام الإجراءات الموضحة سابقا23. احسب مؤشر التفضيلات (PI) كنسبة الفرق في الوقت الذي تقضيه الذبابة في المنطقة بدون المرشح والمنطقة التي بها المرشح إلى الوقت الإجمالي ، كما هو موضح في الصيغة التالية:
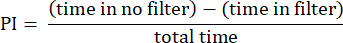
ملاحظة: يتم توفير التفاصيل الإحصائية للتجارب في وسائل الإيضاح الشكلية. يتم إجراء تحليل البيانات باستخدام برنامج تحليل البيانات المناسب.
- تحليل النتائج باستخدام الإجراءات الموضحة سابقا23. احسب مؤشر التفضيلات (PI) كنسبة الفرق في الوقت الذي تقضيه الذبابة في المنطقة بدون المرشح والمنطقة التي بها المرشح إلى الوقت الإجمالي ، كما هو موضح في الصيغة التالية:
4. استجابة تمديد خرطوم البصري الوراثي للضوء الأحمر
- ذبابة الفاكهة سلالات وتربية الذباب
- اعبر خط السائق Gr5a-Gal420 إلى UAS-CsChrimson2 ، مما ينتج عنه النمط الجيني التجريبي المشار إليه باسم Gr5a>CsChrimson. Gr5a>CsChrimson الذباب يعبر عن CsChrimson في الخلايا العصبية لمستقبلات الذوق الحلو.
ملاحظة: تأكد من استخدام عدد متساو من الذباب من الذكور والإناث لكل حالة. - يطير Starve لمدة 16-24 ساعة مع ATR (ATR +) أو بدون (ATR -) قبل الاختبار.
ملاحظة: قد تكون هناك حاجة إلى فترات تجويع أطول للحصول على استجابة قوية.
- اعبر خط السائق Gr5a-Gal420 إلى UAS-CsChrimson2 ، مما ينتج عنه النمط الجيني التجريبي المشار إليه باسم Gr5a>CsChrimson. Gr5a>CsChrimson الذباب يعبر عن CsChrimson في الخلايا العصبية لمستقبلات الذوق الحلو.
- إعداد الفحص التجريبي وتنفيذه
- تخدير الذباب عن طريق التبريد على الجليد (الشكل 1E).
ملاحظة: تجنب الاتصال المباشر بين الذباب والجليد. الحد من وقت التبريد إلى حوالي 1 دقيقة ؛ يمكن أن يؤدي التبريد المطول إلى مشاكل في التعافي والوفيات. - استخدم طرف طرف ماصة سعة 1000 ميكرولتر لتطبيق 7-10 نقاط صغيرة من الغراء على الشرائح الزجاجية.
ملاحظة: تضمن قطرات صغيرة من الغراء على الشريحة عدم غمر الذبابة وتساعد على منع الغراء من الالتصاق بخطوم أو أرجل. - ضع ذبابة واحدة ، الجانب البطني لأعلى ، على كل نقطة غراء. تأكد من أن الصدر والأجنحة ملامسة الغراء لتقليل الحركة. قم بتهوية الأجنحة إلى كل جانب لزيادة مساحة السطح اللاصق.
ملاحظة: تجنب وضع الذباب بالقرب من بعضه البعض ، مما قد يؤدي عن غير قصد إلى تنشيط ذباب متعدد أثناء التعرض للضوء. - اترك الغراء يجف لمدة 10 دقائق.
- انقل الشرائح إلى صندوق رطوبة (صندوق بلاستيكي به مناشف ورقية مبللة) واترك الذباب يتعافى لمدة ساعتين.
- ضع الشريحة تحت المجهر. استخدم حقنة لتوصيل قطرة من الماء لإشباع الذباب ، مما يمنع امتدادات خرطوم الناجمة عن العطش.
- أمسك مؤشر ليزر أحمر يدويا لتسليط الضوء الأحمر على خرطوم / رأس ذبابة واحدة (700 لوكس) أثناء مراقبة استجابة PER من خلال المجهر.
ملاحظة: حماية العين التي يمكنها تصفية الليزر / الضوء الأحمر ضرورية عند مراقبة الضوء الأحمر من خلال المجهر. - راقب وسجل امتداد خرطوم خلال نافذة 30 ثانية. سجل كل ذبابة باستخدام نظام التسجيل التالي: 0 يشير إلى عدم وجود امتداد ، 0.5 يشير إلى امتداد 1-2 ثانية ، 1 يشير إلى أن الامتداد يستمر أكثر من 3 ثوان.
- بعد اختبار تمديد خرطوم الناجم عن الضوء ، افحص الاستجابة ل 4٪ سكروز باستخدام حقنة. طرد قطرة من السكروز في نهاية الإبرة وقم بتقريبها من خرطوم الذبابة.
ملاحظة: تجاهل البيانات من الذباب الذي يفشل في الاستجابة لقطرة السكروز.
- تخدير الذباب عن طريق التبريد على الجليد (الشكل 1E).
- التحليل السلوكي والإحصائي
- إجراء التحليل الإحصائي باستخدام برنامج تحليل البيانات المناسب.
ملاحظة: يتم توفير التفاصيل الإحصائية للتجارب في وسائل الإيضاح الشكلية.
- إجراء التحليل الإحصائي باستخدام برنامج تحليل البيانات المناسب.
5. فحص متاهة الذبابة البصرية الضوئية للضوء الأحمر
- ذبابة الفاكهة سلالات وتربية الذباب
- اعبر خط السائق Gr66a-Gal421 إلى UAS-CsChrimson2 ، مما ينتج عنه النمط الجيني التجريبي Gr66a>CsChrimson. Gr66a>CsChrimson الذباب يعبر عن CsChrimson في الخلايا العصبية ذات الذوق المر.
ملاحظة: تأكد من أن كل مجموعة تحتوي على عدد متساو من ذكور وإناث الذباب.
- اعبر خط السائق Gr66a-Gal421 إلى UAS-CsChrimson2 ، مما ينتج عنه النمط الجيني التجريبي Gr66a>CsChrimson. Gr66a>CsChrimson الذباب يعبر عن CsChrimson في الخلايا العصبية ذات الذوق المر.
- تجميع متاهة الذبابة
- اجعل متاهة الذبابة كما هو موضح في الشكل 1F.
ملاحظة: بدلا من ذلك ، طباعة ثلاثية الأبعاد لمكونات متاهة الذبابة ، والتجميع كما هو مفصلسابقا 25. - قم بقص ثلاثة أنابيب استزراع بلاستيكية سعة 5 مل إلى أطوال مناسبة لعمل أنبوب تحميل وأنبوب اختبار شفاف مكشوف وأنبوب اختبار مغطى بورق الألمنيوم. قم بتوصيل الأنابيب بمتاهة الذباب كما هو موضح في الشكل 1F.
- اعتمادا على مادة المتاهة ، قم بقص أنابيب الاختبار لضمان مسافة متساوية لكل حالة اختبار. بناء على طول غرفة الاحتجاز ، قم بتقصير أنبوب الاختبار المكشوف في متاهة واضحة ، مع تقصير أنبوب الاختبار المغطى بالرقائق إذا كانت المتاهة معتمة.
- اجعل متاهة الذبابة كما هو موضح في الشكل 1F.
- إعداد الفحص التجريبي وتنفيذه
- في الظروف المظلمة أو الإضاءة المنخفضة ، ضع 10 ذكور و 10 إناث في أنبوب التحميل. قم بتوصيل أنبوب التحميل بغرفة الاحتجاز. قم بإمالة المصعد واضغط برفق على الأنبوب لتحريك الذباب إلى غرفة الاحتجاز.
ملاحظة: اخفض المصعد بحيث يكون نصف غرفة التثبيت مفتوحا فقط. يسهل هذا التلاعب نقل الذباب من أنبوب التحميل إلى غرفة الاحتجاز. - بعد نقل الذباب إلى غرفة الاحتجاز ، استخدم المصعد لخفض الذباب بين أنبوب التحميل وفتحات أنبوب الاختبار. ثم قم بإزالة أنبوب التحميل.
- ضع متاهة الذبابة على بعد 13 سم تقريبا من مصدر الضوء الأحمر (1000 مللي أمبير) دون تشغيل الضوء.
- اخفض المصعد حتى تتماشى غرفة التثبيت مع فتحات أنبوب الاختبار ، مما يسمح للذباب بالتحرك بحرية بين أنابيب الاختبار المغلفة بالرقائق وأنابيب الاختبار المكشوفة. في نفس الوقت ، قم بتشغيل الضوء الأحمر لتنشيط CsChrimson. تأكد من أن شدة الضوء الأحمر على سطح أنبوب الاختبار المكشوف تبلغ حوالي 40 كيلو لوكس.
ملاحظة: لا تقم بتشغيل الضوء الأحمر حتى يتم خفض حجرة التثبيت ومحاذاتها مع فتحات أنبوب الاختبار. يوصى بحماية مناسبة للعين يمكنها تصفية الليزر / الضوء الأحمر بسبب السطوع الشديد للضوء الأحمر. - يختار الذباب بين الأنبوب المكشوف بالضوء الأحمر والأنبوب المظلل لمدة دقيقة واحدة.
- بعد 1 دقيقة ، ارفع المصعد بين أنبوب التحميل وفتحات أنبوب الاختبار. عد الذباب في كل أنبوب.
ملاحظة: يتم حساب الذباب النشط وغير المصاب فقط. - قم بتنظيف مصعد الذبابة ومتاهة الطيران باستخدام dH2O بعد كل تجربة.
- في الظروف المظلمة أو الإضاءة المنخفضة ، ضع 10 ذكور و 10 إناث في أنبوب التحميل. قم بتوصيل أنبوب التحميل بغرفة الاحتجاز. قم بإمالة المصعد واضغط برفق على الأنبوب لتحريك الذباب إلى غرفة الاحتجاز.
- تحليل البيانات والإحصاءات
- احسب مؤشر التفضيل (PI) كنسبة الفرق في أعداد الذباب بين الأنابيب المكشوفة والمغطاة إلى العدد الإجمالي للذباب ، كما هو موضح في الصيغة التالية:
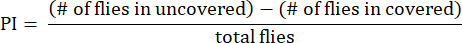
ملاحظة: يتم توفير التفاصيل الإحصائية للتجارب في وسائل الإيضاح الشكلية. يتم إجراء تحليل البيانات باستخدام برنامج تحليل البيانات المناسب
- احسب مؤشر التفضيل (PI) كنسبة الفرق في أعداد الذباب بين الأنابيب المكشوفة والمغطاة إلى العدد الإجمالي للذباب ، كما هو موضح في الصيغة التالية:
النتائج
مقايسة تفضيل الموضعي الحراري الوراثي للضوء الأزرق ذبابة واحدة
اختبرت أربعة شروط: ضوء الغرفة بدون تكميل ATR (ضوء الغرفة، ATR -)، وضوء الغرفة مع مكملة ATR (ضوء الغرفة، ATR +)، والضوء الأزرق بدون مكملة ATR (أزرق، ATR -)، والضوء الأزرق مع مكملة ATR (أزرق، ATR +). كانت الشروط الثلاثة...
Discussion
لقد حول التلاعب البصري الوراثي مجال علم الأعصاب من خلال تمكين التحكم الدقيق في الدوائر العصبية بدقة زمانية مكانية27. تشتمل الدائرة العصبية على مجموعات من الخلايا العصبية المترابطة بواسطة نقاط الاشتباك العصبي ، وتؤدي وظائف محددة عند التنشيط. ذبابة الفاكه?...
Disclosures
يعلن المؤلفون أنه لا يوجد تضارب في المصالح فيما يتعلق بنشر هذه المقالة. كشف جميع المؤلفين عن أي تعارضات محتملة وأكدوا أنه ليس لديهم علاقات مالية أو شخصية يمكن أن تؤثر على العمل المقدم في هذه الدراسة.
Acknowledgements
تم إنشاء مخططات تخطيطية لجميع الأشكال باستخدام Biorender.com. تم دعم هذا العمل من قبل المعاهد الوطنية للصحة R01GM140130 (https://www.nigms.nih.gov/) إلى L.N. لم يكن للممولين أي دور في تصميم الدراسة أو جمع البيانات وتحليلها أو قرار النشر أو إعداد المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| 1000 mA LED driver | Luxeon Star | 3021-D-E-1000 | |
| 5 mL VWR Culture Tubes, Plastic, with Dual-Position Caps | VWR | 60818-664 | |
| 780 Longpass Filter / IR 780 nm 100 mm x 100 mm | Lee Filters | BH #LE8744 | Cut to approximately 47 x 100 fit the plastic cover |
| Agfabric 6.5 ft. x 15 ft. Insect Bug Netting Garden Net for Protecting Plants Vegetables Flowers Fruits | The Home Depot | EIBNW6515 | |
| All trans retinal | Sigma-Aldrich | 116-31-4 | |
| Aluminum Plate (30.5 cm x 30.5 cm x 0.6 cm) | Amazon | purchased from Amazon | |
| Black Plastic Box | LI-COR | 929-97101 | |
| CALCIUM CHLORIDE ANHYDRO 25GR | Thermo Fisher Scientific | AC297150250 | |
| CX405 Handycam with Exmor R CMOS sensor | SONY | HDR-CX405 | |
| Elmer’s “School Glue” | Elmer | ||
| Ethyl alcohol, Pure (200 Proof) | Sigma-Aldrich | E7023 | |
| Fisherbrand Isotemp Hot Plate Stirrer | Fisher Scientific | SP88850200 | |
| Fly line: Gr5a-Gal4 | Bloomington Drosophila Stock Center | 57592 | |
| Fly line: Gr66a-Gal4 | Bloomington Drosophila Stock Center | 57670 | |
| Fly line: HC-Gal4 (II) | Dr. Marco Gallio Lab | A kind gift | |
| Fly line: UAS-CsChrimson | Bloomington Drosophila Stock Center | 55136 | |
| Fly line: UAS-GtACR2/TM6B | Dr. Quentin Gaudry Lab | A kind gift | |
| Flystuff 62-101 Yellow Cornmeal (11.3 Kg), Yellow, 11.3 Kg/Unit | Genesee Scientific | 62-101 | |
| Flystuff 62-107 Inactive Dry Yeast, 10 Kg, Nutritional Flake, 10 Kg/Unit | Genesee Scientific | 62-107 | |
| Flystuff 66-103 Nutri-Fly Drosophila Agar, Gelidium, 100 Mesh, 5 Kg (11.02 lbs)/Unit | Genesee Scientific | 66-103 | |
| FreeMascot OD 8+ 190 nm–420 nm / 600 nm–1100 nm Wavelength Violet/Red/Infrared Laser Safety Glasses | FreeMascot | B08LGMQ65S | purchased from Amazon |
| GoPro Hero8 Black | GoPro | 6365359 | |
| LEE Filters 100×100 mm Infra Red #87 Infrared Polyester Filter | B&H Photo | LE8744 | |
| Longpass Filter, Colored Glass, 50.8 x 50.8 mm, 830 nm Cut-on, RG830 | Newport | FSQ-RG830 | |
| Methyl 4-hydroxybenzoate, 99%, Thermo Scientific Chemicals | Thermo Fisher Scientific | 126960025 | |
| MicroWell Mini Tray 60 Well, Low Profile NS PS | Thermal Scientific | NUNC 439225 | The lids are used as the "plastic cover" |
| Olympus Plastics 24-160RS, 1000 µL Olympus Ergonomic Pipet Tips Low Binding, Racked, Sterile, 8 Racks of 96 Tips/Unit | Eppendorf | 24-160RS | |
| Parafilm M Sealing Film | Heathrow Scientific | HS234526B | 4 in x 125 feet |
| Potassium chloride, ACS, 99.0-100.5%, | Thermo Fisher Scientific | AA1159530 | |
| Prism | GraphPad | Version 9 | data analysis software |
| Samco Graduated Transfer Pipettes | Thermo Fisher Scientific | 225 | 3 mL |
| Slides | Fisher Scientific | 12-544-2 | 5 mm x 75 mm x 1.0 mm |
| Stereo microscope | OLYMPUS | CZ61 | |
| Styrofoam box (27 cm height × 22 cm width × 16 cm length) | |||
| Sucrose | Fisher Scientific | 225911 | |
| Surface temperature probe | Fluke | 80PK-3A | |
| Syringe | BD Integra | 305270 | |
| Tate & Lyle 457 Dextrose, Tate & Lyle, Pow, Tate & Lyle 457 Dextrose, Tate & Lyle, Powder, 50 lbs/Unit | Genesee Scientific | 62-113 | |
| Traceable Calibrated Big-Digit Thermocouple Thermometer | Traceable by cple-parmer | UX-91210-07 | Fisherbrand Traceable BigDigit Type K Thermometer |
| Triple blue LED starboard | LEDSupply | 07007-PB000-D | 470 nm |
| Triple red LED starboard | LEDSupply | 07007-PD000-F | 627 nm |
| Tygon PVC Clear Tubing 1/4" ID, 3/8" OD, 5 ft. Length | McMaster Carr Supply Company | 6516T21 | |
| Univivi IR Illuminator, 850nm 12 LEDs Wide Angle IR Illuminator for Night Vision | Univivi | 4331910725 | |
| Wakefield Thermal 25.4 mm Round Heatsink Star LED Board - 882-100AB | Wakefield-Vette | 882-100AB | |
| Wireless Presenter | DinoFire Store | B01410YNAM | purchased from Amazon |
References
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in neural systems. Neuron. 71 (1), 9-34 (2011).
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nat Methods. 11 (3), 338-346 (2014).
- Mauss, A. S., Busch, C., Borst, A. Optogenetic neuronal silencing in drosophila during visual processing. Sci Rep. 7 (1), 13823 (2017).
- Govorunova, E. G., Sineshchekov, O. A., Janz, R., Liu, X., Spudich, J. L. Neuroscience. Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science. 349 (6248), 647-650 (2015).
- Castaneda, A. N., et al. Functional labeling of individualized postsynaptic neurons using optogenetics and trans-tango in drosophila (flipsot). PLoS Genet. 20 (3), e1011190 (2024).
- Fischer, F. P., et al. Drosophila melanogaster as a versatile model organism to study genetic epilepsies: An overview. Front Mol Neurosci. 16, 1116000 (2023).
- Aragon, M. J., et al. Multiphoton imaging of neural structure and activity in drosophila through the intact cuticle. Elife. 11, e69094 (2022).
- Zhang, W., Ge, W., Wang, Z. A toolbox for light control of drosophila behaviors through channelrhodopsin 2-mediated photoactivation of targeted neurons. Eur J Neurosci. 26 (9), 2405-2416 (2007).
- Kono, M., Goletz, P. W., Crouch, R. K. 11-cis- and all-trans-retinols can activate rod opsin: Rational design of the visual cycle. Biochemistry. 47 (28), 7567-7571 (2008).
- Gallio, M., Ofstad, T. A., Macpherson, L. J., Wang, J. W., Zuker, C. S. The coding of temperature in the drosophila brain. Cell. 144 (4), 614-624 (2011).
- Ni, L., et al. A gustatory receptor paralogue controls rapid warmth avoidance in drosophila. Nature. 500 (7464), 580-584 (2013).
- Weiss, L. A., Dahanukar, A., Kwon, J. Y., Banerjee, D., Carlson, J. R. The molecular and cellular basis of bitter taste in drosophila. Neuron. 69 (2), 258-272 (2011).
- Ling, F., Dahanukar, A., Weiss, L. A., Kwon, J. Y., Carlson, J. R. The molecular and cellular basis of taste coding in the legs of drosophila. J Neurosci. 34 (21), 7148-7164 (2014).
- Dethier, V. G. . The Hungry Fly: A Physiological Study of the Behavior Associated with Feeding. , (1976).
- Shiu, P. K., Sterne, G. R., Engert, S., Dickson, B. J., Scott, K. Taste quality and hunger interactions in a feeding sensorimotor circuit. Elife. 11, e79887 (2022).
- Kim, H., Kirkhart, C., Scott, K. Long-range projection neurons in the taste circuit of drosophila. Elife. 6, e23386 (2017).
- Sayeed, O., Benzer, S. Behavioral genetics of thermosensation and hygrosensation in drosophila. Proc Natl Acad Sci U S A. 93 (12), 6079-6084 (1996).
- Coya, R., Martin, F., Calvin-Cejudo, L., Gomez-Diaz, C., Alcorta, E. Validation of an optogenetic approach to the study of olfactory behavior in the t-maze of drosophila melanogaster adults. Insects. 13 (8), 662 (2022).
- Chu, L. A., Tai, C. Y., Chiang, A. S. Thirst-driven hygrosensory suppression promotes water seeking in drosophila. Proc Natl Acad Sci U S A. 121 (34), e2404454121 (2024).
- Chyb, S., Dahanukar, A., Wickens, A., Carlson, J. R. Drosophila gr5a encodes a taste receptor tuned to trehalose. Proc Natl Acad Sci U S A. 100 (Suppl 2), 14526-14530 (2003).
- Dunipace, L., Meister, S., Mcnealy, C., Amrein, H. Spatially restricted expression of candidate taste receptors in the drosophila gustatory system. Curr Biol. 11 (11), 822-835 (2001).
- Ratnayake, K., et al. Blue light excited retinal intercepts cellular signaling. Sci Rep. 8 (1), 10207 (2018).
- Huda, A., Omelchenko, A. A., Vaden, T. J., Castaneda, A. N., Ni, L. Responses of different drosophila species to temperature changes. J Exp Biol. 225 (11), jeb243708 (2022).
- Tyrrell, J. J., Wilbourne, J. T., Omelchenko, A. A., Yoon, J., Ni, L. Ionotropic receptor-dependent cool cells control the transition of temperature preference in drosophila larvae. PLoS Genet. 17 (4), e1009499 (2021).
- Fu, Z., Huda, A., Kimbrough, I. F., Ni, L. Using drosophila two-choice assay to study optogenetics in hands-on neurobiology laboratory activities. J Undergrad Neurosci Educ. 22 (1), A45-A50 (2023).
- Joseph, R. M., Heberlein, U. Tissue-specific activation of a single gustatory receptor produces opposing behavioral responses in drosophila. Genetics. 192 (2), 521-532 (2012).
- Riemensperger, T., Kittel, R. J., Fiala, A. Optogenetics in drosophila neuroscience. Methods Mol Biol. 1408, 167-175 (2016).
- Dorkenwald, S., et al. Neuronal wiring diagram of an adult brain. Nature. 634 (8032), 124-138 (2024).
- Schlegel, P., et al. Whole-brain annotation and multi-connectome cell typing of drosophila. Nature. 634 (8032), 139-152 (2024).
- Talay, M., et al. Transsynaptic mapping of second-order taste neurons in flies by trans-tango. Neuron. 96 (4), 783-795.e4 (2017).
- Shiraiwa, T., Carlson, J. R. Proboscis extension response (per) assay in drosophila. J Vis Exp. (3), e193 (2007).
- Pulver, S. R., Hornstein, N. J., Land, B. L., Johnson, B. R. Optogenetics in the teaching laboratory: Using channelrhodopsin-2 to study the neural basis of behavior and synaptic physiology in drosophila. Adv Physiol Educ. 35 (1), 82-91 (2011).
- Titlow, J. S., Johnson, B. R., Pulver, S. R. Light activated escape circuits: A behavior and neurophysiology lab module using drosophila optogenetics. J Undergrad Neurosci Educ. 13 (3), A166-A173 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved