JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Drosophila melanogaster에서 신경 회로의 광유전학적 조작을 위한 행동 분석
* 이 저자들은 동등하게 기여했습니다
요약
이 논문은 CsChrimson 및 GtACR2를 활용하여 특정 뉴런을 활성화하고 침묵시키는 Drosophila melanogaster의 광유전학적 조작 방법을 제시합니다. 광유전학을 활용하여 열택 및 미각 행동을 탐구하고 이러한 과정을 제어하는 기본 신경 메커니즘에 대한 통찰력을 제공하는 네 가지 실험이 설명됩니다.
초록
광유전학은 신경 과학의 기본 기술이 되었으며, 빛 자극을 통해 신경 세포 활동을 정밀하게 제어할 수 있습니다. 이 연구는 Drosophila melanogaster에 광유전학적 방법을 적용하기 위한 구현하기 쉬운 설정을 소개합니다. 두 가지 광유전학 도구인 CsChrimson, 적색광 활성화 양이온 채널, 청색광 활성화 음이온 채널인 GtACR2가 4가지 실험적 접근 방식에 사용되었습니다. 이러한 접근 방식 중 세 가지는 단일 파리 실험을 포함합니다 : (1) 온도에 민감한 가열 세포를 표적으로 하는 청색광 광유전학 열tactic 위치 선호 분석, (2) 쓴 감지 뉴런을 활성화하는 적색광 광유전학 위치 선호 분석, (3) 단맛 감지 뉴런을 활성화하는 확장 반응 분석. 네 번째 접근 방식(4)은 여러 파리를 사용하여 회피 행동을 평가하기 위한 파리 미로 설정입니다. 신경 활동을 시간적, 공간적으로 조작할 수 있는 능력은 감각 처리 및 의사 결정에 대한 강력한 통찰력을 제공하며, 신경 기능에 대한 지식을 발전시킬 수 있는 광유전학의 잠재력을 강조합니다. 이러한 방법은 특정 신경 경로와 행동 결과에 대한 이해를 향상시키기 위해 신경 과학의 향후 연구를 위한 접근 가능하고 강력한 프레임워크를 제공합니다.
서문
광유전학은 신경 과학에서 광학과 유전학을 결합한 강력한 기술로 부상했으며, 광 자극1을 통해 신경 활동에 대한 정확하고 비침습적인 제어를 제공합니다. 널리 사용되는 모델 유기체인 Drosophila melanogaster에서 광유전학 도구는 특정 뉴런의 활성화 및 억제를 가능하게 하여 연구자들이 신경 회로를 조절할 수 있도록 합니다. 사용된 도구 중 CsChrimson 및 GtACR(Guillardia theta 음이온 채널 로돕신)은 신경 세포 표적화를 위한 상호 보완적인 접근 방식을 제공합니다. 녹조류의 적색광에 민감한 양이온 채널인 CsChrimson 채널로돕신은 적색광에 노출될 때 탈분극을 통해 뉴런 활성화를 촉진하며 약 590nm에서 피크 활성화를 촉진합니다2. CsChrimson은 이전의 채널로돕신보다 더 나은 조직 침투를 제공하고 초파리 연구에서 빛에 의한 행동 인공물을 감소시킵니다2. 대조적으로, GtACR2와 같은 변형을 포함하는 GtACR은 과분극(hyperpolarization)을 통해 뉴런을 침묵시키는 광의존성 염화물 채널입니다 3,4. GtACR2는 음이온을 전도하고 약 470nm4의 피크 활성화와 함께 청색광에 의해 활성화됩니다. CsChrimson과 GtACR2는 뚜렷한 빛의 파장에 의해 활성화되어 교차 활성화 없이 신경 세포 활동을 정확하고 독립적으로 제어할 수 있습니다5.
초파리는 비용 효율성, 사육 용이성, 매력 및 회피 행동을 포함한 환경 자극에 대한 강력한 행동 반응으로 인해 신경 과학 연구에 효과적인 모델입니다6. 작은 크기와 반투명 큐티클은 빛, 특히 장파장 적색광의 투과를 향상시켜 효율적인 광유전학적 조작을 가능하게 합니다 7,8. 초파리 세포는 채널로돕신의 기능에 중요한 보조인자인 망막을 충분히 생산할 수 없지만, 식단에 망막을 추가하면 이러한 한계를 보상하여 광유전학적 도구의 효과적인 활성화를 보장할 수 있습니다9.
초파리에서 광유전학적 조작의 효과를 탐구하기 위해 서로 다른 신경 회로와 행동을 대상으로 하는 4가지 실험에 대해 설명하며, 각 실험은 단일 비행 분석에서 그룹 기반 평가에 이르기까지 회피 또는 매력적인 반응을 평가하기 위해 고유한 양식을 사용합니다. 초파리의 가열 세포(HC)는 아리스타에 위치한 열감각 뉴런으로 온도 상승에 반응합니다10. 이 뉴런은 회피 행동을 유발하는 열에 민감한 이온 채널을 발현하여 파리를 열원으로부터 멀어지게 합니다10,11. 접근 방식 1에서는 HC 뉴런을 조작하기 위해 단일 비행 청색광 광유전학 열전술 위치 선호 분석을 사용했습니다. 이 뉴런에서 GtACR2를 발현함으로써 청색광 노출 시 뉴런의 활성을 억제했습니다. 파리는 25°C와 31°C의 두 가지 온도 옵션에 노출되었습니다. 실내 조명 아래에서 파리는 31°C 쪽을 피하여 전형적인 열전술 반응을 보여주었습니다. 그러나 GtACR2의 청색광 활성화는 HC 뉴런을 침묵시켰습니다. 그 결과, 파리는 유의미한 온도 선호도를 보이지 않았으며, 이는 성공적인 광유전학적 억제를 시사합니다. 감각 뉴런의 기능을 평가하는 것 외에도 다운스트림 감각 뉴런에서 GtACR2의 발현은 특정 감각 양식에 필요한 신경 회로를 연구하기 위한 유사한 광유전학적 조작을 가능하게 합니다5.
초파리(Drosophila)의 미각 수용체(gustatory receptor) GR66a는 주둥이의 말단부와 다리의 순손바닥(labial palps)에서 발현되어 쓴 맛 감지를 매개합니다12,13. 이 뉴런은 쓴 물질에 대한 반응으로 회피 행동을 유발합니다. 접근법 2에서는 GR66a 발현 뉴런을 조작하기 위해 단일 비행 적색광 광유전학 위치 선호 분석을 사용했습니다. 이 뉴런에서 CsChrimson을 발현함으로써, 우리는 적색광 노출 시 활성화시켰습니다. 파리는 한쪽 반은 붉은 빛에 노출되고 다른 반은 붉은 빛에 노출되는 경기장에 배치되었습니다. 빨간불이 없을 때는 파리가 선호하지 않았습니다. 그러나 CsChrimson의 적색광 활성화는 쓴 감지 뉴런을 자극하여 조명 영역을 크게 피하게 하여 GR66a 뉴런의 성공적인 광유전학적 활성화를 확인했습니다. 회피 거동5에 충분한 가열 셀의 다운스트림 회로를 식별하기 위해 유사한 접근 방식이 사용되었습니다.
우리는 접근법 3에서 식욕 행동의 광유전학적 활성화에 초점을 맞췄습니다. 라벨럼과 다리의 미각 센실라에 위치한 GR5a 발현 뉴런은 당을 감지하고 섭식 행동을 유도합니다. 이러한 뉴런의 활성화는 확장 반응(PER)14을 유발합니다. GR5a 뉴런을 활성화하기 위해 적색광 광유전학 확장 반응 분석을 사용했습니다. 이 뉴런에서 CsChrimson을 발현함으로써 우리는 붉은 빛으로 그들을 자극했습니다. 파리는 실내 조명 조건에서 주둥이를 확장하지 않았습니다. 그러나 CsChrimson의 적색광 활성화는 달콤한 자극 없이 확장을 유도하여 GR5a 뉴런의 성공적인 광유전학적 활성화를 입증했습니다. 이 접근법은 미각 감각 뉴런, 미각 투영 뉴런 및 운동 뉴런을 포함한 신경 회로를 조사하는 데 사용되었습니다15,16.
접근법 4에서는 GR66a 뉴런을 표적으로 하는 적색광 광유전학 파리 미로 분석을 사용하여 파리 그룹에서 회피 행동의 광유전학적 활성화를 조사했습니다. 파리는 두 튜브의 교차점에 배치되었습니다 : 하나는 붉은 빛으로 조명되고 다른 하나는 음영 처리되었습니다. GR66a 뉴런에서 CsChrimson 발현은 회피를 유발했습니다. 적색광이 없을 때는 파리가 선호하지 않았지만, 적색광 활성화는 GR66a가 적색광을 피하기 위해 파리를 발현하도록 유도하여 경로의 성공적인 활성화를 시사했습니다. Fly maze assay는 온도, 습도 및 후각을 포함한 다양한 감각 양식을 연구하는 데 널리 사용되었습니다. 광유전학과 결합할 때, 이 접근법은 매력 행동과 회피 행동을 모두 조사하는 데 강력합니다 17,18,19.
이러한 방법은 초파리 신경 회로의 광유전학적 활성화 및 억제를 연구하기 위한 재현 가능한 프레임워크를 제공합니다. 다양한 채널로돕신과 접근 가능한 행동 분석법의 조합을 활용함으로써 이 개념 증명 연구는 광유전학적 조작의 효과를 입증하여 신경 과학 연구에서 잠재적으로 더 광범위한 응용 프로그램을 통해 신경 회로 기능을 조작하는 간단한 방법을 제공합니다.
프로토콜
1. 스트레인, 플라이 사육 및 플라이 흡입기
- 긴장 및 유지 보수
- 실험에 사용된 균주는 HC-Gal410, Gr5a-Gal420 (Bloomington Drosophila Stock Center (BDSC): 57592), Gr66a-Gal421 (BDSC: 57670), UAS-GtACR23, UAS-CsChrimson2 (BDSC: 55136)입니다. 후방은 12시간 조명:12시간 다크 사이클 아래에서 표준 옥수수 가루 매체에서 25°C로 비행합니다.
참고: 1L 옥수수 가루 배지에는 1L dH2O, 포도당 79g, 한천 7.5g, 플레이크 효모 24g, 옥수수 가루 57g, 메틸-4-하이드록시벤조에이트 2.1g(에탄올 11.1mL에 용해), 주석산칼륨 6g, 사수화 나트륨 6g 및 염화칼슘 0.9g이 포함되어 있습니다.
- 실험에 사용된 균주는 HC-Gal410, Gr5a-Gal420 (Bloomington Drosophila Stock Center (BDSC): 57592), Gr66a-Gal421 (BDSC: 57670), UAS-GtACR23, UAS-CsChrimson2 (BDSC: 55136)입니다. 후방은 12시간 조명:12시간 다크 사이클 아래에서 표준 옥수수 가루 매체에서 25°C로 비행합니다.
- 파리 사육 및 실험 준비
- 0에서 3일 된 파리를 분류합니다. 실험 시점까지 파리는 3-6일째가 되어 연령과 관련된 일관성을 보장합니다(그림 1A).
- 실험을 수행하기 3일 전에 각 유전자형을 실내 조명 ATR -, 실내 조명 ATR +, 빨간색 또는 파란색 조명 ATR -, 빨간색 또는 파란색 빛 ATR +의 4개 그룹으로 나눕니다.
- ATR을 100% 에탄올에 용해시켜 80mM ATR 원액을 준비합니다. ATR + 그룹에 400μM ATR로 식품을 보충합니다.
- 동일한 농도의 에탄올로 식품을 보충하되 ATR이 없는 ATR 그룹에 보충하십시오.
- 어둠 속에서 모든 그룹을 기르다22.
- Starve Gr5a>CsChrimson 은 축축한 조직만 들어 있는 바이알에서 16-24시간 동안 비행합니다. ATR + 바이알에는 물과 혼합된 400μM ATR이 포함되어 있는 반면, ATR-바이알에는 동일한 농도의 에탄올과 혼합된 dH2O가 포함되어 있습니다.
- 플라이 흡인기
- 플라스틱 튜브, 방충망 및 2개의 3mL 전사 피펫을 사용하여 파리 흡인기(그림 1B)를 조립합니다.
- 전사 피펫의 팁과 전구를 절단하여 플라이 흡입 팁이 파리가 편안하게 통과할 수 있도록 합니다. 이 설계는 흡입을 통해 파리의 부드러운 흡인을 가능하게 하여 피해를 최소화하고 개별 파리의 효율적인 수집 및 이동을 용이하게 합니다.
- 플라스틱 튜브 위에 곤충 그물을 드리우고 파라필름을 사용하여 피펫의 전구 끝을 튜브에 고정합니다.
2. 단일 플라이 블루 라이트 광유전학 열전술 위치 선호도 분석
- 초파리의 균주와 파리 사육
- HC-Gal410 드라이버 라인을 UAS-GtACR23으로 교차하여 실험 유전자형 HC>GtACR2를 생성합니다. HC>GtACR2는 발열셀에서 GtACR2를 표현합니다.
알림: 각 조건에 대해 동일한 수의 수컷과 암컷 파리가 사용되는지 확인하십시오.
- HC-Gal410 드라이버 라인을 UAS-GtACR23으로 교차하여 실험 유전자형 HC>GtACR2를 생성합니다. HC>GtACR2는 발열셀에서 GtACR2를 표현합니다.
- 실험적 분석 설정 및 실행
- 두 개의 강판을 별도의 열판에 정렬하여 가장자리가 만나도록 합니다. 그 위에 플라스틱 시트 보호대를 놓고 테이프로 고정하여 움직임을 최소화합니다. 배경 잡음 신호를 줄이기 위해 시트 보호기에 흰 종이 한 장을 놓습니다(그림 1C).
참고: 각 실험을 시작할 때 또는 더러워진 경우 백서를 교체하십시오. - 흰 종이 위에 투명 플라스틱 덮개(높이 2mm, 너비 58mm, 길이 83mm× × 83mm)를 놓습니다. 이 덮개는 파리가 날지 못하게 하면서 자유롭게 걸을 수 있도록 합니다.
- 폴리스티렌 폼 상자(높이 27cm×, 너비 22cm, 길이 16cm)× 폴리스티렌 폼 상자 바닥에 구멍을 뚫어 실험 표면에서 약 12cm 위에 있는 카메라와 청색광(1,000mA)에 부착합니다.
- 카메라와 청색광을 배치하여 눈부심을 최소화하는 동시에 활성화를 활성화합니다.
알림: 청색광의 활성화 범위를 결정하기 위해 사전 테스트가 필요할 수 있습니다. - 다음 설정으로 녹화할 카메라를 설정합니다: 1초 타임랩스, 좁은 필드, 4000 × 3000픽셀.
- 각 강판의 표면 온도를 25 ± 1 °C 및 31 ± 1 °C로 유지하도록 가열판 설정을 조정합니다.
알림: 25°C 미만의 온도가 필요한 조건의 경우 펠티에 장치 또는 얼음과 같은 대체 냉각 방법이 필요합니다. 강판의 온도가 원하는 수준을 초과하면 표면에 증류수를 분사하여 필요한 조건을 달성하고 유지하십시오. 그런 다음 냅킨을 사용하여 플라스틱 시트 보호대에서 과도한 수분을 흡수합니다. - 각 시험 전후에 표면 온도 프로브를 사용하여 온도를 모니터링하십시오.
참고: 변동이 결과에 영향을 줄 수 있으므로 정확한 온도 제어가 중요합니다. - 25°C 쪽에 플라스틱 덮개를 놓습니다. 파리 흡인기기를 사용하여 덮개 아래에 있는 파리 한 마리를 부드럽게 풀어줍니다. 실험 영역 위에 상자를 배치하여 희미한 빛(<10lux)을 만들고 파리가 1분 동안 적응하도록 합니다.
- 적응 기간이 끝나면 상자를 들어 올리고 플라스틱 덮개를 빠르게 조정하여 덮개 중심이 강판 경계와 정렬되도록 배치하여 25°C 및 31°C 측면의 균일한 적용 범위를 보장합니다.
참고: 이 과정에서 31°C 측의 공기 온도와 덮개 내부 온도는 5초 이내에 약 27°C로 증가하며(보충 그림 1), 이는 발열전지(11)를 활성화하기에 충분합니다. - 카메라와 블루라이트(20kLux)를 켜서 평가판을 시작합니다.
알림: 실내 조명 조건에서 파란색 조명을 켜지 마십시오. 카메라를 켜고 몇 프레임을 기록한 후 움직임이 있을 경우 파란색 조명을 켭니다. - 2분 이상 경과한 후 카메라와 조명을 꺼서 평가판을 종료합니다. 흡인기로 파리를 처분하십시오.
참고: 카메라를 끌 때 움직임이 있을 경우를 대비하여 몇 개의 추가 프레임을 기록하십시오.
- 두 개의 강판을 별도의 열판에 정렬하여 가장자리가 만나도록 합니다. 그 위에 플라스틱 시트 보호대를 놓고 테이프로 고정하여 움직임을 최소화합니다. 배경 잡음 신호를 줄이기 위해 시트 보호기에 흰 종이 한 장을 놓습니다(그림 1C).
- 행동 및 통계 분석
- 시험 시작 시 25°C 쪽에 머무르는 파리의 데이터만 분석합니다.
참고: 31°C 쪽에서 시험을 시작하는 파리의 데이터는 종종 선호도가 변경됨23. 31°C 면의 가장자리에 접근하지 않는 파리와 관련된 실험을 버리고 온도 사이에서 선택했는지 확인합니다. 30초 이상 정지해 있는 파리의 데이터를 버립니다. - 앞에서 설명한 절차를 사용하여 결과를 분석합니다 23. 선호도 지수(PI)를 다음 공식과 같이 총 시간에 대한 파리가 각 온도 영역에서 소비한 시간의 차이의 비율로 계산합니다.
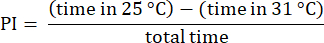
참고: 실험에 대한 통계적 세부 정보는 그림 범례에 제공됩니다. 데이터 분석은 적절한 데이터 분석 소프트웨어를 사용하여 수행됩니다.
- 시험 시작 시 25°C 쪽에 머무르는 파리의 데이터만 분석합니다.
3. 단일 비행 적색광 광유전학 위치 선호도 분석
- 초파리의 균주와 파리 사육
- Gr66a-Gal421 드라이버 라인을 UAS-CsChrimson2로 교차시켜 실험 유전자형 Gr66a>CsChrimson을 생성합니다. Gr66a>CsChrimson 파리는 쓴 맛 뉴런에서 CsChrimson을 표현합니다.
알림: 각 조건에 대해 동일한 수의 수컷과 암컷 파리가 사용되는지 확인하십시오.
- Gr66a-Gal421 드라이버 라인을 UAS-CsChrimson2로 교차시켜 실험 유전자형 Gr66a>CsChrimson을 생성합니다. Gr66a>CsChrimson 파리는 쓴 맛 뉴런에서 CsChrimson을 표현합니다.
- 실험적 분석 설정 및 실행
- CsChrimson의 제어된 활성화를 보장하기 위해 어두운 방이나 어두운 환경에서 분석을 수행합니다(그림 1D).
- 캠코더를 실험 표면에서 약 45cm 위에 배치합니다.
- 적외선 필터가 없는 캠코더를 사용하십시오. 캠코더에 700nm보다 긴 파장을 차단하는 내부 단역 통과 적외선 필터가 있는 경우 제거합니다.
- 적외선 파장을 포착하기 위해 슈퍼 글루를 사용하여 렌즈 위에 830nm 장역 통과 필터를 부착합니다. 이 조정은 적외선 조건에서 파리의 움직임을 기록하는 데 필수적입니다.
- 적색 광원24 를 실험 표면에서 약 45cm 위에 배치하여 약 2.5kLux(1,000mA)의 광도를 보장합니다.
알림: 적색 레이저/빛을 걸러낼 수 있는 적절한 눈 보호구를 사용하는 것이 좋습니다. 레이저 보안경은 강렬한 적색광에 직접 노출되어 눈이 손상될 가능성을 방지하는 데 도움이 됩니다. - 적외선을 사용하여 설정 내의 파리를 시각화합니다. 실험하는 동안 계속 유지하세요.
알림: 적외선으로 인한 실험 영역의 눈부심을 피하십시오. 눈부심은 데이터 분석을 복잡하게 만들 수 있습니다. - 접착제를 사용하여 780nm 적외선 장역 통과 필터를 플라스틱 덮개의 절반에 부착합니다.
참고: 780nm 미만의 파장을 차단하는 장역 통과 필터를 사용하십시오. 여과되지 않은 면은 적색광과 적외선이 통과할 수 있도록 하고 여과된 면은 적외선만 통과시킬 수 있습니다. - 배경 소음을 최소화하기 위해 실험 영역 아래에 검은색 무광택 재료를 놓습니다.
- 파리 흡입기를 사용하여 투명 플라스틱 덮개(높이 2mm×, 너비 58mm, 길이 83mm)× 높이 2mm, 너비 58mm, 길이 83mm) 아래에 파리 한 마리를 놓고 1분 동안 적응시킵니다.
- 여과되지 않은 쪽에서 파리가 보일 때까지 기다립니다. 캠코더와 빨간색 표시등을 켜서 평가판을 시작합니다.
참고: 캠코더는 시작 직후 움직임에 취약합니다. 촬영하는 동안 카메라를 철저히 고정하고 촬영하기 몇 초 전에 카메라를 켜서 분석을 복잡하게 만들 수 있는 비정상적인 움직임을 피하십시오. 평가판이 시작될 때까지 빨간불을 켜지 마십시오. - 1분 동안 파리의 움직임을 기록합니다.
참고: 플라이가 정중선에 접근하지 않거나 15초 이상 움직이지 않는 시도는 폐기합니다. - 1분 후 캠코더와 조명을 꺼서 평가판을 종료합니다. 흡인기로 파리를 처분하십시오.
참고: 카메라를 끌 때 움직임의 영향을 피하기 위해 몇 개의 추가 프레임을 기록하십시오.
- 행동 및 통계 분석
- 앞에서 설명한 절차를 사용하여 결과를 분석합니다 23. 선호도 지수(PI)는 다음 공식과 같이 필터가 없는 영역과 필터가 있는 영역에서 총 시간에 대한 파리가 소비한 시간의 차이의 비율로 계산합니다.
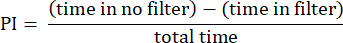
참고: 실험에 대한 통계적 세부 정보는 그림 범례에 제공됩니다. 데이터 분석은 적절한 데이터 분석 소프트웨어를 사용하여 수행됩니다.
- 앞에서 설명한 절차를 사용하여 결과를 분석합니다 23. 선호도 지수(PI)는 다음 공식과 같이 필터가 없는 영역과 필터가 있는 영역에서 총 시간에 대한 파리가 소비한 시간의 차이의 비율로 계산합니다.
4. 적색광 광유전학 확장 반응
- 초파리의 균주와 파리 사육
- Gr5a-Gal420 드라이버 라인을 UAS-CsChrimson2로 교차시켜 Gr5a>CsChrimson이라고 하는 실험적 유전자형을 생성합니다. Gr5a>CsChrimson 파리는 단맛 수용체 뉴런에서 CsChrimson을 발현합니다.
알림: 각 조건에 대해 동일한 수의 수컷과 암컷 파리가 사용되는지 확인하십시오. - 굶주림은 테스트 전에 ATR(ATR +) 또는 ATR 없이(ATR -) 16-24시간 동안 비행합니다.
참고: 강한 반응을 이끌어내기 위해 더 긴 굶주림 기간이 필요할 수 있습니다.
- Gr5a-Gal420 드라이버 라인을 UAS-CsChrimson2로 교차시켜 Gr5a>CsChrimson이라고 하는 실험적 유전자형을 생성합니다. Gr5a>CsChrimson 파리는 단맛 수용체 뉴런에서 CsChrimson을 발현합니다.
- 실험적 분석 설정 및 실행
- 마취는 얼음 위에서 냉각하여 파리를 마취합니다(그림 1E).
알림: 파리와 얼음 사이의 직접적인 접촉을 피하십시오. 냉각 시간을 약 1분으로 제한하십시오. 냉각이 장시간 지속되면 회복 문제와 사망률이 발생할 수 있습니다. - 1000 μL 피펫 팁의 팁을 사용하여 유리 슬라이드에 7-10개의 작은 접착제 점을 도포합니다.
알림: 슬라이드에 접착제를 작게 떨어뜨리면 파리가 물에 잠기지 않고 접착제가 주둥이나 다리에 달라붙는 것을 방지할 수 있습니다. - 각 접착제 점에 복부 쪽이 위로 향하도록 플라이 하나를 배치합니다. 움직임을 최소화하기 위해 흉부와 날개가 접착제에 닿도록 합니다. 날개를 양쪽으로 부채질하여 접착 표면적을 늘립니다.
알림: 빛에 노출되는 동안 실수로 여러 파리를 활성화할 수 있는 파리를 너무 가까이 두지 마십시오. - 접착제를 약 10분 동안 건조시킵니다.
- 슬라이드를 습도 상자(젖은 종이 타월이 들어 있는 플라스틱 상자)로 옮기고 파리가 2시간 동안 회복할 때까지 기다립니다.
- 슬라이드를 현미경 아래에 놓습니다. 주사기를 사용하여 물방울을 전달하여 파리를 포만하게 하고 갈증으로 인한 확장을 방지합니다.
- 수동으로 빨간색 레이저 포인터를 잡고 있으면 현미경을 통해 PER 응답을 관찰하면서 단일 파리(700lux)의 코/머리에 빨간 빛을 비춥니다.
알림: 적색 레이저/광을 걸러낼 수 있는 눈 보호는 현미경을 통해 적색광을 관찰할 때 필수적입니다. - 30초 창 내에서 코가 뻗어 있는 것을 관찰하고 기록합니다. 다음 기록 시스템을 사용하여 각 플라이에 점수를 매깁니다: 0은 확장이 없음을 나타내고, 0.5는 1-2초 확장을 나타내고, 1은 확장이 3초 이상 지속됨을 나타냅니다.
- 광 유도 확장을 테스트한 후 주사기를 사용하여 4% 자당에 대한 반응을 검사합니다. 바늘 끝에 있는 자당 한 방울을 배출하고 파리 주둥이에 가까이 가져갑니다.
참고: 자당 방울에 반응하지 않는 파리의 데이터를 폐기합니다.
- 마취는 얼음 위에서 냉각하여 파리를 마취합니다(그림 1E).
- 행동 및 통계 분석
- 적절한 데이터 분석 소프트웨어를 사용하여 통계 분석을 수행합니다.
참고: 실험에 대한 통계적 세부 정보는 그림 범례에 제공됩니다.
- 적절한 데이터 분석 소프트웨어를 사용하여 통계 분석을 수행합니다.
5. 적색광 광유전학 파리 미로 분석
- 초파리의 균주와 파리 사육
- Gr66a-Gal421 드라이버 라인을 UAS-CsChrimson2로 교차시켜 실험 유전자형 Gr66a>CsChrimson을 생성합니다. Gr66a>CsChrimson 파리는 쓴 맛 뉴런에서 CsChrimson을 표현합니다.
알림: 각 그룹에 동일한 수의 수컷과 암컷 파리가 포함되어 있는지 확인하십시오.
- Gr66a-Gal421 드라이버 라인을 UAS-CsChrimson2로 교차시켜 실험 유전자형 Gr66a>CsChrimson을 생성합니다. Gr66a>CsChrimson 파리는 쓴 맛 뉴런에서 CsChrimson을 표현합니다.
- Fly-maze 조립
- 그림 1F와 같이 파리 미로를 만듭니다.
참고: 또는 파리 미로 구성 요소를 3D 프린팅하여 이전에 자세히 설명한대로 조립합니다 25. - 5mL 플라스틱 배양 튜브 3개를 적절한 길이로 절단하여 로딩 튜브, 덮개가 없는 투명 테스트 튜브 및 호일로 덮인 테스트 튜브를 만듭니다. 그림 1F와 같이 파리 미로에 튜브를 부착합니다.
- 미로 재료에 따라 각 테스트 조건에 대해 동일한 거리를 확보하도록 테스트 튜브를 자릅니다. 홀딩 챔버의 길이에 따라 투명한 미로에서 덮개가 없는 테스트 튜브를 줄이고, 미로가 불투명하면 호일로 덮인 테스트 튜브를 줄입니다.
- 그림 1F와 같이 파리 미로를 만듭니다.
- 실험적 분석 설정 및 실행
- 어둡거나 조명이 어두운 조건에서는 수컷 10명과 암컷 10명을 적재 튜브에 넣습니다. 로딩 튜브를 고정 챔버에 연결합니다. 엘리베이터를 기울이고 튜브를 부드럽게 두드려 파리를 수용실로 이동시킵니다.
참고: 수용실의 절반만 열리도록 엘리베이터를 내립니다. 이 조작은 로딩 튜브에서 홀딩 챔버로 파리를 쉽게 옮길 수 있습니다. - 파리를 수용실로 옮긴 후 엘리베이터를 사용하여 적재 튜브와 테스트 튜브 구멍 사이의 파리를 내립니다. 그런 다음 로딩 튜브를 제거합니다.
- 조명을 켜지 않고 파리 미로를 적색 광원(13mA)에서 약 1000cm 떨어진 곳에 배치합니다.
- 홀딩 챔버가 시험관 구멍과 정렬될 때까지 엘리베이터를 내려 파리가 호일로 감싼 시험관과 덮개가 없는 시험관 사이를 자유롭게 이동할 수 있도록 합니다. 동시에 빨간색 표시등을 켜서 CsChrimson을 활성화합니다. 덮개가 없는 테스트 튜브 표면의 적색광 강도가 약 40kLux인지 확인합니다.
알림: 고정 챔버가 내려가고 시험관 구멍과 정렬될 때까지 빨간색 표시등을 켜지 마십시오. 적색광의 강렬한 밝기로 인해 적색 레이저/광을 걸러낼 수 있는 적절한 눈 보호구가 권장됩니다. - 파리는 1분 동안 적색광에 노출된 튜브와 음영 처리된 튜브 중에서 선택합니다.
- 1분 후 적재 튜브와 테스트 튜브 구멍 사이의 엘리베이터를 올립니다. 각 튜브에 있는 파리를 세십시오.
참고: 활동적이고 다치지 않은 파리만 계산됩니다. - 각 시도 후에 dH2O를 사용하여 플라이 엘리베이터와 플라이 미로를 청소하십시오.
- 어둡거나 조명이 어두운 조건에서는 수컷 10명과 암컷 10명을 적재 튜브에 넣습니다. 로딩 튜브를 고정 챔버에 연결합니다. 엘리베이터를 기울이고 튜브를 부드럽게 두드려 파리를 수용실로 이동시킵니다.
- 데이터 분석 및 통계
- 선호도 지수(PI)를 다음 공식과 같이 총 파리 수에 대한 uncovered tubes와 covered tube 사이의 fly numbers 차이의 비율로 계산합니다.
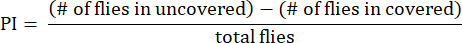
참고: 실험에 대한 통계적 세부 정보는 그림 범례에 제공됩니다. 적절한 데이터 분석 소프트웨어를 사용하여 데이터 분석을 수행합니다.
- 선호도 지수(PI)를 다음 공식과 같이 총 파리 수에 대한 uncovered tubes와 covered tube 사이의 fly numbers 차이의 비율로 계산합니다.
결과
Single-fly blue-light optogenetic thermotactic positional preference assay(단일 비행 청색광 광유전학 열전술 위치 선호 분석)
ATR 보충이 없는 실내 조명(실내 조명, ATR -), ATR 보충이 있는 실내 조명(실내 조명, ATR +), ATR 보충이 없는 청색광(파란색, ATR -), ATR 보충이 있는 청색광(파란색, ATR +)의 4가지 조건을 테스트했습니다. 처음 세 가지 조건은 컨트롤 역할을 했습니다. 대조?...
토론
광유전학적 조작은 시공간 정확도로 신경 회로를 정밀하게 제어할 수 있게 함으로써 신경과학 분야를 변화시켰다27. 신경 회로는 시냅스에 의해 상호 연결된 뉴런 집단을 포함하며, 활성화 시 특정 기능을 수행합니다. 초파리 전뇌 커넥톰(Drosophila whole-brain connectome)이 완성되어 초파리 뇌 내 시냅스 경로에 대한 포괄적인 통찰력을 제공합니?...
공개
저자는 이 기사의 출판과 관련하여 이해 상충이 없음을 선언합니다. 모든 저자는 잠재적인 갈등을 공개했으며 이 연구에서 제시된 연구에 영향을 미칠 수 있는 재정적 또는 개인적 관계가 없음을 확인합니다.
감사의 말
모든 그림에 대한 개략도는 Biorender.com 로 생성되었습니다. 이 작업은 NIH R01GM140130(https://www.nigms.nih.gov/)에서 L.N.에 지원했습니다. 자금 제공자는 연구 설계, 데이터 수집 및 분석, 출판 결정 또는 원고 준비에 아무런 역할도 하지 않았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1000 mA LED driver | Luxeon Star | 3021-D-E-1000 | |
| 5 mL VWR Culture Tubes, Plastic, with Dual-Position Caps | VWR | 60818-664 | |
| 780 Longpass Filter / IR 780 nm 100 mm x 100 mm | Lee Filters | BH #LE8744 | Cut to approximately 47 x 100 fit the plastic cover |
| Agfabric 6.5 ft. x 15 ft. Insect Bug Netting Garden Net for Protecting Plants Vegetables Flowers Fruits | The Home Depot | EIBNW6515 | |
| All trans retinal | Sigma-Aldrich | 116-31-4 | |
| Aluminum Plate (30.5 cm x 30.5 cm x 0.6 cm) | Amazon | purchased from Amazon | |
| Black Plastic Box | LI-COR | 929-97101 | |
| CALCIUM CHLORIDE ANHYDRO 25GR | Thermo Fisher Scientific | AC297150250 | |
| CX405 Handycam with Exmor R CMOS sensor | SONY | HDR-CX405 | |
| Elmer’s “School Glue” | Elmer | ||
| Ethyl alcohol, Pure (200 Proof) | Sigma-Aldrich | E7023 | |
| Fisherbrand Isotemp Hot Plate Stirrer | Fisher Scientific | SP88850200 | |
| Fly line: Gr5a-Gal4 | Bloomington Drosophila Stock Center | 57592 | |
| Fly line: Gr66a-Gal4 | Bloomington Drosophila Stock Center | 57670 | |
| Fly line: HC-Gal4 (II) | Dr. Marco Gallio Lab | A kind gift | |
| Fly line: UAS-CsChrimson | Bloomington Drosophila Stock Center | 55136 | |
| Fly line: UAS-GtACR2/TM6B | Dr. Quentin Gaudry Lab | A kind gift | |
| Flystuff 62-101 Yellow Cornmeal (11.3 Kg), Yellow, 11.3 Kg/Unit | Genesee Scientific | 62-101 | |
| Flystuff 62-107 Inactive Dry Yeast, 10 Kg, Nutritional Flake, 10 Kg/Unit | Genesee Scientific | 62-107 | |
| Flystuff 66-103 Nutri-Fly Drosophila Agar, Gelidium, 100 Mesh, 5 Kg (11.02 lbs)/Unit | Genesee Scientific | 66-103 | |
| FreeMascot OD 8+ 190 nm–420 nm / 600 nm–1100 nm Wavelength Violet/Red/Infrared Laser Safety Glasses | FreeMascot | B08LGMQ65S | purchased from Amazon |
| GoPro Hero8 Black | GoPro | 6365359 | |
| LEE Filters 100×100 mm Infra Red #87 Infrared Polyester Filter | B&H Photo | LE8744 | |
| Longpass Filter, Colored Glass, 50.8 x 50.8 mm, 830 nm Cut-on, RG830 | Newport | FSQ-RG830 | |
| Methyl 4-hydroxybenzoate, 99%, Thermo Scientific Chemicals | Thermo Fisher Scientific | 126960025 | |
| MicroWell Mini Tray 60 Well, Low Profile NS PS | Thermal Scientific | NUNC 439225 | The lids are used as the "plastic cover" |
| Olympus Plastics 24-160RS, 1000 µL Olympus Ergonomic Pipet Tips Low Binding, Racked, Sterile, 8 Racks of 96 Tips/Unit | Eppendorf | 24-160RS | |
| Parafilm M Sealing Film | Heathrow Scientific | HS234526B | 4 in x 125 feet |
| Potassium chloride, ACS, 99.0-100.5%, | Thermo Fisher Scientific | AA1159530 | |
| Prism | GraphPad | Version 9 | data analysis software |
| Samco Graduated Transfer Pipettes | Thermo Fisher Scientific | 225 | 3 mL |
| Slides | Fisher Scientific | 12-544-2 | 5 mm x 75 mm x 1.0 mm |
| Stereo microscope | OLYMPUS | CZ61 | |
| Styrofoam box (27 cm height × 22 cm width × 16 cm length) | |||
| Sucrose | Fisher Scientific | 225911 | |
| Surface temperature probe | Fluke | 80PK-3A | |
| Syringe | BD Integra | 305270 | |
| Tate & Lyle 457 Dextrose, Tate & Lyle, Pow, Tate & Lyle 457 Dextrose, Tate & Lyle, Powder, 50 lbs/Unit | Genesee Scientific | 62-113 | |
| Traceable Calibrated Big-Digit Thermocouple Thermometer | Traceable by cple-parmer | UX-91210-07 | Fisherbrand Traceable BigDigit Type K Thermometer |
| Triple blue LED starboard | LEDSupply | 07007-PB000-D | 470 nm |
| Triple red LED starboard | LEDSupply | 07007-PD000-F | 627 nm |
| Tygon PVC Clear Tubing 1/4" ID, 3/8" OD, 5 ft. Length | McMaster Carr Supply Company | 6516T21 | |
| Univivi IR Illuminator, 850nm 12 LEDs Wide Angle IR Illuminator for Night Vision | Univivi | 4331910725 | |
| Wakefield Thermal 25.4 mm Round Heatsink Star LED Board - 882-100AB | Wakefield-Vette | 882-100AB | |
| Wireless Presenter | DinoFire Store | B01410YNAM | purchased from Amazon |
참고문헌
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in neural systems. Neuron. 71 (1), 9-34 (2011).
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nat Methods. 11 (3), 338-346 (2014).
- Mauss, A. S., Busch, C., Borst, A. Optogenetic neuronal silencing in drosophila during visual processing. Sci Rep. 7 (1), 13823 (2017).
- Govorunova, E. G., Sineshchekov, O. A., Janz, R., Liu, X., Spudich, J. L. Neuroscience. Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science. 349 (6248), 647-650 (2015).
- Castaneda, A. N., et al. Functional labeling of individualized postsynaptic neurons using optogenetics and trans-tango in drosophila (flipsot). PLoS Genet. 20 (3), e1011190 (2024).
- Fischer, F. P., et al. Drosophila melanogaster as a versatile model organism to study genetic epilepsies: An overview. Front Mol Neurosci. 16, 1116000 (2023).
- Aragon, M. J., et al. Multiphoton imaging of neural structure and activity in drosophila through the intact cuticle. Elife. 11, e69094 (2022).
- Zhang, W., Ge, W., Wang, Z. A toolbox for light control of drosophila behaviors through channelrhodopsin 2-mediated photoactivation of targeted neurons. Eur J Neurosci. 26 (9), 2405-2416 (2007).
- Kono, M., Goletz, P. W., Crouch, R. K. 11-cis- and all-trans-retinols can activate rod opsin: Rational design of the visual cycle. Biochemistry. 47 (28), 7567-7571 (2008).
- Gallio, M., Ofstad, T. A., Macpherson, L. J., Wang, J. W., Zuker, C. S. The coding of temperature in the drosophila brain. Cell. 144 (4), 614-624 (2011).
- Ni, L., et al. A gustatory receptor paralogue controls rapid warmth avoidance in drosophila. Nature. 500 (7464), 580-584 (2013).
- Weiss, L. A., Dahanukar, A., Kwon, J. Y., Banerjee, D., Carlson, J. R. The molecular and cellular basis of bitter taste in drosophila. Neuron. 69 (2), 258-272 (2011).
- Ling, F., Dahanukar, A., Weiss, L. A., Kwon, J. Y., Carlson, J. R. The molecular and cellular basis of taste coding in the legs of drosophila. J Neurosci. 34 (21), 7148-7164 (2014).
- Dethier, V. G. . The Hungry Fly: A Physiological Study of the Behavior Associated with Feeding. , (1976).
- Shiu, P. K., Sterne, G. R., Engert, S., Dickson, B. J., Scott, K. Taste quality and hunger interactions in a feeding sensorimotor circuit. Elife. 11, e79887 (2022).
- Kim, H., Kirkhart, C., Scott, K. Long-range projection neurons in the taste circuit of drosophila. Elife. 6, e23386 (2017).
- Sayeed, O., Benzer, S. Behavioral genetics of thermosensation and hygrosensation in drosophila. Proc Natl Acad Sci U S A. 93 (12), 6079-6084 (1996).
- Coya, R., Martin, F., Calvin-Cejudo, L., Gomez-Diaz, C., Alcorta, E. Validation of an optogenetic approach to the study of olfactory behavior in the t-maze of drosophila melanogaster adults. Insects. 13 (8), 662 (2022).
- Chu, L. A., Tai, C. Y., Chiang, A. S. Thirst-driven hygrosensory suppression promotes water seeking in drosophila. Proc Natl Acad Sci U S A. 121 (34), e2404454121 (2024).
- Chyb, S., Dahanukar, A., Wickens, A., Carlson, J. R. Drosophila gr5a encodes a taste receptor tuned to trehalose. Proc Natl Acad Sci U S A. 100 (Suppl 2), 14526-14530 (2003).
- Dunipace, L., Meister, S., Mcnealy, C., Amrein, H. Spatially restricted expression of candidate taste receptors in the drosophila gustatory system. Curr Biol. 11 (11), 822-835 (2001).
- Ratnayake, K., et al. Blue light excited retinal intercepts cellular signaling. Sci Rep. 8 (1), 10207 (2018).
- Huda, A., Omelchenko, A. A., Vaden, T. J., Castaneda, A. N., Ni, L. Responses of different drosophila species to temperature changes. J Exp Biol. 225 (11), jeb243708 (2022).
- Tyrrell, J. J., Wilbourne, J. T., Omelchenko, A. A., Yoon, J., Ni, L. Ionotropic receptor-dependent cool cells control the transition of temperature preference in drosophila larvae. PLoS Genet. 17 (4), e1009499 (2021).
- Fu, Z., Huda, A., Kimbrough, I. F., Ni, L. Using drosophila two-choice assay to study optogenetics in hands-on neurobiology laboratory activities. J Undergrad Neurosci Educ. 22 (1), A45-A50 (2023).
- Joseph, R. M., Heberlein, U. Tissue-specific activation of a single gustatory receptor produces opposing behavioral responses in drosophila. Genetics. 192 (2), 521-532 (2012).
- Riemensperger, T., Kittel, R. J., Fiala, A. Optogenetics in drosophila neuroscience. Methods Mol Biol. 1408, 167-175 (2016).
- Dorkenwald, S., et al. Neuronal wiring diagram of an adult brain. Nature. 634 (8032), 124-138 (2024).
- Schlegel, P., et al. Whole-brain annotation and multi-connectome cell typing of drosophila. Nature. 634 (8032), 139-152 (2024).
- Talay, M., et al. Transsynaptic mapping of second-order taste neurons in flies by trans-tango. Neuron. 96 (4), 783-795.e4 (2017).
- Shiraiwa, T., Carlson, J. R. Proboscis extension response (per) assay in drosophila. J Vis Exp. (3), e193 (2007).
- Pulver, S. R., Hornstein, N. J., Land, B. L., Johnson, B. R. Optogenetics in the teaching laboratory: Using channelrhodopsin-2 to study the neural basis of behavior and synaptic physiology in drosophila. Adv Physiol Educ. 35 (1), 82-91 (2011).
- Titlow, J. S., Johnson, B. R., Pulver, S. R. Light activated escape circuits: A behavior and neurophysiology lab module using drosophila optogenetics. J Undergrad Neurosci Educ. 13 (3), A166-A173 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유