Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Ensayos conductuales para la manipulación optogenética de circuitos neuronales en Drosophila melanogaster
* Estos autores han contribuido por igual
En este artículo
Resumen
Este artículo presenta métodos para la manipulación optogenética en Drosophila melanogaster, utilizando CsChrimson y GtACR2 para activar y silenciar neuronas específicas. Se describen cuatro experimentos que utilizan la optogenética para explorar los comportamientos termotácticos y gustativos, proporcionando información sobre los mecanismos neuronales subyacentes que gobiernan estos procesos.
Resumen
La optogenética se ha convertido en una técnica fundamental en neurociencia, ya que permite un control preciso de la actividad neuronal a través de la estimulación lumínica. Este estudio presenta configuraciones fáciles de implementar para aplicar métodos optogenéticos en Drosophila melanogaster. Dos herramientas optogenéticas, CsChrimson, un canal catiónico activado por luz roja, y GtACR2, un canal aniónico activado por luz azul, se emplearon en cuatro enfoques experimentales. Tres de estos enfoques involucran experimentos con una sola mosca: (1) un ensayo de preferencia posicional termotáctica optogenética de luz azul dirigido a células de calentamiento sensibles a la temperatura, (2) un ensayo de preferencia posicional optogenética de luz roja que activa las neuronas de detección amarga y (3) un ensayo de respuesta de extensión de probóscide que activa las neuronas de detección dulce. El cuarto enfoque (4) es una configuración de laberinto de moscas para evaluar las conductas de evitación utilizando múltiples moscas. La capacidad de manipular la actividad neuronal temporal y espacialmente ofrece información valiosa sobre el procesamiento sensorial y la toma de decisiones, lo que subraya el potencial de la optogenética para avanzar en nuestro conocimiento de la función neuronal. Estos métodos proporcionan un marco accesible y sólido para futuras investigaciones en neurociencia con el fin de mejorar la comprensión de vías neuronales específicas y sus resultados conductuales.
Introducción
La optogenética se ha convertido en una poderosa técnica que combina la óptica y la genética en neurociencia, proporcionando un control preciso y no invasivo sobre la actividad neuronal a través de la estimulaciónlumínica. En Drosophila melanogaster, un organismo modelo ampliamente utilizado, las herramientas optogenéticas permiten la activación e inhibición de neuronas específicas, lo que permite a los investigadores modular los circuitos neuronales. Entre las herramientas utilizadas, CsChrimson y GtACR (rodopsinas del canal aniónico Guillardia theta) proporcionan enfoques complementarios para la focalización neuronal. CsChrimson canalrodopsina, un canal catiónico sensible a la luz roja de las algas verdes, facilita la activación neuronal a través de la despolarización cuando se expone a la luz roja, con una activación máxima de aproximadamente 590 nm2. CsChrimson ofrece una mejor penetración en el tejido que las canalrodopsinas anteriores y reduce los artefactos de comportamiento inducidos por la luz en los estudios de Drosophila 2. Por el contrario, el GtACR, que incluye variantes como el GtACR2, es un canal de cloruro activado por luz que silencia las neuronas a través de la hiperpolarización 3,4. GtACR2 conduce aniones y es activado por la luz azul con un pico de activación alrededor de 470 nm4. CsChrimson y GtACR2 se activan mediante distintas longitudes de onda de luz, lo que garantiza un control preciso e independiente de la actividad neuronal sin activación cruzada5.
Drosophila es un modelo eficaz para la investigación en neurociencia debido a su rentabilidad, facilidad de crianza y respuestas conductuales robustas a los estímulos ambientales, incluidas las conductas atractivas y de evitación6. Su pequeño tamaño y su cutícula semitransparente mejoran la penetración de la luz, especialmente de la luz roja de longitud de onda larga, lo que permite una manipulación optogenética eficiente 7,8. Si bien las células de Drosophila no pueden producir suficiente retinal, un cofactor crucial para la funcionalidad de las canalrodopsinas, la adición de retinal a su dieta compensa esta limitación, asegurando la activación efectiva de las herramientas optogenéticas9.
Para explorar los efectos de la manipulación optogenética en Drosophila, describimos cuatro experimentos dirigidos a diferentes circuitos neuronales y comportamientos, cada uno de los cuales utiliza distintas modalidades para evaluar la evitación o las respuestas atractivas, que van desde ensayos de una sola mosca hasta evaluaciones basadas en grupos. Las células de calentamiento (HC) en Drosophila son neuronas termosensoriales ubicadas en el arista, que responden a los aumentos de temperatura10. Estas neuronas expresan canales iónicos sensibles al calor que desencadenan el comportamiento de evitación, alejando a las moscas de las fuentes de calor10,11. En el enfoque 1, empleamos un ensayo de preferencia posicional termotáctica optogenética de luz azul de una sola mosca para manipular las neuronas HC. Al expresar GtACR2 en estas neuronas, inhibimos su actividad tras la exposición a la luz azul. Las moscas se expusieron a dos opciones de temperatura: 25 °C y 31 °C. Bajo la luz de la habitación, las moscas evitaron el lado de 31 °C, demostrando una respuesta termotáctica típica. Sin embargo, la activación de la luz azul de GtACR2 silenció las neuronas HC. Como resultado, las moscas no mostraron una preferencia significativa por la temperatura, lo que sugiere una inhibición optogenética exitosa. Además de evaluar la función de las neuronas sensoriales, la expresión de GtACR2 en las neuronas sensoriales posteriores permite manipulaciones optogenéticas similares para estudiar los circuitos neuronales necesarios para modalidades sensoriales específicas5.
El receptor gustativo GR66a en Drosophila se expresa en los palpos labiales en el extremo distal de la probóscide y en las patas, mediando la detección del sabor amargo12,13. Estas neuronas desencadenan conductas de evitación en respuesta a sustancias amargas. En el enfoque 2, utilizamos un ensayo de preferencia posicional optogenética de luz roja de una sola mosca para manipular las neuronas que expresan GR66a. Al expresar CsChrimson en estas neuronas, las activamos tras la exposición a la luz roja. Las moscas se colocaron en una arena con una mitad expuesta a la luz roja y la otra mitad filtrando la luz roja. En ausencia de luz roja, las moscas no mostraron preferencia. Sin embargo, la activación de CsChrimson por luz roja estimuló las neuronas sensibles a la amargura, lo que resultó en una evitación significativa del área iluminada, lo que confirma la activación optogenética exitosa de las neuronas GR66a. Se han utilizado enfoques similares para identificar los circuitos posteriores de las celdas de calentamiento suficientes para el comportamiento de evitación5.
Nos centramos en la activación optogenética de la conducta apetitiva en el enfoque 3. Las neuronas que expresan GR5a, ubicadas en la sensibilidad gustativa en el labelo y las patas, detectan azúcares e impulsan el comportamiento de alimentación. La activación de estas neuronas desencadena la respuesta de extensión de la probóscide (PER)14. Utilizamos un ensayo de respuesta de extensión de probóscide optogenética de luz roja para activar las neuronas GR5a. Al expresar CsChrimson en estas neuronas, las estimulamos con luz roja. Las moscas no extendían su probóscide en condiciones de luz ambiente. Sin embargo, la activación de CsChrimson con luz roja condujo a la extensión de la probóscide sin un estímulo dulce, lo que demuestra una activación optogenética exitosa de las neuronas GR5a. Este enfoque se ha utilizado para investigar el circuito neuronal, incluidas las neuronas sensoriales gustativas, las neuronas de proyección gustativa y las neuronas motoras de probóscide15,16.
En el enfoque 4, investigamos la activación optogenética de los comportamientos de evitación en grupos de moscas, utilizando un ensayo de laberinto de moscas optogenéticas de luz roja dirigido a las neuronas GR66a. Se colocaron moscas en la intersección de dos tubos: uno iluminado con luz roja y el otro sombreado. La expresión de CsChrimson en las neuronas GR66a desencadenó la evitación. En ausencia de luz roja, las moscas no mostraron preferencia, pero la activación de la luz roja llevó a las moscas que expresan GR66a a evitar la luz roja, lo que sugiere la activación exitosa de la vía. Los ensayos de laberinto de moscas se han utilizado ampliamente para estudiar diversas modalidades sensoriales, como la temperatura, la humedad y el olfato. Cuando se combina con la optogenética, este enfoque es poderoso para investigar tanto las conductas atractivas como las de evitación 17,18,19.
Estos métodos proporcionan un marco reproducible para estudiar la activación optogenética y la inhibición de los circuitos neuronales de Drosophila . Mediante la utilización de una combinación de diferentes canalrodopsinas y ensayos conductuales accesibles, este estudio de prueba de concepto demuestra la eficacia de la manipulación optogenética, proporcionando métodos sencillos para manipular las funciones de los circuitos neuronales con posibles aplicaciones más amplias en la investigación en neurociencia.
Protocolo
1. Cepas, cría de moscas y aspirador de moscas
- Deformaciones y mantenimiento
- Las cepas utilizadas en los experimentos incluyen HC-Gal410, Gr5a-Gal420 (Bloomington Drosophila Stock Center (BDSC): 57592), Gr66a-Gal421 (BDSC: 57670), UAS-GtACR23, UAS-CsChrimson2 (BDSC: 55136). La parte trasera vuela a 25 °C en un medio de harina de maíz estándar bajo un ciclo de luz de 12 h: 12 h de oscuridad.
NOTA: 1 L de medio de harina de maíz contiene 1 L dH2O, 79 g de dextrosa, 7,5 g de agar, 24 g de levadura en escamas, 57 g de harina de maíz, 2,1 g de metil-4-hidroxibenzoato (disuelto en 11,1 mL de etanol), 6 g de tartrato de sodio y potasio tetrahidratado y 0,9 g de cloruro de calcio.
- Las cepas utilizadas en los experimentos incluyen HC-Gal410, Gr5a-Gal420 (Bloomington Drosophila Stock Center (BDSC): 57592), Gr66a-Gal421 (BDSC: 57670), UAS-GtACR23, UAS-CsChrimson2 (BDSC: 55136). La parte trasera vuela a 25 °C en un medio de harina de maíz estándar bajo un ciclo de luz de 12 h: 12 h de oscuridad.
- Cría de moscas y preparación experimental
- Clasifique las moscas de 0 a 3 días de edad. En el momento de la experimentación, las moscas tendrán de 3 a 6 días de edad, lo que garantiza la consistencia relacionada con la edad (Figura 1A).
- Divida cada genotipo en cuatro grupos 3 días antes de realizar los experimentos: ATR de luz ambiental, ATR + de luz ambiental, ATR de luz roja o azul y ATR+ de luz roja o azul.
- Prepare una solución madre de ATR de 80 mM disolviendo ATR en etanol al 100%. Complementar el alimento con 400 μM de ATR a los grupos ATR+.
- Complementar el alimento con la misma concentración de etanol pero sin ATR a los grupos ATR.
- Rear a todos los grupos en la oscuridad22.
- Starve Gr5a>CsChrimson vuela durante 16-24 horas en viales que contienen solo tejido húmedo. Los viales ATR+ contienen 400 μM de ATR mezclado con agua, mientras que los viales ATR contienendH2O mezclado con la misma concentración de etanol.
- Aspirador de moscas
- Ensamble el aspirador de moscas (Figura 1B) usando un tubo de plástico, una mosquitera y dos pipetas de transferencia de 3 mL.
- Corte las puntas y los bulbos de las pipetas de transferencia, asegurándose de que la punta de succión de moscas permita el paso cómodo de una mosca. Este diseño permite una aspiración suave de moscas a través de la inhalación, minimizando el daño y facilitando la recolección y transferencia eficiente de moscas individuales.
- Coloque una mosquitera sobre el tubo de plástico y asegure los extremos de la pera de la pipeta al tubo con Parafilm.
2. Ensayo de preferencia posicional termotáctica optogenética de luz azul de una sola mosca
- Cepas de Drosophila y cría de moscas
- Cruce la línea de controladores HC-Gal410 con UAS-GtACR23, lo que da como resultado el genotipo experimental HC>GtACR2. Las moscas HC>GtACR2 expresan GtACR2 en las celdas de calentamiento.
NOTA: Asegúrese de utilizar el mismo número de moscas macho y hembra para cada condición.
- Cruce la línea de controladores HC-Gal410 con UAS-GtACR23, lo que da como resultado el genotipo experimental HC>GtACR2. Las moscas HC>GtACR2 expresan GtACR2 en las celdas de calentamiento.
- Configuración y ejecución de ensayos experimentales
- Alinee dos placas de acero en placas calefactoras separadas para que sus bordes se unan. Coloque un protector de lámina de plástico encima, asegurándolo con cinta adhesiva para minimizar el movimiento. Coloque un pedazo de papel blanco sobre el protector de hojas para reducir las señales de ruido de fondo (Figura 1C).
NOTA: Reemplace el papel blanco al comienzo de cada experimento o cuando esté sucio. - Coloque una cubierta de plástico transparente (2 mm de alto × 58 mm de ancho × 83 mm de largo) encima del papel blanco. Esta cubierta permite que la mosca camine libremente a la vez que evita que vuele.
- Corta un agujero en la parte inferior de una caja de espuma de poliestireno (27 cm de altura × 22 cm de ancho × 16 cm de largo) para que se adhiera a la cámara y a la luz azul (1.000 mA) a unos 12 cm por encima de la superficie experimental.
- Coloque la cámara y la luz azul para minimizar el deslumbramiento mientras habilita la activación.
NOTA: Es posible que se requiera una prueba previa para determinar el rango de activación de la luz azul. - Configure la cámara para grabar con los siguientes ajustes: lapso de tiempo de 1 s, campo estrecho, 4000 × 3000 píxeles.
- Ajuste la configuración de la placa calefactora para mantener una temperatura superficial de 25 ± 1 °C y de 31 ± 1 °C en las placas de acero respectivas.
NOTA: Para condiciones que requieren temperaturas inferiores a 25 °C, son necesarios métodos de enfriamiento alternativos, como dispositivos Peltier o hielo. Si las temperaturas de las placas de acero superan los niveles deseados, rocíe la superficie con agua destilada para lograr y mantener las condiciones requeridas. Luego, use una servilleta para absorber el exceso de humedad del protector de láminas de plástico. - Antes y después de cada prueba, controle las temperaturas con una sonda de temperatura de superficie.
NOTA: El control preciso de la temperatura es crucial, ya que las fluctuaciones pueden afectar los resultados. - Coloque la cubierta de plástico en el lado de 25 °C. Con un aspirador de moscas, suelte suavemente una sola mosca debajo de la cubierta. Coloque la caja sobre el área experimental para crear una luz tenue (<10 lux) y permita que la mosca se aclimate durante 1 minuto.
- Después del período de aclimatación, levante la caja y ajuste rápidamente la cubierta de plástico, colocándola con el centro de la cubierta alineado con el límite de la placa de acero para garantizar una cobertura uniforme de los lados de 25 °C y 31 °C.
NOTA: Durante este proceso, la temperatura del aire y la temperatura dentro de la cubierta en el lado de 31 °C aumentan a aproximadamente 27 °C en 5 s (Figura complementaria 1), suficiente para activar las celdas de calentamiento11. - Inicie la prueba encendiendo la cámara y la luz azul (20 kLux).
NOTA: No encienda la luz azul en condiciones de luz ambiental. Encienda la cámara y grabe algunos fotogramas antes de encender la luz azul en caso de movimiento. - Después de más de 2 minutos, finalice la prueba apagando la cámara y la luz. Deseche las moscas con el aspirador.
NOTA: Grabe algunos fotogramas adicionales en caso de movimiento al apagar la cámara.
- Alinee dos placas de acero en placas calefactoras separadas para que sus bordes se unan. Coloque un protector de lámina de plástico encima, asegurándolo con cinta adhesiva para minimizar el movimiento. Coloque un pedazo de papel blanco sobre el protector de hojas para reducir las señales de ruido de fondo (Figura 1C).
- Análisis conductual y estadístico
- Analice solo los datos de las moscas que permanecen en el lado de 25 °C al comienzo del ensayo.
NOTA: Deseche los datos de las moscas que inician ensayos en el lado de 31 °C, que a menudo presentan preferencias alteradas23. Descarte los ensayos con moscas que no se acerquen al borde del lado de 31 °C, asegurándose de que hayan elegido entre las temperaturas. Deseche los datos de las moscas que permanezcan inmóviles durante más de 30 s. - Analice los resultados utilizando los procedimientos descritos anteriormente23. Calcule el índice de preferencia (IP) como la relación entre la diferencia de tiempo que la mosca pasó en cada zona de temperatura y el tiempo total, como se muestra en la siguiente fórmula:
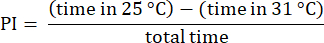
NOTA: Los detalles estadísticos de los experimentos se proporcionan en las leyendas de las figuras. El análisis de datos se realiza utilizando un software de análisis de datos adecuado.
- Analice solo los datos de las moscas que permanecen en el lado de 25 °C al comienzo del ensayo.
3. Ensayo de preferencia posicional optogenética de luz roja de una sola mosca
- Cepas de Drosophila y cría de moscas
- Cruce la línea de controladores Gr66a-Gal421 a UAS-CsChrimson2, lo que da como resultado el genotipo experimental Gr66a>CsChrimson. Las moscas Gr66a>CsChrimson expresan CsChrimson en las neuronas de sabor amargo.
NOTA: Asegúrese de utilizar el mismo número de moscas macho y hembra para cada condición.
- Cruce la línea de controladores Gr66a-Gal421 a UAS-CsChrimson2, lo que da como resultado el genotipo experimental Gr66a>CsChrimson. Las moscas Gr66a>CsChrimson expresan CsChrimson en las neuronas de sabor amargo.
- Configuración y ejecución de ensayos experimentales
- Realice el ensayo en una habitación oscura o en un entorno oscuro para garantizar una activación controlada de CsChrimson (Figura 1D).
- Coloque una videocámara a unos 45 cm por encima de la superficie experimental.
- Utilice una videocámara sin filtro de infrarrojos. Si una videocámara tiene un filtro infrarrojo interno de paso corto que bloquea longitudes de onda superiores a 700 nm, retírelo.
- Adhiera un filtro de paso largo de 830 nm sobre la lente con superpegamento para capturar las longitudes de onda infrarrojas. Este ajuste es esencial para registrar el movimiento de la mosca en condiciones de luz infrarroja.
- Coloque una fuente de luz roja24 aproximadamente a 45 cm por encima de la superficie experimental, asegurando una intensidad de luz de aproximadamente 2,5 kLux (1.000 mA).
NOTA: Se recomienda una protección ocular adecuada que pueda filtrar el láser/luz roja. Las gafas de seguridad láser ayudan a prevenir posibles daños oculares por la exposición directa a la luz roja intensa. - Use una luz infrarroja para visualizar las moscas dentro de la instalación. Mantenlo encendido durante todo el experimento.
NOTA: Evite el deslumbramiento en el área experimental causado por la luz infrarroja; El deslumbramiento puede complicar el análisis de datos. - Use pegamento para colocar un filtro infrarrojo de paso largo de 780 nm en la mitad de la cubierta de plástico.
NOTA: Utilice cualquier filtro de paso largo que bloquee longitudes de onda inferiores a 780 nm. El lado sin filtrar permite el paso de la luz roja y los infrarrojos, mientras que el lado filtrado solo permite el paso de la luz infrarroja. - Coloque un material negro mate debajo del área experimental para minimizar el ruido de fondo.
- Coloque una sola mosca debajo de una cubierta de plástico transparente (2 mm de alto × 58 mm de ancho × 83 mm de largo) con un aspirador de moscas y deje que se aclimate durante 1 minuto.
- Espere hasta que la mosca sea visible en el lado sin filtrar. Inicie la prueba encendiendo la videocámara y la luz roja.
NOTA: La videocámara es susceptible al movimiento inmediatamente después de iniciarse. Asegure bien la cámara mientras graba y enciéndala varios segundos antes de grabar para evitar movimientos aberrantes que puedan complicar el análisis. No encienda la luz roja hasta el inicio de la prueba. - Registra el movimiento de la mosca durante 1 min.
NOTA: Descarte los ensayos en los que la mosca no se acerque a la línea media o no se mueva durante más de 15 s. - Después de 1 minuto, finalice la prueba apagando la videocámara y la luz. Deseche las moscas con el aspirador.
NOTA: Grabe algunos fotogramas adicionales para evitar los efectos del movimiento al apagar la cámara.
- Análisis conductual y estadístico
- Analice los resultados utilizando los procedimientos descritos anteriormente23. Calcule el índice de preferencia (IP) como la relación entre la diferencia entre el tiempo que la mosca pasó en el área sin el filtro y el área con el filtro y el tiempo total, como se muestra en la siguiente fórmula:
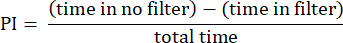
NOTA: Los detalles estadísticos de los experimentos se proporcionan en las leyendas de las figuras. El análisis de datos se realiza utilizando un software de análisis de datos adecuado.
- Analice los resultados utilizando los procedimientos descritos anteriormente23. Calcule el índice de preferencia (IP) como la relación entre la diferencia entre el tiempo que la mosca pasó en el área sin el filtro y el área con el filtro y el tiempo total, como se muestra en la siguiente fórmula:
4. Respuesta de extensión de la probóscide optogenética de luz roja
- Cepas de Drosophila y cría de moscas
- Cruce la línea de controladores Gr5a-Gal420 a UAS-CsChrimson2, lo que da como resultado el genotipo experimental denominado Gr5a>CsChrimson. Las moscas Gr5a>CsChrimson expresan CsChrimson en las neuronas receptoras del sabor dulce.
NOTA: Asegúrese de utilizar el mismo número de moscas macho y hembra para cada condición. - Las moscas hambrientas durante 16-24 h con ATR (ATR +) o sin (ATR -) antes de la prueba.
NOTA: Es posible que se requieran períodos de inanición más largos para provocar una respuesta fuerte.
- Cruce la línea de controladores Gr5a-Gal420 a UAS-CsChrimson2, lo que da como resultado el genotipo experimental denominado Gr5a>CsChrimson. Las moscas Gr5a>CsChrimson expresan CsChrimson en las neuronas receptoras del sabor dulce.
- Configuración y ejecución de ensayos experimentales
- Anestesiar las moscas enfriándolas en hielo (Figura 1E).
NOTA: Evite el contacto directo entre las moscas y el hielo. Limite el tiempo de enfriamiento a aproximadamente 1 minuto; El enfriamiento prolongado puede provocar problemas de recuperación y mortalidad. - Utilice la punta de una pipeta de 1000 μL para aplicar de 7 a 10 puntos pequeños de pegamento en los portaobjetos de vidrio.
NOTA: Pequeñas gotas de pegamento en el portaobjetos aseguran que la mosca no se sumerja y ayudan a evitar que el pegamento se pegue a su probóscide o patas. - Coloque una mosca, con el lado ventral hacia arriba, en cada punto de pegamento. Asegúrese de que el tórax y las alas entren en contacto con el pegamento para minimizar el movimiento. Ventile las alas hacia cada lado para aumentar el área de superficie adhesiva.
NOTA: Evite colocar moscas demasiado juntas, lo que puede activar inadvertidamente varias moscas durante la exposición a la luz. - Deja que el pegamento se seque durante unos 10 minutos.
- Transfiera los portaobjetos a una caja de humedad (una caja de plástico con toallas de papel húmedas) y deje que las moscas se recuperen durante 2 h.
- Coloque el portaobjetos bajo el microscopio. Use una jeringa para administrar una gota de agua para saciar las moscas, evitando las extensiones de la probóscide inducidas por la sed.
- Sostenga manualmente un puntero láser rojo para iluminar con luz roja la probóscide/cabeza de una sola mosca (700 lux) mientras observa la respuesta PER a través del microscopio.
NOTA: La protección ocular que pueda filtrar el láser/luz roja es esencial cuando se observa la luz roja a través del microscopio. - Observe y registre la extensión de la probóscide dentro de una ventana de 30 s. Anote cada mosca utilizando el siguiente sistema de registro: 0 indica que no hay extensión, 0.5 indica que hay 1-2 s de extensión, 1 indica que la extensión dura más de 3 s.
- Después de probar la extensión de la probóscide inducida por la luz, examine la respuesta a la sacarosa al 4% con una jeringa. Expulsa una gota de sacarosa en el extremo de la aguja y acércala a la probóscide de la mosca.
NOTA: Deseche los datos de las moscas que no respondan a la gota de sacarosa.
- Anestesiar las moscas enfriándolas en hielo (Figura 1E).
- Análisis conductual y estadístico
- Realizar análisis estadísticos utilizando un software de análisis de datos adecuado.
NOTA: Los detalles estadísticos de los experimentos se proporcionan en las leyendas de las figuras.
- Realizar análisis estadísticos utilizando un software de análisis de datos adecuado.
5. Ensayo de laberinto de moscas optogenéticas de luz roja
- Cepas de Drosophila y cría de moscas
- Cruce la línea de controladores Gr66a-Gal421 a UAS-CsChrimson2, lo que da como resultado el genotipo experimental Gr66a>CsChrimson. Las moscas Gr66a>CsChrimson expresan CsChrimson en las neuronas de sabor amargo.
NOTA: Asegúrese de que cada grupo contenga el mismo número de moscas macho y hembra.
- Cruce la línea de controladores Gr66a-Gal421 a UAS-CsChrimson2, lo que da como resultado el genotipo experimental Gr66a>CsChrimson. Las moscas Gr66a>CsChrimson expresan CsChrimson en las neuronas de sabor amargo.
- Montaje de laberinto de moscas
- Haga el laberinto de moscas como se muestra en la Figura 1F.
NOTA: Alternativamente, imprima en 3D los componentes del laberinto de moscas, ensamblándolos como se detalló anteriormente25. - Corta tres tubos de cultivo de plástico de 5 ml a la longitud adecuada para hacer un tubo de carga, un tubo de ensayo transparente descubierto y un tubo de ensayo cubierto con papel de aluminio. Conecte los tubos al laberinto de moscas como se muestra en la Figura 1F.
- Dependiendo del material del laberinto, corte los tubos de ensayo para garantizar la misma distancia para cada condición de prueba. Según la longitud de la cámara de retención, acorte el tubo de ensayo descubierto en un laberinto transparente, mientras acorta el tubo de ensayo cubierto con papel de aluminio si el laberinto es opaco.
- Haga el laberinto de moscas como se muestra en la Figura 1F.
- Configuración y ejecución de ensayos experimentales
- En condiciones de oscuridad o poca luz, coloque 10 machos y 10 hembras en el tubo de carga. Conecte el tubo de carga a la cámara de retención. Incline el elevador y golpee suavemente el tubo para mover las moscas a la cámara de retención.
NOTA: Baje el elevador de modo que solo quede abierta la mitad de la cámara de retención. Esta manipulación facilita la transferencia de moscas desde el tubo de carga a la cámara de retención. - Después de que las moscas se transfieran a la cámara de retención, use el elevador para bajar las moscas entre el tubo de carga y los orificios del tubo de prueba. A continuación, retire el tubo de carga.
- Coloque el laberinto de moscas a una distancia aproximada de 13 cm de la fuente de luz roja (1000 mA) sin encender la luz.
- Baje el elevador hasta que la cámara de retención se alinee con los orificios del tubo de ensayo, permitiendo que las moscas se muevan libremente entre los tubos de ensayo envueltos en papel de aluminio y los descubiertos. Al mismo tiempo, encienda la luz roja para activar CsChrimson. Asegúrese de que la intensidad de la luz roja en la superficie del tubo de ensayo descubierto sea de aproximadamente 40 kLux.
NOTA: No encienda la luz roja hasta que la cámara de retención esté bajada y alineada con los orificios del tubo de ensayo. Se recomienda una protección ocular adecuada que pueda filtrar el láser/luz roja debido al intenso brillo de la luz roja. - Las moscas eligen entre el tubo expuesto a la luz roja y el tubo sombreado durante un minuto.
- Después de 1 minuto, levante el elevador entre el tubo de carga y los orificios del tubo de prueba. Cuenta las moscas en cada tubo.
NOTA: Solo se cuentan las moscas activas y no heridas. - Limpie el elevador de moscas y el laberinto de moscas con dH2O después de cada prueba.
- En condiciones de oscuridad o poca luz, coloque 10 machos y 10 hembras en el tubo de carga. Conecte el tubo de carga a la cámara de retención. Incline el elevador y golpee suavemente el tubo para mover las moscas a la cámara de retención.
- Análisis de datos y estadísticas
- Calcule el índice de preferencia (IP) como la relación entre la diferencia en el número de moscas entre los tubos descubiertos y cubiertos y el número total de moscas, como se muestra en la siguiente fórmula:
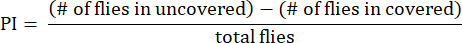
NOTA: Los detalles estadísticos de los experimentos se proporcionan en las leyendas de las figuras. El análisis de datos se realiza utilizando un software de análisis de datos adecuado
- Calcule el índice de preferencia (IP) como la relación entre la diferencia en el número de moscas entre los tubos descubiertos y cubiertos y el número total de moscas, como se muestra en la siguiente fórmula:
Resultados
Ensayo de preferencia posicional termotáctica optogenética de luz azul de una sola mosca
Se probaron cuatro condiciones: luz ambiental sin suplementación de ATR (luz de la habitación, ATR -), luz de la habitación con suplementación de ATR (luz de la habitación, ATR +), luz azul sin suplementación de ATR (azul, ATR -) y luz azul con suplementación de ATR (azul, ATR +). Las tres primeras condiciones sirvieron como controles. En los experimentos de control, las ...
Discusión
La manipulación optogenética ha transformado el campo de la neurociencia al permitir un control preciso de los circuitos neuronales con exactitud espacio-temporal27. Un circuito neuronal incluye poblaciones de neuronas interconectadas por sinapsis, que realizan funciones específicas tras la activación. Se ha completado el conectoma del cerebro completo de Drosophila, que ofrece una visión completa de las vías sinápticas dentro del cerebro de Dr...
Divulgaciones
Los autores declaran que no existen conflictos de intereses con respecto a la publicación de este artículo. Todos los autores han revelado cualquier conflicto potencial y afirman que no tienen relaciones financieras o personales que puedan influir en el trabajo presentado en este estudio.
Agradecimientos
Los diagramas esquemáticos de todas las figuras se crearon con Biorender.com. Este trabajo fue apoyado por NIH R01GM140130 (https://www.nigms.nih.gov/) a L.N. Los financiadores no participaron en el diseño del estudio, la recopilación y el análisis de datos, la decisión de publicación ni la preparación del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 1000 mA LED driver | Luxeon Star | 3021-D-E-1000 | |
| 5 mL VWR Culture Tubes, Plastic, with Dual-Position Caps | VWR | 60818-664 | |
| 780 Longpass Filter / IR 780 nm 100 mm x 100 mm | Lee Filters | BH #LE8744 | Cut to approximately 47 x 100 fit the plastic cover |
| Agfabric 6.5 ft. x 15 ft. Insect Bug Netting Garden Net for Protecting Plants Vegetables Flowers Fruits | The Home Depot | EIBNW6515 | |
| All trans retinal | Sigma-Aldrich | 116-31-4 | |
| Aluminum Plate (30.5 cm x 30.5 cm x 0.6 cm) | Amazon | purchased from Amazon | |
| Black Plastic Box | LI-COR | 929-97101 | |
| CALCIUM CHLORIDE ANHYDRO 25GR | Thermo Fisher Scientific | AC297150250 | |
| CX405 Handycam with Exmor R CMOS sensor | SONY | HDR-CX405 | |
| Elmer’s “School Glue” | Elmer | ||
| Ethyl alcohol, Pure (200 Proof) | Sigma-Aldrich | E7023 | |
| Fisherbrand Isotemp Hot Plate Stirrer | Fisher Scientific | SP88850200 | |
| Fly line: Gr5a-Gal4 | Bloomington Drosophila Stock Center | 57592 | |
| Fly line: Gr66a-Gal4 | Bloomington Drosophila Stock Center | 57670 | |
| Fly line: HC-Gal4 (II) | Dr. Marco Gallio Lab | A kind gift | |
| Fly line: UAS-CsChrimson | Bloomington Drosophila Stock Center | 55136 | |
| Fly line: UAS-GtACR2/TM6B | Dr. Quentin Gaudry Lab | A kind gift | |
| Flystuff 62-101 Yellow Cornmeal (11.3 Kg), Yellow, 11.3 Kg/Unit | Genesee Scientific | 62-101 | |
| Flystuff 62-107 Inactive Dry Yeast, 10 Kg, Nutritional Flake, 10 Kg/Unit | Genesee Scientific | 62-107 | |
| Flystuff 66-103 Nutri-Fly Drosophila Agar, Gelidium, 100 Mesh, 5 Kg (11.02 lbs)/Unit | Genesee Scientific | 66-103 | |
| FreeMascot OD 8+ 190 nm–420 nm / 600 nm–1100 nm Wavelength Violet/Red/Infrared Laser Safety Glasses | FreeMascot | B08LGMQ65S | purchased from Amazon |
| GoPro Hero8 Black | GoPro | 6365359 | |
| LEE Filters 100×100 mm Infra Red #87 Infrared Polyester Filter | B&H Photo | LE8744 | |
| Longpass Filter, Colored Glass, 50.8 x 50.8 mm, 830 nm Cut-on, RG830 | Newport | FSQ-RG830 | |
| Methyl 4-hydroxybenzoate, 99%, Thermo Scientific Chemicals | Thermo Fisher Scientific | 126960025 | |
| MicroWell Mini Tray 60 Well, Low Profile NS PS | Thermal Scientific | NUNC 439225 | The lids are used as the "plastic cover" |
| Olympus Plastics 24-160RS, 1000 µL Olympus Ergonomic Pipet Tips Low Binding, Racked, Sterile, 8 Racks of 96 Tips/Unit | Eppendorf | 24-160RS | |
| Parafilm M Sealing Film | Heathrow Scientific | HS234526B | 4 in x 125 feet |
| Potassium chloride, ACS, 99.0-100.5%, | Thermo Fisher Scientific | AA1159530 | |
| Prism | GraphPad | Version 9 | data analysis software |
| Samco Graduated Transfer Pipettes | Thermo Fisher Scientific | 225 | 3 mL |
| Slides | Fisher Scientific | 12-544-2 | 5 mm x 75 mm x 1.0 mm |
| Stereo microscope | OLYMPUS | CZ61 | |
| Styrofoam box (27 cm height × 22 cm width × 16 cm length) | |||
| Sucrose | Fisher Scientific | 225911 | |
| Surface temperature probe | Fluke | 80PK-3A | |
| Syringe | BD Integra | 305270 | |
| Tate & Lyle 457 Dextrose, Tate & Lyle, Pow, Tate & Lyle 457 Dextrose, Tate & Lyle, Powder, 50 lbs/Unit | Genesee Scientific | 62-113 | |
| Traceable Calibrated Big-Digit Thermocouple Thermometer | Traceable by cple-parmer | UX-91210-07 | Fisherbrand Traceable BigDigit Type K Thermometer |
| Triple blue LED starboard | LEDSupply | 07007-PB000-D | 470 nm |
| Triple red LED starboard | LEDSupply | 07007-PD000-F | 627 nm |
| Tygon PVC Clear Tubing 1/4" ID, 3/8" OD, 5 ft. Length | McMaster Carr Supply Company | 6516T21 | |
| Univivi IR Illuminator, 850nm 12 LEDs Wide Angle IR Illuminator for Night Vision | Univivi | 4331910725 | |
| Wakefield Thermal 25.4 mm Round Heatsink Star LED Board - 882-100AB | Wakefield-Vette | 882-100AB | |
| Wireless Presenter | DinoFire Store | B01410YNAM | purchased from Amazon |
Referencias
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in neural systems. Neuron. 71 (1), 9-34 (2011).
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nat Methods. 11 (3), 338-346 (2014).
- Mauss, A. S., Busch, C., Borst, A. Optogenetic neuronal silencing in drosophila during visual processing. Sci Rep. 7 (1), 13823 (2017).
- Govorunova, E. G., Sineshchekov, O. A., Janz, R., Liu, X., Spudich, J. L. Neuroscience. Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science. 349 (6248), 647-650 (2015).
- Castaneda, A. N., et al. Functional labeling of individualized postsynaptic neurons using optogenetics and trans-tango in drosophila (flipsot). PLoS Genet. 20 (3), e1011190 (2024).
- Fischer, F. P., et al. Drosophila melanogaster as a versatile model organism to study genetic epilepsies: An overview. Front Mol Neurosci. 16, 1116000 (2023).
- Aragon, M. J., et al. Multiphoton imaging of neural structure and activity in drosophila through the intact cuticle. Elife. 11, e69094 (2022).
- Zhang, W., Ge, W., Wang, Z. A toolbox for light control of drosophila behaviors through channelrhodopsin 2-mediated photoactivation of targeted neurons. Eur J Neurosci. 26 (9), 2405-2416 (2007).
- Kono, M., Goletz, P. W., Crouch, R. K. 11-cis- and all-trans-retinols can activate rod opsin: Rational design of the visual cycle. Biochemistry. 47 (28), 7567-7571 (2008).
- Gallio, M., Ofstad, T. A., Macpherson, L. J., Wang, J. W., Zuker, C. S. The coding of temperature in the drosophila brain. Cell. 144 (4), 614-624 (2011).
- Ni, L., et al. A gustatory receptor paralogue controls rapid warmth avoidance in drosophila. Nature. 500 (7464), 580-584 (2013).
- Weiss, L. A., Dahanukar, A., Kwon, J. Y., Banerjee, D., Carlson, J. R. The molecular and cellular basis of bitter taste in drosophila. Neuron. 69 (2), 258-272 (2011).
- Ling, F., Dahanukar, A., Weiss, L. A., Kwon, J. Y., Carlson, J. R. The molecular and cellular basis of taste coding in the legs of drosophila. J Neurosci. 34 (21), 7148-7164 (2014).
- Dethier, V. G. . The Hungry Fly: A Physiological Study of the Behavior Associated with Feeding. , (1976).
- Shiu, P. K., Sterne, G. R., Engert, S., Dickson, B. J., Scott, K. Taste quality and hunger interactions in a feeding sensorimotor circuit. Elife. 11, e79887 (2022).
- Kim, H., Kirkhart, C., Scott, K. Long-range projection neurons in the taste circuit of drosophila. Elife. 6, e23386 (2017).
- Sayeed, O., Benzer, S. Behavioral genetics of thermosensation and hygrosensation in drosophila. Proc Natl Acad Sci U S A. 93 (12), 6079-6084 (1996).
- Coya, R., Martin, F., Calvin-Cejudo, L., Gomez-Diaz, C., Alcorta, E. Validation of an optogenetic approach to the study of olfactory behavior in the t-maze of drosophila melanogaster adults. Insects. 13 (8), 662 (2022).
- Chu, L. A., Tai, C. Y., Chiang, A. S. Thirst-driven hygrosensory suppression promotes water seeking in drosophila. Proc Natl Acad Sci U S A. 121 (34), e2404454121 (2024).
- Chyb, S., Dahanukar, A., Wickens, A., Carlson, J. R. Drosophila gr5a encodes a taste receptor tuned to trehalose. Proc Natl Acad Sci U S A. 100 (Suppl 2), 14526-14530 (2003).
- Dunipace, L., Meister, S., Mcnealy, C., Amrein, H. Spatially restricted expression of candidate taste receptors in the drosophila gustatory system. Curr Biol. 11 (11), 822-835 (2001).
- Ratnayake, K., et al. Blue light excited retinal intercepts cellular signaling. Sci Rep. 8 (1), 10207 (2018).
- Huda, A., Omelchenko, A. A., Vaden, T. J., Castaneda, A. N., Ni, L. Responses of different drosophila species to temperature changes. J Exp Biol. 225 (11), jeb243708 (2022).
- Tyrrell, J. J., Wilbourne, J. T., Omelchenko, A. A., Yoon, J., Ni, L. Ionotropic receptor-dependent cool cells control the transition of temperature preference in drosophila larvae. PLoS Genet. 17 (4), e1009499 (2021).
- Fu, Z., Huda, A., Kimbrough, I. F., Ni, L. Using drosophila two-choice assay to study optogenetics in hands-on neurobiology laboratory activities. J Undergrad Neurosci Educ. 22 (1), A45-A50 (2023).
- Joseph, R. M., Heberlein, U. Tissue-specific activation of a single gustatory receptor produces opposing behavioral responses in drosophila. Genetics. 192 (2), 521-532 (2012).
- Riemensperger, T., Kittel, R. J., Fiala, A. Optogenetics in drosophila neuroscience. Methods Mol Biol. 1408, 167-175 (2016).
- Dorkenwald, S., et al. Neuronal wiring diagram of an adult brain. Nature. 634 (8032), 124-138 (2024).
- Schlegel, P., et al. Whole-brain annotation and multi-connectome cell typing of drosophila. Nature. 634 (8032), 139-152 (2024).
- Talay, M., et al. Transsynaptic mapping of second-order taste neurons in flies by trans-tango. Neuron. 96 (4), 783-795.e4 (2017).
- Shiraiwa, T., Carlson, J. R. Proboscis extension response (per) assay in drosophila. J Vis Exp. (3), e193 (2007).
- Pulver, S. R., Hornstein, N. J., Land, B. L., Johnson, B. R. Optogenetics in the teaching laboratory: Using channelrhodopsin-2 to study the neural basis of behavior and synaptic physiology in drosophila. Adv Physiol Educ. 35 (1), 82-91 (2011).
- Titlow, J. S., Johnson, B. R., Pulver, S. R. Light activated escape circuits: A behavior and neurophysiology lab module using drosophila optogenetics. J Undergrad Neurosci Educ. 13 (3), A166-A173 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados