Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Drosophila melanogaster'de Nöral Devrelerin Optogenetik Manipülasyonu için Davranışsal Testler
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu makale, belirli nöronları aktive etmek ve susturmak için CsChrimson ve GtACR2 kullanarak Drosophila melanogaster'de optogenetik manipülasyon yöntemlerini sunmaktadır. Termotaktik ve tat davranışlarını keşfetmek için optogenetiği kullanmak ve bu süreçleri yöneten altta yatan nöral mekanizmalar hakkında bilgi sağlamak için dört deney tanımlanmıştır.
Özet
Optogenetik, sinirbilimde temel bir teknik haline gelmiştir ve ışık stimülasyonu yoluyla nöronal aktivitenin hassas kontrolünü sağlar. Bu çalışma, Drosophila melanogaster'de optogenetik yöntemlerin uygulanması için uygulaması kolay kurulumları tanıtmaktadır. İki optogenetik araç, kırmızı ışıkla aktive edilen bir katyon kanalı olan CsChrimson ve mavi ışıkla aktive edilen bir anyon kanalı olan GtACR2, dört deneysel yaklaşımda kullanıldı. Bu yaklaşımlardan üçü tek sinek deneylerini içerir: (1) sıcaklığa duyarlı ısıtma hücrelerini hedefleyen mavi ışıklı optogenetik termotaktik konumsal tercih testi, (2) acı algılama nöronlarını aktive eden kırmızı ışıklı optogenetik konumsal tercih testi ve (3) tatlı algılayan nöronları aktive eden bir hortum uzatma yanıtı testi. Dördüncü yaklaşım (4), birden fazla sinek kullanarak kaçınma davranışlarını değerlendirmek için bir sinek labirenti kurulumudur. Nöral aktiviteyi zamansal ve mekansal olarak manipüle etme yeteneği, duyusal işleme ve karar verme konusunda güçlü içgörüler sunar ve optogenetiğin nöral işlev bilgimizi ilerletme potansiyelinin altını çizer. Bu yöntemler, belirli nöral yolların ve bunların davranışsal sonuçlarının anlaşılmasını geliştirmek için sinirbilimde gelecekteki araştırmalar için erişilebilir ve sağlam bir çerçeve sağlar.
Giriş
Optogenetik, sinirbilimde optik ve genetiği birleştiren, ışık stimülasyonu yoluyla nöral aktivite üzerinde hassas, invaziv olmayan kontrol sağlayan güçlü bir teknik olarak ortaya çıkmıştır1. Yaygın olarak kullanılan bir model organizma olan Drosophila melanogaster'de, optogenetik araçlar, belirli nöronların aktivasyonunu ve inhibisyonunu sağlayarak araştırmacıların nöral devreleri modüle etmesine olanak tanır. Kullanılan araçlar arasında CsChrimson ve GtACR (Guillardia theta anyon kanal rhodopsins) nöronal hedefleme için tamamlayıcı yaklaşımlar sağlar. Yeşil alglerden kırmızı ışığa duyarlı bir katyon kanalı olan CsChrimson channelrhodopsin, kırmızı ışığa maruz kaldığında depolarizasyon yoluyla nöronal aktivasyonu kolaylaştırır ve yaklaşık 590nm2'de tepe aktivasyonu sağlar. CsChrimson, önceki channelrhodopsinlerden daha iyi doku penetrasyonu sunar ve Drosophila çalışmalarındaışığa bağlı davranışsal artefaktları azaltır 2. Buna karşılık, GtACR2 gibi varyantları içeren GtACR, hiperpolarizasyon 3,4 yoluyla nöronları susturan ışık kapılı bir klorür kanalıdır. GtACR2 anyonları iletir ve 470 nm4 civarında bir tepe aktivasyonu ile mavi ışıkla aktive edilir. CsChrimson ve GtACR2, farklı dalga boylarındaki ışıkla aktive edilir ve çapraz aktivasyon olmadan nöronal aktivitenin hassas ve bağımsız kontrolünü sağlar5.
Drosophila, maliyet etkinliği, yetiştirme kolaylığı ve çekici ve kaçınma davranışları da dahil olmak üzere çevresel uyaranlara karşı güçlü davranışsal tepkileri nedeniyle sinirbilim araştırmaları için etkili bir modeldir6. Küçük boyutu ve yarı saydam kütikülü, ışığın, özellikle uzun dalga boylu kırmızı ışığın penetrasyonunu artırarak verimli optogenetik manipülasyonu mümkün kılar 7,8. Drosophila hücreleri, channelrhodopsinlerin işlevselliği için çok önemli bir kofaktör olan yeterli retinal üretemezken, diyetlerine retinal eklemek bu sınırlamayı telafi ederek optogenetik araçların etkili aktivasyonunu sağlar9.
Drosophila'da optogenetik manipülasyonun etkilerini araştırmak için, her biri tek sinek tahlillerinden grup temelli değerlendirmelere kadar kaçınma veya çekici tepkileri değerlendirmek için farklı modaliteler kullanan farklı nöral devreleri ve davranışları hedefleyen dört deneyi açıklıyoruz. Drosophila'daki ısıtma hücreleri (HC), aristada bulunan ve sıcaklık artışlarınayanıt veren termosensör nöronlardır 10. Bu nöronlar, kaçınma davranışını tetikleyen ve sinekleri ısı kaynaklarından uzaklaştıran ısıya duyarlı iyon kanallarını ifade eder10,11. Yaklaşım 1'de, HC nöronlarını manipüle etmek için tek sinekli mavi ışık optogenetik termotaktik konumsal tercih testi kullandık. Bu nöronlarda GtACR2'yi eksprese ederek, mavi ışığa maruz kaldıklarında aktivitelerini inhibe ettik. Sinekler iki sıcaklık seçeneğine maruz bırakıldı: 25 ° C ve 31 ° C. Oda ışığı altında, sinekler 31 °C tarafından kaçındı ve tipik bir termotaktik tepki gösterdi. Bununla birlikte, GtACR2'nin mavi ışık aktivasyonu HC nöronlarını susturdu. Sonuç olarak, sinekler önemli bir sıcaklık tercihi göstermedi, bu da başarılı optogenetik inhibisyon olduğunu düşündürdü. Duyusal nöronların işlevini değerlendirmeye ek olarak, aşağı akış duyusal nöronlarda GtACR2 ekspresyonu, belirli duyusal modaliteler için gerekli nöral devreleri incelemek için benzer optogenetik manipülasyonları mümkün kılar5.
Drosophila'daki tat reseptörü GR66a, hortumun distal ucundaki labial palplarda ve bacaklarda eksprese edilir ve acı tat tespitinearacılık eder 12,13. Bu nöronlar, acı maddelere tepki olarak kaçınma davranışlarını tetikler. Yaklaşım 2'de, GR66a eksprese eden nöronları manipüle etmek için tek sinek kırmızı ışık optogenetik konumsal tercih testi kullandık. Bu nöronlarda CsChrimson'u eksprese ederek, kırmızı ışığa maruz kaldıklarında onları aktive ettik. Sinekler, bir yarısı kırmızı ışığa maruz kalacak ve diğer yarısı kırmızı ışığı filtreleyecek şekilde bir arenaya yerleştirildi. Kırmızı ışığın yokluğunda, sinekler tercih göstermedi. Bununla birlikte, CsChrimson'un kırmızı ışık aktivasyonu, acı algılayan nöronları uyararak, aydınlatılmış alandan önemli ölçüde kaçınılmasına neden oldu ve GR66a nöronlarının başarılı optogenetik aktivasyonunu doğruladı. Kaçınma davranışı5 için yeterli olan ısıtma hücrelerinin aşağı akış devrelerini tanımlamak için benzer yaklaşımlar kullanılmıştır.
Yaklaşım 3'te iştah açıcı davranışın optogenetik aktivasyonuna odaklandık. Labellum ve bacaklardaki tat duyusunda bulunan GR5a eksprese eden nöronlar, şekerleri algılar ve beslenme davranışını yönlendirir. Bu nöronların aktivasyonu, hortum uzatma yanıtını (PER) tetikler14. GR5a nöronlarını aktive etmek için kırmızı ışıkta optogenetik hortum uzatma yanıtı testi kullandık. Bu nöronlarda CsChrimson eksprese ederek, onları kırmızı ışıkla uyardık. Sinekler, oda ışığı koşullarında hortumlarını uzatmadılar. Bununla birlikte, CsChrimson'un kırmızı ışık aktivasyonu, tatlı bir uyaran olmadan hortum uzamasına yol açtı ve GR5a nöronlarının başarılı optogenetik aktivasyonunu gösterdi. Bu yaklaşım, tat alma duyu nöronları, tat projeksiyon nöronları ve hortum motor nöronları dahil olmak üzere nöral devreyi araştırmak için kullanılmıştır15,16.
Yaklaşım 4'te, GR66a nöronlarını hedefleyen kırmızı ışıklı bir optogenetik sinek labirent testi kullanarak, sinek gruplarında kaçınma davranışlarının optogenetik aktivasyonunu araştırdık. Sinekler iki tüpün kesişme noktasına yerleştirildi: biri kırmızı ışıkla aydınlatılmış, diğeri gölgeli. GR66a nöronlarındaki CsChrimson ekspresyonu kaçınmayı tetikledi. Kırmızı ışığın yokluğunda, sinekler hiçbir tercih göstermedi, ancak kırmızı ışık aktivasyonu, GR66a eksprese eden sineklerin kırmızı ışıktan kaçınmasına yol açtı ve bu da yolun başarılı bir şekilde aktive edildiğini düşündürdü. Sinek labirent deneyleri, sıcaklık, nem ve koku alma dahil olmak üzere çeşitli duyusal modaliteleri incelemek için yaygın olarak kullanılmaktadır. Optogenetik ile birleştirildiğinde, bu yaklaşım hem çekici hem de kaçınma davranışlarını araştırmak için güçlüdür 17,18,19.
Bu yöntemler, Drosophila nöral devrelerinin optogenetik aktivasyonunu ve inhibisyonunu incelemek için tekrarlanabilir bir çerçeve sağlar. Farklı channelrhodopsinlerin ve erişilebilir davranışsal tahlillerin bir kombinasyonunu kullanarak, bu kavram kanıtı çalışması, optogenetik manipülasyonun etkinliğini göstermekte ve sinirbilim araştırmalarında potansiyel daha geniş uygulamalarla nöral devre fonksiyonlarını manipüle etmek için basit yöntemler sunmaktadır.
Protokol
1. Suşlar, sinek yetiştirme ve sinek aspiratörü
- Suşlar ve bakım
- Deneylerde kullanılan suşlar arasında HC-Gal410, Gr5a-Gal420 (Bloomington Drosophila Stok Merkezi (BDSC): 57592), Gr66a-Gal421 (BDSC: 57670), UAS-GtACR23, UAS-CsChrimson2 (BDSC: 55136) bulunur. Arka, 12 saatlik ışık: 12 saatlik karanlık döngü altında standart bir mısır unu ortamında 25 ° C'de uçar.
NOT: 1 L mısır unu ortamı 1 L dH2O, 79 g dekstroz, 7.5 g agar, 24 g pul maya, 57 g mısır unu, 2.1 g metil-4-hidroksibenzoat (11.1 mL etanol içinde çözülmüş), 6 g sodyum potasyum tartrat tetrahidrat ve 0.9 g kalsiyum klorür içerir.
- Deneylerde kullanılan suşlar arasında HC-Gal410, Gr5a-Gal420 (Bloomington Drosophila Stok Merkezi (BDSC): 57592), Gr66a-Gal421 (BDSC: 57670), UAS-GtACR23, UAS-CsChrimson2 (BDSC: 55136) bulunur. Arka, 12 saatlik ışık: 12 saatlik karanlık döngü altında standart bir mısır unu ortamında 25 ° C'de uçar.
- Sinek yetiştirme ve deneysel hazırlık
- 0 ila 3 günlük sinekleri sıralayın. Deney sırasında, sinekler 3 ila 6 günlük olacak ve yaşa bağlı tutarlılığı sağlayacaktır (Şekil 1A).
- Deney yapmadan 3 gün önce her genotipi dört gruba ayırın: oda ışığı ATR -, oda ışığı ATR +, kırmızı veya mavi ışık ATR - ve kırmızı veya mavi ışık ATR +.
- ATR'yi %100 etanol içinde çözerek 80 mM ATR stok çözeltisi hazırlayın. Yiyecekleri ATR + gruplarına 400 μM ATR ile destekleyin.
- Yiyecekleri aynı konsantrasyonda etanol ile ancak ATR olmadan ATR gruplarına takviye edin.
- Karanlıkta tüm grupları geride bırakın22.
- Starve Gr5a>CsChrimson , sadece nemli doku içeren şişelerde 16-24 saat boyunca uçar. ATR + şişeleri, su ile karıştırılmış 400 μM ATR içerirken, ATR şişeleri, aynı konsantrasyonda etanol ile karıştırılmışdH2O içerir.
- Sinek aspiratörü
- Sinek aspiratörünü (Şekil 1B) plastik boru, böcek ağı ve iki adet 3 mL transfer pipeti kullanarak monte edin.
- Transfer pipetlerinin uçlarını ve ampullerini kesin, sinek emme ucunun bir sineğin rahat geçişine izin verdiğinden emin olun. Bu tasarım, sineklerin soluma yoluyla nazikçe aspire edilmesini sağlar, zararı en aza indirir ve tek tek sineklerin verimli bir şekilde toplanmasını ve aktarılmasını kolaylaştırır.
- Plastik borunun üzerine böcek ağı örtün ve pipetin ampul uçlarını Parafilm kullanarak boruya sabitleyin.
2. Tek sinek mavi ışık optogenetik termotaktik konumsal tercih testi
- Drosophila suşları ve sinek yetiştirme
- HC-Gal410 sürücü hattını UAS-GtACR23'e çaprazlayın, böylece deneysel genotip HC>GtACR2 elde edilir. HC>GtACR2 sinekleri, ısıtma hücrelerinde GtACR2'yi eksprese eder.
NOT: Her koşul için eşit sayıda erkek ve dişi sinek kullanıldığından emin olun.
- HC-Gal410 sürücü hattını UAS-GtACR23'e çaprazlayın, böylece deneysel genotip HC>GtACR2 elde edilir. HC>GtACR2 sinekleri, ısıtma hücrelerinde GtACR2'yi eksprese eder.
- Deneysel tahlil kurulumu ve yürütülmesi
- İki çelik plakayı, kenarları birleşecek şekilde ayrı sıcak plakalar üzerine hizalayın. Hareketi en aza indirmek için üstüne plastik bir tabaka koruyucu yerleştirin ve bantla sabitleyin. Arka plan gürültüsü sinyallerini azaltmak için sayfa koruyucunun üzerine bir parça beyaz kağıt yerleştirin (Şekil 1C).
NOT: Teknik incelemeyi her deneyin başında veya kirlendiğinde değiştirin. - Beyaz kağıdın üzerine şeffaf bir plastik kapak (2 mm yükseklik × 58 mm genişlik × 83 mm uzunluk) yerleştirin. Bu örtü sineğin özgürce yürümesini sağlarken uçmasını da engeller.
- Deney yüzeyinin yaklaşık 12 cm yukarısında kameraya ve mavi ışığa (1.000 mA) yapışması için polistiren köpük kutunun (27 cm yükseklik × 22 cm genişlik × 16 cm uzunluk) altında bir delik açın.
- Etkinleştirmeyi etkinleştirirken parlamayı en aza indirmek için kamerayı ve mavi ışığı konumlandırın.
NOT: Mavi ışığın aktivasyon aralığını belirlemek için bir ön test gerekebilir. - Fotoğraf makinesini aşağıdaki ayarlarla kayıt yapacak şekilde ayarlayın: 1 sn timelapse, dar alan, 4000 × 3000 piksel.
- İlgili çelik plakalarda 25 ± 1 °C ve 31 ± 1 °C yüzey sıcaklığını korumak için sıcak plaka ayarlarını yapın.
NOT: 25 °C'nin altındaki sıcaklıkları gerektiren koşullar için Peltier cihazları veya buz gibi alternatif soğutma yöntemleri gereklidir. Çelik levhaların sıcaklıkları istenen seviyeleri aşarsa, gerekli koşulları elde etmek ve korumak için yüzeye damıtılmış su püskürtün. Ardından, plastik tabaka koruyucudaki fazla nemi emmek için bir peçete kullanın. - Her denemeden önce ve sonra, bir yüzey sıcaklığı probu kullanarak sıcaklıkları izleyin.
NOT: Dalgalanmalar sonuçları etkileyebileceğinden hassas sıcaklık kontrolü çok önemlidir. - Plastik kapağı 25 °C tarafına yerleştirin. Bir sinek aspiratörü kullanarak, kapağın altına tek bir sineği yavaşça bırakın. Loş ışık (<10 lüks) oluşturmak için kutuyu deney alanının üzerine yerleştirin ve sineğin 1 dakika boyunca alışmasına izin verin.
- Alışma süresinden sonra, kutuyu kaldırın ve 25 °C ve 31 °C kenarların eşit şekilde kaplanmasını sağlamak için kapağın merkezi çelik levha sınırıyla aynı hizada olacak şekilde konumlandırarak plastik kapağı hızlı bir şekilde ayarlayın.
NOT: Bu işlem sırasında, 31 °C tarafındaki hava sıcaklığı ve kapağın içindeki sıcaklık, 27 saniye içinde yaklaşık 5 °C'ye yükselir (Ek Şekil 1), bu da ısıtma hücrelerini11 etkinleştirmek için yeterlidir. - Kamerayı ve mavi ışığı (20 kLux) açarak denemeyi başlatın.
NOT: Oda ışığı koşullarında mavi ışığı açmayın. Hareket durumunda mavi ışığı açmadan önce kamerayı açın ve birkaç kare kaydedin. - 2 dakikadan fazla bir süre sonra kamerayı ve ışığı kapatarak denemeyi sonlandırın. Sinekleri aspiratörü kullanarak atın.
NOT: Kamerayı kapatırken hareket olması durumunda fazladan birkaç kare kaydedin.
- İki çelik plakayı, kenarları birleşecek şekilde ayrı sıcak plakalar üzerine hizalayın. Hareketi en aza indirmek için üstüne plastik bir tabaka koruyucu yerleştirin ve bantla sabitleyin. Arka plan gürültüsü sinyallerini azaltmak için sayfa koruyucunun üzerine bir parça beyaz kağıt yerleştirin (Şekil 1C).
- Davranışsal ve istatistiksel analiz
- Yalnızca denemenin başlangıcında 25 °C tarafında kalan sineklerden elde edilen verileri analiz edin.
NOT: 31 °C tarafında denemelere başlayan ve genellikle değişen tercihler sergileyen sineklerden gelen verileri atın23. 31 °C kenarının kenarına yaklaşmayan sinekleri içeren denemeleri atın ve sıcaklıklar arasında bir seçim yaptıklarından emin olun. 30 saniyeden fazla sabit kalan sineklerden gelen verileri atın. - Daha önce açıklanan prosedürleri kullanarak sonuçları analiz edin23. Aşağıdaki formülde gösterildiği gibi, sineğin her bir sıcaklık bölgesinde geçirdiği zaman farkının toplam süreye oranı olarak tercih indeksini (PI) hesaplayın:
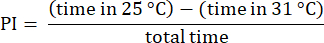
NOT: Deneyler için istatistiksel detaylar şekil açıklamalarında verilmiştir. Veri analizi, uygun veri analiz yazılımı kullanılarak gerçekleştirilir.
- Yalnızca denemenin başlangıcında 25 °C tarafında kalan sineklerden elde edilen verileri analiz edin.
3. Tek sinek kırmızı ışık optogenetik pozisyonel tercih testi
- Drosophila suşları ve sinek yetiştirme
- Gr66a-Gal421 sürücü hattını UAS-CsChrimson2'ye geçin, bu da deneysel genotip Gr66a>CsChrimson ile sonuçlanır. Gr66a>CsChrimson sinekleri, acı tat nöronlarında CsChrimson'u eksprese eder.
NOT: Her koşul için eşit sayıda erkek ve dişi sinek kullanıldığından emin olun.
- Gr66a-Gal421 sürücü hattını UAS-CsChrimson2'ye geçin, bu da deneysel genotip Gr66a>CsChrimson ile sonuçlanır. Gr66a>CsChrimson sinekleri, acı tat nöronlarında CsChrimson'u eksprese eder.
- Deneysel tahlil kurulumu ve yürütülmesi
- CsChrimson'un kontrollü aktivasyonunu sağlamak için testi karanlık bir odada veya karanlık bir ortamda gerçekleştirin (Şekil 1D).
- Bir video kamerayı deney yüzeyinin yaklaşık 45 cm yukarısına yerleştirin.
- Kızılötesi filtresi olmayan bir video kamera kullanın. Video kamerada 700 nm'den uzun dalga boylarını engelleyen dahili bir kısa geçiren kızılötesi filtre varsa bu filtreyi çıkarın.
- Kızılötesi dalga boylarını yakalamak için süper yapıştırıcı kullanarak lensin üzerine 830 nm uzun geçiren bir filtre yapıştırın. Bu ayar, kızılötesi ışık koşulları altında sinek hareketini kaydetmek için gereklidir.
- Yaklaşık 24 kLux (45 mA) ışık yoğunluğu sağlayacak şekilde deney yüzeyinin yaklaşık 2.5 cm yukarısına bir kırmızı ışık kaynağı 1,000 yerleştirin.
NOT: Kırmızı lazeri/ışığı filtreleyebilen uygun göz koruması önerilir. Lazer koruyucu gözlükler, yoğun kırmızı ışığa doğrudan maruz kalmaktan kaynaklanan olası göz hasarını önlemeye yardımcı olur. - Kurulum içindeki sinekleri görselleştirmek için kızılötesi ışık kullanın. Deney boyunca açık tutun.
NOT: Deney alanında kızılötesi ışığın neden olduğu parlamayı önleyin; Parlama, veri analizini karmaşık hale getirebilir. - Plastik kapağın yarısına 780 nm kızılötesi uzun geçiren filtre takmak için yapıştırıcı kullanın.
NOT: 780 nm'nin altındaki dalga boylarını engelleyen herhangi bir uzun geçiren filtre kullanın. Filtrelenmemiş taraf kırmızı ışığın ve kızılötesinin geçmesine izin verirken, filtrelenmiş taraf yalnızca kızılötesi ışığın geçmesine izin verir. - Arka plan gürültüsünü en aza indirmek için deney alanının altına siyah mat bir malzeme yerleştirin.
- Bir sinek aspiratörü kullanarak şeffaf plastik bir örtünün (2 mm yükseklik × 58 mm genişlik × 83 mm uzunluk) altına tek bir sinek yerleştirin ve 1 dakika boyunca alışmasını bekleyin.
- Sinek filtrelenmemiş tarafta görünene kadar bekleyin. Video kamerayı ve kırmızı ışığı açarak denemeyi başlatın.
NOT: Video kamera, başlatıldıktan hemen sonra harekete karşı hassastır. Kayıt sırasında kamerayı iyice sabitleyin ve analizi zorlaştırabilecek anormal hareketlerden kaçınmak için kayıttan birkaç saniye önce kamerayı açın. Deneme süresi başlayana kadar kırmızı ışığı açmayın. - Sineğin hareketini 1 dakika boyunca kaydedin.
NOT: Sineğin orta hatta yaklaşmadığı veya 15 saniyeden fazla hareket etmediği denemeleri atın. - 1 dakika sonra kamerayı ve ışığı kapatarak denemeyi sonlandırın. Sinekleri aspiratörü kullanarak atın.
NOT: Kamerayı kapatırken hareketin etkilerinden kaçınmak için fazladan birkaç kare kaydedin.
- Davranışsal ve istatistiksel analiz
- Daha önce açıklanan prosedürleri kullanarak sonuçları analiz edin23. Aşağıdaki formülde gösterildiği gibi, sineğin filtresiz alanda ve filtreli alanda geçirdiği süre arasındaki farkın toplam süreye oranı olarak tercih indeksini (PI) hesaplayın:
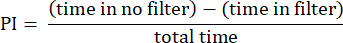
NOT: Deneyler için istatistiksel detaylar şekil açıklamalarında verilmiştir. Veri analizi, uygun veri analiz yazılımı kullanılarak gerçekleştirilir.
- Daha önce açıklanan prosedürleri kullanarak sonuçları analiz edin23. Aşağıdaki formülde gösterildiği gibi, sineğin filtresiz alanda ve filtreli alanda geçirdiği süre arasındaki farkın toplam süreye oranı olarak tercih indeksini (PI) hesaplayın:
4. Kırmızı ışık optogenetik hortum uzatma yanıtı
- Drosophila suşları ve sinek yetiştirme
- Gr5a-Gal420 sürücü hattını UAS-CsChrimson2'ye geçin, bu da Gr5a>CsChrimson olarak adlandırılan deneysel genotiple sonuçlanır. Gr5a>CsChrimson sinekleri, tatlı tat reseptör nöronlarında CsChrimson'u eksprese eder.
NOT: Her koşul için eşit sayıda erkek ve dişi sinek kullanıldığından emin olun. - Starve, testten önce ATR (ATR +) veya ATR -) olmadan 16-24 saat uçar.
NOT: Güçlü bir yanıt ortaya çıkarmak için daha uzun açlık süreleri gerekebilir.
- Gr5a-Gal420 sürücü hattını UAS-CsChrimson2'ye geçin, bu da Gr5a>CsChrimson olarak adlandırılan deneysel genotiple sonuçlanır. Gr5a>CsChrimson sinekleri, tatlı tat reseptör nöronlarında CsChrimson'u eksprese eder.
- Deneysel tahlil kurulumu ve yürütülmesi
- Anestezi yapan sinekler buz üzerinde soğuyarak hareket eder (Şekil 1E).
NOT: Sinekler ve buz arasındaki doğrudan temastan kaçının. Soğutma süresini yaklaşık 1 dakika ile sınırlayın; Uzun süreli soğutma, kurtarma sorunlarına ve ölüme neden olabilir. - Cam slaytların üzerine 7-10 küçük nokta yapıştırıcı uygulamak için 1000 μL'lik bir pipet ucunun ucunu kullanın.
NOT: Sürgü üzerindeki küçük tutkal damlaları, sineğin suya batmamasını sağlar ve yapıştırıcının hortumuna veya bacaklarına yapışmasını önlemeye yardımcı olur. - Her bir tutkal noktasına bir sineği ventral tarafı yukarı gelecek şekilde yerleştirin. Hareketi en aza indirmek için göğüs kafesi ve kanatların yapıştırıcıya temas ettiğinden emin olun. Yapışkan yüzey alanını artırmak için kanatları her iki tarafa doğru havalandırın.
NOT: Sinekleri birbirine çok yakın yerleştirmekten kaçının, bu ışığa maruz kalma sırasında yanlışlıkla birden fazla sineği harekete geçirebilir. - Tutkalın yaklaşık 10 dakika kurumasını bekleyin.
- Slaytları bir nem kutusuna (ıslak kağıt havlulu plastik bir kutu) aktarın ve sineklerin 2 saat iyileşmesine izin verin.
- Slaytı mikroskobun altına yerleştirin. Sinekleri doyurmak için bir damla su vermek için bir şırınga kullanın ve susuzluğa bağlı hortum uzantılarını önleyin.
- Mikroskopta PER yanıtını gözlemlerken tek bir sineğin hortumuna/kafasına (700 lüks) kırmızı ışık yakmak için kırmızı bir lazer işaretçiyi manuel olarak tutun.
NOT: Mikroskopta kırmızı ışığı gözlemlerken kırmızı lazeri/ışığı filtreleyebilen göz koruması çok önemlidir. - 30 sn'lik bir pencere içinde hortum uzantısını gözlemleyin ve kaydedin. Aşağıdaki kayıt sistemini kullanarak her sineği puanlayın: 0 uzatma olmadığını, 0.5 1-2 s uzatmayı, 1 uzatmanın 3 s'den fazla sürdüğünü gösterir.
- Işık kaynaklı hortum uzantısını test ettikten sonra, bir şırınga kullanarak% 4 sakaroza yanıtı inceleyin. İğnenin ucuna bir damla sakaroz atın ve sinek hortumuna yaklaştırın.
NOT: Sükroz damlacığına yanıt vermeyen sineklerden gelen verileri atın.
- Anestezi yapan sinekler buz üzerinde soğuyarak hareket eder (Şekil 1E).
- Davranışsal ve istatistiksel analiz
- Uygun veri analizi yazılımını kullanarak istatistiksel analiz yapın.
NOT: Deneyler için istatistiksel detaylar şekil açıklamalarında verilmiştir.
- Uygun veri analizi yazılımını kullanarak istatistiksel analiz yapın.
5. Kırmızı ışık optogenetik sinek labirent testi
- Drosophila suşları ve sinek yetiştirme
- Gr66a-Gal421 sürücü hattını UAS-CsChrimson2'ye geçin, bu da deneysel genotip Gr66a>CsChrimson ile sonuçlanır. Gr66a>CsChrimson sinekleri, acı tat nöronlarında CsChrimson'u eksprese eder.
NOT: Her grubun eşit sayıda erkek ve dişi sinek içerdiğinden emin olun.
- Gr66a-Gal421 sürücü hattını UAS-CsChrimson2'ye geçin, bu da deneysel genotip Gr66a>CsChrimson ile sonuçlanır. Gr66a>CsChrimson sinekleri, acı tat nöronlarında CsChrimson'u eksprese eder.
- Sinek labirenti montajı
- Sinek labirentini Şekil 1F'de gösterildiği gibi yapın.
NOT: Alternatif olarak, daha önce detaylandırıldığı gibi monte edilen sinek labirent bileşenlerini3D yazdırın 25. - Bir yükleme tüpü, üstü açık şeffaf bir test tüpü ve folyo kaplı bir test tüpü yapmak için üç adet 5 mL plastik kültür tüpünü uygun uzunluklarda kesin. Tüpleri Şekil 1F'de gösterildiği gibi sinek labirentine takın.
- Labirent malzemesine bağlı olarak, her test koşulu için eşit mesafe sağlamak için test tüplerini kesin. Tutma odasının uzunluğuna bağlı olarak, açık bir labirentte üstü açık test tüpünü kısaltın, labirent opaksa folyo kaplı test tüpünü kısaltın.
- Sinek labirentini Şekil 1F'de gösterildiği gibi yapın.
- Deneysel tahlil kurulumu ve yürütülmesi
- Karanlık veya düşük ışık koşullarında, yükleme borusuna 10 erkek ve 10 dişi yerleştirin. Yükleme borusunu tutma odasına bağlayın. Asansörü eğin ve sinekleri tutma odasına taşımak için tüpe hafifçe vurun.
NOT: Asansörü, tutma odasının sadece yarısı açık olacak şekilde indirin. Bu manipülasyon, sineklerin yükleme borusundan tutma odasına aktarılmasını kolaylaştırır. - Sinekler tutma odasına aktarıldıktan sonra, yükleme borusu ile test borusu delikleri arasındaki sinekleri indirmek için asansörü kullanın. Ardından yükleme borusunu çıkarın.
- Işığı açmadan sinek labirentini kırmızı ışık kaynağından (1000 mA) yaklaşık 13 cm uzağa yerleştirin.
- Tutma haznesi test tüpü delikleriyle aynı hizaya gelene kadar asansörü indirin, böylece sineklerin folyo ile sarılmış ve üstü açık test tüpleri arasında serbestçe hareket etmesine izin verin. Aynı anda, CsChrimson'ı etkinleştirmek için kırmızı ışığı açın. Açıkta kalan test tüpünün yüzeyindeki kırmızı ışık yoğunluğunun yaklaşık 40 kLux olduğundan emin olun.
NOT: Tutma haznesi alçaltılana ve test tüpü delikleriyle hizalanana kadar kırmızı ışığı açmayın. Kırmızı ışığın yoğun parlaklığı nedeniyle kırmızı lazeri/ışığı filtreleyebilen uygun göz koruması önerilir. - Sinekler, bir dakika boyunca kırmızı ışığa maruz kalan tüp ile gölgeli tüp arasında seçim yapar.
- 1 dakika sonra, yükleme borusu ile test borusu delikleri arasındaki asansörü kaldırın. Her tüpteki sinekleri sayın.
NOT: Sadece aktif ve yaralanmamış sinekler sayılır. - Her denemeden sonra sinek asansörünü ve sinek labirentini dH2O kullanarak temizleyin.
- Karanlık veya düşük ışık koşullarında, yükleme borusuna 10 erkek ve 10 dişi yerleştirin. Yükleme borusunu tutma odasına bağlayın. Asansörü eğin ve sinekleri tutma odasına taşımak için tüpe hafifçe vurun.
- Veri analizi ve istatistik
- Aşağıdaki formülde gösterildiği gibi, üstü açık ve üstü kapalı tüpler arasındaki sinek sayısı farkının toplam sinek sayısına oranı olarak tercih indeksini (PI) hesaplayın:
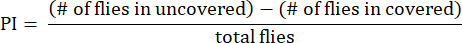
NOT: Deneyler için istatistiksel detaylar şekil açıklamalarında verilmiştir. Veri analizi, uygun veri analiz yazılımı kullanılarak gerçekleştirilir
- Aşağıdaki formülde gösterildiği gibi, üstü açık ve üstü kapalı tüpler arasındaki sinek sayısı farkının toplam sinek sayısına oranı olarak tercih indeksini (PI) hesaplayın:
Sonuçlar
Tek sinek mavi ışık optogenetik termotaktik pozisyonel tercih testi
Dört koşul test edildi: ATR takviyesi olmayan oda lambası (oda lambası, ATR -), ATR takviyesi olan oda lambası (oda lambası, ATR +), ATR takviyesi olmayan mavi ışık (mavi, ATR -) ve ATR takviyesi olan mavi ışık (mavi, ATR +). İlk üç koşul kontrol görevi gördü. Kontrol deneylerinde, sinekler 31 °C tarafından kaçındı. ATR takviyesi ile mavi ışıkta, sinekler 25 ° C ile 31 ?...
Tartışmalar
Optogenetik manipülasyon, nöral devrelerin uzay-zamansal doğrulukla hassas kontrolünü sağlayarak sinirbilim alanını dönüştürmüştür27. Bir nöral devre, aktivasyon üzerine belirli işlevleri yerine getiren, sinapslarla birbirine bağlı nöron popülasyonlarını içerir. Drosophila tüm beyin konektomu tamamlandı ve Drosophila beynindeki sinaptik yollar hakkında kapsamlı bilgiler sunuyor28,29<...
Açıklamalar
Yazarlar bu makalenin yayınlanması ile ilgili herhangi bir çıkar çatışması olmadığını beyan ederler. Tüm yazarlar olası çatışmaları açıklamış ve bu çalışmada sunulan çalışmayı etkileyebilecek hiçbir finansal veya kişisel ilişkileri olmadığını teyit etmişlerdir.
Teşekkürler
Tüm şekiller için şematik diyagramlar Biorender.com ile oluşturulmuştur. Bu çalışma NIH R01GM140130 (https://www.nigms.nih.gov/) tarafından L.N.'ye desteklenmiştir. Fon sağlayıcıların çalışma tasarımında, veri toplama ve analizinde, yayın kararında veya makale hazırlamada hiçbir rolü yoktu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1000 mA LED driver | Luxeon Star | 3021-D-E-1000 | |
| 5 mL VWR Culture Tubes, Plastic, with Dual-Position Caps | VWR | 60818-664 | |
| 780 Longpass Filter / IR 780 nm 100 mm x 100 mm | Lee Filters | BH #LE8744 | Cut to approximately 47 x 100 fit the plastic cover |
| Agfabric 6.5 ft. x 15 ft. Insect Bug Netting Garden Net for Protecting Plants Vegetables Flowers Fruits | The Home Depot | EIBNW6515 | |
| All trans retinal | Sigma-Aldrich | 116-31-4 | |
| Aluminum Plate (30.5 cm x 30.5 cm x 0.6 cm) | Amazon | purchased from Amazon | |
| Black Plastic Box | LI-COR | 929-97101 | |
| CALCIUM CHLORIDE ANHYDRO 25GR | Thermo Fisher Scientific | AC297150250 | |
| CX405 Handycam with Exmor R CMOS sensor | SONY | HDR-CX405 | |
| Elmer’s “School Glue” | Elmer | ||
| Ethyl alcohol, Pure (200 Proof) | Sigma-Aldrich | E7023 | |
| Fisherbrand Isotemp Hot Plate Stirrer | Fisher Scientific | SP88850200 | |
| Fly line: Gr5a-Gal4 | Bloomington Drosophila Stock Center | 57592 | |
| Fly line: Gr66a-Gal4 | Bloomington Drosophila Stock Center | 57670 | |
| Fly line: HC-Gal4 (II) | Dr. Marco Gallio Lab | A kind gift | |
| Fly line: UAS-CsChrimson | Bloomington Drosophila Stock Center | 55136 | |
| Fly line: UAS-GtACR2/TM6B | Dr. Quentin Gaudry Lab | A kind gift | |
| Flystuff 62-101 Yellow Cornmeal (11.3 Kg), Yellow, 11.3 Kg/Unit | Genesee Scientific | 62-101 | |
| Flystuff 62-107 Inactive Dry Yeast, 10 Kg, Nutritional Flake, 10 Kg/Unit | Genesee Scientific | 62-107 | |
| Flystuff 66-103 Nutri-Fly Drosophila Agar, Gelidium, 100 Mesh, 5 Kg (11.02 lbs)/Unit | Genesee Scientific | 66-103 | |
| FreeMascot OD 8+ 190 nm–420 nm / 600 nm–1100 nm Wavelength Violet/Red/Infrared Laser Safety Glasses | FreeMascot | B08LGMQ65S | purchased from Amazon |
| GoPro Hero8 Black | GoPro | 6365359 | |
| LEE Filters 100×100 mm Infra Red #87 Infrared Polyester Filter | B&H Photo | LE8744 | |
| Longpass Filter, Colored Glass, 50.8 x 50.8 mm, 830 nm Cut-on, RG830 | Newport | FSQ-RG830 | |
| Methyl 4-hydroxybenzoate, 99%, Thermo Scientific Chemicals | Thermo Fisher Scientific | 126960025 | |
| MicroWell Mini Tray 60 Well, Low Profile NS PS | Thermal Scientific | NUNC 439225 | The lids are used as the "plastic cover" |
| Olympus Plastics 24-160RS, 1000 µL Olympus Ergonomic Pipet Tips Low Binding, Racked, Sterile, 8 Racks of 96 Tips/Unit | Eppendorf | 24-160RS | |
| Parafilm M Sealing Film | Heathrow Scientific | HS234526B | 4 in x 125 feet |
| Potassium chloride, ACS, 99.0-100.5%, | Thermo Fisher Scientific | AA1159530 | |
| Prism | GraphPad | Version 9 | data analysis software |
| Samco Graduated Transfer Pipettes | Thermo Fisher Scientific | 225 | 3 mL |
| Slides | Fisher Scientific | 12-544-2 | 5 mm x 75 mm x 1.0 mm |
| Stereo microscope | OLYMPUS | CZ61 | |
| Styrofoam box (27 cm height × 22 cm width × 16 cm length) | |||
| Sucrose | Fisher Scientific | 225911 | |
| Surface temperature probe | Fluke | 80PK-3A | |
| Syringe | BD Integra | 305270 | |
| Tate & Lyle 457 Dextrose, Tate & Lyle, Pow, Tate & Lyle 457 Dextrose, Tate & Lyle, Powder, 50 lbs/Unit | Genesee Scientific | 62-113 | |
| Traceable Calibrated Big-Digit Thermocouple Thermometer | Traceable by cple-parmer | UX-91210-07 | Fisherbrand Traceable BigDigit Type K Thermometer |
| Triple blue LED starboard | LEDSupply | 07007-PB000-D | 470 nm |
| Triple red LED starboard | LEDSupply | 07007-PD000-F | 627 nm |
| Tygon PVC Clear Tubing 1/4" ID, 3/8" OD, 5 ft. Length | McMaster Carr Supply Company | 6516T21 | |
| Univivi IR Illuminator, 850nm 12 LEDs Wide Angle IR Illuminator for Night Vision | Univivi | 4331910725 | |
| Wakefield Thermal 25.4 mm Round Heatsink Star LED Board - 882-100AB | Wakefield-Vette | 882-100AB | |
| Wireless Presenter | DinoFire Store | B01410YNAM | purchased from Amazon |
Referanslar
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in neural systems. Neuron. 71 (1), 9-34 (2011).
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nat Methods. 11 (3), 338-346 (2014).
- Mauss, A. S., Busch, C., Borst, A. Optogenetic neuronal silencing in drosophila during visual processing. Sci Rep. 7 (1), 13823 (2017).
- Govorunova, E. G., Sineshchekov, O. A., Janz, R., Liu, X., Spudich, J. L. Neuroscience. Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science. 349 (6248), 647-650 (2015).
- Castaneda, A. N., et al. Functional labeling of individualized postsynaptic neurons using optogenetics and trans-tango in drosophila (flipsot). PLoS Genet. 20 (3), e1011190 (2024).
- Fischer, F. P., et al. Drosophila melanogaster as a versatile model organism to study genetic epilepsies: An overview. Front Mol Neurosci. 16, 1116000 (2023).
- Aragon, M. J., et al. Multiphoton imaging of neural structure and activity in drosophila through the intact cuticle. Elife. 11, e69094 (2022).
- Zhang, W., Ge, W., Wang, Z. A toolbox for light control of drosophila behaviors through channelrhodopsin 2-mediated photoactivation of targeted neurons. Eur J Neurosci. 26 (9), 2405-2416 (2007).
- Kono, M., Goletz, P. W., Crouch, R. K. 11-cis- and all-trans-retinols can activate rod opsin: Rational design of the visual cycle. Biochemistry. 47 (28), 7567-7571 (2008).
- Gallio, M., Ofstad, T. A., Macpherson, L. J., Wang, J. W., Zuker, C. S. The coding of temperature in the drosophila brain. Cell. 144 (4), 614-624 (2011).
- Ni, L., et al. A gustatory receptor paralogue controls rapid warmth avoidance in drosophila. Nature. 500 (7464), 580-584 (2013).
- Weiss, L. A., Dahanukar, A., Kwon, J. Y., Banerjee, D., Carlson, J. R. The molecular and cellular basis of bitter taste in drosophila. Neuron. 69 (2), 258-272 (2011).
- Ling, F., Dahanukar, A., Weiss, L. A., Kwon, J. Y., Carlson, J. R. The molecular and cellular basis of taste coding in the legs of drosophila. J Neurosci. 34 (21), 7148-7164 (2014).
- Dethier, V. G. . The Hungry Fly: A Physiological Study of the Behavior Associated with Feeding. , (1976).
- Shiu, P. K., Sterne, G. R., Engert, S., Dickson, B. J., Scott, K. Taste quality and hunger interactions in a feeding sensorimotor circuit. Elife. 11, e79887 (2022).
- Kim, H., Kirkhart, C., Scott, K. Long-range projection neurons in the taste circuit of drosophila. Elife. 6, e23386 (2017).
- Sayeed, O., Benzer, S. Behavioral genetics of thermosensation and hygrosensation in drosophila. Proc Natl Acad Sci U S A. 93 (12), 6079-6084 (1996).
- Coya, R., Martin, F., Calvin-Cejudo, L., Gomez-Diaz, C., Alcorta, E. Validation of an optogenetic approach to the study of olfactory behavior in the t-maze of drosophila melanogaster adults. Insects. 13 (8), 662 (2022).
- Chu, L. A., Tai, C. Y., Chiang, A. S. Thirst-driven hygrosensory suppression promotes water seeking in drosophila. Proc Natl Acad Sci U S A. 121 (34), e2404454121 (2024).
- Chyb, S., Dahanukar, A., Wickens, A., Carlson, J. R. Drosophila gr5a encodes a taste receptor tuned to trehalose. Proc Natl Acad Sci U S A. 100 (Suppl 2), 14526-14530 (2003).
- Dunipace, L., Meister, S., Mcnealy, C., Amrein, H. Spatially restricted expression of candidate taste receptors in the drosophila gustatory system. Curr Biol. 11 (11), 822-835 (2001).
- Ratnayake, K., et al. Blue light excited retinal intercepts cellular signaling. Sci Rep. 8 (1), 10207 (2018).
- Huda, A., Omelchenko, A. A., Vaden, T. J., Castaneda, A. N., Ni, L. Responses of different drosophila species to temperature changes. J Exp Biol. 225 (11), jeb243708 (2022).
- Tyrrell, J. J., Wilbourne, J. T., Omelchenko, A. A., Yoon, J., Ni, L. Ionotropic receptor-dependent cool cells control the transition of temperature preference in drosophila larvae. PLoS Genet. 17 (4), e1009499 (2021).
- Fu, Z., Huda, A., Kimbrough, I. F., Ni, L. Using drosophila two-choice assay to study optogenetics in hands-on neurobiology laboratory activities. J Undergrad Neurosci Educ. 22 (1), A45-A50 (2023).
- Joseph, R. M., Heberlein, U. Tissue-specific activation of a single gustatory receptor produces opposing behavioral responses in drosophila. Genetics. 192 (2), 521-532 (2012).
- Riemensperger, T., Kittel, R. J., Fiala, A. Optogenetics in drosophila neuroscience. Methods Mol Biol. 1408, 167-175 (2016).
- Dorkenwald, S., et al. Neuronal wiring diagram of an adult brain. Nature. 634 (8032), 124-138 (2024).
- Schlegel, P., et al. Whole-brain annotation and multi-connectome cell typing of drosophila. Nature. 634 (8032), 139-152 (2024).
- Talay, M., et al. Transsynaptic mapping of second-order taste neurons in flies by trans-tango. Neuron. 96 (4), 783-795.e4 (2017).
- Shiraiwa, T., Carlson, J. R. Proboscis extension response (per) assay in drosophila. J Vis Exp. (3), e193 (2007).
- Pulver, S. R., Hornstein, N. J., Land, B. L., Johnson, B. R. Optogenetics in the teaching laboratory: Using channelrhodopsin-2 to study the neural basis of behavior and synaptic physiology in drosophila. Adv Physiol Educ. 35 (1), 82-91 (2011).
- Titlow, J. S., Johnson, B. R., Pulver, S. R. Light activated escape circuits: A behavior and neurophysiology lab module using drosophila optogenetics. J Undergrad Neurosci Educ. 13 (3), A166-A173 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır