14.9 : 勒夏特列原理(LeChatelier's Principle) :温度变化
与质量作用定律一致,浓度变化所强调的平衡将转变为重新建立平衡,而不会改变平衡常数的值, K。 当平衡因温度变化而变化时, 然而,它以不同的相对成分重新建立,显示了平衡常数的不同值。
要了解这种现象,请考虑基本反应:
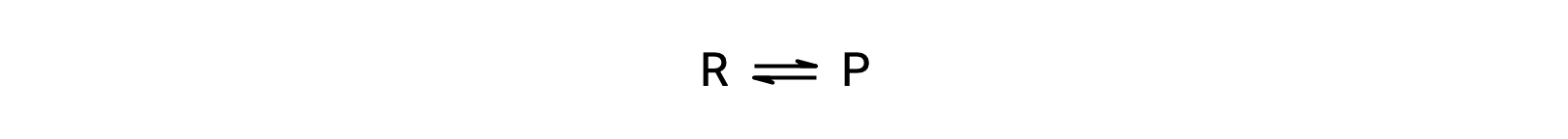
由于这是一种基本反应,正向和反向的速率定律可以直接从平衡方程的化学计量法中得出:
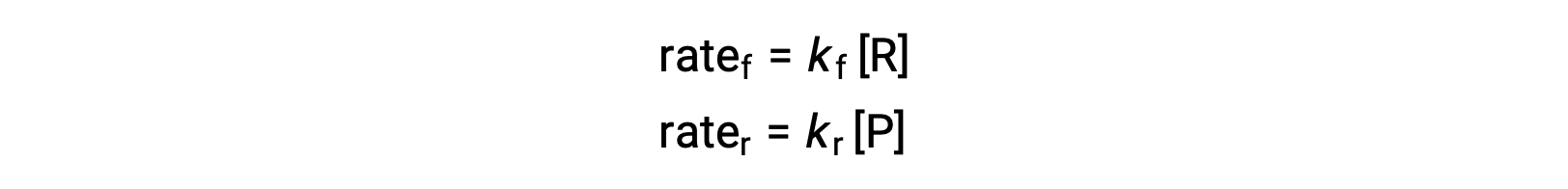
当系统处于平衡状态时,
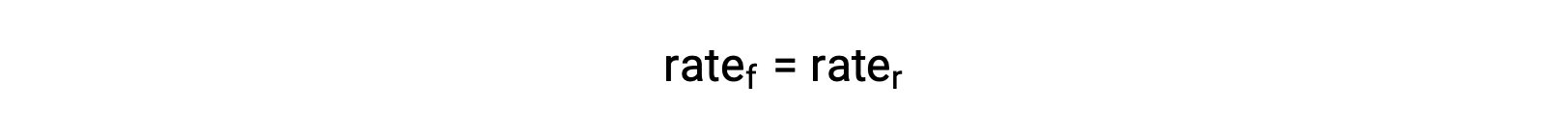
将速率定律替换为这一相等,并重新排列
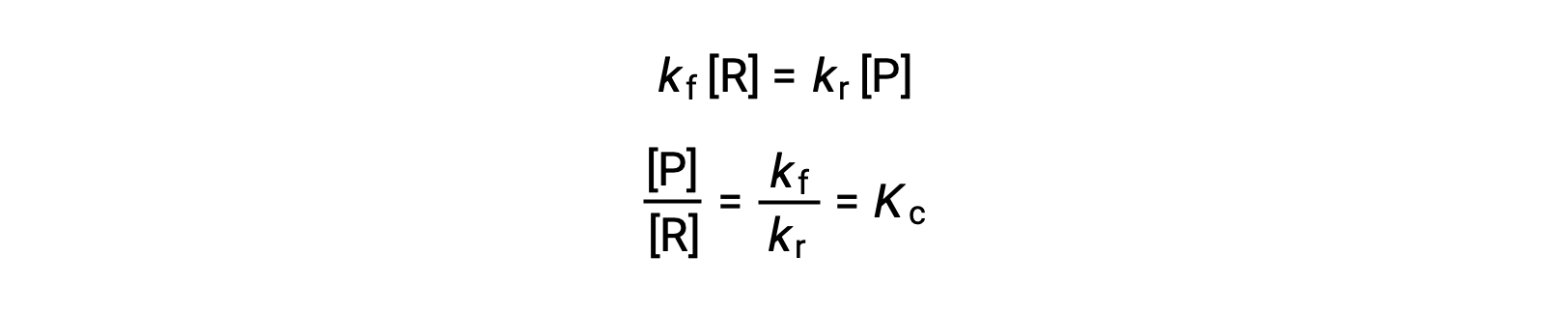
平衡常数可以表示为正向和反向反应的率值常量的数学函数。 由于率值常量随阿伦尼乌斯方程所述的温度而变化,因此平衡常量也会随温度变化而变化 (假设率值常量受温度变化影响到不同范围)。 对于涉及多步反应机理的更复杂的反应,率值中步骤的平衡常数和机理常数之间存在类似但更复杂的数学关系。 无论反应的复杂程度如何,其平衡常数的温度依赖性仍然存在。
通过考虑到反应的焓变化,最方便的方法是预测温度变化时的平衡。 例如, Haber 过程产生的氨是放热 (热产生) 过程:
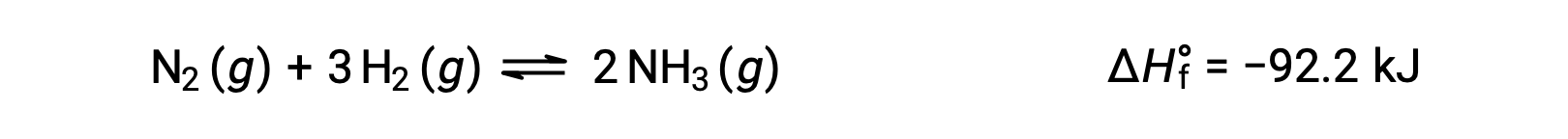
为了应用 勒夏特列原理(Le Chatelier's Principle) , 热 , q 可以被视为生成物:
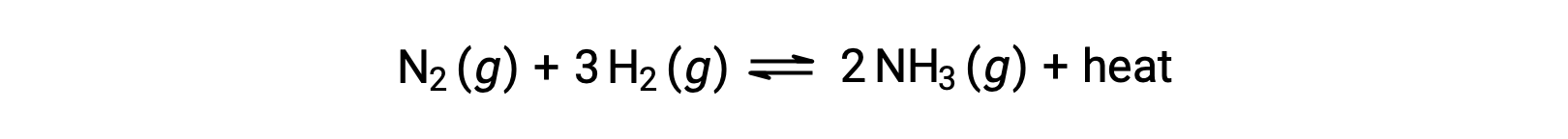
升高系统温度就像增加生成物的数量一样,因此平衡将向左移动。 降低系统温度同样会导致平衡向右移动。 对于吸热过程,热量被视为反应的反应物,因此观察到相反的温度依赖性。
本文改编自 Openstax, 化学 2e, 第13.3节:平衡位移: Le Châtelier ’ s principle。
来自章节 14:

Now Playing
14.9 : 勒夏特列原理(LeChatelier's Principle) :温度变化
化学平衡
29.1K Views

14.1 : 动态平衡
化学平衡
50.2K Views

14.2 : 平衡常数
化学平衡
46.6K Views

14.3 : 气态反应和非均相反应的平衡
化学平衡
24.6K Views

14.4 : 计算平衡常数
化学平衡
30.9K Views

14.5 : 反应商
化学平衡
48.0K Views

14.6 : 计算平衡浓度
化学平衡
47.4K Views

14.7 : 勒夏特列原理(Le Chatelier's Principle) :浓度变化
化学平衡
57.4K Views

14.8 : 勒夏特列原理(Le Chatelier's Principle) :体积变化 (压力)
化学平衡
34.1K Views

14.10 : 未知数小x假设
化学平衡
45.9K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。