14.9 : Principe de le Châtelier : modification de la température
Conformément à la loi d'action de masse, un équilibre contraint par une modification de la concentration se déplace pour rétablir l'équilibre sans modification de la valeur de la constante d'équilibre, K. Lorsqu'un équilibre se déplace en réponse à un changement de température, cependant, il est rétabli avec une composition relative différente qui présente une valeur différente de la constante d'équilibre.
Pour comprendre ce phénomène, considérons la réaction élémentaire :
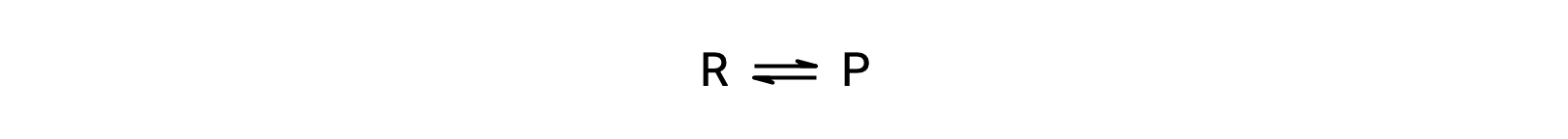
Comme il s'agit d'une réaction élémentaire, les lois de vitesse pour le sens direct et le sens inverse peuvent être déduites directement à partir de la stœchiométrie de l'équation équilibrée :
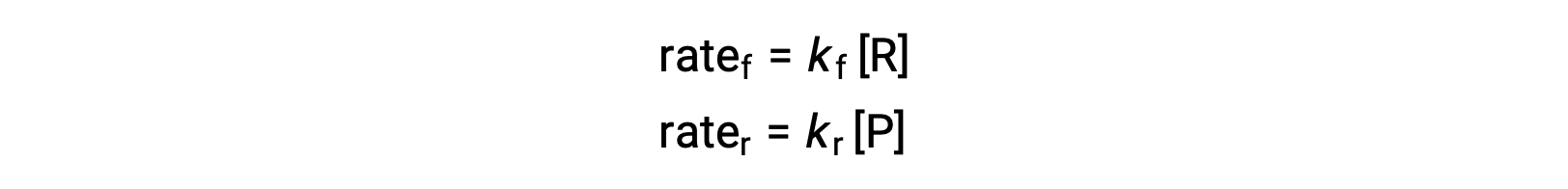
Lorsque le système est à l'équilibre,
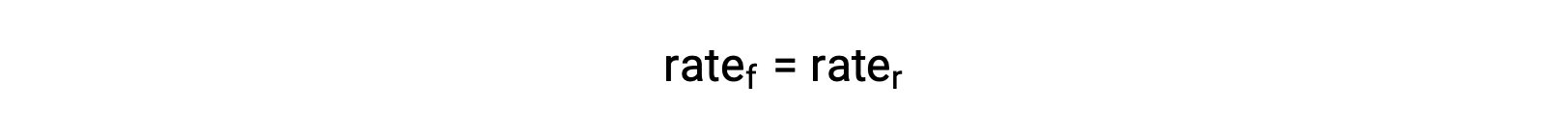
Le remplacement des lois de vitesse dans cette égalité et la réorganisation donne
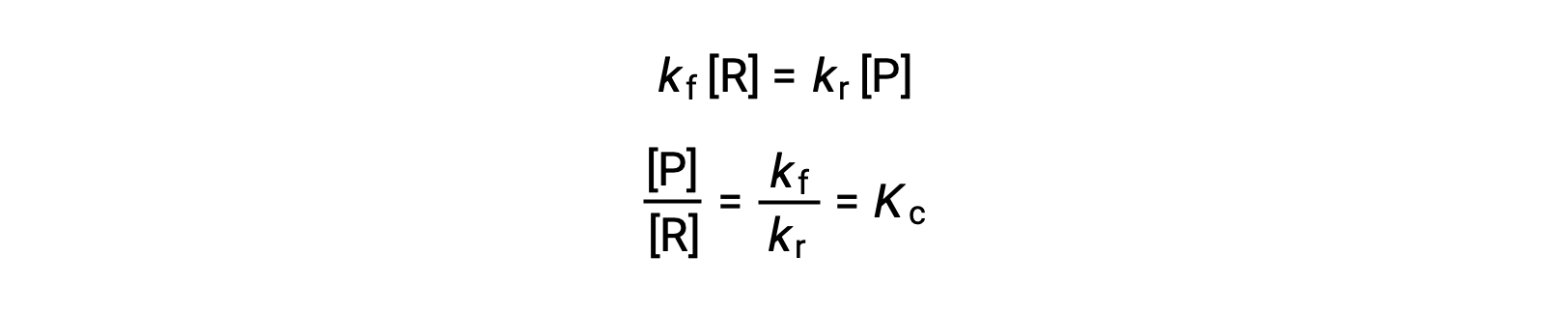
La constante d'équilibre peut être exprimée comme une fonction mathématique des constantes de vitesse pour les réactions directes et inverses. Puisque les constantes de vitesse varient avec la température comme le décrit l'équation d'Arrhénius, il est logique que la constante d'équilibre varie également avec la température (en supposant que les constantes de vitesse sont impactées à des degrés différents par le changement de température). Pour les réactions plus complexes impliquant des mécanismes de réaction en plusieurs étapes, il existe une relation mathématique similaire mais plus complexe entre la constante d'équilibre et les constantes de vitesse des étapes du mécanisme. Quelle que soit la complexité de la réaction, la dépendance de sa constante d'équilibre envers la température persiste.
Prédire le déplacement qu'un équilibre subira en réponse à une modification de la température est réalisé plus aisément en considérant la variation d'enthalpie de la réaction. Par exemple, la formation de l’ammoniac par le procédé Haber est un processus exothermique (produisant de la chaleur) :
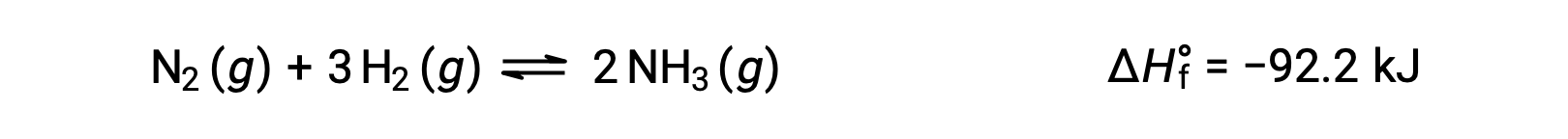
Afin d’appliquer le principe de Le Châtelier, la chaleur, q, peut être considérée comme un produit :
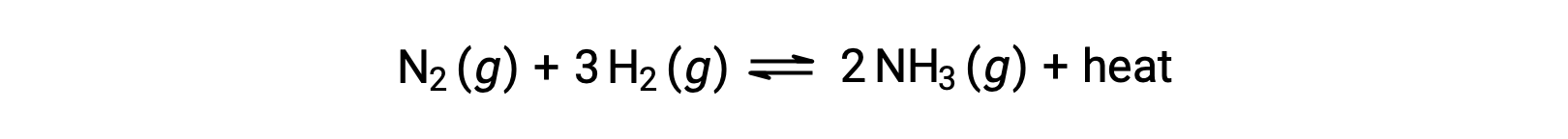
L'élévation de la température du système revient à augmenter la quantité d'un produit et l'équilibre se déplace donc vers la gauche. L'abaissement de la température du système entraîne également un déplacement vers la droite de l'équilibre. Pour les processus endothermiques, la chaleur est considérée comme un réactif de la réaction et donc on observe la dépendance opposée envers la température.
Ce texte a été adapté d’Openstax, Chimie 2e, Section 13.3 Déplacement d’équilibres :Le principe de Le Châtelier.
Du chapitre 14:

Now Playing
14.9 : Principe de le Châtelier : modification de la température
Équilibre chimique
29.1K Vues

14.1 : Équilibre dynamique
Équilibre chimique
50.3K Vues

14.2 : La constante d'équilibre
Équilibre chimique
46.6K Vues

14.3 : Équilibre homogène pour les réactions gazeuses
Équilibre chimique
24.6K Vues

14.4 : Calcul de la constante d'équilibre
Équilibre chimique
30.9K Vues

14.5 : Quotient de réaction
Équilibre chimique
48.0K Vues

14.6 : Calcul des concentrations d'équilibre
Équilibre chimique
47.4K Vues

14.7 : Principe de Le Châtelier : modification de la concentration
Équilibre chimique
57.5K Vues

14.8 : Principe de Le Châtelier : modification du volume (pression)
Équilibre chimique
34.1K Vues

14.10 : Négliger le changement de concentration initiale
Équilibre chimique
45.9K Vues