14.9 : O Princípio de Le Chatelier: Alteração da Temperatura
Em conformidade com a lei de ação das massas, um equilíbrio stressado por uma mudança de concentração irá deslocar-se para restabelecer o equilíbrio sem qualquer alteração do valor da constante de equilíbrio, K. Quando um equilíbrio muda em resposta a uma alteração de temperatura, no entanto, ele é restabelecido com uma composição relativa diferente que apresenta um valor diferente para a constante de equilíbrio.
Para entender esse fenómeno, considere a reação elementar:
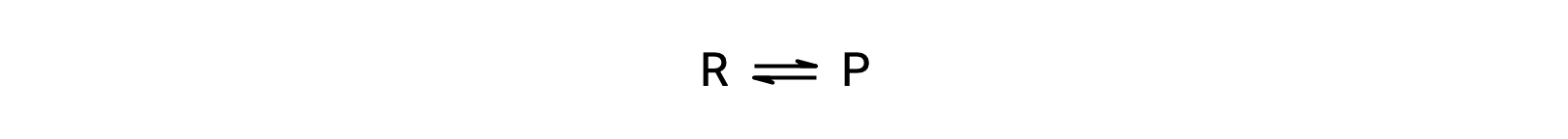
Uma vez que se trata de uma reação elementar, as leis de velocidade na direção direta e inversa podem ser derivadas diretamente da estequiometria da equação equilibrada:
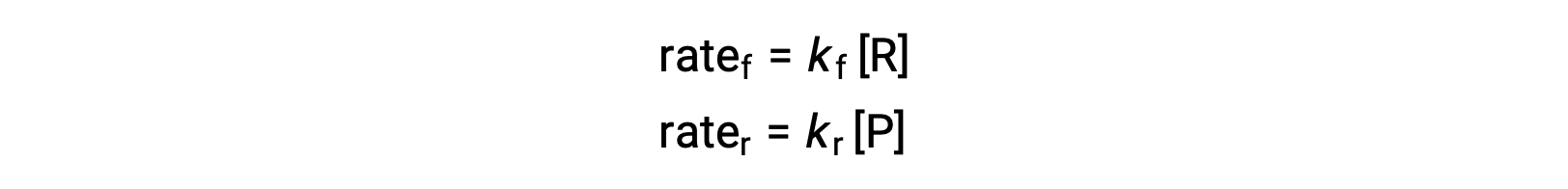
Quando o sistema está em equilíbrio,
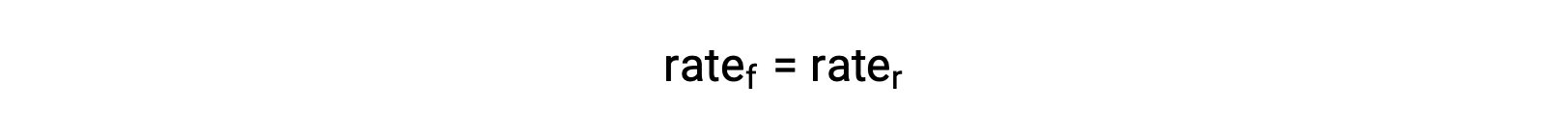
Substituindo as leis de velocidade por esta igualdade e reorganizando obtemos
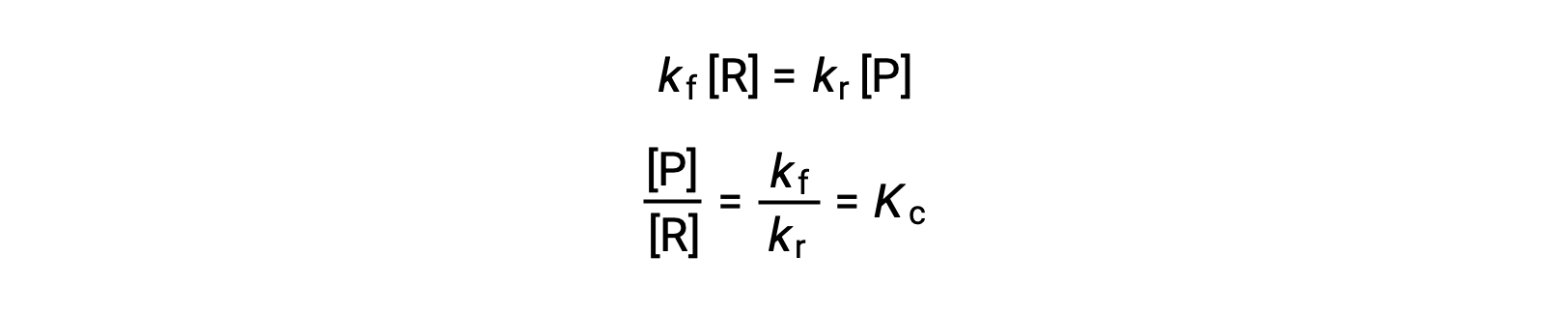
A constante de equilíbrio pode ser expressa como uma função matemática das constantes de velocidade para as reações direta e inversa. Uma vez que as constantes da velocidade variam com a temperatura, conforme descrito pela equação de Arrhenius, é de esperar que a constante de equilíbrio varie igualmente com a temperatura (assumindo que as constantes de velocidade são afetadas a diferentes extensões pela alteração da temperatura). Para reações mais complexas envolvendo mecanismos de reação multipassos, existe uma relação matemática semelhante, mas mais complexa, entre a constante de equilíbrio e as constantes de velocidade dos passos do mecanismo. Independentemente de quão complexa pode ser a reação, a dependência da temperatura da sua constante de equilíbrio persiste.
Prever a alteração que um equilíbrio irá experienciar em resposta a uma mudança na temperatura é realizado mais convenientemente considerando a mudança de entalpia da reação. Por exemplo, a formação de amoníaco pelo processo de Haber é um processo exotérmico (produtor de calor):
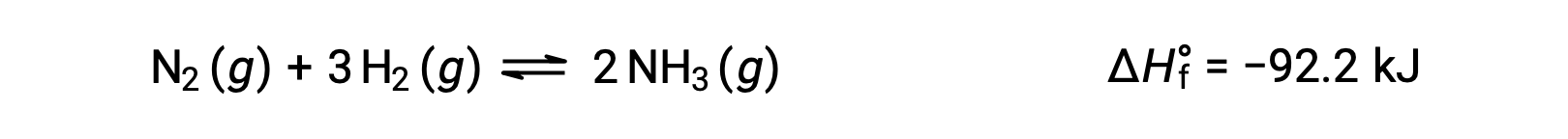
Para efeitos da aplicação do princípio de Châtelier, o calor, q, pode ser considerado como um produto:
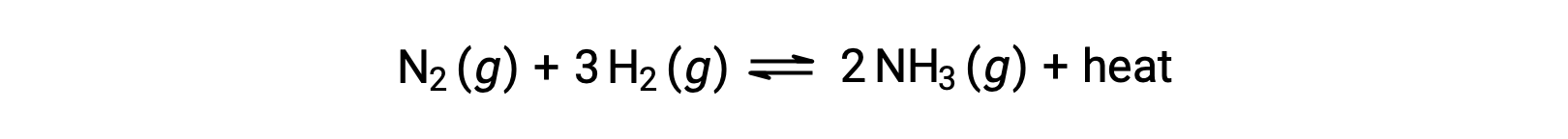
Aumentar a temperatura do sistema é semelhante a aumentar a quantidade de um produto, e assim o equilíbrio vai mudar para a esquerda. Baixar a temperatura do sistema fará com que o equilíbrio se desloque para a direita. Para os processos endotérmicos, o calor é visto como um reagente da reação e, portanto, a dependência oposta da temperatura é observada.
Este texto foi adaptado de Openstax, Chemistry 2e, Section 13.3 Shifting Equilibria: Le Châtelier’s Principle.
Do Capítulo 14:

Now Playing
14.9 : O Princípio de Le Chatelier: Alteração da Temperatura
Equilíbrio Químico
28.7K Visualizações

14.1 : Equilíbrio Dinâmico
Equilíbrio Químico
49.6K Visualizações

14.2 : A Constante de Equilíbrio
Equilíbrio Químico
46.1K Visualizações

14.3 : Equilíbrio para Reações Gasosas e Reações Heterogêneas
Equilíbrio Químico
24.2K Visualizações

14.4 : Cálculo da Constante de Equilíbrio
Equilíbrio Químico
30.5K Visualizações

14.5 : Quociente da Reação
Equilíbrio Químico
47.7K Visualizações

14.6 : Cálculo das Concentrações de Equilíbrio
Equilíbrio Químico
47.1K Visualizações

14.7 : O Princípio de Le Chatelier: Alteração da Concentração
Equilíbrio Químico
57.0K Visualizações

14.8 : O Princípio de Le Chatelier: Alteração do Volume (Pressão)
Equilíbrio Químico
33.7K Visualizações

14.10 : A Aproximação do x Pequeno
Equilíbrio Químico
45.7K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados