包含大量弱共轭酸碱对的溶液称为缓冲溶液或缓冲液。 添加少量强酸或强碱时,缓冲溶液可抵抗 pH 值的变化。 乙酸和乙酸钠的溶液是由弱酸及其盐组成的缓冲液的一个示例: CH3COOH (AQ) + CH3COONA (AQ)。 由弱碱及其盐组成的缓冲液的一个示例是氨和氯化铵的溶液: NH3 (AQ) + NH4Cl (AQ)。
缓冲液的工作原理
为了说明缓冲溶液的功能,请考虑一种醋酸和乙酸钠含量大致相等的混合物。 溶液中存在弱共轭酸碱对,这削弱了抵消少量新增强酸或碱的能力。 例如,在该溶液中添加强碱将中和水合氢离子,并将乙酸电离平衡转移到右侧,从而部分恢复降低的 H3O+ 浓度:
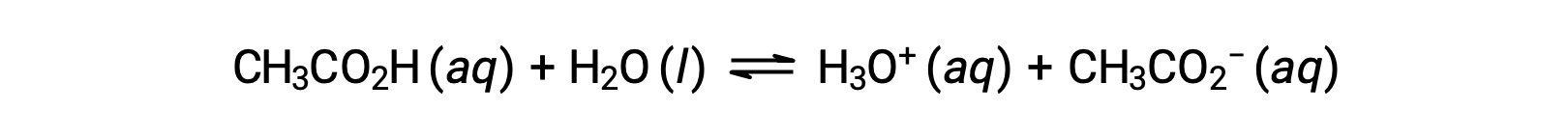
同样,向该缓冲溶液添加强酸将中和乙酸酯离子,使上述电离平衡向右移动,并使 [H3O+] 恢复到接近其原始值。 图 1 提供了添加强酸和碱时对缓冲溶液所做更改的图形说明。 溶液的缓冲操作基本上是由添加的强酸和碱转换为组成缓冲区共轭对的弱酸和碱引起的。 与强酸和碱的完全电离相比,弱酸和碱只会发生轻微电离。 因此,溶液 pH 值的变化远低于无缓冲溶液中的变化。
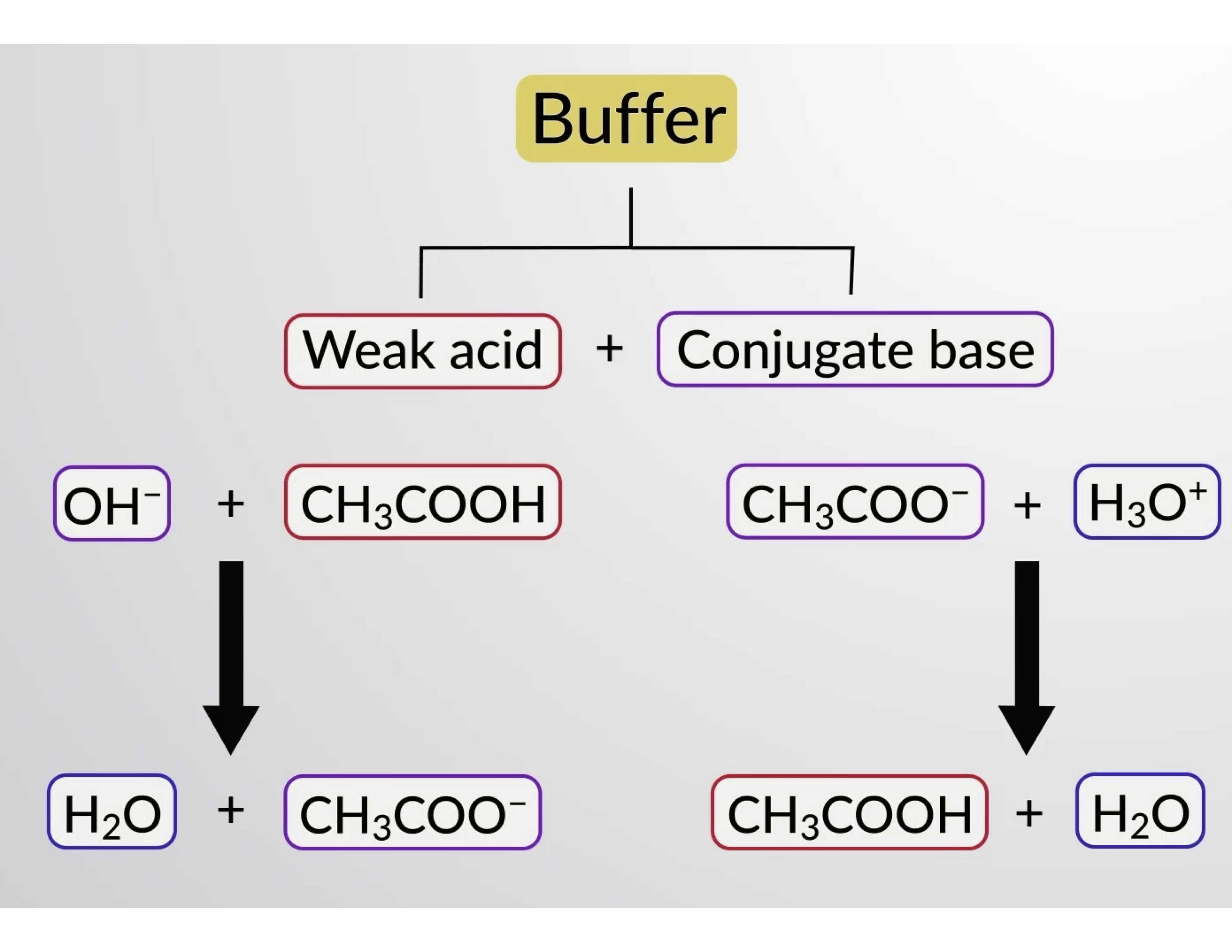
图 1. 乙酸和醋酸盐混合物中的缓冲作用。
本文改编自 Openstax, 化学 2e, 第14.6节:缓冲液。
来自章节 16:

Now Playing
16.2 : 缓冲液
酸碱和溶解度平衡
162.6K Views

16.1 : 同离子效应
酸碱和溶解度平衡
40.3K Views

16.3 : 亨德森-哈塞尔巴尔赫方程(Henderson-Hasselbalch Equation)
酸碱和溶解度平衡
67.3K Views

16.4 : 计算缓冲溶液中的 pH 值变化
酸碱和溶解度平衡
52.0K Views

16.5 : 缓冲液效力
酸碱和溶解度平衡
47.9K Views

16.6 : 滴定计算:强酸 - 强碱
酸碱和溶解度平衡
28.2K Views

16.7 : 滴定计算:弱酸 - 弱碱
酸碱和溶解度平衡
42.8K Views

16.8 : 指标
酸碱和溶解度平衡
47.3K Views

16.9 : 多质子酸的滴定
酸碱和溶解度平衡
95.2K Views

16.10 : 溶解度平衡
酸碱和溶解度平衡
50.3K Views

16.11 : 影响溶解度的因素
酸碱和溶解度平衡
32.6K Views

16.12 : 错合离子的形成
酸碱和溶解度平衡
22.8K Views

16.13 : 离子沉淀
酸碱和溶解度平衡
27.1K Views

16.14 : 定性分析
酸碱和溶解度平衡
19.2K Views

16.15 : 酸-碱 滴定曲线
酸碱和溶解度平衡
124.4K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。