滴定曲线是一些溶液属性与添加滴定剂的数量的图解。 对于 酸-碱 滴定,溶液 pH 是一种有用的属性进行监测,因为它可以预测地随溶液成分的变化而变化,因此可以用于监测滴定的进展并检测其终点。 酸-碱 滴定可通过强酸和强碱,强酸和弱碱,强碱和弱酸来执行。
对于使用强碱 NaOH 的 0.100 M 强酸对 25.00 mL 0.100 M HCL 进行滴定,其滴定曲线在图 1a 中显示为红色。 对于使用 0.100 M NaOH 的 25.00 mL 0.100 M CH3COOH (弱酸) 滴定,其滴定曲线在图 1b 中显示为黄色。
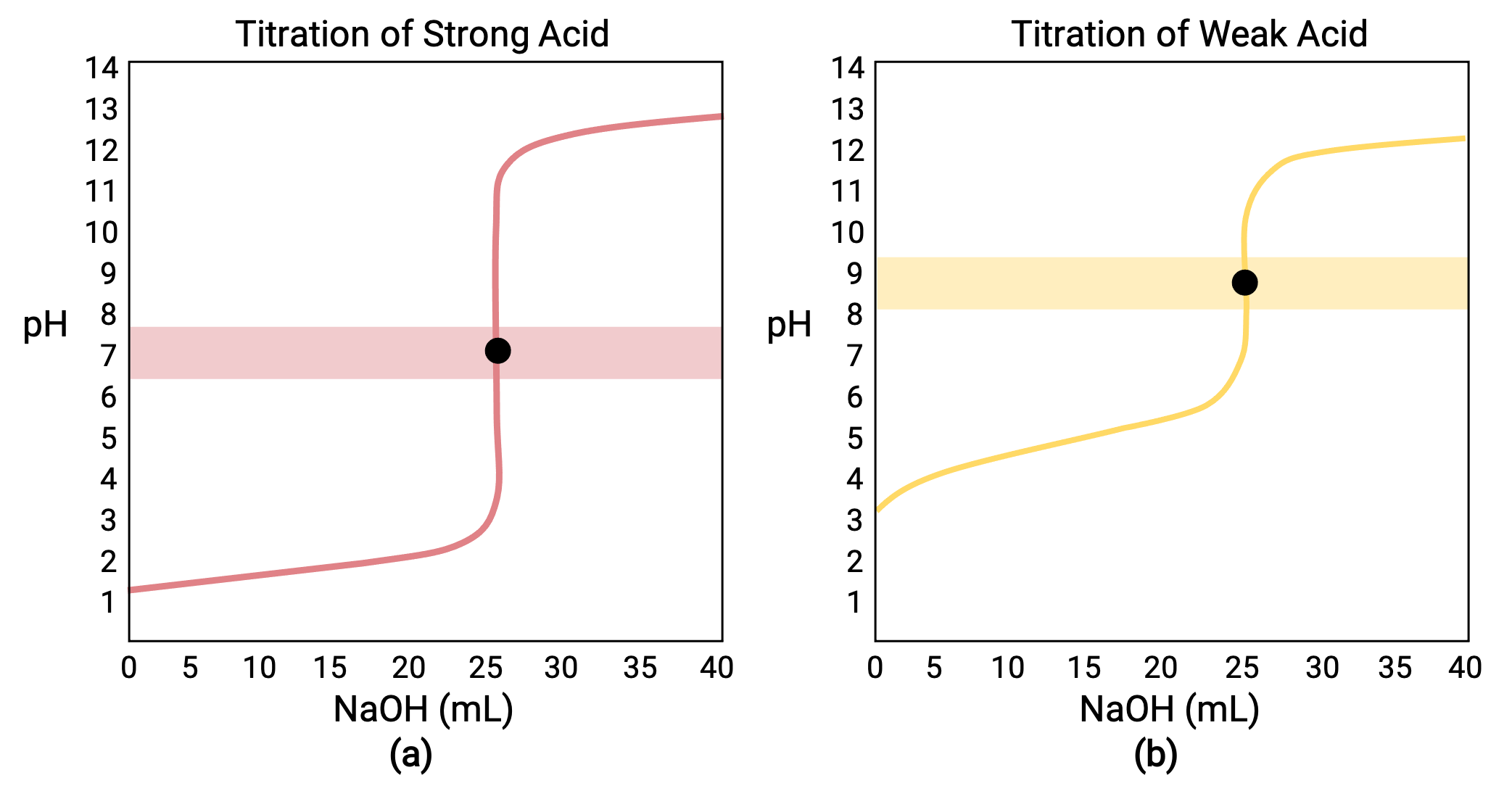
图 1 (a) 含 0.100 M NaOH (强碱) 的 25 mL 0.100 M HCL (强酸) 滴定曲线的等效点为 7.00 pH。 (b) 25 mL 0.100 M 乙酸 (弱酸) 与 100 M NaOH (强碱) 滴定曲线的等效点为 8.72 pH。
使用强酸的强或弱碱的滴定具有类似的 S 形曲线;但是,曲线会反转,因为 pH 值将从基本区域开始,随着强酸的增加而降低。 弱酸或碱的滴定也可用于分别确定 Ka 或 Kb。
滴定的四个阶段:
- 初始状态 (添加滴定剂体积 = 0 mL) : pH 由滴定酸确定;由于两个酸样本均浓度相同,弱酸的初始 pH 值将更高
- 前等效点 (0 mL < V < 25 mL) :溶液 pH 逐渐升高,酸通过反应被添加滴定剂消耗;成分包括未反应酸和反应生成物及其共轭碱
- 等效点 (V = 25 mL) :当溶液成分从酸性过渡到中性 (对于强酸样本) 或碱性 (对于弱酸样本) 时, pH 值会急剧上升, pH 值由酸的共轭碱电离决定
- 后等效点 (V > 25 mL) : pH 由添加了过量强碱滴定剂的数量确定;由于两个样本都使用相同滴定剂滴定,因此这一阶段的两个滴定曲线都类似。
来自章节 16:

Now Playing
16.15 : 酸-碱 滴定曲线
酸碱和溶解度平衡
125.9K Views

16.1 : 同离子效应
酸碱和溶解度平衡
40.7K Views

16.2 : 缓冲液
酸碱和溶解度平衡
163.1K Views

16.3 : 亨德森-哈塞尔巴尔赫方程(Henderson-Hasselbalch Equation)
酸碱和溶解度平衡
67.8K Views

16.4 : 计算缓冲溶液中的 pH 值变化
酸碱和溶解度平衡
52.3K Views

16.5 : 缓冲液效力
酸碱和溶解度平衡
48.3K Views

16.6 : 滴定计算:强酸 - 强碱
酸碱和溶解度平衡
28.8K Views

16.7 : 滴定计算:弱酸 - 弱碱
酸碱和溶解度平衡
43.6K Views

16.8 : 指标
酸碱和溶解度平衡
47.6K Views

16.9 : 多质子酸的滴定
酸碱和溶解度平衡
95.5K Views

16.10 : 溶解度平衡
酸碱和溶解度平衡
51.5K Views

16.11 : 影响溶解度的因素
酸碱和溶解度平衡
32.9K Views

16.12 : 错合离子的形成
酸碱和溶解度平衡
23.0K Views

16.13 : 离子沉淀
酸碱和溶解度平衡
27.4K Views

16.14 : 定性分析
酸碱和溶解度平衡
19.9K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。