需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
荧光标记的果蝇心结构
摘要
在这里,我们描述了从幼虫和成虫心管的不同元素的荧光标记的一个基本协议果蝇。这些标本非常适合通过荧光或共聚焦显微镜成像。这种技术允许一个强大的模式生物的心功能的详细的结构分析。
摘要
“
研究方案
在您开始之前
- 准备了以下解决方案:
- 放宽缓冲区(人工果蝇血淋巴(ADH)的(见“可视化在果蝇中跳动的心脏”),其中包含10 mM的EGTA)
- 固定液(4%甲醛1X PBS)
- PBSTx(用含0.1%TRITON - X - 100的)
- 适当稀释的小学和物种特异性荧光标记PBSTx中学的抗体
- 解剖果蝇暴露心脏管(成人苍蝇和/或幼虫)
- 在“可视化在果蝇的心脏跳动 ”半完整的果蝇心脏准备协议,或
- 果蝇幼虫NMJ夹层协议 1以下修改:使用含氧在幼虫夹层ADH和取代的腹侧中线后针稍微。幼虫沿腹中线被切断。不要删除任何组织内固定前。
荧光染色
- 检查所有心中有节奏地跳动含氧ADH的。迅速取代放宽缓冲液的乙醇脱氢酶。检查每个心管,以确保收缩有抑制作用。
- 修复取代放宽缓冲固定液的心。在室温下孵育20分钟,轻轻摇动。 (幼虫准备晃动是没有必要在任何步骤,并可能被视为有损心脏组织的完整性)。
- 洗净标本与PBSTx 10分钟,在室温下不断晃动三次。
- 对于成年人来说,精心修剪等,剩下的就是更多的椭圆形,少圆润的腹部角质层的腹侧边缘。此外,确保与腹部和胸部之间的单切,仔细和清楚分开的两个身体细分和心前区的最小的损害。幼虫的心,用细镊子小心取出脂肪体。去除脂肪,必须执行非常谨慎,因为幼虫的心,尤其是脆弱的,并已很少从其他肌肉或结缔组织的支持。不要取出气管分支,因为这可能会损害心脏。
- 的边缘修剪背腹部角质层的地区转移,避免接触到一个96口井,包含50-100μl稀释的抗体在PBSTx的孔板,位于市中心的心脏管。将不超过12%以及标本。在室温下孵育2小时,不断搅拌。孵化可能一蹴而就,在4 ° C。
- 删除第一抗体的解决方案。 10分钟在室温下用100μLPBSTx不断晃动的心洗净三次。
- 继拆除最后的洗涤缓冲液,添加在PBSTx 100μL二次抗体,辅以Alexa594 -鬼笔环肽(1:1000)。在室温下持续摇晃一小时孵育。保持样本覆盖,防止荧光团的漂白。
- 二次孵化之后,心中洗为10分钟三次在室温下持续晃动100μLPBSTx。保持整个洗涤步骤所涉及的样本。
- 拆除TRITON - X - 100,100μL的PBS冲洗心中最后的10分钟时间。标本可以保存在4 ° C安装前几天在黑暗中。
成人心脏安装
- 坚持两个18 × 18毫米的盖玻片,显微镜幻灯片与10μLVectashield安装介质。在盖玻片应间隔〜10-15毫米。安装在两个盖玻片之间的媒介放置一个小的第三个下拉。
- 将在第三盖玻片中心20μLVectashield。
- PBS洗涤液,小心地取出心中的极端边缘的角质层,并轻轻地放到他们心端安装介质下降第三盖玻片。盖玻片放在心中不超过5%下降。
- 在显微镜下检查,以确保所有的心都朝下。
- 小心反转盖玻片的心,并迅速在幻灯片上放置含有盖玻片对这样Vectashield液滴之间的盖玻片对心脏管保险丝的液滴。 “桥梁”,应成立由盖玻片。盖玻片,在显微镜幻灯片之间的心将暂停。
- 在显微镜下检查,以确保现在的心是朝上。
- 指甲油的边缘固定在盖玻片。
- 现在随时可以通过荧光或共聚焦显微镜成像的心。
安装幼虫心脏
- 将载玻片上滴(约20μL)Vectashield。
- 小心地转移到Vectashield和东方背侧下来两个幼虫标本使用钨针。
- 单独拖动标本的安装介质和调整每个并行。
- 将试样两侧盖玻片。使用镊子,放置在顶部的第三盖玻片,首先由后盖玻片一侧铺设降下来前盖玻片,从而形成了一个桥梁。毛细管的力量将导致Vectashield从后到前这有助于正确对齐的幼虫的心流。
- 固定盖玻片,在其边缘,指甲油,并认真填写20-30μLVectashield的盖玻片之间的空间。
- 指甲油和存储密封在4 ° C,或长期储存在-20 ° C
代表性的成果
正确执行时,背船只的所有组件和相关的组织应保持不变,很容易地可视化。背景荧光应该不大。对于成年人,腹侧纵肌层污渍非常好,并产生了大量的信号(图1和图2)。底层圆形心肌然而,往往不产生激烈的一个信号覆腹层。前的“锥形腔”成人心脏的心肌细胞含有大量的收缩材料,因此,本地区最强大的心脏管的其余部分相出现。幼虫的心,显示了一个螺旋式上升的肌原纤维的安排,类似成人收缩的心肌细胞(图3)。
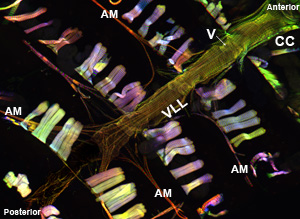
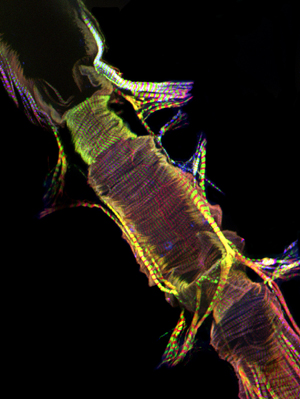
图1:顶。一种荧光显微照片显示的整个成年果蝇心脏管,表达肌球蛋白GFP。形象是一个蔡司成像仪配备了一个Apotome滑动模块的Z1的荧光显微镜。肌球蛋白GFP显示为绿色,肌动蛋白是与AlexaFluor ® 594鬼笔环肽(红色)和α-辅肌动蛋白染色标记的抗-α-辅肌动蛋白抗体(蓝色)。注意:制备过程中允许恢复心脏样本保存完好的结构。 CC =锥形腔; AM = alary肌肉,V =内部阀; VLL的腹侧纵肌层。底部。通过第三腹部下方呈现不断上升的肌原纤维的收缩心肌安排的腹侧纵层的核心部分CC成人心脏管区域。请点击这里图1a为一个更大的版本,并在这里图1b为一个更大的版本
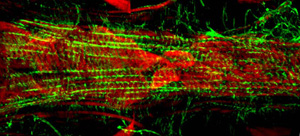
图2:AlexaFluor ® 594鬼笔环肽(红色)和反Pericardin(IV型胶原)(绿色)抗体染色成人心脏的前部的代表共聚焦栈。 Pericardin是与沿腹面的心,有可能从腹侧的肌肉层的纵向为主的肌原纤维的。请点击这里为图2的较大版本。

图3:一个分部了第三阶段的果蝇幼虫心脏A7的荧光显微镜。形象是一个蔡司成像仪配备了一个Apotome滑动模块的Z1的荧光显微镜。肌动蛋白是标记AlexaFluor ® 594鬼笔环肽(绿色)和α-辅肌动蛋白是染色与抗-α-辅肌动蛋白抗体(红色)。请点击这里为图3的较大版本。
讨论
在这里,我们提出了一个协议, 准备和染色果蝇背血管和组织通过荧光或共聚焦显微镜成像。我们提供一个简洁的细化和有效的染色, 允许在幼虫和成虫果蝇心管原位成像解决通常在我们的实验室工作的步骤帐户。其他缩写形式2,3,4所描述的类似的方法。
实施染色过程时,重要的额外细节需要考虑。例如,与其他生物材料中发现,相当<...
致谢
作者感谢SI伯恩斯坦(圣迭戈州立大学)批判性阅读和有益的建议,关于这个手稿的准备。这项工作是由美国国立卫生研究院拨款支持SI伯恩斯坦,SDSU的,和R.博德默,BIMR;和一个博士后奖学金从西方国家的美国心脏协会联盟G. Vogler和A. Cammarato。
材料
| Name | Company | Catalog Number | Comments | |
| Ethylene glycol-bis (2-amino-ethylether) -N,N,N’,N’-tetra-acetic acid (EGTA) | Reagent | Sigma-Aldrich | E4378 | |
| Formaldehyde, 10%, methanol free, Ultra Pure | Reagent | Polysciences, Inc. | 50-00-0 | |
| Triton-X-100 | Reagent | Sigma-Aldrich | 9002-93-1 | |
| Alexa Fluor® 594 phalloidin | Reagent | Invitrogen | A12381 | |
| Vectashield® Mounting Medium for Fluorescence with DAPI | Reagent | Vector Laboratories | H-1200 | |
| Tungsten pins | Reagent | Fine Science Tools | 26002-10 | |
| Pin holder | Reagent | Fine Science Tools | 26018-17 |
参考文献
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. , (2009).
- Molina, M. R., Cripps, R. M. Ostia, the inflow tracts of the Drosophila heart, develop from a genetically distinct subset of cardial cells. Mech Dev. 1, 51-59 (2001).
- Dulcis, D., Levine, R. B. Glutamatergic innervation of the heart initiates retrograde contractions in adult Drosophila melanogaster. J Neurosci. 2, 271-280 (2005).
- Zeitouni, B. Signalling pathways involved in adult heart formation revealed by gene expression profiling in Drosophila. PLoS Genet. 10, 1907-1921 (2007).
- Robertson, C. W. The metamorphosis of Drosophila melanogaster, including an accurately timed account of the principal morphological change. J. Morphol. 2, 351-399 (1936).
- Miller, A. . The internal anatomy and histology of the imago of Drosophila melanogaster. , (1950).
- Rizki, T. M. The circulatory system and associated cells and tissues. , (1978).
- Cammarato, A. Myosin transducer mutations differentially affect motor function, myofibril structure, and the performance of skeletal and cardiac muscles. Mol Biol Cell. 2, 553-562 (2008).
- Taghli-Lamallem, O. Dystrophin deficiency in Drosophila reduces lifespan and causes a dilated cardiomyopathy phenotype. Aging Cell. 2, 237-249 (2008).
- Kelso, R. J. a database documenting a GFP protein-trap insertion screen in Drosophila melanogaster. Nucleic Acids Res. 32, D418-D420 (2004).
- Dietzl, G. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 7150, 151-156 (2007).
- Mery, A. The Drosophila muscle LIM protein, Mlp84B, is essential for cardiac function. J Exp Biol. 211, 15-23 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。