Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Marquage fluorescent Drosophile Coeur
Dans cet article
Résumé
Nous décrivons ici un protocole de base pour le marquage fluorescent des différents éléments de tubes coeur de la larve et l'adulte Drosophila melanogaster. Ces spécimens sont bien adaptés pour l'imagerie par microscopie fluorescente ou confocale. Cette technique permet une analyse détaillée des caractéristiques structurelles des cœurs d'un organisme modèle puissant.
Résumé
L'
Protocole
Avant de commencer
- Préparer les solutions suivantes:
- mémoire tampon de détente (artificielle drosophile hémolymphe (ADH) (voir "Visualisation du cœur battant de la drosophile") qui contient 10 mM EGTA)
- fixateur (formaldéhyde à 4% dans du PBS 1X)
- PBSTx (PBS contenant 0,1% de Triton-X-100)
- Convenablement diluée primaire et spécifique à l'espèce marqué par fluorescence des anticorps secondaire dans PBSTx
- Disséquer la drosophile pour exposer les tubes cardiaques (des mouches adultes et / ou larves) suite
- le protocole de semi-intactes drosophile préparation cardiaque dans «Visualiser le cœur battant de la drosophile», ou
- Drosophile larvaire Dissection JNM 1 du protocole avec les modifications suivantes: Utilisez oxygénée ADH pendant la dissection des larves et de déplacer la broche postérieure légèrement de la ligne médiane ventrale. Les larves sont coupés le long de la ligne médiane ventrale. Ne pas enlever tout tissu avant la fixation.
Révélation
- Vérifier que tous les cœurs sont frappant en cadence dans oxygénée ADH. Remplacer rapidement l'ADH à la détente de la mémoire tampon. Examinez chaque tube cardiaque à assurer les contractions sont inhibées.
- Fixer les cœurs en remplaçant le tampon de détente avec fixateur. Incuber à température ambiante pendant 20 minutes en remuant doucement. (Pour secouer la préparation des larves n'est pas nécessaire à n'importe quelle étape, et peut être considéré comme préjudiciable à l'intégrité du tissu cardiaque).
- Lavez échantillons à trois reprises pendant dix minutes avec PBSTx à température ambiante avec agitation continue.
- Pour les adultes, soigneusement tailler les bords ventraux de la cuticule abdominale telle que ce qui reste est plus elliptique et moins arrondis. En outre, avec une seule coupure entre l'abdomen et du thorax, avec soin et proprement séparées deux segments du corps et assurer un minimum de dommages à la région antérieure du cœur. Pour les cœurs des larves, retirez soigneusement le corps gras à l'aide de pinces fines. L'élimination de la graisse doit être exécuté avec une extrême prudence, puisque le cœur des larves est particulièrement fragile et a très peu de soutien d'autres muscles ou les tissus conjonctifs. Ne pas enlever les branches trachéale car cela peut endommager le coeur.
- Transfert de la région dorsale parés de la cuticule abdominale par les bords, en évitant tout contact avec le tube situé cardiaque, dans une plaque de 96 puits avec des puits qui contiennent de 50 à 100 pi d'anticorps primaire dilué dans PBSTx. Ne placez pas plus de 12 spécimens par puits. Incuber à température ambiante pendant 2 heures avec une agitation continuelle. L'incubation peut aussi être fait durant la nuit à 4 ° C.
- Retirer solution d'anticorps primaire. Lavez le cœur à trois reprises pendant dix minutes avec 100 ul PBSTx à température ambiante avec une agitation continuelle.
- Après élimination du tampon de lavage final, ajouter 100 pi d'anticorps secondaire dans PBSTx, complétée par Alexa594-phalloïdine (1:1000). Incuber pendant une heure avec agitation constante à température ambiante. Conserver les échantillons couverts pour éviter fluorophore blanchiment.
- Après incubation du secondaire, se laver le cœur à trois reprises pendant dix minutes avec 100 pi de PBSTx à température ambiante avec une agitation continuelle. Conserver les échantillons couvertes au long des étapes de lavage.
- Pour le retrait de Triton-X-100, rincer les cœurs une dernière fois dans 100 ul de PBS pendant 10 minutes. Les échantillons peuvent être stockés dans l'obscurité à 4 ° C pendant plusieurs jours avant le montage.
Montage pour Hearts adultes
- Adhérer deux 18 x 18 mm à lamelles une lame de microscope avec 10 ul de milieu Vectashield montage. Les lamelles doivent être espacés de ~ 10-15 mm. Placer une petite goutte tiers de milieu de montage en entre les deux lamelles.
- Placer 20 ul de Vectashield dans le centre d'une lamelle tiers.
- Retirez soigneusement chacun des coeurs de la solution de lavage PBS par les bords extrêmes de la cuticule, et placez doucement les coeur vers le bas sur la goutte de milieu de montage sur la lamelle tiers. Ne placez pas plus de cinq coeurs par goutte sur la lamelle.
- Vérifiez sous un microscope pour s'assurer que tous les cœurs sont vers le bas.
- Retourner avec précaution la lamelle contenant le cœur et rapidement le placer sur la diapositive contenant la paire de lamelles de telle sorte que la goutte avec fusibles tubes cardiaque avec la gouttelette Vectashield entre la paire de lamelle. Un «pont» doit être formé par les lamelles. Les coeurs seront suspendus entre une lamelle et la lame de microscope.
- Vérifiez sous un microscope pour s'assurer que les cœurs sont maintenant confrontés à la hausse.
- Fixer des lamelles à leurs bords avec des vernis à ongles.
- Les cœurs sont maintenant prêts à être imagée par microscopie fluorescente ou confocale.
Montage pour Hearts larvaires
- Déposer une goutte (~ 20 pl) Vectashield sur une lame de microscope.
- Soigneusement de transfert jusqu'à deux spécimens de larves dans le Vectashield et les orienter face dorsale vers le bas en utilisant des aiguilles de tungstène.
- Individuellement glisser les spécimens hors du milieu de montage et d'aligner chacune en parallèle.
- Placer une lamelle sur des côtés opposés de l'échantillon. En utilisant des pinces, placer une lamelle troisième sommet, d'abord par la pose d'un côté sur la lamelle postérieure et l'abaisser jusqu'à la lamelle antérieure formant ainsi un pont. Forces capillaires provoquera un flux de Vectashield d'arrière en avant qui permet un bon alignement du cœur larvaire.
- Fixer tous les lamelles en place, à leurs bords, avec du vernis à ongles et remplissez soigneusement l'espace entre les lamelles avec 20-30 Vectashield ul.
- Sceller avec du vernis à ongles et stocker à 4 ° C, ou pour stockage à long terme à -20 ° C.
Les résultats représentatifs
Lorsqu'il est exécuté correctement, tous les composants et les tissus associés du vaisseau dorsal doit rester intact et être facilement visualisés. La fluorescence de fond devrait être minime. Pour les adultes, la ventrale longitudinale taches couche musculaire très bien et produit un signal important (Figure 1 et Figure 2). Les cardiomyocytes sous-jacente circulaires ont cependant tendance à ne pas produire un signal plus intense que celle de la couche recouvrant ventrale. Les myocytes de l'antérieur "chambre conique» du cœur adulte contient une quantité importante de matériel contractile et, par conséquent, cette région apparaît comme le parent le plus robuste pour le reste du tube cardiaque. Le cœur des larves montre un agencement en spirale myofibrillaire similaire à celle de l'cardiomyocytes adultes contractiles (Figure 3).
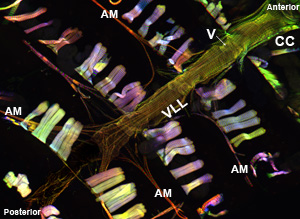
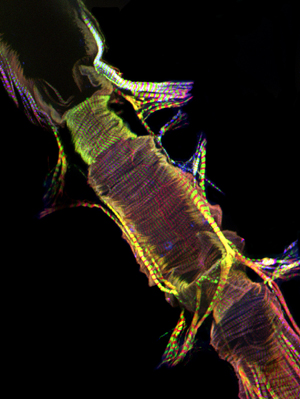
Figure 1: Haut. Une micrographie montrant le tube fluorescent toute cardiaque d'un adulte de Drosophila melanogaster qui exprime la myosine-GFP. L'image a été prise avec un microscope Zeiss Z1 Imager fluorescents équipés d'un module Apotome coulissantes. Myosine-GFP est représenté en vert, l'actine est coloré avec AlexaFluor phalloïdine ® 594 (rouge) et α-actinine est étiqueté avec des anti-α-actinine anticorps (bleu). Notez la procédure de préparation permet la récupération des échantillons coeur avec des structures bien conservées. CC = coniques chambre; AM = muscle Alary; V = interne de soupape; VLL = couche musculaire ventrale longitudinale. Bottom. Une région du tube cardiaques adultes de la CC à travers le 3ème segment abdominal de coeur juste sous la couche ventrale longitudinale montrant l'agencement en spirale myofibrille des cardiomyocytes contractiles. S'il vous plaît cliquez ici pour une version agrandie de la figure 1a, et ici pour une version agrandie de la figure 1b
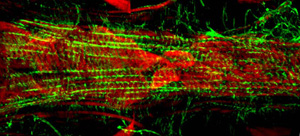
Figure 2: Représentant des piles confocale d'une partie antérieure du cœur adulte colorés avec AlexaFluor phalloïdine ® 594 (rouge) et un anti-Pericardin (collagène de type IV) (vert) d'anticorps. Pericardin est associé avec le cœur le long de la surface ventrale, vraisemblablement originaires du myofibrilles orientées longitudinalement de la couche musculaire ventrale. S'il vous plaît cliquez ici pour une version agrandie de la figure 2.

Figure 3: Une micrographie fluorescence du segment A7 du cœur d'un bon trois étapes larve de drosophile. L'image a été prise avec un microscope Zeiss Z1 Imager fluorescents équipés d'un module Apotome coulissantes. L'actine est étiqueté avec AlexaFluor phalloïdine ® 594 (vert) et α-actinine est taché avec des anti-α-actinine anticorps (rouge). S'il vous plaît cliquez ici pour une version agrandie de la figure 3.
Access restricted. Please log in or start a trial to view this content.
Discussion
Nous présentons ici un protocole utile pour la préparation et la coloration du navire Drosophila melanogaster dorsale et des tissus attenants à l'imagerie par microscopie fluorescente ou confocale. Nous fournissons un compte rendu concis des étapes affiné par et couramment employées dans notre laboratoire pour la coloration efficace qui permet de bien résolu à l'imagerie in situ de la larve et adulte tubes cardiaques chez la drosophile. D'autres ont décrit des méthodes si...
Access restricted. Please log in or start a trial to view this content.
Remerciements
Les auteurs remercient SI Bernstein (San Diego State University) pour une lecture critique et des suggestions utiles concernant la préparation de ce manuscrit. Ce travail a été soutenu par des subventions du NIH pour SI Bernstein, SDSU, et à R. Bodmer, BIMR, et par une bourse post-doctorale de l'affiliation Ouest des États de l'American Heart Association à G. Vogler et à A. Cammarato.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments | |
| Ethylene glycol-bis (2-amino-ethylether) -N,N,N’,N’-tetra-acetic acid (EGTA) | Reagent | Sigma-Aldrich | E4378 | |
| Formaldehyde, 10%, methanol free, Ultra Pure | Reagent | Polysciences, Inc. | 50-00-0 | |
| Triton-X-100 | Reagent | Sigma-Aldrich | 9002-93-1 | |
| Alexa Fluor® 594 phalloidin | Reagent | Invitrogen | A12381 | |
| Vectashield® Mounting Medium for Fluorescence with DAPI | Reagent | Vector Laboratories | H-1200 | |
| Tungsten pins | Reagent | Fine Science Tools | 26002-10 | |
| Pin holder | Reagent | Fine Science Tools | 26018-17 |
Références
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. , (2009).
- Molina, M. R., Cripps, R. M. Ostia, the inflow tracts of the Drosophila heart, develop from a genetically distinct subset of cardial cells. Mech Dev. 1, 51-59 (2001).
- Dulcis, D., Levine, R. B. Glutamatergic innervation of the heart initiates retrograde contractions in adult Drosophila melanogaster. J Neurosci. 2, 271-280 (2005).
- Zeitouni, B. Signalling pathways involved in adult heart formation revealed by gene expression profiling in Drosophila. PLoS Genet. 10, 1907-1921 (2007).
- Robertson, C. W. The metamorphosis of Drosophila melanogaster, including an accurately timed account of the principal morphological change. J. Morphol. 2, 351-399 (1936).
- Miller, A. The internal anatomy and histology of the imago of Drosophila melanogaster. , Wiley. New York. (1950).
- Rizki, T. M. The circulatory system and associated cells and tissues. , Academic Press. New York. (1978).
- Cammarato, A. Myosin transducer mutations differentially affect motor function, myofibril structure, and the performance of skeletal and cardiac muscles. Mol Biol Cell. 2, 553-562 (2008).
- Taghli-Lamallem, O. Dystrophin deficiency in Drosophila reduces lifespan and causes a dilated cardiomyopathy phenotype. Aging Cell. 2, 237-249 (2008).
- Kelso, R. J. a database documenting a GFP protein-trap insertion screen in Drosophila melanogaster. Nucleic Acids Res. 32, D418-D420 (2004).
- Dietzl, G. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 7150, 151-156 (2007).
- Mery, A. The Drosophila muscle LIM protein, Mlp84B, is essential for cardiac function. J Exp Biol. 211, 15-23 (2008).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon