Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
VE Floresan Etiketleme Drosophila Kalp Yapıları
Özet
Burada larva ve yetişkin kalp tüplerin farklı unsurları floresan etiketlenmesi için temel bir protokol tanımlamak Drosophila melanogaster. Bu örnekler, floresan veya konfokal mikroskopi ile görüntüleme için çok uygundur. Bu teknik, güçlü bir model organizma kalplerin özellikleri ayrıntılı yapısal analiz izin verir.
Özet
Protokol
Başlamadan önce
- Aşağıdaki çözümleri hazırlayın:
- rahatlatıcı tamponu (10 mM EGTA içeren yapay Drosophila hemolimf (ADH) ("Drosophilia'daki kalpte görselleştirme" bölümüne bakın))
- fiksatif (1x PBS içinde% 4 formaldehit)
- PBSTx (% 0.1 Triton X-100 içeren PBS)
- PBSTx uygun şekilde seyreltilmiş birincil ve türe spesifik floresan etiketli sekonder antikorlar
- Drosophila teşrih kalp tüpleri (erişkin sinek ve / veya larva) maruz
- yarı sağlam Drosophila kalp hazırlanması "Drosophila kalpte görselleştirme" protokolü, veya
- Drosophila Larvaların NMJ Diseksiyon aşağıdaki değişiklikler protokolü 1: Kullanım larva diseksiyonu sırasında ADH oksijenli ve ventral orta hat posterior iğne hafifçe yerinden. Larva ventral orta hat boyunca kesilir. Fiksasyon için önce herhangi bir doku çıkarmayın.
Floresan Boyama
- Tüm kalpleri ritmik oksijenli ADH yenerek olduğunu kontrol edin. Hızlı tampon rahatlatıcı ADH değiştirin. Kasılmaları inhibe edilir sağlamak için her kalp tüp inceleyin.
- Fiksatif ile rahatlatıcı bir tampon yerine kalbini düzelt. Nazik sallayarak 20 dakika oda sıcaklığında inkübe edin. (Larva hazırlık çalkalanması için herhangi bir adım gerekli değildir ve kardiyak doku bütünlüğü için zararlı olarak kabul edilebilir).
- On dakika boyunca sürekli titriyor oda sıcaklığında PBSTx örnekleri üç kez yıkayın.
- Yetişkinler için, kalan şey daha oval ve daha az yuvarlak olduğu gibi karın manikür ventral kenarlar dikkatle geri düzeltin. Ayrıca, karın ve göğüs arasındaki tek kesim, dikkatli ve temiz ayrı vücut bölümlerinin ve kalbin ön bölgeye en az zararla sağlar. Larva kalpleri için, dikkatle, ince forseps kullanarak yağ vücut çıkarın. Larva kalp, özellikle kırılgan ve diğer kasların veya bağ dokusu çok az destek beri yağ alınması, son derece dikkatli yürütülmelidir. Bu kalp zarar verebilir olarak trakeal dallar çıkarmayın.
- 50-100 ul PBSTx içinde seyreltilmesi birincil antikor içeren kuyu ile 96 kuyu plakasına, merkezi bir konumda yer alan kalp tüpü ile temastan kaçınarak, kenarlarından kesilmiş sırt bölgesi karın manikür aktarın. Başına en fazla 12 numuneler yerleştirin. Sürekli ajitasyon ile 2 saat oda sıcaklığında inkübe edin. Kuluçka de gecede 4 yapılabilir ° C.
- Primer antikor çözümü çıkarın. 100 oda sıcaklığında sürekli sallayarak ul PBSTx on dakika boyunca kalpleri üç kez yıkayın.
- Son yıkama tamponu kaldırılması ardından, Alexa594-Phalloidin (1:1000) ile desteklenmiş PBSTx 100 ul, ikincil antikor ekleyin. Oda sıcaklığında sürekli sallayarak bir saat süreyle inkübe edin. Örnekleri beyazlatma fluorofor önlemek için kapalı tutun.
- Ikincil inkübasyon sonrasında oda sıcaklığında sürekli sallayarak PBSTx 100 ul ile on dakika boyunca kalpleri üç kez yıkayın. Örnekleri yıkama adımları boyunca kapalı tutun.
- Triton X-100 kaldırılması için, 10 dakika süreyle PBS 100 ul içindeki kalpler kör olur son bir kez yıkayın. Örnekleri monte etmeden önce birkaç gün süreyle 4 ° C'de karanlıkta saklanabilir.
Yetişkin Kalpler Montaj
- 10 ul Vectashield montaj orta bir mikroskop lamı iki 18 x 18 mm kapak fişleri uyun. Lamelleri ~ 10-15 mm arayla olmalıdır. Iki lamelleri arasında orta montaj küçük bir üçüncü damla yerleştirin.
- Üçüncü bir lamel merkezinde Vectashield 20 ul yerleştirin.
- Manikür aşırı kenarlarından dikkatlice PBS yıkama solüsyonu her kalplerin kaldırmak ve yavaşça üçüncü lamel üzerine montaj orta damla kalp tarafı aşağı yerde. Lamel başına en fazla beş damla kalpleri yerleştirin.
- Bütün kalpleri aşağı bakacak şekilde sağlamak için bir mikroskop altında kontrol edin.
- Kalpleri içeren lamel dikkatlice ters ve hızlı lamelleri çifti içeren, kalp tüpleri sigortalar ile lamel çifti arasında Vectashield damlacık damlacık. Slaytta yer "Köprü" lamelleri tarafından oluşturulmalıdır. Kalpleri bir lamel ve mikroskop lamı arasında askıya alınacaktır.
- Kalpleri şimdi yukarı gelecek sağlamak için bir mikroskop altında kontrol edin.
- Lamelleri oje ile kenarlarına sabitleyin.
- Kalpleri şimdi floresan veya konfokal mikroskobu aracılığıyla görüntülü olarak hazırız.
Larvaların Kalpler Montaj
- Bir mikroskop lamı üzerine bir damla (~ 20 ul) Vectashield yerleştirin.
- Tungsten iğneler kullanarak aşağı Vectashield ve yönlendirmek onları dorsal tarafına içine iki larva örneklerinin dikkatle kadar veri transferi.
- Bireysel montaj orta örneklerin dışına sürükleyin ve paralel olarak her hizalamak.
- Örneğinin karşı taraf bir lamel yerleştirin. Forseps kullanarak, arka lamel bir tarafta döşeme ve böylece bir köprü oluşturan ön lamel aşağı düşürerek ilk kez, üst üste üçüncü bir lamel yerleştirin. Kılcal güçleri larva kalbin düzgün hizalama yardımcı anterior posterior Vectashield akışı neden olacaktır.
- Oje, kenarlarında yer Fix tüm lamelleri ve dikkatli bir şekilde 20-30 ul Vectashield lamelleri arasındaki boşluğu doldurmak.
- Mühür oje ve mağaza ile 4 ° C veya -20 ° C'de uzun süreli depolama için
Temsilcisi Sonuçlar
Doğru çalıştırıldığında, dorsal geminin tüm bileşenleri ve ilgili dokuların sağlam kalır ve kolayca görüntülenebilmekte. Eşiğe düzeyde olmalıdır. Çok iyi yetişkin, ventral longitudinal kas tabakası lekeleri için önemli bir sinyal üretir (Şekil 1 ve Şekil 2). Altta yatan dairesel kardiyomiyositlerde Bununla birlikte, ventral örten tabakanın olduğu gibi yoğun bir sinyal üretmek için değil eğilimindedir. Yetişkin kalp ön konik odasına "miyositler kontraktil malzemenin önemli bir miktarda içerir ve dolayısıyla, bu bölgede kalp tüp kalan en sağlam göreceli olarak görünür. Larva kalp yetişkin kontraktil kardiyomiyositlerde (Şekil 3) benzer bir helezonik myofibrillar düzenleme gösterir.
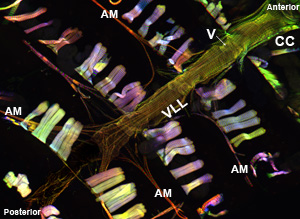
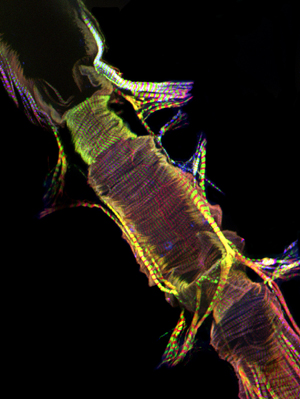
Şekil 1: Üst. Gösteren bir yetişkin bir Drosophila melanogaster ifade miyozin-GFP tüm kalp tüp floresan mikrografı. Görüntü Apotome bir kayma modülü ile donatılmış bir Zeiss Imager Z1, floresan mikroskop ile alınmıştır. Miyozin-GFP yeşil gösterilir, aktin AlexaFluor ® 594 Phalloidin (kırmızı) ve α-aktinin ile boyandı anti-α-aktinin antikor (mavi) ile etiketlenir. Hazırlık prosedürü iyi korunmuş yapıları ile kalp örneklerinin kurtarma izin unutmayın. CC = konik kamara; AM = alary kas, V = dahili valf; VLL = ventral uzunlamasına kas tabakası. Alt. 3. sadece kasılma kardiyomiyositlerde helezonik myofibril düzenleme gösteren ventral longitudinal tabakasının altındaki kalp karın segment üzerinden CC yetişkin kardiyak tüpün bir bölge. Lütfen buraya tıklayın Şekil 1a daha büyük bir versiyonu için, burada daha büyük bir rakam 1b sürümü için
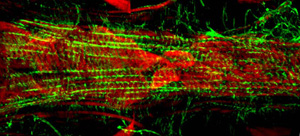
Şekil 2: AlexaFluor ® 594 Phalloidin (kırmızı) ve bir anti-Pericardin (kollajen tip IV) (yeşil) antikor ile boyandı yetişkin kalp anterior kısmı Temsilcisi konfokal yığınları. Pericardin muhtemelen ventral kas tabakası uzunlamasına odaklı myofibrils kaynaklanan, ventral yüzeyi boyunca kalp ile ilişkilidir. Lütfen buraya tıklayın Şekil 2 daha büyük bir versiyonu için.

Şekil 3: Bir floresan segment bir sahne üç Drosophila larva uygun kalp A7 mikrografı. Görüntü Apotome bir kayma modülü ile donatılmış bir Zeiss Imager Z1, floresan mikroskop ile alınmıştır. Aktin AlexaFluor ® 594 Phalloidin (yeşil) ve α-aktinin ile etiketlenmiş anti-α-aktinin antikor (kırmızı) ile boyandı. Lütfen buraya tıklayın daha büyük bir şekil 3 sürümü için.
Tartışmalar
Burada Drosophila melanogaster dorsal damar ve görüntüleme için floresan veya konfokal mikroskopi ile ilgili dokuların hazırlanması ve boyanması için yararlı bir protokol mevcut. Rafine edilmiş ve yaygın olarak larva ve yetişkin Drosophila kalp tüpleri in situ görüntüleme iyi bir çözüme izin verir etkin boyama laboratuarımızda istihdam adımların kısa ve öz bir açıklama sağlamalıdır . Diğerleri kısaltılmış biçim, 2, 3, 4 benzer yöntemler var.
Teşekkürler
Yazarlar SI Bernstein (San Diego Eyalet Üniversitesi) Bu yazının hazırlanması ile ilgili eleştirel okuma ve yararlı önerileri için teşekkür ederim. Bu çalışma SI Bernstein, SDSU, R. Bodmer, BIMR NIH hibe programı tarafından desteklenen ve G. Batılı Devletler, Amerikan Kalp Derneği Ortaklık Vogler ve A. Cammarato bir post-doktora bursu.
Malzemeler
| Name | Company | Catalog Number | Comments | |
| Ethylene glycol-bis (2-amino-ethylether) -N,N,N’,N’-tetra-acetic acid (EGTA) | Reagent | Sigma-Aldrich | E4378 | |
| Formaldehyde, 10%, methanol free, Ultra Pure | Reagent | Polysciences, Inc. | 50-00-0 | |
| Triton-X-100 | Reagent | Sigma-Aldrich | 9002-93-1 | |
| Alexa Fluor® 594 phalloidin | Reagent | Invitrogen | A12381 | |
| Vectashield® Mounting Medium for Fluorescence with DAPI | Reagent | Vector Laboratories | H-1200 | |
| Tungsten pins | Reagent | Fine Science Tools | 26002-10 | |
| Pin holder | Reagent | Fine Science Tools | 26018-17 |
Referanslar
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. , (2009).
- Molina, M. R., Cripps, R. M. Ostia, the inflow tracts of the Drosophila heart, develop from a genetically distinct subset of cardial cells. Mech Dev. 1, 51-59 (2001).
- Dulcis, D., Levine, R. B. Glutamatergic innervation of the heart initiates retrograde contractions in adult Drosophila melanogaster. J Neurosci. 2, 271-280 (2005).
- Zeitouni, B. Signalling pathways involved in adult heart formation revealed by gene expression profiling in Drosophila. PLoS Genet. 10, 1907-1921 (2007).
- Robertson, C. W. The metamorphosis of Drosophila melanogaster, including an accurately timed account of the principal morphological change. J. Morphol. 2, 351-399 (1936).
- Miller, A. . The internal anatomy and histology of the imago of Drosophila melanogaster. , (1950).
- Rizki, T. M. The circulatory system and associated cells and tissues. , (1978).
- Cammarato, A. Myosin transducer mutations differentially affect motor function, myofibril structure, and the performance of skeletal and cardiac muscles. Mol Biol Cell. 2, 553-562 (2008).
- Taghli-Lamallem, O. Dystrophin deficiency in Drosophila reduces lifespan and causes a dilated cardiomyopathy phenotype. Aging Cell. 2, 237-249 (2008).
- Kelso, R. J. a database documenting a GFP protein-trap insertion screen in Drosophila melanogaster. Nucleic Acids Res. 32, D418-D420 (2004).
- Dietzl, G. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 7150, 151-156 (2007).
- Mery, A. The Drosophila muscle LIM protein, Mlp84B, is essential for cardiac function. J Exp Biol. 211, 15-23 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır