Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Marcaje fluorescente de Drosophila Estructuras del Corazón
En este artículo
Resumen
Aquí se describe un protocolo básico para el marcaje fluorescente de diferentes elementos de los tubos de corazón de la larva y el adulto Drosophila melanogaster. Estas muestras son adecuadas para las imágenes a través de microscopía de fluorescencia confocal o. Esta técnica permite el análisis estructural detallado de las características de los corazones de un organismo modelo de gran alcance.
Resumen
La
Protocolo
Antes de empezar
- Prepare las siguientes soluciones:
- buffer relajante (artificial hemolinfa Drosophila (ADH) (véase "Visualización de los latidos del corazón en Drosophila") que contiene 10 mM EGTA)
- fijador (formaldehído al 4% en PBS 1x)
- PBSTx (PBS con 0,1% Triton-X-100)
- Convenientemente diluida primaria y especies específicas de la etiqueta fluorescente secundaria de anticuerpos en PBSTx
- Diseccionar Drosophila para exponer los tubos cardíacos (de moscas adultas y / o larvas), tras
- la semi-intacta corazón Drosophila preparación del protocolo de "visualizar el corazón latiendo en Drosophila", o
- Drosophila larval NMJ disección 1 del protocolo con las siguientes modificaciones: Use oxigenada ADH durante la disección de larvas y desplazar el pasador posterior ligeramente de la línea media ventral. Las larvas se cortan a lo largo de la línea media ventral. No remover el tejido antes de la fijación.
La tinción fluorescente
- Compruebe que todos los corazones están latiendo en rítmicamente oxigenada ADH. Colocar inmediatamente ADH con relajantes buffer. Examine cada tubo cardíaco para asegurar las contracciones se inhiben.
- Fijar los corazones mediante la sustitución de la memoria intermedia de relax con fijador. Incube a temperatura ambiente durante 20 minutos con agitación suave. (Para agitar la preparación de las larvas no es necesario en cualquier etapa, y puede ser considerado perjudicial para la integridad del tejido cardíaco).
- Lávese las muestras tres veces durante diez minutos con PBSTx a temperatura ambiente con agitación continua.
- Para los adultos, cuidadosamente Recorte los bordes de la cutícula ventral abdominal, que lo que queda es más elíptica y menos redondeada. Además, con un solo corte entre el abdomen y el tórax, cuidadosa y limpiamente separar ambos segmentos del cuerpo y asegurar el mínimo daño a la región anterior del corazón. Por los corazones de larvas, retire con cuidado la grasa corporal utilizando unas pinzas finas. La eliminación de grasa deben ser ejecutados con extrema precaución, ya que el corazón de larvas es muy frágil y tiene muy poco apoyo de otros músculos o del tejido conectivo. No quite las ramas traqueal, ya que puede dañar el corazón.
- Transferencia de la región dorsal recortada de la cutícula abdominal por los bordes, evitando el contacto con el tubo situado en el centro cardíaco, en una placa de 96 pocillos con pozos que contienen desde 50 hasta 100 l de anticuerpo primario diluido en PBSTx. Por no más de 12 muestras por pozo. Incube a temperatura ambiente durante 2 horas con agitación continua. Incubación también se puede hacer durante la noche a 4 ° C.
- Eliminar la solución de anticuerpo primario. Lavar el corazón tres veces durante diez minutos con 100 PBSTx l a temperatura ambiente con agitación continua.
- Tras la retirada del tampón de lavado final, añadir 100 ml de anticuerpo secundario en PBSTx, complementado con Alexa594-phalloidin (1:1000). Incubar durante una hora con agitación continua a temperatura ambiente. Mantener las muestras cubiertas para evitar fluoróforo blanqueo.
- Después de la incubación secundaria, lavar el corazón tres veces durante diez minutos con 100 l de PBSTx a temperatura ambiente con agitación continua. Mantener las muestras cubiertas a lo largo de las etapas de lavado.
- Para la eliminación de Triton-X-100, aclare el corazón por última vez en 100 l de PBS durante 10 minutos. Las muestras se pueden almacenar en la oscuridad a 4 ° C durante varios días antes del montaje.
Montaje de los corazones de adultos
- Se adhieren dos de 18 x 18 mm cubreobjetos a un portaobjetos de microscopio con 10 l de medio Vectashield montaje. Los cubreobjetos se deben espaciar ~ 10-15 mm. Coloque una pequeña gota de tercero medio de montaje en entre los dos cubreobjetos.
- Ponga 20 l de Vectashield en el centro de un cubre terceros.
- Retire con cuidado cada uno de los corazones de la solución de lavado PBS por los bordes extremos de la cutícula, y suavemente coloque su corazón hacia abajo sobre la gota de medio de montaje sobre el cubreobjetos terceros. Por no más de cinco corazones por gota sobre el cubreobjetos.
- Compruebe bajo un microscopio para asegurar que todos los corazones están mirando hacia abajo.
- Con cuidado, invertir el cubreobjetos que contiene el corazón y la rapidez con que el lugar de la diapositiva que contiene el par de cubreobjetos de tal manera que la gota con fusibles tubos cardíaco con la gota Vectashield entre los dos cubreobjetos. Un "puente" debe ser formado por el cubreobjetos. Los corazones serán suspendidos entre un cubreobjetos y portaobjetos de microscopio.
- Compruebe bajo un microscopio para asegurarse de que los corazones están mirando hacia arriba.
- Fix cubreobjetos en sus bordes con esmalte de uñas.
- El corazón está listo para ser fotografiado por fluorescentes o de cmicroscopía onfocal.
Montaje de los corazones de larvas
- Coloque una gota (aproximadamente 20 l) Vectashield en un portaobjetos de microscopio.
- Cuidado de transferencia de hasta dos muestras de larvas en el Vectashield y orientarlos lado dorsal por el uso de agujas de tungsteno.
- Individualmente arrastrar las muestras de medio de montaje y de alinear cada en paralelo.
- Coloque un cubreobjetos en lados opuestos de la muestra. Con unas pinzas, coloque un cubreobjetos tercera en la parte superior, por primera vez por un lado, por la que se sobre el cubreobjetos posterior y bajándola hasta el cubreobjetos anterior, formando así un puente. Las fuerzas capilares causará un flujo de Vectashield de posterior a anterior, que ayuda a la correcta alineación del corazón larval.
- Arreglar todos los cubreobjetos en su lugar, en sus bordes, con esmalte de uñas y cuidado rellenar el espacio entre los cubreobjetos Vectashield con 20-30 l.
- Sellar con esmalte de uñas y se almacenan a 4 ° C, o para almacenamiento a largo plazo a -20 ° C.
Resultados representante
Cuando se ejecuta correctamente, todos los componentes y los tejidos del vaso dorsal deben permanecer intactos y se visualiza fácilmente. La fluorescencia de fondo debe ser mínimo. Para los adultos, el ventral manchas longitudinales capa muscular muy bien y produce una señal importante (Figura 1 y Figura 2). Los cardiomiocitos circular subyacente sin embargo, tienden a no producir una señal tan intenso como el de la capa que recubre ventral. Los miocitos de la anterior "cámara cónica" del corazón adulto contienen una cantidad considerable de material contráctil y, en consecuencia, esta región aparece como la relación más sólida con el resto del tubo cardíaco. El corazón de larvas muestra una espiral arreglo miofibrilar similar a la de los cardiomiocitos adultos contráctil (Figura 3).
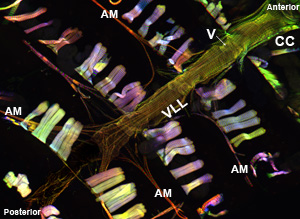
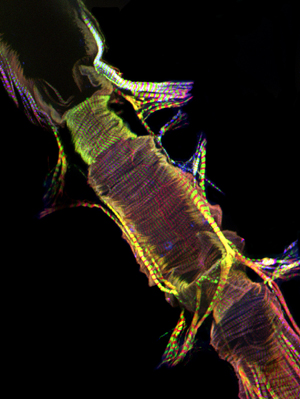
Figura 1: Inicio. Una micrografía fluorescente que muestra todo el tubo cardíaco de un adulto Drosophila melanogaster, que expresa la miosina-GFP. La imagen fue tomada con un microscopio Zeiss Imager Z1 fluorescentes equipados con un módulo ApoTome deslizamiento. Miosina-GFP se muestra en verde, la actina se tiñe con AlexaFluor phalloidin ® 594 (roja) y α-actinina se etiqueta con anti-α-actinina anticuerpos (azul). Tenga en cuenta el procedimiento de preparación permite la recuperación de las muestras de corazón con estructuras bien conservadas. CC = cónica cámara; AM = músculo Alary, V = válvula interna; VLL = capa muscular longitudinal ventral. Parte inferior. Una región de la trompa de un adulto cardiaca de la CC a través del segmento abdominal tercero del corazón justo debajo de la capa ventral longitudinal que muestra la disposición de las miofibrillas en espiral de los cardiomiocitos contráctiles.
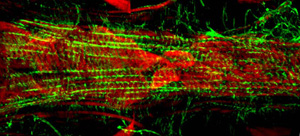
Figura 2: Representante confocal pilas de una porción anterior del corazón adulto teñidas con phalloidin AlexaFluor ® 594 (rojo) y un anti-Pericardin (colágeno tipo IV) (verde) de anticuerpos. Pericardin se asocia con el corazón a lo largo de la superficie ventral, probablemente procedentes de las miofibrillas orientadas longitudinalmente de la capa muscular ventral.

Figura 3: Una micrografía fluorescente del segmento A7 del corazón propio de una etapa de tres larvas de Drosophila. La imagen fue tomada con un microscopio Zeiss Imager Z1 fluorescentes equipados con un módulo ApoTome deslizamiento. Actina se etiqueta con AlexaFluor phalloidin ® 594 (verde) y α-actinina se tiñeron con anti-α-actinina anticuerpos (rojo).
Discusión
Aquí se presenta un protocolo útil para la preparación y la tinción de la embarcación Drosophila melanogaster dorsal y los tejidos a través de imágenes de microscopía de fluorescencia confocal o. Ofrecemos un relato conciso de los pasos y refinado por empleado comúnmente en nuestro laboratorio para la tinción de efectivo que permita bien resueltos en las imágenes in situ de las larvas y adultos tubos corazón Drosophila. Otros han descrito métodos similares en forma abrevi...
Agradecimientos
Los autores agradecen SI Bernstein (San Diego State University) para la lectura crítica y sugerencias relativas a la preparación de este manuscrito. Este trabajo fue apoyado por subvenciones del NIH para SI Bernstein, SDSU, y R. Bodmer, BIMR, y por una beca post-doctoral de la Filial Oeste de los Estados de la Asociación Americana del Corazón para G. Vogler y A. Cammarato.
Materiales
| Name | Company | Catalog Number | Comments | |
| Ethylene glycol-bis (2-amino-ethylether) -N,N,N’,N’-tetra-acetic acid (EGTA) | Reagent | Sigma-Aldrich | E4378 | |
| Formaldehyde, 10%, methanol free, Ultra Pure | Reagent | Polysciences, Inc. | 50-00-0 | |
| Triton-X-100 | Reagent | Sigma-Aldrich | 9002-93-1 | |
| Alexa Fluor® 594 phalloidin | Reagent | Invitrogen | A12381 | |
| Vectashield® Mounting Medium for Fluorescence with DAPI | Reagent | Vector Laboratories | H-1200 | |
| Tungsten pins | Reagent | Fine Science Tools | 26002-10 | |
| Pin holder | Reagent | Fine Science Tools | 26018-17 |
Referencias
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. , (2009).
- Molina, M. R., Cripps, R. M. Ostia, the inflow tracts of the Drosophila heart, develop from a genetically distinct subset of cardial cells. Mech Dev. 1, 51-59 (2001).
- Dulcis, D., Levine, R. B. Glutamatergic innervation of the heart initiates retrograde contractions in adult Drosophila melanogaster. J Neurosci. 2, 271-280 (2005).
- Zeitouni, B. Signalling pathways involved in adult heart formation revealed by gene expression profiling in Drosophila. PLoS Genet. 10, 1907-1921 (2007).
- Robertson, C. W. The metamorphosis of Drosophila melanogaster, including an accurately timed account of the principal morphological change. J. Morphol. 2, 351-399 (1936).
- Miller, A. . The internal anatomy and histology of the imago of Drosophila melanogaster. , (1950).
- Rizki, T. M. The circulatory system and associated cells and tissues. , (1978).
- Cammarato, A. Myosin transducer mutations differentially affect motor function, myofibril structure, and the performance of skeletal and cardiac muscles. Mol Biol Cell. 2, 553-562 (2008).
- Taghli-Lamallem, O. Dystrophin deficiency in Drosophila reduces lifespan and causes a dilated cardiomyopathy phenotype. Aging Cell. 2, 237-249 (2008).
- Kelso, R. J. a database documenting a GFP protein-trap insertion screen in Drosophila melanogaster. Nucleic Acids Res. 32, D418-D420 (2004).
- Dietzl, G. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 7150, 151-156 (2007).
- Mery, A. The Drosophila muscle LIM protein, Mlp84B, is essential for cardiac function. J Exp Biol. 211, 15-23 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados