需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
浆液性卵巢癌原位模型在免疫小鼠,为在体内肿瘤显像和肿瘤免疫反应的监测
摘要
研究在体内肿瘤的生长和肿瘤微环境中,我们用在免疫动物的同源和原位卵巢癌的小鼠模型。我们转Katushka荧光蛋白(MOV1一只老鼠的肿瘤细胞株(MOV1) KAT),我们在这里展示其在卵巢原位移植和在体内成像。
摘要
背景:卵巢癌是一般诊断为晚期的情况下/病死率高,因此仍是最致命之间的美国妇女1,2,3的所有妇科恶性肿瘤。浆液性肿瘤卵巢癌的最普遍的形式和4,5 TG - MISIIR标签转基因是唯一的,自发地发展这种类型的肿瘤的小鼠模型。 TG - MISIIR标签小鼠表达SV40病毒转化地区的苗勒氏管抑制物质II型受体(MISIIR) 第 6基因启动子的控制之下。额外的转基因株系已经确定,表达转基因SV40的标签,但不发展卵巢肿瘤。非肿瘤易感小鼠C57BL / 6小鼠表现出典型的寿命和肥沃。这些小鼠可用于隔离TG - MISIIR - TAG - DR26小鼠肿瘤细胞同源移植。
目的:虽然肿瘤显像7,小动物活体深部肿瘤的早期发现是具有挑战性的。为了使浆液性卵巢癌的免疫完整的动物模型的临床前研究,我们描述了一个这种类型的卵巢癌,在活体成像,肿瘤微环境与肿瘤的免疫反应的研究许可证的同源小鼠模型。
方法:我们首先来自收获一种自发的在26周岁的DR26 TG - MISIIR标签的女性卵巢肿瘤标记+鼠标癌症细胞株(MOV1 )。然后,我们稳定转导MOV1 TurboFP635的慢病毒哺乳动物载体,编码Katushka, 海葵Entacmaea quadricolor红色荧光蛋白635分之588 纳米 8,9,10极大激发/发射远红外突变细胞。我们原位植入MOV1 吉非肿瘤容易发生TG - MISIIR标签女性小鼠卵巢11,12,13,14。其次是在体内光学成像和肿瘤微环境是由免疫组织化学分析的肿瘤进展。
结果:原位植入MOV1 吉细胞浆液性卵巢肿瘤。 MOV1 吉肿瘤可以在活体成像的可视化由植入后3周(图1),并与白细胞浸润,15(图2)在人类卵巢癌的观察。
结论:我们描述了一个卵巢癌原位模型, 适合在高pH值的稳定,并在深部组织Katushka耐光由于早期肿瘤的体内成像。我们建议使用这种新颖的浆液性卵巢癌的同源模型,在活体成像的研究和监测肿瘤的免疫反应和免疫疗法。
研究方案
1。细胞培养
- 前原位注射,文化MOV1 吉细胞,DR26肿瘤所得在T175烧瓶,直到他们90%融合。计划用1至5亿个细胞,每次注射,这将需要1或2 T175烧瓶。
- 注射当天,收获细胞,并确定使用血球细胞数。
- 一旦细胞浓度已经确定,颗粒细胞离心5分钟,在室温下在300 X克。
- 旋转,悬浮细胞,在10微升无菌PBS 1万,0.002 M EDTA
2。手术前
- 手术前,填补了一个3/10cc胰岛素注射器1万MOV1 吉在10微升的PBS EDTA细胞。
- 转让isofluorane麻醉鼠标加热垫。添加眼药膏,以防止眼部脱水。然后,立即插入一个鼻锥系统连接到一个异氟醚蒸发器,以提供整个手术的麻醉动物的头部。
- 注射部位用酒精棉签消毒后,皮下注入酮洛芬,术前镇痛药5毫克/公斤,与3/10cc胰岛素注射器。
- 使用快船,刮背的左边,从胸腰椎交界的尾部部分动物尾巴的基地。应用脱毛膏彻底清除头发。然后,取出用湿纸巾的过量。
- 一旦头发已被删除,消毒用碘伏和酒精棉签剃光面积。然后,将手术切口区周围的悬垂。
3。外科
- 只需在手术前,调整至1.5%的异氟醚蒸发器水平。
- 验证捏垫脚的动物是完全麻醉。
- 接下来,找到皮肤下的脾脏。然后用手术剪,一个背外侧切口长1-2厘米,脾右上方。
- 解剖后腹膜。将观察到小鼠卵巢周围的垫。用弯钳把握和暴露小鼠卵巢周围的脂肪垫。
- 水合物的器官与一些滴无菌PBS。
- 用弯钳把握,收回... ...位置... ...然后安全注射卵巢
- 虽然牢牢把握镊子卵巢,卵巢注入MOV1 吉肿瘤细胞的10微升。一个牢牢把握,防止液体返流或泄漏。
- 注射后立即释放镊子施加的张力。卵巢穿孔自发地缩回并关闭。
- 使用可吸收聚乙醇酸缝合针,关闭复古腹膜伤口。
- 推出动物的鼻锥。
- 拉伸皮肤和几滴组织粘合剂与密封背侧的伤口边缘。
- 最后,口服抗生素管理100微升的动物。然后将它在笼子里,并恢复显示器。一个星期保持在饮水中的抗生素的动物。
活体成像4。
- MOV1 吉肿瘤细胞原位注射一个星期后, 在体内成像执行。开始转移isofluorane麻醉鼠标成像室。
- 关闭异氟醚蒸发器的水平下降到2%。
- 根据成像系统制造商的指示执行,在体内成像。在这个视频,Lumina的系统将被使用。
- 形象,点击的生活图像软件桌面上的图标。然后,在IVIS采集控制面板,选择“初始化”。仪器设置类似的相机设置
- 在收购控制面板设置仪器的采集参数。荧光,检查“荧光”。点击照片框,以获取与每一个形象照片。
- 接下来,设置为自动曝光时间。根据“像素合并或CCD分辨率”,“中等”。的F /停止或光圈,然后根据检查的值2。下一步,选择535激发滤光片和DsRed的排放过滤器。
- 根据视野,形象一个单一的鼠标点击视图B。
- 然后,点击获得的图像采集开始。
- 一旦完成图像采集,使用感兴趣区域,或投资回报率,信号的工具来测量。测量图示上按一下释放的信号值和面积。
- 最后,点击“保存”,保存在用户文件夹中的图像
- 已保存的图像后,停止异氟醚的管理和鼠标返回到笼子里。鼠标应该立即起床。
5。代表性的成果
使用此协议原位卵巢癌的生长, 在体内可以监控使用一种非侵入性的程序至少3周。
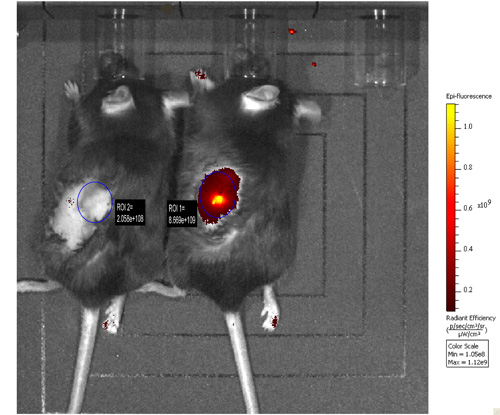
图1。MOV1 吉细胞,PBS为阴性对照,原位注入卵巢非肿瘤易感小鼠(对动物和左边的动物,分别)。 体内成像2周后进行。 MOV1 吉在卵巢嫁接的细胞所产生的荧光发射测量,与阴性对照组小鼠相比。
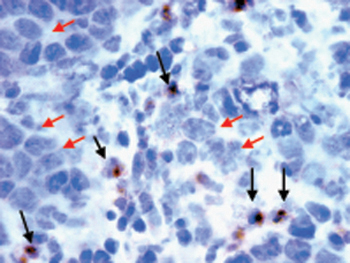
图2。MOV1 吉卵巢肿瘤冰冻切片染色与生物素标记的抗CD4单克隆抗体由民建联基板(深褐色)检测肿瘤浸润淋巴细胞(黑色箭头)。细胞counterstained甲基绿色可视化细胞的细胞核(蓝色)。 T细胞的形态,从不同的肿瘤细胞(红色箭头)。幻灯片的显示放大40倍。
讨论
手术和原位注射
卵巢囊原位注射要求的培训和精度。因此
- 可怜的手术经验,实践与尸体第一。
- 使用优先multiparous女性(一个或两个升)作为他们发展,随着时间的推移有利于注射和提高生存与未产妇女性更大卵巢。
- 由于小鼠卵巢囊体积小,使用的最小可用针头大小的大力鼓励。
在活体成像
- 始终使用荧光,如1.5毫升...
披露声明
致谢
这项工作是支持由美国国立卫生研究院授予P01人工智能068730(SNC,NS),美国国立卫生研究院授予CA016520 / TAPITMAT(NS),从Claneil基金会(NS)的私人资金,和卵巢孢子授予“气候变化框架公约”和美国宾夕法尼亚大学( P50 CA83638)和福克斯蔡斯癌症中心的核心格兰特(P30 CA06927)(DCC)的。作者感谢的光/生物发光博士EJ Delikatny执导,安东尼秘密的宾夕法尼亚大学在美国宾夕法尼亚州癌症大学博士G. Danet - Desnoyers定向干细胞和异种核心的核心,优秀的技术援助中心培训SNC的原位注射技术,在美国宾夕法尼亚州/ OCRC大学Denada Dangaj协助手术。
材料
| Name | Company | Catalog Number | Comments |
| DMEM-GLUTAMAX | Invitrogen | 10564-011 | |
| PBS | GIBCO, by Life Technologies | 14040 | |
| Versene | Lonza Inc. | 17-711E | |
| Heating pad | Deltaphase | 39 DP | |
| Povidone pads | Dynarex | 1108 | |
| Alcohol pads | Fisher Scientific | 06-669-62 | |
| Artificial tears ointment | Phoenix Pharmaceuticals, Inc. | 17845-153 | |
| Ketoprofen | Fort Dodge Animal Health | ||
| 3cc/insulin syringe | BD Biosciences | 309301 | |
| Polyg Polyglycolic Acid suture/needle (3/8 19mm) | Syneture | 9612-31 | |
| Tissue adhesive | Vetbond | 3M | |
| Vet Bactrim/ oral suspension | Hi-tech Pharmacal | 840823 | |
| IVIS-Lumina | Caliper Life Sciences | ||
| Isofluorane | Phoenix Pharmaceuticals, Inc. | J108013 | |
| Fetal Bovine Serum, Qualified | Invitrogen | 10437036 | |
| Penicillin/streptomycin | GIBCO, by Life Technologies | 15140 | |
| TurboFP635 mammalian vector | Evrogen | FP721 | |
| T175 flasks | cellstar | 660-190 |
参考文献
- Etzioni, R., et al. The case for early detection. Nat Rev Cancer. 3, 243-252 (2003).
- Sasaroli, D., Coukos, G., Scholler, N. Beyond CA125: the coming of age of ovarian cancer biomarkers. Are we there yet. Future Medicine. 3, 275-288 (2009).
- Anderson, G. L., et al. Assessing Lead Time of Selected Ovarian Cancer Biomarkers: A Nested Case Control Study. J Natl Cancer Inst. 102, 26-38 (2010).
- Auersperg, N., Wong, A. S., Choi, K. C., Kang, S. K., Leung, P. C. Ovarian surface epithelium: biology, endocrinology, and pathology. Endocr Rev 22. , 255-288 (2001).
- Dubeau, L. The cell of origin of ovarian epithelial tumours. Lancet Oncol. 9, 1191-1197 (2008).
- Connolly, D. C., et al. Female mice chimeric for expression of the simian virus 40 TAg under control of the MISIIR promoter develop epithelial ovarian cancer. Cancer Res. 63, 1389-1397 (2003).
- Hensley, H., et al. Magnetic resonance imaging for detection and determination of tumor volume in a genetically engineered mouse model of ovarian cancer. Cancer Biol Ther. 6, (2007).
- Deliolanis, N. C., et al. Performance of the red-shifted fluorescent proteins in deep-tissue molecular imaging applications. J Biomed Opt. 13, (2008).
- Hoffman, R. M. A better fluorescent protein for whole-body imaging. Trends Biotechnol. 26, (2008).
- Shcherbo, D., et al. far-red fluorescent protein for whole-body imaging. Nat Methods. 4, 741-746 (2007).
- Fu, X., Hoffman, R. M. Human ovarian carcinoma metastatic models constructed in nude mice by orthotopic transplantation of histologically-intact patient specimens. Anticancer Res. 13, 283-286 (1993).
- Kiguchi, K., et al. A patient-like orthotopic implantation nude mouse model of highly metastatic human ovarian cancer. Clinical & experimental metastasis 16. , 751-756 (1998).
- Bao, R., et al. Activation of cancer-specific gene expression by the survivin promoter. J Natl Cancer Inst. 94, 522-528 (2002).
- Connolly, D. C., Hensley, H. H. Xenograft and Transgenic Mouse Models of Epithelial Ovarian Cancer and Non Invasive Imaging Modalities to Monitor Ovarian Tumor Growth In situ -Applications in Evaluating Novel Therapeutic Agents. Current Protocols in Pharmacology 45. , 1-36 .
- Milne, K., et al. Systematic analysis of immune infiltrates in high-grade serous ovarian cancer reveals CD20, FoxP3 and TIA-1 as positive prognostic factors. , (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。