Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Ортотопическая Модель серозного рака яичников у иммунокомпетентных мышей для В естественных условиях Опухоль изображений и мониторинг иммунного ответа опухоли
В этой статье
Резюме
Для изучения В естественных условиях Рост опухоли и микроокружения, мы использовали сингенных и ортотопической мышиной модели рака яичников у иммунокомпетентных животных. Мы трансдуцированных клетка опухоли мышей линии (MOV1) с Katushka флуоресцентный белок (MOV1 KAT), И здесь мы показываем свою ортотопической имплантации в яичнике и В естественных условиях Изображений.
Аннотация
Background: Ovarian cancer is generally diagnosed at an advanced stage where the case/fatality ratio is high and thus remains the most lethal of all gynecologic malignancies among US women 1,2,3. Serous tumors are the most widespread forms of ovarian cancer and 4,5 the Tg-MISIIR-TAg transgenic represents the only mouse model that spontaneously develops this type of tumors. Tg-MISIIR-TAg mice express SV40 transforming region under control of the Mullerian Inhibitory Substance type II Receptor (MISIIR) gene promoter 6. Additional transgenic lines have been identified that express the SV40 TAg transgene, but do not develop ovarian tumors. Non-tumor prone mice exhibit typical lifespan for C57Bl/6 mice and are fertile. These mice can be used as syngeneic allograft recipients for tumor cells isolated from Tg-MISIIR-TAg-DR26 mice.
Objective: Although tumor imaging is possible 7, early detection of deep tumors is challenging in small living animals. To enable preclinical studies in an immunologically intact animal model for serous ovarian cancer, we describe a syngeneic mouse model for this type of ovarian cancer that permits in vivo imaging, studies of the tumor microenvironment and tumor immune responses.
Methods: We first derived a TAg+ mouse cancer cell line (MOV1) from a spontaneous ovarian tumor harvested in a 26 week-old DR26 Tg-MISIIR-TAg female. Then, we stably transduced MOV1 cells with TurboFP635 Lentivirus mammalian vector that encodes Katushka, a far-red mutant of the red fluorescent protein from sea anemone Entacmaea quadricolor with excitation/emission maxima at 588/635 nm 8,9,10. We orthotopically implanted MOV1Kat in the ovary 11,12,13,14 of non-tumor prone Tg-MISIIR-TAg female mice. Tumor progression was followed by in vivo optical imaging and tumor microenvironment was analyzed by immunohistochemistry.
Results: Orthotopically implanted MOV1Kat cells developed serous ovarian tumors. MOV1Kat tumors could be visualized by in vivo imaging up to three weeks after implantation (fig. 1) and were infiltrated with leukocytes, as observed in human ovarian cancers 15 (fig. 2).
Conclusions: We describe an orthotopic model of ovarian cancer suitable for in vivo imaging of early tumors due to the high pH-stability and photostability of Katushka in deep tissues. We propose the use of this novel syngeneic model of serous ovarian cancer for in vivo imaging studies and monitoring of tumor immune responses and immunotherapies.
протокол
1. Культуре клеток
- Перед ортотопической инъекции, культуры MOV1 Kat клетки, полученные из DR26 опухолей, в T175 колбу, пока они не 90% вырожденная. План использования от 1 до 5 миллионов клеток на инъекцию, для чего потребуется 1 или 2 T175 колб.
- В день инъекции, урожай клеток и определить номер ячейки использованием гемоцитометра.
- Как только концентрации клеток было определено, пеллет клетки центрифугированием в течение 5 минут при 300 Х г при комнатной температуре.
- После спина, ресуспендируют клетки иметь 1 миллион в 10 мкл стерильной PBS с 0,002 М ЭДТА
2. Предварительно хирургии
- До операции, пополнить 3/10cc шприц инсулина с 1 млн. MOV1-Кат клеток в 10 мкл PBS ЭДТА.
- Передача isofluorane наркозом мыши грелку. Добавить глазную мазь, чтобы предотвратить обезвоживание глаз. Затем сразу же вставить голову животного в системе носового конуса связаны с изофлуран испарителя доставить анестезии всей операции.
- После дезинфекции место инъекции спиртом тампоны, подкожно вводят 5 мг / кг Кетопрофен, предоперационная болеутоляющее, с 3/10cc шприц инсулина.
- Использование кусачки, бриться левой хвостовой части спинки от грудопоясничного перехода к основанию хвоста животного. Нанесите крем удаления волос для полного удаления волос. Затем удалите излишки с мокрым бумажным полотенцем.
- Как только волосы были удалены, стерилизовать бритой области с повидон-йодом и спиртом тампоны. Затем поместите хирургических драпировать вокруг области разреза.
3. Хирургия
- Незадолго до операции, регулировать уровни изофлуран испаритель до 1,5%.
- Убедитесь, что животное полностью под наркозом, зажимая ногу площадку.
- Затем найдите селезенки под кожей. Затем, используя хирургические ножницы, чтобы дорсолатеральной разрез 1-2 см в длину на правой верхней части селезенки.
- Рассеките забрюшинного пространства. Площадку окружающих мыши яичников будет наблюдаться. Использование изогнутых щипцов для восприятия и подвергать жировой ткани окружающие мыши яичника.
- Гидратов орган с несколько капель стерильного PBS.
- Использование изогнутых щипцов для понимания, убрать ... Позиция ... и затем закрепите яичников для инъекций
- Решительно схватив яичника с щипцами, вводят 10 мкл MOV1 клетки Kat опухоли в яичниках. Твердое понимание позволит предотвратить срыгивание жидкости или утечки.
- Сразу же после инъекции, снять напряжение со стороны щипцами. Перфорация в яичнике должно спонтанно отказаться и закрыть.
- Использование рассасывающиеся нити кислота полигликолевой прилагается к игле, рядом ретро-брюшины раны.
- Выпуск животного от носа конус.
- Натяжные кожи и печатью дорсолатеральной краев раны с несколькими каплями клея ткани.
- Наконец, устно управлять 100 мкл антибиотики для животных. Затем поместите его обратно в клетку и монитор для восстановления. Держите животное на антибиотики в питьевой воде в течение одной недели.
4. В естественных изображений
- Через неделю после ортотопической инъекции MOV1 клетки Kat опухоль, выполняют в области обработки изображений естественных условиях. Начните с передачи isofluorane наркозом мыши изображения камеры.
- Включите изофлуран уровня испарителя до 2%.
- Выполните в естественных изображений в соответствии с инструкциями изготовителя изображения системы. В этом видео, системы Lumina будет использоваться.
- Чтобы создать образ, нажмите живой образ программного обеспечения на рабочем столе. Затем, на панели управления Приобретение ИВИС, выберите "Initialize". Настройки прибора аналогичны настройки камеры
- На панели управления приобретение создана приобретение инструмента параметров. Для флуоресценции, установите флажок "Лампа дневного света." Нажмите Фотография поле, чтобы приобрести фотографии с каждого изображения.
- Далее, установите выдержку как Auto. В разделе "Pixel биннинга или CCD разрешение", установите флажок "Medium". Тогда в F / стоп или диафрагмы, проверьте значение 2. Далее, выберите фильтр 535 возбуждения и DsRed фильтра выбросов.
- Под полем зрения, щелкните по View B имиджу одной мыши.
- Затем нажмите на приобретение, чтобы начать захвата изображений.
- После получения изображения завершена, использования области интереса, или ROI, инструмент для измерения сигнала. Нажмите на иконку для измерения выпуска значений сигнала и области.
- Наконец, нажмите кнопку "Сохранить" для сохранения изображения в папке пользователя
- После того, как изображения были сохранены, остановить администрации изофлуран и вернуть мышь в клетку. Мышь должна проснуться немедленно.
5. Представитель Результаты
-С помощью этого протокола, В естественных условиях роста из ортотопической рака яичников можно наблюдать в течение 3 недель, используя неинвазивные процедуры.
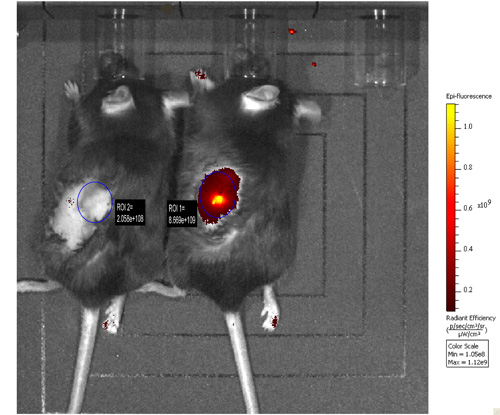
Рисунок 1. MOV1 Kat клеток, или PBS в качестве отрицательного контроля, были orthotopically вводят в яичнике неопухолевой склонны мыши (правая и левая животных и животных соответственно). В естественных изображений была выполнена через 2 недели. Флуоресценции выбросов, полученных от MOV1 клетки Kat привиты в яичнике было измерено и по сравнению с тем, от отрицательных управление мышью.
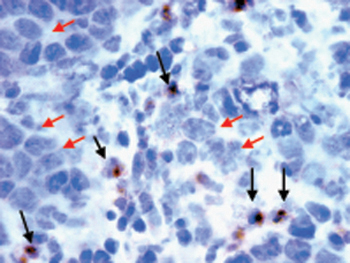
Рисунок 2. Замороженные разделы MOV1 опухолей яичников Kat окрашивали биотинилированного анти-CD4 мАт следуют DAB подложки (темно-коричневый) для обнаружения опухоли проникают лимфоциты (черная стрелка). Клетки контрастно с метил-зеленый для визуализации клеточных ядер (синий). Опухолевые клетки (красные стрелки) были морфологически отличие от Т-клеток. Слайд появляется увеличенное 40x.
Обсуждение
Хирургии и Ортотопическая инъекций
Ортотопическая инъекций в яичниках сумки требует подготовки и точности. Таким образом
- В случае плохой хирургический опыт, практика с трупов в первую очередь.
- Использование преимущественно повторнородящих женщин (один или...
Раскрытие информации
Благодарности
Эта работа была поддержана NIH грант P01 А.И. 068730 (SNC, Н. С.), грант NIH CA016520 / TAPITMAT (NS), частное финансирование из Фонда Claneil (NS) и яичников SPORE предоставить РКИК и Университета Пенсильвании ( P50 CA83638) и Fox Chase Cancer Center Основные Грант (P30 CA06927) (ДКК). Авторы выражают благодарность отличном техническом содействии оптический / Биолюминесценция Основные фонда направлено доктором Э. Delikatny в Университете Пенсильвании, Энтони Secreto из стволовых клеток и ксенотрансплантата Основные режиссера д-р Г. Дане-Денуайе в Университете Пенсильвании рака Центр подготовки к SNC ортотопической технике инъекций и Denada Dangaj в Университете штата Пенсильвания / ОЦРК для оказания помощи по хирургии.
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM-GLUTAMAX | Invitrogen | 10564-011 | |
| PBS | GIBCO, by Life Technologies | 14040 | |
| Versene | Lonza Inc. | 17-711E | |
| Heating pad | Deltaphase | 39 DP | |
| Povidone pads | Dynarex | 1108 | |
| Alcohol pads | Fisher Scientific | 06-669-62 | |
| Artificial tears ointment | Phoenix Pharmaceuticals, Inc. | 17845-153 | |
| Ketoprofen | Fort Dodge Animal Health | ||
| 3cc/insulin syringe | BD Biosciences | 309301 | |
| Polyg Polyglycolic Acid suture/needle (3/8 19mm) | Syneture | 9612-31 | |
| Tissue adhesive | Vetbond | 3M | |
| Vet Bactrim/ oral suspension | Hi-tech Pharmacal | 840823 | |
| IVIS-Lumina | Caliper Life Sciences | ||
| Isofluorane | Phoenix Pharmaceuticals, Inc. | J108013 | |
| Fetal Bovine Serum, Qualified | Invitrogen | 10437036 | |
| Penicillin/streptomycin | GIBCO, by Life Technologies | 15140 | |
| TurboFP635 mammalian vector | Evrogen | FP721 | |
| T175 flasks | cellstar | 660-190 |
Ссылки
- Etzioni, R., et al. The case for early detection. Nat Rev Cancer. 3, 243-252 (2003).
- Sasaroli, D., Coukos, G., Scholler, N. Beyond CA125: the coming of age of ovarian cancer biomarkers. Are we there yet. Future Medicine. 3, 275-288 (2009).
- Anderson, G. L., et al. Assessing Lead Time of Selected Ovarian Cancer Biomarkers: A Nested Case Control Study. J Natl Cancer Inst. 102, 26-38 (2010).
- Auersperg, N., Wong, A. S., Choi, K. C., Kang, S. K., Leung, P. C. Ovarian surface epithelium: biology, endocrinology, and pathology. Endocr Rev 22. , 255-288 (2001).
- Dubeau, L. The cell of origin of ovarian epithelial tumours. Lancet Oncol. 9, 1191-1197 (2008).
- Connolly, D. C., et al. Female mice chimeric for expression of the simian virus 40 TAg under control of the MISIIR promoter develop epithelial ovarian cancer. Cancer Res. 63, 1389-1397 (2003).
- Hensley, H., et al. Magnetic resonance imaging for detection and determination of tumor volume in a genetically engineered mouse model of ovarian cancer. Cancer Biol Ther. 6, (2007).
- Deliolanis, N. C., et al. Performance of the red-shifted fluorescent proteins in deep-tissue molecular imaging applications. J Biomed Opt. 13, (2008).
- Hoffman, R. M. A better fluorescent protein for whole-body imaging. Trends Biotechnol. 26, (2008).
- Shcherbo, D., et al. far-red fluorescent protein for whole-body imaging. Nat Methods. 4, 741-746 (2007).
- Fu, X., Hoffman, R. M. Human ovarian carcinoma metastatic models constructed in nude mice by orthotopic transplantation of histologically-intact patient specimens. Anticancer Res. 13, 283-286 (1993).
- Kiguchi, K., et al. A patient-like orthotopic implantation nude mouse model of highly metastatic human ovarian cancer. Clinical & experimental metastasis 16. , 751-756 (1998).
- Bao, R., et al. Activation of cancer-specific gene expression by the survivin promoter. J Natl Cancer Inst. 94, 522-528 (2002).
- Connolly, D. C., Hensley, H. H. Xenograft and Transgenic Mouse Models of Epithelial Ovarian Cancer and Non Invasive Imaging Modalities to Monitor Ovarian Tumor Growth In situ -Applications in Evaluating Novel Therapeutic Agents. Current Protocols in Pharmacology 45. , 1-36 .
- Milne, K., et al. Systematic analysis of immune infiltrates in high-grade serous ovarian cancer reveals CD20, FoxP3 and TIA-1 as positive prognostic factors. , (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены