需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
剖检诊断,并选择在大鼠和小鼠的组织和样品收集
摘要
本文介绍了进行基本的鼠标或大鼠尸检的程序,以及收集的基本器官,以及更多具有挑战性的样品类型,病理,微生物,和PCR评价。
摘要
有多个样品,可以收集从安乐死的动物,以帮助诊断或发现的动物群中的传染性病原体的类型。妥善收集进一步组织处理的组织可能会影响测试结果的质量。本文介绍了一个基本的总检查,包括识别心,肝,肺,肾,和脾,以及如何收集这些机关的行为。另外四个较困难的组织/样品采集技术演示。龙收集和灌注可以特别具有挑战性的组织需要正确的膨胀,在组织内部的秩序固定液适当的修正,以便彻底的组织学评价。本文演示了由一步一步的技术,以实现在24小时内组织的最佳固定删除肺和固定液膨胀。脑集合可以用同样的挑战,组织是软的,容易损坏。本文演示了通过一步一步的技术,从颅骨与脑组织损害最小的揭露和消除。肠系膜淋巴结是一个很好的样本类型,在其中发现许多常见的传染性病原体为肠道病毒持续在淋巴结,比他们在粪便棚。本文演示的定位,并在无菌条件下取出肠系膜淋巴结的一步一步程序。最后,呼吸道传染性病原体的鉴定可以由鼻腔和/或吸在剖检支气管液的细菌培养或PCR测试。此过程介绍了获取和准备进行细菌培养和PCR检测呼吸道吸出样品。
研究方案
1。剖检的准备工作
- 任何总尸检(总尸检)的重要组成部分,是动物的历史和调查结果的描述。
- 一个兽医病理学家读您的组织病理学幻灯片可能没有见过的动物,是靠你的背景资料。
- 准确描述你所看到之前安乐死的动物。例如,“雌性小鼠在笼子里五之一; C57BL/6N;头部倾斜的权利”或“棕色的雄性大鼠应变未知;动物刮伤;有斑片状脱发足背附近的尾巴,和头“。
- 使用清晰的,描述性的,客观的的语言。 “温和”,“温和”,并“严重”等修饰词可能是有用的,如果水平之间的截止分明。一般不建议在食品或家用物品描述事物。
- 度量衡动物,研究成果,或器官通常是有用的。一个“大脾”,你可能是一个正常的脾脏另一名观察员。说,脾措施3 ×1.5厘米提供更客观的信息。
- Photodocumentation可以是无价的。
- 遵守所有有关的职业健康和活的动物,可能具有传染性的尸体,或福尔马林等化学品的工作所需的个人防护装备。
2。毛死后的位置和心脏检查,肺,肝,肾和脾
- 收集必要物资的动物实施安乐死之前。最低限度,这应该包括一个夹层板或类似的工作表面,镊子,剪刀,容器标签,固定液,任何媒体或收集管/杯,可能有潜在需要。
- 简要评估的条件,行为和动物的运动。观察并记录呼吸模式(例如,快速,浅)以及日间能力和步态(例如,跛行,转圈,震颤)。
- 安乐死的动物,按照机构的标准程序,始终坚持AVMA指引。
- 评估动物的皮肤和毛发异常,消瘦,或脱水的身体状况。请注意任何人工操作,植入物,或手术疤痕。
- 检查所有外部窍(耳,眼,鼻,肛门,生殖器开口,口腔)。仔细观察解剖范围的建议使用。
- 奠定安乐死鼠标在背斜卧在一个干净的夹层板或类似的工作表面或鼠胴体。
- 用剪刀,切开皮肤,从肛门到下巴的ventrum全长,反映了皮肤,切开腹壁,暴露腹腔脏器,唾液和包皮/阴蒂腺和颈部和腋窝淋巴结。切左肋揭露和研究2削减横向高达每一侧胸腔,然后跨胸内脏,在胸骨上方,打开一个空间足够宽,能够彻底检查所有的叶肺。
- 检查肌肉骨骼结构的外观。
- 评估异常的所有器官。具体来说,发现和识别的心脏和肺在胸腔。具体来说,找到并确定在腹腔的肝脏,肾脏和脾脏。注意:任何颜色改变,大小有差异,丢失或mislocated机关。注意表面的一致性,任何额外的组织(例如,群众),流体的口袋,或存在的液体在腹腔/胸腔。
- 观察胃肠道的内容,或缺乏内容,加厚墙壁,群众,和/或出血支付的特别关注。切割手术刀或刀片,以检查任何异常的实质与肾脏(左纵切面,正确的截面,上中线,但偏离中心)。检查肠系膜淋巴结肿大和/或群众。
- 泌尿生殖系统检查,堵塞,流体口袋,出血或其他异常。
3。尸检收集的心,肝,肾,脾为组织病理学
- 收集适当大小,标记容器(S)充满适量的10%中性缓冲福尔马林(NBF)。调整10%NBF的金额,以获得比为20:1的固定液组织。
- 放置在一个干净的夹层板或类似的工作表面背斜卧的小鼠或大鼠胴体暴露的利益的组织。
- 取出使用镊子和剪刀的胴体组织。
- 组织应密切修剪,去除脂肪和不必要的结缔组织。组织应清洁血液;正常使用(或生理)盐水)冲洗必要的。切勿使用蒸馏水或自来水冲洗组织。
- 放入容器的10%NBF的组织。
4。事后收集和肺组织灌注
- 收集适当大小,填充适量的10%NBF标记容器(S)。为了获得比为20:1的固定液组织,调整金额的10%NBF。
- 放置在一个干净的夹层板或类似的工作表面上背斜卧的小鼠或大鼠胴体。
- 暴露气管,心脏和肺部。
- 用剪刀和镊子取出覆腹胸椎和颈椎地区的皮肤和肌肉。
- 用剪刀和镊子,取出肋骨,暴露2削减横向高达每一侧胸腔,然后跨锁骨附近打开一个空间足够宽,能够彻底检查所有的叶肺,心脏和肺部。
- 切去颈部肌肉,从胸骨和肋骨延伸到下巴,包括气管上方。
- 下方的肋骨前缘插入剪刀和2削减,对任何一方,以消除覆气管骨部分。
- 掌握与钳气管附近的下巴,并完全通过气管切开以上钳放置剪刀
- 轻轻拉扯气管向上,使用镊子,用剪刀剪断腹侧组织连接,直到胸组织整组(气管,肺,心脏,这是有时被称为“摘去”)已经从人体取出的。
- 打好肺部的工作表面上的平面。
- 松散的领带一块缝合材料或气管周围,小心不要扯紧厨房麻线。
- 与固定液填充注射器和附加针,小到足以进入气管。对于小鼠,一个用26号针头1毫升或3毫升注射器效果很好。对于大鼠,与18针注射器5ml注射器的效果很好。
- 针插入气管的开放和使用镊子举行的气管周围的针。开始缓慢地填满肺部与固定液。
- 填补肺部,直到完全充气。不要过度或underinflate。需要充分膨胀肺的固定液量不同年龄,应变和动物的健康。
- 检测液体渗出和肺组织发泡过通胀。
- 充气不足是检测肺部出现在各个领域的单位和不充分。
- 取出针从气管。
- 拧紧缝合材料或字符串周围固定液出肺部的气管,以防止回流。
- 放入固定液的膨胀肺组织的比例约20:1固定液。
5。尸检收集的大脑
- 收集适当大小,填充适量的10%NBF标记容器(S)。为了获得比为20:1的固定液组织,调整金额的10%NBF。
- 将安乐死鼠标在一个干净的夹层板或类似的工作表面上的腹卧或鼠胴体。
- 用剪刀和镊子,取出覆盖在颅骨的皮肤和肌肉。
- 用剪刀去除头完全的胴体。
- 使用小剪刀插入到枕骨大孔,打开颅骨打开椎管的底部刀片,并保持剪刀提示指出向上,开始切割直接和通过的颅骨中线。
- 使用镊子,反射回来的两半,露出大脑在颅骨。
1。在可能的情况下,放入固定液中暴露的大脑,而仍然在颅骨。这将使组织成为公司之前,从头骨取出,如果这是必需的。许多病理学家宁愿削减部分同时还从大脑在颅骨。
- 轻轻地颠倒的头骨,使重力将有助于该组织属于从头骨。
- 用弯钳,小心地将镊子沿大脑外缘,并根据大脑嗅叶开始,在大脑和小脑对移动。轻轻捏住镊子任何结缔组织或神经从头骨下降,抑制大脑。
- 将进入定影液使用脑组织近似20:1比例,以固定液。
6。尸检收集的肠系膜淋巴结(MLN)
- 组织进行PCR分析收集应使用无菌操作技术。火焰消毒,灭菌,或等价的消毒仪器应使用。
- 组装无菌Eppendorf管和无菌剪刀和镊子。
- 将安乐死鼠标在背斜卧在一个干净的夹层板或类似的工作表面或大鼠胴体。
- 使用消毒剪刀和镊子切开腹腹壁从生殖器部位的胸腔基地消除皮肤和肌肉,露出的肠子。
- MLN是位于腹腔,沿结肠,肠系膜组织在紧邻盲肠。
- 为了找到MLN,先找到盲肠,这是大,逗号形截面肠道。盲肠和结肠延伸,它往往可以由粪粒的存在鉴定。 MLN是位于沿相邻盲肠结肠肠系膜。它可以被认定为组织一个黄色,卵圆形或球形的小疙瘩白色肠系膜组织,往往是稍厚,更加坚实的质地比周围的肠系膜和脂肪。为取向必要的解剖教科书。
- 使用无菌技术操作和无菌器械MLN和地点到标有识别信息的Eppendorf管中删除。
7。尸检收集的呼吸道吸
- 组装所需的物资 - 无菌吸管,无菌剪刀和镊子,无菌解决方案,通过呼吸道刷新和一个干净的夹层板或类似的工作表面。
- 奠定安乐死鼠标在解剖板背斜卧或鼠胴体。
- 对大鼠支气管吸出,进入呼吸道气管。鼻吸在大鼠,通过气管或通过鼻咽部鼻道的访问。在小鼠支气管或鼻吸出,获得通过呼吸道鼻咽部鼻道。
- 如果鼻腔和支气管吸出物是必要的,先执行支气管吸。使用一个新的无菌吸管执行鼻吸。
- 气管接入老鼠的方法(推荐):
- 反映皮肤远离宫颈面积的揭露皮下组织。
- 取出唾液腺和颈椎肌肉,暴露气管。
- 用无菌文书,切开气管管腔允许访问。整个集合保持无菌(转到步骤7.7)。
- 鼻咽癌鼻道访问(鼻吸小鼠由于规模较小的气管和支气管吸出物,建议方法):
- 此过程可能会表现为鼻吸和支气管吸。
- 使用火焰消毒或灭菌的仪器,切断颞下颌(颚)联合,反映离上颌骨下颌骨,暴露鼻咽部鼻道。整个集合保持无菌(转到步骤7.7)。
- 绘制成无菌吸管约采样液1毫升。这可能是生理盐水,磷酸盐缓冲液,或胰酪胨大豆肉汤。 (转到步骤7.8或7.9,取决于您收集的吸。)
- 支气管吸出物:
1。无菌吸管插入气管管腔,定向尾端,慢慢地注入到支气管和肺的采样液。退出支气管和肺的采样液吸管和吸液管从气管中删除。并非所有的流体将返回到吸液管。重复更流畅,如果需要进行测试。
- 鼻吸:
- 无菌吸管,插入鼻咽部鼻道(小鼠)或气管管腔(只),定向颅和鼻腔采样液缓缓注入。
- 确保鼻腔是由枪头,或被迫在鼻孔(鼻孔)或流体通过半透明的口腔腭可见半月板形成的腔,流体的观察鼻腭接触达到。流体不应被视为退出口。如果是这样,重新定位的吸管。
- 撤柜采样液从鼻腔进入移液器和吸液管从鼻道或气管中删除。
- 无菌样品转移到适当的媒体或测试容器。
8。代表性的成果
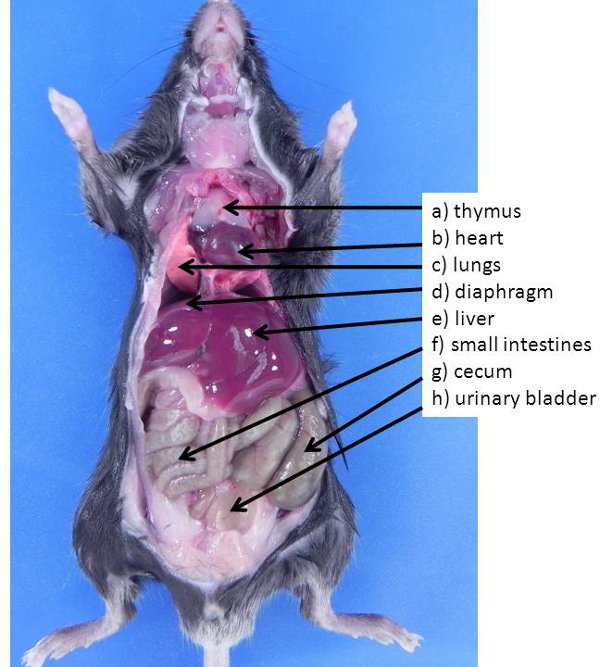
图1在小鼠腹部和胸腔器官。这些器官通常是可见的,第一次打开时,动物(机关都已经转移到暴露在腹腔其他器官)。肺部一)胸腺,B)的心,C),D)隔膜,E )肝,F)小肠,G)盲肠,H)膀胱。

图2。腹部腹膜后脏器和鼠标。如果被取消,并移动(或删除)的肠子和肝脏,这些器官的CA肚子肠子(供参考),n 是 A)肝(供参考),B),C),D),脾,E)的肾脏,F),降结肠,G)子宫。
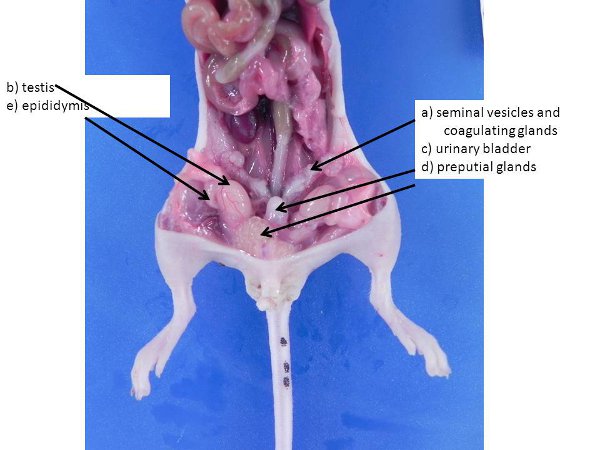
图3。男性生殖器官。这些都可以在更大,性成熟的男性更大。)精囊和凝固腺,B)睾丸(推入从 阴囊通过腹股沟环,仍然在小鼠和大鼠的腹腔),C)膀胱, D)包皮腺,E)附睾。
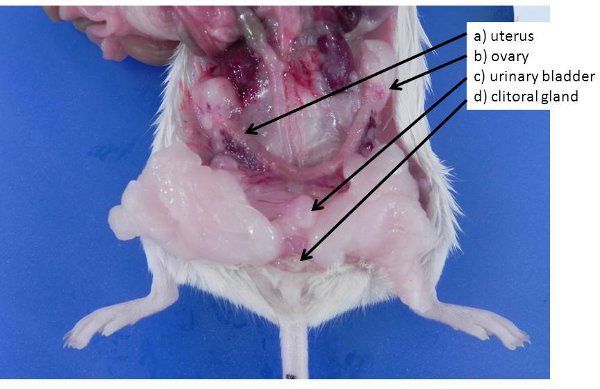
图4。女性的生殖器官a)非妊娠子宫(小鼠和大鼠有双角子宫) 二)卵巢,卵巢脂肪垫,C埋),膀胱,D)阴蒂腺(类似于男性的包皮腺) 。
讨论
在研究结束的数据收集可能需要的动物尸检。说明什么是见过,记得检查所有的组织。这些程序设计主要是为了优化剖检传染病的监测和样品采集,但最容易适应怀疑疾病的事件或聘用爆发也许只是一个程序的一个子集,将重点调查。很多手续也较常用在研究结束时,作为一个整体形态再加上收集特定的研究样本以供后续分析评估的一部分进行验尸有关。
披露声明
作者是查尔斯河实验室啮齿类动物诊断实验室,这些服务提供商业的所有员工。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
|---|---|---|---|
| 菜板 | 热电公司猫#36114 | CAT#36114 | |
| 小剪刀 | ROBOZ | RS - 5910,G204 | 23毫米刀片,3.5“长,直 |
| 中等剪刀 | ROBOZ | RS - 6808,G207 | 5“ |
| 大剪刀 | ROBOZ | RS - 6826,G65“ | 6.25“ |
| 钳弯 | ROBOZ | RS - 8254(M1/21004) | 4.5英寸,锯齿,轻微的曲线 |
| 镊子,Microdissecting | ROBOZ | RS - 5238 | 哈德森(埃瓦尔德) |
| 钳,组织钳 | ROBOZ | RS - 8160 | 鼠齿 |
| 火焰消毒器 | 牛津大学医学实验产品 | Bacti的焚尸炉#5889-001007 | |
| 解剖刀 | 癌症诊断, | 手指解剖刀#60,#FS0060猫 | |
| 移液器 | VWR | 巴斯德吸取5 3 / 4“,猫#14672-400 | |
| 高压灭菌袋 | 正确的制造公司 | 灭菌袋纸包装袋猫#021002(3100923)E09110 | 对于巴氏吸管 |
| 移液器灯泡 | VWR | CAT#56310-240 | |
| Eppendorf管 | Sarstedt | SafeSeal微管2ML,楼盘编号72.695 | |
| Eppendorf管 | 雅高 | 5ML微管猫#T20765 - C | |
| 注射器 | BD(Beckton迪肯森) | 1毫升- 309602 3猫ML - 300910 5ML - 309603 10ML 20ML猫#309604#309661 | |
| 针 | 屋宇署 | 26G - 309625 18G - 305195 | |
| 中性缓冲福尔马林 | VWR | 20L NBF 10%,猫#16004-128 | |
| 盐水 | ThermoScientific | 缓冲血库生理盐水,猫#23-309-178 | |
| 胰酪胨大豆肉汤 | 流式细胞迪肯森 | TSB:脱水,猫#211825 | |
| 磷酸盐缓冲液 | 西格玛爱秩序 | 房委会的缓冲区,CAT#P3813 - 10PAK | |
| 福尔马林杯 | VWR | 4盎司猫#36318-8528盎司猫#36318-86016盎司猫#36318-858 | |
| 大型福尔马林杯 | 橡树岭产品 | 32盎司容器猫#0432-1100 | |
| 超大福尔马林杯 | VWR | 高密度聚乙烯多用途160盎司容器猫#89038-282 | |
| 缝合材料 | 亨利施恩 | 手术缝合线编织丝绸,楼盘编号100-5000,M766750 | 对于鼠标肺胀 |
| 缠绕 | 斯台普斯 | 猫#QUA - 46173 | 对于大鼠肺胀 |
参考文献
- AVMA. . AVMA Guidelines on Euthanasia. , (2007).
- Feldman, D. B., Seely, J. C. . Necropsy Guide: Rodents and the rabbit. , (1988).
- King, J. M., Dodd, D. C., Roth, L. . The Necropsy Book. , (2006).
- Kittel, B. Revised guides for organ sampling and trimming in rats and mice--Part 2. A joint publication of the RITA and NACAD groups. Exp Toxicol Pathol. 55, 413-431 (2004).
- Komarek, V., Fox, J. G. Chapter 1. The Mouse in Biomedical Research. , 1-22 (2007).
- Morawietz, G. Revised guides for organ sampling and trimming in rats and mice--Part 3. A joint publication of the RITA and NACAD groups. Exp Toxicol Pathol. 55, 433-449 (2004).
- Popesko, P., Raijtová, V., Horák, J. . Colour Atlas of Anatomy of Small Laboratory Animals. 2, 91-106 (2002).
- Ruehl-Fehlert, C. Revised guides for organ sampling and trimming in rats and mice--part 1. Exp Toxicol Pathol. 55, 91-106 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。