É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Necropsia de diagnóstico e coleta de tecido e amostra selecionada em ratos e camundongos
Resumo
Este artigo descreve os procedimentos para a realização de um exame post-mortem básicas de um mouse ou rato, ea coleta de órgãos básica, bem como mais tipos de amostra desafiador para avaliação histológica, microbiológica e PCR.
Resumo
Existem vários tipos de amostras que podem ser coletadas de um animal sacrificado, a fim de ajudar a diagnosticar ou descobrir agentes infecciosos em uma colônia animal. Cobrança adequada dos tecidos para processamento histológico mais podem impactar a qualidade dos resultados de testes. Este artigo descreve a conduta de um exame básico bruta incluindo a identificação de coração, fígado, pulmões, rins e baço, bem como a forma de recolher esses órgãos. Além disso quatro dos mais difíceis técnicas de tecido / da coleta da amostra são demonstradas. Coleta de perfusão pulmonar e pode ser particularmente difícil como o tecido tem de ser devidamente inflado com um fixador, para que dentro do tecido para fixar corretamente e para permitir a avaliação histológica completa. Este artigo demonstra o passo a passo a técnica para remover o pulmão e inflá-lo com o fixador, a fim de obter uma fixação ideal do tecido no prazo de 24 horas. Coleta de cérebro pode ser igualmente desafiador como o tecido é macio e facilmente danificada. Este artigo demonstra o passo a passo técnica para expor e remover o cérebro do crânio com danos mínimos ao tecido. Linfonodo mesentérico é uma boa amostra do tipo em que muitos comuns para detectar agentes infecciosos como vírus entéricos persistir por mais tempo no linfonodo do que são eliminados nas fezes. Este artigo demonstra o procedimento passo a passo para localizar e remover o assepticamente linfonodos mesentéricos. Finalmente, a identificação de agentes infecciosos do trato respiratório podem ser realizadas por cultura bacteriana ou testes PCR de nasal e / ou brônquica fluidos aspirados tomadas no momento da necropsia. Este procedimento descreve a obtenção e preparação da amostra de aspirado respiratório para a cultura bacteriana e testes de PCR.
Protocolo
1. Preparação para a necropsia
- Partes importantes de qualquer exame post-mortem bruto (valor bruto necropsia) são a história do animal ea descrição dos achados.
- Um patologista veterinário ler seus slides histopatologia pode não ter visto o animal e está contando com você para obter as informações de fundo.
- Descrever exatamente o que você vê antes de eutanásia do animal. Por exemplo, "mouse feminino; um dos cinco na gaiola; C57BL/6N; cabeça inclinada para a direita" ou "rato marrom do sexo masculino; estirpe desconhecida; animal está coçando, não há perda de cabelo desigual sobre o dorso, próximo à cauda e cabeça ".
- Use clara, a linguagem descritiva, objetiva. Modificadores como "suave", "moderado" e "grave" pode ser útil se os valores de corte entre os níveis são claramente demarcadas. Descrevendo as coisas em termos de objetos alimentos ou para uso doméstico, geralmente não é recomendado.
- Pesagem e medição animais, descobertas, ou órgãos é muitas vezes útil. A "baço grande" para você pode ser um baço normal para outro observador. Dizendo que o baço medidas 3cm x 1,5 centímetros fornece informações mais objetivas.
- Fotodocumentação pode ser inestimável.
- Observar todas as relevantes de saúde ocupacional e equipamentos de proteção individual necessários para trabalhar com animais vivos, carcaças potencialmente infecciosos, ou substâncias químicas, tais como formalina.
2. Localização postmortem bruta e exame de coração, pulmões, fígado, rins e baço
- Reunir os suprimentos necessários antes da eutanásia do animal. No mínimo, isso deve incluir uma placa de dissecção ou superfície de trabalho similar, pinças, tesouras, etiquetas para contentores, fixador, e qualquer mídia ou tubos de coleta / cups que potencialmente podem ser necessários.
- Brevemente avaliar a condição, comportamento e movimento do animal. Observar e registrar os padrões de respiração (por exemplo, rápida e superficial), bem como a capacidade ambulatorial e marcha (por exemplo, mancando, circulando, tremores).
- Eutanásia do animal de acordo com os procedimentos padrão de sua instituição, sempre aderindo às regras AVMA.
- Avaliar a condição corporal do animal para a pele e pelagem anormalidades, emagrecimento, ou desidratação. Tome nota de quaisquer manipulações artificiais, implantes, ou cirúrgico cicatrizes.
- Examine todos os orifícios externos (orelhas, olhos, nariz, ânus, aberturas genital, e cavidade oral). Uso de um escopo de dissecação é recomendado para uma observação mais atenta.
- Lay o mouse sacrificados ou carcaça de rato em decúbito dorsal em uma placa de dissecação limpa ou superfície de trabalho similar.
- Com uma tesoura, inciso a pele do comprimento total do ventrum do ânus até o queixo, refletindo a pele e incisão na parede abdominal, expondo as vísceras abdominais, glândulas salivares e prepucial / clitóris, e os linfonodos cervical e axilar. Cortar a caixa torácica para expor e examinar as vísceras torácicas, fazendo dois cortes lateralmente até cada lado da caixa torácica, em seguida, um outro lado, no topo do esterno, para abrir um espaço amplo o suficiente para examinar cuidadosamente todos os lobos do pulmão.
- Examine a aparência da estrutura músculo-esqueléticas.
- Avaliar todos os órgãos de anormalidades. Especificamente encontrar e identificar o coração e os pulmões na cavidade torácica. Especificamente encontrar e identificar o fígado, rins e baço na cavidade abdominal. Anotar todas as mudanças de cor, as diferenças de tamanho, e os órgãos faltando ou mal posicionada. Observe a consistência das superfícies, qualquer tecido adicionais (por exemplo, massas), bolsões de líquidos, ou a presença de líquido na cavidade abdominal / torácica.
- Observe o trato gastrointestinal ao seu conteúdo, ou a falta de conteúdos, com especial atenção para as paredes espessadas, massas, e / ou hemorragia. Inciso rins (da esquerda longitudinal direita, seção-transversal, na linha média, mas fora do centro), com uma lâmina de bisturi ou navalha para verificar parênquima para qualquer anormalidade. Verifique o mesentério para linfonodos aumentados e / ou massas.
- Examine o sistema urogenital, procurando bloqueios, bolsos fluido, hemorragia ou outras anormalidades.
3. Postmortem coleção de coração, fígado, rins e baço para exame histopatológico
- Reúna de tamanho adequado, recipiente rotulado (s) preenchido com uma quantidade adequada de 10% neutro tamponado (NBF). Ajustar a quantidade de NBF 10% a fim de obter uma proporção de 20:1 de fixador para tecidos.
- Posicione o mouse ou carcaça de rato em decúbito dorsal em uma placa de dissecação limpa ou superfície de trabalho similares e exponha o tecido de interesse.
- Remover o tecido da carcaça usando uma pinça e tesouras.
- Tecidos devem ser cuidadosamente aparado para remover gordura e desnecessária do tecido conjuntivo. Tecido deve ser limpo de sangue, uso normal (ou fisiológica) salina) para lavar, se necessário. Nunca use água destilada ou da torneira para enxaguar tecidos.
- Coloque o tecido para dentro do recipiente de NBF 10%.
4. Post-mortem de coleta e de perfusão do tecido pulmonar
- Reúna de tamanho adequado, recipiente rotulado (s) preenchido com uma quantidade adequada de NBF 10%. Ajuste quantidade de NBF 10% a fim de obter uma proporção de 20:1 de fixador para tecidos.
- Posicione o mouse ou carcaça de rato em decúbito dorsal em uma placa de dissecação limpa ou superfície de trabalho similar.
- Expor a traquéia, coração e pulmões.
- Usando uma tesoura e uma pinça retire a pele e músculo que recobre a região ventral torácica e cervical.
- Usando uma tesoura e uma pinça, retire a caixa torácica expondo o coração e os pulmões, fazendo dois cortes lateralmente até cada lado da caixa torácica, em seguida, um outro lado, perto da clavícula para abrir um espaço amplo o suficiente para examinar cuidadosamente todos os lobos do pulmão.
- Cortar os músculos do pescoço que se estende do esterno e costelas na mandíbula, incluindo aqueles que recobre a traquéia.
- Inserir uma tesoura por baixo da borda anterior da caixa torácica e fazer dois cortes, um de cada lado, para remover a seção de osso que recobre a traquéia.
- Segure a traquéia perto do queixo com uma pinça e cortar completamente através da traquéia com uma tesoura colocada acima da pinça
- Gentilmente puxe para cima traquéia usando a pinça, cortando ligações tecido ventral com uma tesoura, até todo o conjunto de tecidos torácica (traqueia, pulmões e coração, que é às vezes chamado de "arrancar") foi removida do corpo.
- Lay os pulmões plana na superfície de trabalho.
- Vagamente amarrar um pedaço de material de sutura ou fio de cozinha em torno da traquéia tomando cuidado para não puxar apertado.
- Encha uma seringa com fixador e uma agulha que é pequeno o suficiente para entrar na traquéia. Para ratos, uma seringa de 1 ml ou 3 ml com uma agulha de calibre 26 funciona bem. Para ratos, uma seringa de 5 ml com uma seringa de calibre 18 funciona bem.
- Inserir a agulha na abertura da traquéia e utilize uma pinça para segurar a traquéia ao redor da agulha. Comece devagar enchendo os pulmões com o fixador.
- Encher os pulmões até estar totalmente inflado. Não over-ou underinflate. A quantidade de fixador necessária para inflar completamente os pulmões varia de acordo com a idade, tensão, ea saúde do animal.
- Sobre a inflação é detectada por um fluido que escoa e formação de espuma do tecido pulmonar.
- Subenchimento é detectado pelos pulmões aparecendo plana e não completa em todas as áreas.
- Retire a agulha da traquéia.
- Aperte o material de sutura ou barbante em torno da traquéia para evitar o refluxo de fora fixador dos pulmões.
- Coloque os pulmões inflados em fixador usando um fixador 20:01 aproximada à relação de tecido.
5. Postmortem coleção de cérebro
- Reúna de tamanho adequado, recipiente rotulado (s) preenchido com uma quantidade adequada de NBF 10%. Ajuste quantidade de NBF 10% a fim de obter uma proporção de 20:1 de fixador para tecidos.
- Posicione o mouse sacrificados ou carcaça de rato em decúbito ventral em uma placa de dissecação limpa ou superfície de trabalho similar.
- Usando uma tesoura e uma pinça, retire a pele e músculo que recobre a calvária.
- Com uma tesoura retire a cabeça completamente da carcaça.
- Com uma tesoura pequena inserir a lâmina de fundo para o forame magno, a abertura do crânio, onde se abre para dentro do canal espinhal, e mantendo dicas tesoura apontada para cima, começar a cortar-se diretamente e através da linha média da calvária.
- Utilizando uma pinça, refletir ambas as metades do calvária expondo o cérebro.
1. Quando possível, coloque o cérebro exposto em fixador, ainda no crânio. Isso permitirá que o tecido para se tornar empresa antes da remoção do crânio, se isso for requerido. Patologistas muitos preferem que as seções são cortadas a partir do cérebro, ainda no crânio.
- Inverta cuidadosamente o crânio de modo que a gravidade vai ajudar o tecido a cair do crânio.
- Utilizando uma pinça curva, deslize com cuidado a pinça ao longo da borda externa do cérebro e sob o cérebro a partir de lobos olfativos, movendo-se sob o cérebro e para o cerebelo. Aperte suavemente com a pinça qualquer tecido conectivo ou nervos que inibem o cérebro de cair do crânio.
- Coloque o cérebro em fixador usando uma proporção de 20:1 aproximada de tecido para fixador.
6. Postmortem coleta dos linfonodos mesentéricos (MLN)
- Coleta de tecido para análise PCR deve ser feito usando uma técnica asséptica. Chama esterilizados, autoclavado ou equivalentemente instrumentos esterilizados devem ser usados.
- Montar tubos estéreis Eppendorf e tesouras e pinças esterilizadas.
- Posicione o mouse sacrificados ou carcaça de rato em decúbito dorsal em uma placa de dissecação limpa ou superfície de trabalho similar.
- Com uma tesoura esterilizada e uma pinça inciso parede abdominal ventral da área genital para a base da caixa torácica, Removendo a pele e músculo e expondo os intestinos.
- O MLN estão localizados na cavidade abdominal no tecido mesentérica ao longo do cólon, imediatamente adjacente ao ceco.
- Para localizar o MLN, primeiro localize o ceco, que é a grande, em forma de vírgula seção do intestino. Os dois pontos se estende desde o ceco e que muitas vezes pode ser identificado pela presença de pelotas fecais. O MLN estão localizados no mesentério ao longo do cólon adjacente ao ceco. Ele pode ser identificado como um amarelo, fixo ovóide ou esférica pequena de tecido no tecido mesentérica branco e muitas vezes é um pouco mais grosso e mais firme em textura do que o mesentério circundante e gordura. Use livros de texto de anatomia como necessário para a orientação.
- Utilizando uma técnica asséptica e instrumentos esterilizados remover o MLN e coloque em um tubo Eppendorf rotulado com informações de identificação.
7. Postmortem coleta de aspirado respiratório
- Montar suprimentos necessários - pipeta estéril, tesouras e pinças esterilizadas, soluções estéreis para ser liberado através do trato respiratório, e uma placa limpa de dissecação ou superfície de trabalho similar.
- Lay o mouse sacrificados ou carcaça de rato em decúbito dorsal na mesa de dissecação.
- Para aspirado brônquico em ratos, o acesso do trato respiratório por meio da traquéia. Para aspirar nasal em ratos de acesso, seja através da traquéia ou através do meato nasofaringe. Para aspirados brônquica ou nasal em ratos, o acesso do trato respiratório através do meato nasofaringe.
- Se aspirados tanto nasal e brônquica são necessários, executar a primeira aspirado brônquico. Executar nasal aspirado com uma pipeta nova estéril.
- Acesso traqueal (método recomendado para ratos):
- Refletem a pele longe da área cervical para expor os tecidos subcutâneos.
- Remoção das glândulas salivares e musculatura cervical para expor a traquéia.
- Utilizando instrumentos esterilizados, inciso traquéia para permitir o acesso ao lúmen. Manter a assepsia em toda coleção (Vá para o passo 7.7).
- Acesso meato nasofaríngea (nasal aspire e aspirado brônquico, método recomendado para ratos devido ao menor tamanho da traquéia):
- Este procedimento pode ser realizado tanto para a aspiração nasal e aspirado brônquico.
- Usando chama-esterilizados ou autoclavados instrumentos, sever do temporomandibular (mandíbula) articular e refletir a mandíbula longe da maxila, expondo o meato nasofaringe. Manter a assepsia em toda coleção (Vá para o passo 7.7).
- Desenhe aproximadamente 1ml de líquido de amostragem em uma pipeta estéril. Isto pode ser solução salina, tampão fosfato salino, ou caldo de tripticase de soja. (Vá para a etapa 7,8 ou 7,9, dependendo de qual você está coletando aspirar.)
- Aspirado brônquico:
1. Assepticamente inserir pipeta luz traqueal, dirigido caudalmente, e injecte lentamente o líquido de amostragem nos brônquios e do pulmão. Retirar o líquido de amostragem de brônquios e pulmões para a pipeta e remover a pipeta da traquéia. Nem todos os fluidos Voltarei para a pipeta. Repita se mais fluido é necessário para o ensaio.
- Nasal aspirar:
- Assepticamente inserir pipeta no meato nasofaríngea (ratos) ou luz traqueal (ratos), dirigido cranialmente, e injecte lentamente o líquido de amostragem para a cavidade nasal.
- Certifique-se que a cavidade nasal é alcançada pelo contato do palato nasal com a ponta da pipeta, ou pela observação do líquido forçado para dentro da cavidade, visto como meniscos formando no orifício nasal (narinas) ou como fluido visível através do palato translúcida oral. Fluido não deve ser visto saindo pela boca. Se assim for, re-orientar a pipeta.
- Retirar o líquido de amostragem a partir da cavidade nasal para a pipeta e remover a pipeta do meato ou traquéia.
- Assepticamente para transferir a mídia apropriada ou recipiente para o teste.
8. Resultados representativos
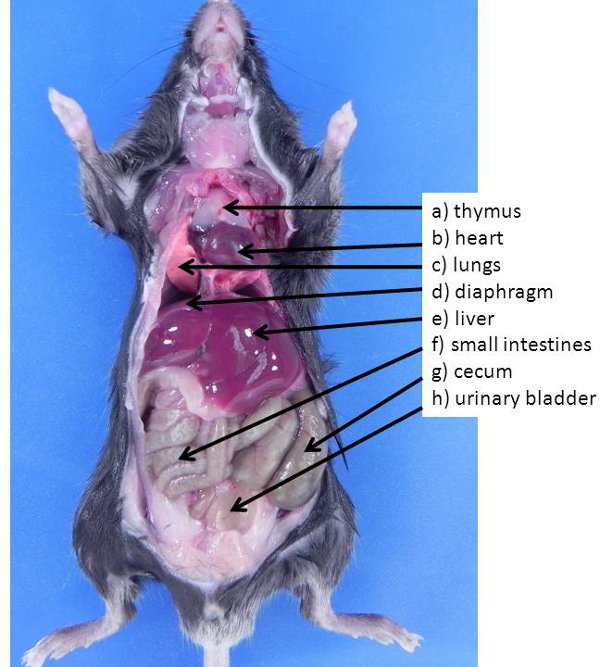
Figura 1. Abdominal e órgãos torácicos no mouse. Estes órgãos são normalmente visível quando um animal é aberto pela primeira vez (nenhum dos órgãos foram movidos para expor outros órgãos também presente na cavidade abdominal). A) do coração timo, b), c) pulmões, d), diafragma e) do fígado , f) intestino delgado, g) ceco, h) bexiga urinária.

Figura 2. Abdominais e órgãos retroperitoneal no mouse. Se os intestinos e fígado são levantadas e mudou-se (ou removido), estes ca órgãosn ser visto. fígado) (para referência), b) intestinos (para referência), c) estômago, d), baço e) os rins, f) cólon descendente, g) útero.
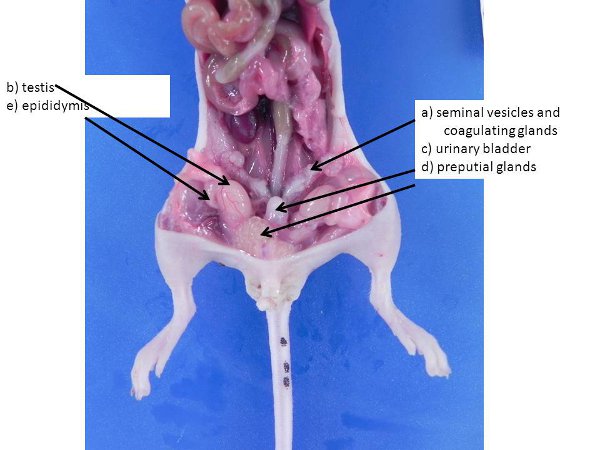
Figura 3. Órgãos reprodutivos masculinos. Estes podem ser maiores em grandes, os machos sexualmente maduros. Um vesículas) seminais e glândulas de coagulação, b) testículo bexiga urinária (empurrado para dentro da cavidade abdominal do escroto através dos anéis inguinais, que permanecerá aberto em camundongos e ratos), c), d) glândulas prepucial, e epidídimo).
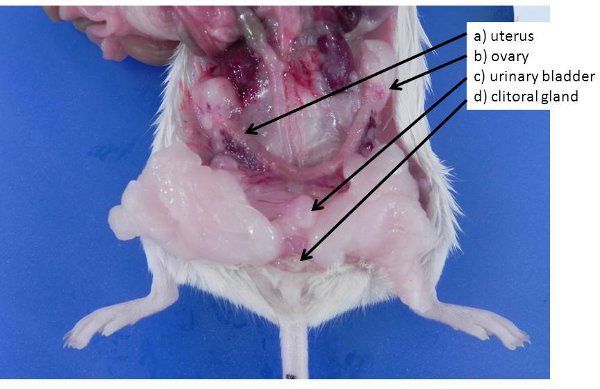
Figura 4. Órgãos reprodutivos femininos. A) útero não-gravídico (camundongos e ratos têm um útero bicorno) b) da bexiga, ovário enterrado em um bloco de ovário gordura, c) urinário, d) as glândulas do clitóris (análogo para as glândulas do sexo masculino prepucial) .
Access restricted. Please log in or start a trial to view this content.
Discussão
Coleta de dados no final de um estudo pode exigir um exame post-mortem dos animais. Descrevem bem o que é visto e lembre-se de examinar todos os tecidos. Estes procedimentos são projetados principalmente para otimizar a necropsia e coleta de amostras para vigilância de doenças infecciosas, mas a maioria é facilmente adaptado para as investigações de incidentes focada suspeita de doença ou surtos em que talvez apenas um subconjunto dos procedimentos seriam empregadas. Muitos dos procedimentos também são relevan...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores são todos os funcionários do laboratório de Charles River com o roedor de diagnóstico de laboratório, onde estes serviços são oferecidos comercialmente.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
|---|---|---|---|
| Tábua | Thermo Electron Cat # 36114 Corp | Cat # 36114 | |
| Tesoura pequena | ROBOZ | RS-5910, G204 | Lâminas de 23 milímetros, 3,5 comprimento ", em linha reta |
| Tesoura médio | ROBOZ | RS-6808, G207 | 5 " |
| Tesouras grandes | ROBOZ | RS-6826, G65 " | 6,25 " |
| Pinça-Curved | ROBOZ | RS-8254 (M1/21004) | 4.5 ", serrilhada, curva ligeira |
| Pinça-Microdissecting | ROBOZ | RS-5238 | Hudson (EWALD) |
| Pinça-Pinça | ROBOZ | RS - 8160 | Dente de rato |
| Chama esterilizador | Oxford Produtos para laboratórios | Bacti Cinerator-# 5889-001007 | |
| Bisturi | Diagnóstico de câncer, Inc. | Bisturis dedo # 60, # Cat FS0060 | |
| Pipetas | VWR | Pasteur Pipetar 5 3 / 4 ", Cat # 14672-400 | |
| Sacos de autoclave | Manufacturing Company adequada | Bag esterilizador Paper Cat Bolsas # 021002 (3100923) E09110 | Para pipetas Pasteur |
| Bulbo da pipeta | VWR | # Cat 56310-240 | |
| Tubos Eppendorf | Sarstedt | SafeSeal 2mL microtubo, Ref # 72,695 | |
| Tubos Eppendorf | Argos | Cat microtubo 5mL # T20765-C | |
| Seringa | BD (Beckton Dickenson) | 1ml-309602-300910 3 ml 10 ml 5 ml-309603 # 309604 Cat Cat 20mL # 309661 | |
| Agulhas | BD | 26G-18G-309.625 305.195 | |
| Formalina tamponada neutra | VWR | 20L NBF 10%, Cat # 16004-128 | |
| Salina | ThermoScientific | Buffered Saline Banco de Sangue do gato, # 23-309-178 | |
| Tripticase soja caldo | Becton Dickinson | TSB: Cat, desidratados # 211825 | |
| Tampão fosfato salino | Sigma Aldrich | HA Buffer, Cat # P3813-10PAK | |
| Copos de formalina | VWR | Cat 4 oz # 8 onças 36318-852 36318-860 Cat # 16 onças Cat # 36318-858 | |
| Copos grandes de formol | Oakridge Produtos | 32 onças Cat # container 0432-1100 | |
| Copo extra grande formol | VWR | Multipurpose HDPE Cat container # 160 onças 89038-282 | |
| Material de sutura | Henry Schein | Fio de seda trançada cirúrgico, Ref # 100-5000, M766750 | De insuflação pulmonar do rato |
| Barbante | Staples | Cat # QUA-46173 | Para a inflação de pulmão de ratos |
Referências
- AVMA. AVMA Guidelines on Euthanasia. , (2007).
- Feldman, D. B., Seely, J. C. Necropsy Guide: Rodents and the rabbit. , CRC Press. (1988).
- King, J. M., Dodd, D. C., Roth, L. The Necropsy Book. , 4th edn, C.L. Davis Foundation. (2006).
- Kittel, B. Revised guides for organ sampling and trimming in rats and mice--Part 2. A joint publication of the RITA and NACAD groups. Exp Toxicol Pathol. 55, 413-431 (2004).
- Fox, J. G. Chapter 1. The Mouse in Biomedical Research. , Elsevier. Vol. 3: Normative biology, husbandry, and models 1-22 (2007).
- Morawietz, G. Revised guides for organ sampling and trimming in rats and mice--Part 3. A joint publication of the RITA and NACAD groups. Exp Toxicol Pathol. 55, 433-449 (2004).
- Popesko, P., Raijtová, V., Horák, J. Colour Atlas of Anatomy of Small Laboratory Animals. 2, 1st edn, Saunders. vol. 2: Rat, mouse, hamster 91-106 (2002).
- Ruehl-Fehlert, C. Revised guides for organ sampling and trimming in rats and mice--part 1. Exp Toxicol Pathol. 55, 91-106 (2003).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados