Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Autopsie de diagnostic et de certains tissus et de collecte des échantillons dans les rats et les souris
Dans cet article
Résumé
Cet article décrit les procédures permettant d'effectuer un examen post-mortem de base d'une souris ou un rat, et la collecte des organes de base, ainsi que plusieurs types d'échantillons difficiles à partir de l'évaluation histologique, microbiologique et la PCR.
Résumé
Il ya différents types d'échantillons multiples qui peuvent être recueillies à partir d'un animal euthanasié en vue d'aider à diagnostiquer ou de découvrir des agents infectieux dans une colonie d'animaux. Le ramassage des tissus pour le traitement histologique supplémentaires peuvent influer sur la qualité des résultats des tests. Cet article décrit le comportement d'un examen de base brut, y compris l'identification de coeur, le foie, les poumons, les reins et la rate, ainsi que la manière de collecter ces organes. Par ailleurs quatre des techniques plus difficiles la collecte de tissus / échantillon sont démontrés. La collecte et la perfusion du poumon peut être particulièrement difficile car le tissu doit être bien gonflés avec un fixatif pour que l'intérieur du tissu à fixer correctement et approfondie pour permettre l'évaluation histologique. Cet article montre étape par étape pour supprimer la technique du poumon et le gonfler avec fixateur afin d'obtenir une fixation optimale du tissu dans les 24 heures. La collecte du cerveau peut être également difficile car le tissu est doux et facilement endommagée. Cet article montre étape par étape la technique d'exposer et de retirer le cerveau du crâne avec des dommages minimaux aux tissus. Les ganglions mésentériques est un type bon échantillon dans lequel de nombreuses communes de détecter les agents infectieux comme les virus entériques persister plus longtemps dans les ganglions lymphatiques que ce qu'ils sont excrétés dans les selles. Cet article démontre l'procédure étape par étape pour localiser et retirer aseptiquement le ganglion mésentérique. Enfin, l'identification des agents infectieux des voies respiratoires peut être effectuée par culture bactérienne ou des tests PCR de nasale et / ou bronchique fluides aspirats prélevés à l'autopsie. Cette procédure décrit l'obtention et la préparation de l'échantillon d'aspiration des voies respiratoires pour la culture bactérienne et tests de PCR.
Protocole
1. Préparation à l'autopsie
- Des éléments importants de tout examen post-mortem brut (autopsie) sont les antécédents de l'animal et la description des résultats.
- Un pathologiste vétérinaire lire vos diapositives histopathologiques peuvent ne pas avoir vu l'animal et compte sur vous pour les renseignements généraux.
- Décrivez exactement ce que vous voyez devant vous euthanasier l'animal. Par exemple, "souris femelle; l'un des cinq dans la cage; C57BL/6N, tête inclinée vers la droite" ou "rat brun de sexe masculin; souche inconnue; animaux se gratte, il ya perte de cheveux par endroits sur le dos, près de la queue et tête ».
- Utilisez claires, explicites, langage objectif. Les modificateurs tels que "mild", "modérée" et "sévère" peut être utile si les seuils entre les niveaux sont clairement délimitées. Décrivant les choses en termes d'objets alimentaires ou le ménage n'est généralement pas recommandée.
- Peser et mesurer les animaux, les résultats, ou des organes est souvent utile. Une "grande rate" pour vous pourrait être une rate normale à un autre observateur. Dire que la rate des mesures 3cm x 1.5cm fournit des informations plus objectives.
- Photodocumentation peut être précieuse.
- Respectez tous pertinents sur la santé au travail et les équipements de protection nécessaires pour travailler avec des animaux vivants, les carcasses potentiellement infectieux, ou des produits chimiques tels que le formol.
2. Lieu autopsie et l'examen de brut cœur, les poumons, le foie, les reins et la rate
- Rassembler les fournitures nécessaires avant l'euthanasie de l'animal. Au minimum, cela devrait inclure une planche à dissection ou surface de travail similaires, pinces, ciseaux, des étiquettes pour les conteneurs, fixateur, et tout média ou des tubes de prélèvement / cups qui peuvent potentiellement être nécessaire.
- Évaluer brièvement l'état, le comportement, et le mouvement de l'animal. Observer et enregistrer les modèles de respiration (par exemple, rapide, superficielle) ainsi que la capacité ambulatoire et la démarche (par exemple, en boitant, encerclant, tremblements).
- Euthanasier l'animal selon des procédures standard de votre établissement, toujours en respectant les directives de l'AVMA.
- Évaluer l'état corporel de l'animal pour des anomalies peau et du pelage, l'amaigrissement, ou de déshydratation. Prenez note de toutes les manipulations artificielles, les implants ou de cicatrice chirurgicale.
- Examinez tous les orifices externes (oreilles, yeux, nez, l'anus, les orifices génitaux, et la cavité buccale). L'utilisation d'un microscope à dissection est recommandé pour une observation plus attentive.
- Posez la souris euthanasiés ou une carcasse de rat en décubitus dorsal sur une planche de dissection propre ou surface de travail similaires.
- Avec des ciseaux, inciser la peau sur toute la longueur de la ventrale de l'anus vers le menton, ce qui reflète la peau et inciser la paroi abdominale, exposant les viscères abdominaux, des glandes salivaires et préputiales / clitoridiennes, et les ganglions lymphatiques cervicaux et axillaires. Couper la cage thoracique afin d'exposer et d'examiner les viscères thoraciques en faisant deux coupes latéralement jusqu'à chaque côté de la cage thoracique, puis un travers, dans le haut du sternum, d'ouvrir un espace assez large pour examiner tous les lobes du poumon.
- Examiner l'aspect de la structure musculo-squelettiques.
- Évaluer tous les organes pour les anomalies. Trouver et identifier précisément le cœur et les poumons dans la cavité thoracique. Trouver et identifier précisément le foie, les reins et la rate dans la cavité abdominale. Notez tout changement de couleur, des différences de taille, et des organes manquants ou mislocated. Notez la cohérence des surfaces, tout tissu supplémentaire (par exemple, des masses), des poches de liquide, ou la présence de liquide dans les cavités abdominales / thoraciques.
- Observez le tractus gastro-intestinal pour le contenu, ou le manque de contenu, en accordant une attention particulière pour les murs épais, des masses, et / ou d'hémorragie. Inciser les reins (gauche-section longitudinale, droite-coupe, sur la ligne médiane, mais hors centre) avec une lame de scalpel ou un rasoir pour vérifier le parenchyme de toute anomalie. Vérifiez le mésentère des ganglions lymphatiques et / ou des masses.
- Examiner le système génito-urinaire, à la recherche d'obstructions, des poches de liquide, une hémorragie ou d'autres anomalies.
3. Collecte de post-mortem du cœur, le foie, les reins et la rate pour l'histopathologie
- Rassemblez de taille appropriée, contenant étiqueté (s) rempli d'une quantité appropriée de 10% du formol tamponné neutre (FBN). Ajustez la quantité de FBN 10% afin d'obtenir un ratio de 20:1 de fixateur pour les tissus.
- Placez la souris ou le rat des carcasses en décubitus dorsal sur une planche de dissection propre ou surface de travail similaires, et exposer le tissu d'intérêt.
- Retirez le tissu de la carcasse à l'aide de pinces et ciseaux.
- Les tissus doivent être étroitement parées pour retirer la graisse et les tissus conjonctifs inutiles. Les tissus doivent être propres de sang; une utilisation normale (ou physiologique) salin) pour rincer si nécessaire. Ne jamais utiliser d'eau distillée ou du robinet pour rincer les tissus.
- Placez le tissu dans le récipient de la FBN 10%.
4. Collecte de l'autopsie et la perfusion des tissus pulmonaires
- Rassemblez de taille appropriée, contenant étiqueté (s) rempli avec une quantité appropriée de la FBN 10%. Ajuster le montant de la FBN 10% afin d'obtenir un ratio de 20:1 de fixateur pour les tissus.
- Placez la souris ou le rat des carcasses en décubitus dorsal sur une planche de dissection propre ou surface de travail similaires.
- Exposer la trachée, du coeur et les poumons.
- Avec des ciseaux et des pinces à enlever la peau et du muscle sus-jacentes dans les régions ventrales thoraciques et cervicales.
- En utilisant des ciseaux et des pinces, enlever la cage thoracique exposant le cœur et les poumons en faisant deux coupes latéralement jusqu'à chaque côté de la cage thoracique, puis un à travers près de la clavicule pour ouvrir un espace assez large pour examiner tous les lobes du poumon.
- Coupez les muscles du cou s'étendant du sternum et des côtes à la mâchoire, y compris celles recouvrant la trachée.
- Insérez des ciseaux sous le bord antérieur de la cage thoracique et de faire deux coupes, un de chaque côté, de supprimer la section de l'os recouvrant la trachée.
- Saisir la trachée près de la mâchoire avec une pince et couper complètement à travers la trachée avec des ciseaux placés au-dessus de la pince
- Tirez doucement vers le haut la trachée à l'aide de la pince, coupant les connexions tissus ventraux avec des ciseaux jusqu'à ce que l'ensemble des tissus thoraciques (trachée, des poumons et du cœur, ce qui est parfois appelé le "plumer") a été éliminé de l'organisme.
- Poser les poumons à plat sur la surface de travail.
- Vaguement attachez un morceau de matériel de suture ou de la ficelle de cuisine autour de la trachée, en prenant soin de ne pas serrer.
- Remplir une seringue avec fixateur et fixer une aiguille qui est assez petit pour entrer dans la trachée. Pour les souris, une seringue de 1ml ou 3ml avec une aiguille de calibre 26 qui fonctionne bien. Pour les rats, une seringue 5ml avec une seringue de calibre 18 qui fonctionne bien.
- Insérez l'aiguille dans l'ouverture de la trachée et l'utilisation de pinces pour tenir la trachée entourant l'aiguille. Commencez lentement remplir les poumons avec fixateur.
- Remplir les poumons jusqu'au complètement gonflé. Ne pas sur-ou SOUS-GONFLER. Le montant de fixateur nécessaire pour gonfler complètement les poumons varie selon l'âge, la souche, et la santé de l'animal.
- Un sur-gonflage est détecté par le liquide s'infiltre et le moussage du tissu pulmonaire.
- Un sous-gonflage est détecté par les poumons apparaissant à plat et pas plein dans tous les domaines.
- Retirez l'aiguille de la trachée.
- Serrer le matériel de suture ou une chaîne autour de la trachée pour empêcher le retour du fixateur hors des poumons.
- Placez les poumons gonflés en utilisant un fixateur fixatif approximative 20:01 ratio de tissus.
5. Collecte de post-mortem du cerveau
- Rassemblez de taille appropriée, contenant étiqueté (s) rempli avec une quantité appropriée de la FBN 10%. Ajuster le montant de la FBN 10% afin d'obtenir un ratio de 20:1 de fixateur pour les tissus.
- Placez la souris euthanasiés ou une carcasse de rat en décubitus ventral sur une planche de dissection propre ou surface de travail similaires.
- Avec des ciseaux et des pinces, retirer la peau et le muscle recouvrant la voûte crânienne.
- Avec des ciseaux retirer complètement la tête de la carcasse.
- L'utilisation de petits ciseaux insérer la lame de fond dans le trou occipital, l'ouverture où le crâne s'ouvre dans le canal rachidien, et en gardant conseils ciseaux pointé vers le haut, commencer à couper directement et à travers la ligne médiane de la calvaria.
- En utilisant des pinces, renvoient les deux moitiés de la calvaria exposer le cerveau.
1. Lorsque c'est possible, placer le cerveau exposé dans fixateur tout en restant dans le crâne. Cela permettra au tissu devient ferme avant l'enlèvement du crâne, si cela est nécessaire. Pathologistes Beaucoup préfèrent que les articles sont coupés dans le cerveau tout en restant dans le crâne.
- Retourner doucement le crâne afin que la gravité aidera le tissu à tomber du crâne.
- En utilisant des pinces courbes, glissez soigneusement la pince le long du bord externe du cerveau et sous le cerveau à partir de lobes olfactifs, se déplaçant sous le cerveau et vers le cervelet. Pincer doucement à la pince tout le tissu conjonctif ou des nerfs qui inhibent le cerveau de tomber du crâne.
- Placez le cerveau en utilisant un fixateur approximative 20:01 ratio de tissus pour fixateur.
6. La collecte de l'autopsie des ganglions mésentériques (MLN)
- Collecte de tissus pour analyse par PCR devrait être fait en utilisant une technique aseptique. Flamme stérilisé, autoclavés ou instruments stérilisés équivalente devrait être utilisée.
- Assemblez stériles tubes Eppendorf et ciseaux stériles et une pince.
- Placez la souris euthanasiés ou une carcasse de rat en décubitus dorsal sur une planche de dissection propre ou surface de travail similaires.
- Avec des ciseaux stérilisés et pince inciser la paroi ventrale abdominale de la zone génitale à la base de la cage thoracique, Enlever la peau et les muscles et en exposant les intestins.
- Le MLN sont situés dans la cavité abdominale dans le tissu mésentérique long du côlon, juste à côté du caecum.
- Pour localiser le MLN, d'abord localiser le caecum qui est la grande, la section des virgules en forme de l'intestin. Le côlon s'étend du caecum et il peut souvent être identifiées par la présence de pelotes fécales. Le MLN sont situés dans le mésentère le long du côlon adjacent au caecum. Il peut être identifié comme un jaune, petite bosse ovoïde ou sphérique de tissu dans le tissu mésentérique blanc et est souvent légèrement plus épais et plus ferme dans la texture que le mésentère entoure et de graisse. Utilisez les manuels d'anatomie comme nécessaires pour l'orientation.
- En utilisant une technique aseptique et des instruments stériles retirer du MLN et le placer dans un tube Eppendorf étiqueté avec des informations d'identification.
7. La collecte des aspirations des voies respiratoires post-mortem
- Assemblez les fournitures nécessaires - pipette stérile, ciseaux stériles et des solutions stériles d'être rincé par les voies respiratoires, et une planche propre dissection ou surface de travail similaires.
- Posez la souris euthanasiés ou une carcasse de rat en décubitus dorsal sur la planche de dissection.
- Pour aspiration bronchique chez le rat, l'accès des voies respiratoires en passant par la trachée. Pour aspirer nasales chez les rats, l'accès soit à travers la trachée ou par le méat du nasopharynx. Pour des aspirations bronchiques et nasales chez la souris, l'accès des voies respiratoires par le méat du nasopharynx.
- Si aspirats nasaux et bronchiques sont nécessaires, effectuer les aspiration bronchique premier. Effectuer aspiration nasale à l'aide d'une pipette stérile neuve.
- L'accès trachéale (méthode recommandée pour les rats):
- Refléter la peau loin de la zone cervicale pour exposer les tissus sous-cutanés.
- Retirez les glandes salivaires et la musculature cervicale pour exposer la trachée.
- Utiliser des instruments stériles, inciser la trachée afin de permettre l'accès à la lumière. Maintenir l'asepsie long de la collecte (Passez à l'étape 7.7).
- L'accès méat du nasopharynx (nasales aspirer et aspiration bronchique, méthode recommandée pour les souris à cause de la petite taille de la trachée):
- Cette procédure peut être effectuée à la fois pour l'aspiration nasale et aspiration bronchique.
- Utiliser la flamme stérilisé ou autoclavé instruments, couper les temporo-mandibulaire (mâchoire) commune et reflètent la mandibule loin du maxillaire, exposant le méat du nasopharynx. Maintenir l'asepsie long de la collecte (Passez à l'étape 7.7).
- Tirage d'environ 1 ml de liquide de prélèvement dans une pipette stérile. Cela peut être une solution saline normale, tampon phosphate salin, ou bouillon trypticase soja. (Passez à l'étape 7.8 ou 7.9, selon le aspirez vous collectez.)
- Aspiration bronchique:
1. Aseptiquement insérez pipette dans lumière trachéale, dirigé caudalement, et injecter lentement le liquide de prélèvement dans les bronches et les poumons. Retirer du liquide de prélèvement à partir des bronches et des poumons dans la pipette et retirer la pipette de la trachée. Pas tous du fluide sera de retour dans la pipette. Répéter si plus fluide est nécessaire pour les tests.
- Nasale aspiration:
- Aseptiquement insérez pipette dans le méat du nasopharynx (souris) ou lumière trachéale (rats), dirigé crânialement, et injecter lentement le liquide de prélèvement dans la cavité nasale.
- Assurez-vous que la cavité nasale est atteint par le contact de la bouche du nez avec la pointe de la pipette, ou par l'observation des fluides forcée dans la cavité, considérée comme formant ménisques à l'orifice nasal (narines) ou comme fluide visible à travers le palais translucides orale. Fluide ne doit pas être vu sortant par la bouche. Si oui, de réorienter la pipette.
- Retirer le liquide d'échantillonnage de la cavité nasale dans la pipette et retirer la pipette du méat ou de la trachée.
- Transférer de façon aseptique échantillon médias appropriés ou conteneur pour les tests.
8. Les résultats représentatifs
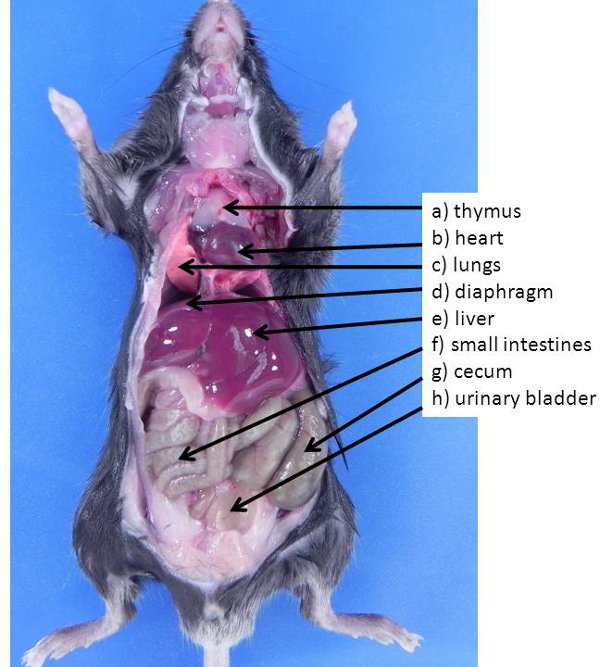
Figure 1. Abdominale et les organes thoraciques chez la souris. Ces organes sont généralement visibles lorsque l'animal est d'abord ouvert (aucun des organes ont été déplacés pour exposer d'autres organes également présent dans la cavité abdominale). A) le thymus, b) le cœur, c) les poumons, d) le diaphragme, e) du foie , f) l'intestin grêle, g) de la vessie caecum, h).

Figure 2. Abdominale et les organes rétropéritonéaux chez la souris. Si les intestins et le foie sont soulevés et déplacés (ou enlevés), ces organes can être vu. foie) (pour référence), b) les intestins (pour référence), c) l'estomac, d) la rate, e) les reins, f) côlon descendant, g) utérus.
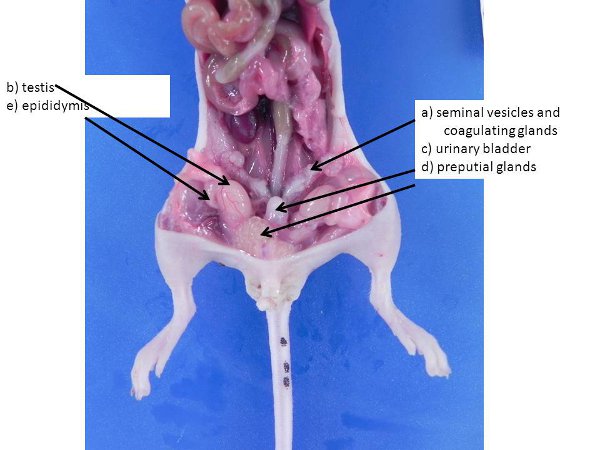
Figure 3. Les organes reproducteurs mâles. Ceux-ci peuvent être plus importants dans les grandes, les mâles sexuellement matures. Une vésicules) séminales et les glandes coagulantes, b) la vessie urinaire testicule (poussé dans la cavité abdominale du scrotum à travers les anneaux inguinaux, qui restent ouvertes chez les souris et les rats), c), d) les glandes préputiales, e) épididyme.
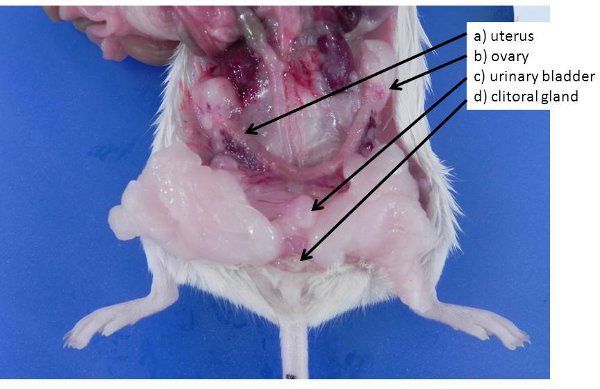
Figure 4. Les organes de reproduction. A) l'utérus non gravides (souris et rats ont un utérus bicorne) b) l'ovaire, enterré dans un tampon de l'ovaire graisse, c) de la vessie, d) les glandes clitoridiennes (analogue aux glandes préputiales masculins) .
Access restricted. Please log in or start a trial to view this content.
Discussion
La collecte des données à la fin de l'étude peut exiger un examen post-mortem des animaux. Décrivent bien ce qui est vu et n'oubliez pas d'examiner tous les tissus. Ces procédures sont principalement conçus pour optimiser l'autopsie et de collecte de l'échantillon pour la surveillance des maladies infectieuses, mais la plupart sont facilement adaptés aux enquêtes ont porté sur les incidents suspects de maladie ou d'épidémies dans laquelle peut-être seulement un sous-ensemble des proc...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs sont tous des employés de la Charles River laboratoire de diagnostic des rongeurs de laboratoire, où ces services sont offerts commercialement.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Le numéro de catalogue | Commentaires |
|---|---|---|---|
| Planche à découper | Thermo Electron Corp Cat # 36114 | Cat # 36114 | |
| Petits ciseaux | Roboz | RS-5910, G204 | Lames de 23mm, 3,5 "de longueur, droites |
| Ciseaux Medium | Roboz | RS-6808, G207 | 5 " |
| Gros ciseaux | Roboz | RS-6826, G65 " | 6.25 " |
| Pince-courbée | Roboz | RS-8254 (M1/21004) | 4.5 ", dentelé, légère courbe |
| Pince-Microdissecting | Roboz | RS-5238 | Hudson (Ewald) |
| Pince-Tissue forceps | Roboz | RS - 8160 | Dent de rat |
| Flamme stérilisateur | Oxford Produits Labware | Bacti-Cinerator # 5889-001007 | |
| Scalpel | Diagnostic du cancer, Inc | Scalpels Finger # 60, Cat # FS0060 | |
| Pipettes | VWR | Pipette Pasteur 5 3 / 4 ", Cat # 14672-400 | |
| Sacs à autoclave | Manufacturing Company correcte | Sac Papier stérilisateur Cat # 021002 Pochettes (3100923) E09110 | Pour pipettes Pasteur |
| Ampoule pipette | VWR | Cat # 56310-240 | |
| Tubes Eppendorf | Sarstedt | 2mL microtube Safeseal, Réf # 72,695 | |
| Tubes Eppendorf | Argos | Cat microtube 5mL # T20765-C | |
| Seringue | De BD (Beckton Dickinson) | 1ml-309602-3 ml 300910 309603 5ml-Cat # 309604 10mL 20mL Cat # 309661 | |
| Aiguilles | BD | 26G-18G-309625 305195 | |
| Formol tamponné neutre | VWR | FBN 20L 10%, Cat # 16004-128 | |
| Saline | ThermoScientific | Buffered Saline de la Banque de sang, Cat # 23-309-178 | |
| Bouillon de trypticase soja | Becton Dickinson | TSB: déshydratées, Cat # 211825 | |
| Tampon phosphate salin | Sigma-Aldrich | HA Tampon, Cat # P3813-10PAK | |
| Tasses formol | VWR | Cat 4 onces # 36318-852 8 onces Cat # 36318-860 16 onces Cat # 36318-858 | |
| Grande tasse de formol | Produits Oakridge | Cat contenant 32 onces # 0432-1100 | |
| Extra grande tasse de formol | VWR | Multipurpose PEHD contenant 160 onces Cat # 89038-282 | |
| Matériel de suture | Henry Schein | Suture tressée de soie chirurgicale, Réf # 100-5000, M766750 | Pour l'inflation des poumons de souris |
| Ficelle | Staples | Cat # QUA-46173 | Pour l'inflation poumon chez le rat |
Références
- AVMA. AVMA Guidelines on Euthanasia. , (2007).
- Feldman, D. B., Seely, J. C. Necropsy Guide: Rodents and the rabbit. , CRC Press. (1988).
- King, J. M., Dodd, D. C., Roth, L. The Necropsy Book. , 4th edn, C.L. Davis Foundation. (2006).
- Kittel, B. Revised guides for organ sampling and trimming in rats and mice--Part 2. A joint publication of the RITA and NACAD groups. Exp Toxicol Pathol. 55, 413-431 (2004).
- Fox, J. G. Chapter 1. The Mouse in Biomedical Research. , Elsevier. Vol. 3: Normative biology, husbandry, and models 1-22 (2007).
- Morawietz, G. Revised guides for organ sampling and trimming in rats and mice--Part 3. A joint publication of the RITA and NACAD groups. Exp Toxicol Pathol. 55, 433-449 (2004).
- Popesko, P., Raijtová, V., Horák, J. Colour Atlas of Anatomy of Small Laboratory Animals. 2, 1st edn, Saunders. vol. 2: Rat, mouse, hamster 91-106 (2002).
- Ruehl-Fehlert, C. Revised guides for organ sampling and trimming in rats and mice--part 1. Exp Toxicol Pathol. 55, 91-106 (2003).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon