Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Diagnostic Necropsy und ausgewählte Gewebe und Probenentnahme bei Ratten und Mäusen
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt die Verfahren für die Durchführung eine grundlegende Obduktion einer Maus oder Ratte, und die Sammlung der wichtigsten Organe, sowie eine größere Herausforderung Probe Typen aus für histologische, mikrobiologische und PCR Auswertung.
Zusammenfassung
Es gibt mehrere Sample-Typen, die von einem Tier eingeschläfert gesammelt werden, um möglicherweise zu diagnostizieren oder entdecke Infektionserreger in ein Tier Kolonie. Proper Sammlung von Geweben für weitere histologische Verarbeitung kann Auswirkungen auf die Qualität der Testergebnisse. Dieser Artikel beschreibt das Verhalten eines Bruttogrundgehalt Untersuchung einschließlich Identifizierung von Herz, Leber, Lunge, Nieren und Milz, und wie diese Organe zu sammeln. Zusätzlich vier desto schwieriger Gewebe / Probennahme-Techniken werden demonstriert. Lung Sammlung und Perfusion kann besonders anspruchsvoll wie das Gewebe muss ordnungsgemäß mit einem Fixativ, um für Innere des Gewebes richtig zu fixieren und gründliche histologische Untersuchung zu ermöglichen aufgeblasen werden. Dieser Artikel zeigt, die Schritt für Schritt Technik, um die Lunge zu entfernen und pumpen sie mit Fixativ, um eine optimale Fixierung des Gewebes innerhalb von 24 Stunden zu erreichen. Brain-Sammlung kann ähnlich herausfordernd wie das Gewebe weich und leicht beschädigt werden. Dieser Artikel zeigt, die Schritt für Schritt Technik zu entlarven und entfernen Sie das Gehirn aus dem Schädel mit minimaler Schädigung des Gewebes. Die mesenterialen Lymphknoten ist ein gutes Beispiel geben, in denen viele gemeinsame Infektionserreger erkennen als Darmviren länger anhalten in den Lymphknoten, als sie im Kot abgestoßen werden. Dieser Artikel zeigt, die Schritt für Schritt Verfahren zum Auffinden und aseptisch Entfernen der mesenterialen Lymphknoten. Schließlich kann die Identifizierung von Infektionserregern der Atemwege durch bakterielle Kultur oder PCR-Tests von Nasen-und / oder bronchiale Flüssigkeit ansaugt bei der Obduktion entnommen durchgeführt werden. Dieses Verfahren beschreibt, Beschaffung und Vorbereitung der Atemwege absaugen Probe für die Bakterienkultur und PCR-Tests.
Protokoll
1. Vorbereitung für die Autopsie
- Wichtige Teile der grobe Obduktion (Autopsie) sind die Geschichte des Tieres und der Beschreibung der Befunde.
- Ein Veterinärpathologe Lesen Ihrer Histopathologie Dias können nicht das Tier gesehen haben und sich auf Sie verlassen für die Hintergrund-Informationen.
- Beschreiben Sie genau, was Sie, bevor Sie das Tier einschläfern zu sehen. Zum Beispiel, "weiblichen Maus, einer von fünf in den Käfig; C57BL/6N; geneigtem Kopf nach rechts" oder "braunen männlichen Ratten, Stamm unbekannt; Tier kratzt, es gibt kreisrundem Haarausfall auf dem Rücken, in der Nähe des Schwanzes und Kopf ".
- Verwenden Sie klare, beschreibende, objektive Sprache. Modifikatoren wie "mild", "mäßig" und "schwer" kann nützlich sein, wenn die Schwellenwerte zwischen den Ebenen klar abzugrenzen. Beschreiben Dinge in Bezug auf Essen oder Haushaltsgegenstände ist in der Regel nicht empfohlen.
- Wiegen und Messen Tiere, Erkenntnisse oder Organen ist oft nützlich. Eine "große Milz" Sie könnte eine normale Milz zu einem anderen Beobachter. Zu sagen, dass die Milz Maßnahmen 3cm x 1.5cm bietet mehr objektive Informationen.
- Fotodokumentation kann von unschätzbarem Wert.
- Beachten Sie alle relevanten Gesundheits-und persönliche Schutzausrüstung für die Arbeit mit lebenden Tieren, potentiell infektiösen Kadavern oder Chemikalien wie Formalin erforderlich.
2. Gross postmortalen Lage und Untersuchung von Herz, Lunge, Leber, Nieren und Milz
- Sammle die nötigen Materialien vor Euthanasie des Tieres. Minimal, muss dies eine Dissektion Bord oder eine ähnliche Arbeit Oberfläche, Zangen, Scheren, Etiketten für Container, Fixativ und Medien oder Sammelröhrchen / cups, die möglicherweise benötigt werden.
- Kurz über den Zustand, Verhalten und Bewegung des Tieres. Beobachten und aufzeichnen Atemmuster (zB schnelle, flache) sowie ambulante Fähigkeit und Gang (zB Hinken, kreisen, Tremor).
- Euthanize das Tier nach üblichen Verfahren in Ihrer Institution, immer dem AVMA Richtlinien.
- Beurteilen Sie den Körper des Tieres Voraussetzung für Haut und Fell Anomalien, Abmagerung oder Austrocknung. Notieren Sie sich alle künstlichen Manipulationen, Implantate oder chirurgische Narben.
- Überprüfen Sie alle externen Öffnungen (Ohren, Augen, Nase, After, Genital-Öffnungen, und in der Mundhöhle). Die Verwendung eines Binokular ist für eine engere Beobachtung empfohlen.
- Legen Sie die eingeschläfert Maus oder Ratte Kadaver in Rückenlage auf einer sauberen Dissektion Bord oder eine ähnliche Arbeit Oberfläche.
- Mit Schere, incise die Haut über die gesamte Länge des ventrum aus dem Anus bis zum Kinn, was Haut und Einschneiden der Bauchwand, Freilegung der Bauchorgane, der Speicheldrüsen und Vorhaut / Klitoris Drüsen und Hals-und Achsel-Lymphknoten. Schneiden Sie den Brustkorb zu entlarven und zu untersuchen, die Brustorgane, indem 2 Schnitte seitlich bis jeder Seite des Brustkorbs, dann über, an der Spitze des Brustbeins, einen Raum groß genug, um gründlich zu untersuchen alle Lungenlappen zu öffnen.
- Untersuchen Sie das Aussehen des Muskel-Skelett-Struktur.
- Werten Sie alle Organe auf Anomalien. Insbesondere finden und identifizieren das Herz und die Lunge in den Brustraum. Insbesondere finden und identifizieren die Leber, Nieren und Milz in der Bauchhöhle. Notieren Sie alle Farbänderungen, Größenunterschiede, fehlende oder mislocated Organe. Beachten Sie die Konsistenz von Oberflächen, keine zusätzlichen Gewebe (z. B. Massen), Fluidtaschen, oder das Vorhandensein von Flüssigkeit in der Bauchhöhle / Brusthöhle.
- Beobachten Sie den Gastrointestinaltrakt für den Inhalt, oder das Fehlen von Inhalten, mit besonderem Augenmerk für die verdickten Wänden, Massen, und / oder Blutungen. Inzision der Niere (links Längsschnitt, rechts-Querschnitt, auf der Mittellinie, sondern außermittig) mit einem Skalpell oder einer Rasierklinge zu Parenchym für etwas Ungewöhnliches zu überprüfen. Überprüfen Sie das Mesenterium für vergrößerte Lymphknoten und / oder Massen.
- Untersuchen des Urogenitalsystems, auf der Suche nach Blockaden, Fluidtaschen, Blutungen oder andere Auffälligkeiten.
3. Postmortem Sammlung von Herz, Leber, Nieren und Milz für die Histopathologie
- Sammeln entsprechender Größe, beschrifteten Behälter (s) mit einer geeigneten Menge von 10% neutral gepuffertem Formalin gefüllten (NBF). Passen Sie die Höhe von 10% NBF, um ein 20:1-Verhältnis von Fixiermittel, um Gewebe zu erhalten.
- Legen Sie die Maus oder Ratte Kadaver in Rückenlage auf einer sauberen Dissektion Bord oder eine ähnliche Arbeit Oberfläche und setzen das Gewebe von Interesse.
- Entfernen Sie das Gewebe von der Karkasse mit einer Pinzette und Schere.
- Tissue sollten eng beschnitten werden, um Fett und unnötige Bindegewebe zu entfernen. Tissue sollte sauber sein Blut, die Nutzung normal (oder physiologische) Kochsalzlösung) als notwendig zu spülen. Verwenden Sie niemals destilliertes oder Leitungswasser auf Gewebe zu spülen.
- Legen Sie das Gewebe in den Behälter von 10% NBF.
4. Postmortem Sammlung und Perfusion des Lungengewebes
- Sammeln entsprechender Größe, beschrifteten Behälter (s) mit einer geeigneten Menge von 10% NBF gefüllt. Passen Höhe von 10% NBF, um ein 20:1-Verhältnis von Fixiermittel, um Gewebe zu erhalten.
- Legen Sie die Maus oder Ratte Kadaver in Rückenlage auf einer sauberen Dissektion Bord oder eine ähnliche Arbeit Oberfläche.
- Expose der Luftröhre, Herz und Lunge.
- Mit Schere und Pinzette entfernen Sie die Haut und Muskeln, die über der ventralen Brust-und Gebärmutterhalskrebs Regionen.
- Mit Schere und Pinzette, entfernen Sie den Brustkorb Aussetzen des Herzens und der Lunge, indem sie 2 Schnitte seitlich bis jeder Seite des Brustkorbs, dann über in der Nähe des Schlüsselbeins, um einen Raum groß genug, um gründlich zu untersuchen alle Lungenlappen zu öffnen.
- Schneiden Sie die Nackenmuskulatur, die sich von dem Brustbein und Rippen, die Kiefer, einschließlich derjenigen, die über der Luftröhre.
- Legen Schere unter den vorderen Rand des Brustkorbs und machen 2 Schnitte, einer auf jeder Seite, um den Abschnitt des Knochens über der Luftröhre zu entfernen.
- Fassen Sie die Luftröhre in der Nähe des Kiefers mit einer Pinzette und schneiden vollständig durch die Luftröhre mit einer Schere über der Zange platziert
- Sanft Schlepper der Luftröhre nach oben mit der Zange, Schnippeln ventralen Gewebe-Verbindungen mit der Schere, bis die gesamte Menge von Thorax-Gewebe (Luftröhre, Lunge und Herz, das manchmal auch als die "pflücken") hat aus dem Körper entfernt worden.
- Lay die Lunge flach auf der Arbeitsfläche.
- Lose Krawatte ein Stück Nahtmaterial oder in der Küche umschlingen die Luftröhre kümmern, keine zu engen ziehen.
- Füllen Sie eine Spritze mit Fixiermittel und fügen Sie eine Nadel, die klein genug, um die Luftröhre zu betreten. Bei Mäusen, arbeitet ein 1ml oder 3ml Spritze mit einer 26-Gauge-Nadel gut. Für Ratten, arbeitet ein 5ml-Spritze mit einer 18-Gauge-Spritze gut.
- Führen Sie die Nadel in die Öffnung der Luftröhre und die Verwendung einer Pinzette in die Luftröhre umgibt die Nadel zu halten. Beginnen Sie langsam Füllung der Lunge mit Fixativ.
- Füllen Sie den Lungen, bis sie vollständig aufgeblasen. Nicht über-oder underinflate. Die Höhe der Fixiermittel benötigt, um vollständig aufzublasen der Lunge variiert je nach Alter, Dehnungs-und Gesundheitszustand des Tieres.
- Over-Inflation wird durch Flüssigkeit sickert und Schäumen aus dem Lungengewebe nachgewiesen werden.
- Minderdruck von Lungen erscheinen flach und nicht voll in alle Bereiche erfasst.
- Entfernen Sie die Nadel aus der Luftröhre.
- Ziehen Sie das Nahtmaterial oder String um die Luftröhre zu Rückfluss von Fixativ aus den Lungen zu verhindern.
- Setzen Sie den aufgeblasenen Lungen in Fixativ mit ca. 20:1 Fixativ, um Gewebe-Verhältnis.
5. Postmortem Sammlung von Gehirn
- Sammeln entsprechender Größe, beschrifteten Behälter (s) mit einer geeigneten Menge von 10% NBF gefüllt. Passen Höhe von 10% NBF, um ein 20:1-Verhältnis von Fixiermittel, um Gewebe zu erhalten.
- Legen Sie die eingeschläfert Maus oder Ratte Kadaver in ventralen Liegen auf einer sauberen Dissektion Bord oder eine ähnliche Arbeit Oberfläche.
- Mit Schere und Pinzette, entfernen Sie die Haut und Muskeln, die über der Schädeldecke.
- Mit einer Schere entfernen den Kopf vollständig von der Karkasse.
- Mit einer kleinen Schere legen Sie die untere Klinge in das Foramen magnum, die Öffnung, wo der Schädel öffnet sich in den Wirbelkanal und halten Schere spitz nach oben, beginnen Schneiden direkt nach oben und durch die Mittellinie der Schädeldecke.
- Mit einer Pinzette, reflektieren die beiden Hälften der Kalotte Aussetzen des Gehirns.
1. Wenn möglich, stellen Sie die freiliegenden Gehirn in Fixativ noch im Schädel. Dies ermöglicht dem Gewebe Firma vor der Entfernung aus dem Schädel zu werden, wenn dies erforderlich ist. Viele Pathologen bevorzugen, dass Teile des Gehirns sind, während noch in den Schädel geschnitten.
- Vorsichtig auf den Kopf des Schädels, so dass die Schwerkraft hilft das Gewebe aus dem Schädel fallen.
- Mit einer gebogenen Pinzette vorsichtig schieben Sie die Zange entlang der Außenkante des Gehirns und unter dem Gehirn ab dem Riechkolben, sich auf die im Großhirn und zum Kleinhirn. Vorsichtig mit der Pinzette eine Bindegewebe oder Nerven, die das Gehirn hemmen fallen aus dem Schädel zu kneifen.
- Legen Sie das Gehirn in Fixativ mit einem ungefähren Verhältnis 20:1 von Gewebe zu Fixativ.
6. Postmortem Sammlung der mesenterialen Lymphknoten (MLN)
- Tissue-Kollektion für PCR-Analyse sollte mit aseptischen werden. Flamme sterilisiert, autoklaviert oder äquivalent sterilisierten Instrumente sollten genutzt werden.
- Montieren Sie sterile Eppendorf-Röhrchen und einer sterilen Schere und Pinzette.
- Legen Sie die eingeschläfert Maus oder Ratte Kadaver in Rückenlage auf einer sauberen Dissektion Bord oder eine ähnliche Arbeit Oberfläche.
- Mit sterilisiert Schere und Pinzette incise der ventralen Bauchwand aus dem Genitalbereich auf die Basis des Brustkorbs, Entfernen von Haut und Muskulatur und Freilegen der Darm.
- Die MLN sind in der Bauchhöhle in den mesenterialen Gewebe entlang des Dickdarms, unmittelbar angrenzend an den Blinddarm entfernt.
- So finden Sie die MLN, suchen Sie zunächst den Blinddarm, die die großen, Komma geformten Abschnitt des Darms ist. Der Doppelpunkt erstreckt sich von der Blinddarm, und es kann oft durch die Anwesenheit von fäkalen Pellets identifiziert werden. Die MLN sind im Mesenterium entlang des Dickdarms neben Blinddarm entfernt. Es kann als eine gelbe, ovale oder kugelförmige kleine Klumpen Gewebe in den weißen mesenterialen Gewebe identifiziert werden und ist oft etwas dicker und fester in der Textur als das umgebende Mesenterium und Fett. Verwenden Anatomie Text Bücher als notwendig für die Orientierung.
- Unter aseptischen und sterilen Instrumenten entfernen MLN und Ort in ein Eppendorf-Röhrchen mit der Identifizierung beschriftet.
7. Postmortem Sammlung von Atemwegserkrankungen absaugen
- Montieren benötigten Nachschub - sterilen Pipette, sterile Schere und Pinzette, sterile Lösungen, um über die Atemwege gespült werden, und eine saubere Sezieren Bord oder eine ähnliche Arbeit Oberfläche.
- Legen Sie die eingeschläfert Maus oder Ratte Kadaver in Rückenlage auf dem Sezieren Bord.
- Für bronchiale Aspiration in Ratten, auf die Atemwege durch die Luftröhre. Für die nasale Absaugen in Ratten, den Zugang entweder durch die Luftröhre oder durch den Nasen-Rachen-Gehörgang. Für bronchiale oder nasale saugt bei Mäusen, Zugriff auf die Atemwege durch den Nasen Gehörgang.
- Wenn beide Nasenschleimhaut und Bronchien saugt notwendig sind, führen Sie die Bronchien absaugen zuerst. Führen nasal absaugen mit einer neuen sterilen Pipette.
- Tracheal-Zugang (empfohlene Methode für Ratten):
- Zurückhalten der Haut weg von der Halswirbelsäule bis subkutanen Gewebe freizulegen.
- Entfernen Sie die Speicheldrüsen und Halsmuskulatur zur Luftröhre aussetzen.
- Mit sterilen Instrumenten, incise der Luftröhre, den Zugang zu dem Lumen ermöglichen. Pflegen Sie Asepsis während Sammlung (Fahren Sie mit Schritt 7.7).
- Nasen-Rachen-Nasengang Zugang (nasal absaugen und Bronchien absaugen, empfohlene Methode für Mäuse aufgrund der geringeren Größe der Luftröhre):
- Dieses Verfahren kann sowohl für die nasale absaugen und Bronchien absaugen durchgeführt werden.
- Mit Flamme sterilisiert oder autoklaviert Instrumente, sever der Kiefergelenke (Kiefer) Gelenk-und reflektieren den Unterkiefer vom Oberkiefer, Freilegung der Nasen-Rachen-Gehörgang. Pflegen Sie Asepsis während Sammlung (Fahren Sie mit Schritt 7.7).
- Draw etwa 1 ml der Probenahme Flüssigkeit in einer sterilen Pipette. Dies kann physiologische Kochsalzlösung werden, Phosphat-gepufferte Kochsalzlösung oder Trypticase-Soja-Bouillon. (Go auf 7,8 oder 7,9 Schritt, je nachdem, welche absaugen Sie sammeln.)
- Bronchiale Aspiration:
1. Aseptischen Bedingungen einfügen Pipette in Tracheallumen, gerichtet kaudal und injizieren Sie langsam die Probenahme Flüssigkeit in den Bronchien und der Lunge. Ziehen Sie die Sampling-Flüssigkeit aus den Bronchien und der Lunge in die Pipette und entfernen Sie die Pipette aus der Luftröhre. Nicht alle der Flüssigkeit in die Pipette zurück. Wiederholen Sie, wenn mehr Flüssigkeit für die Prüfung benötigt wird.
- Nasal absaugen:
- Aseptischen Bedingungen einfügen Pipette in den Nasen-Rachen Gehörgang (Mäuse) oder Tracheallumen (Ratten), gerichtet kranial und injizieren Sie langsam die Probenahme Flüssigkeit in die Nasenhöhle.
- Stellen Sie sicher, dass die Nasenhöhle durch den Kontakt der Nase Gaumen mit der Pipettenspitze oder durch Beobachtung von Flüssigkeit in den Hohlraum, wie Menisken bildet sich an der Nasenöffnung (Nasenlöcher) oder als Flüssigkeit sichtbar durch die transluzente mündlichen Gaumen gesehen gezwungen erreicht ist. Flüssigkeit sollte nicht gesehen Verlassen durch den Mund sein. Wenn ja, neu orientieren die Pipette.
- Ziehen Sie die Sampling-Flüssigkeit aus der Nasenhöhle in die Pipette und entfernen Sie die Pipette aus dem Gehörgang oder der Luftröhre.
- Überführen Probe geeigneten Medien oder Container für die Prüfung.
8. Repräsentative Ergebnisse
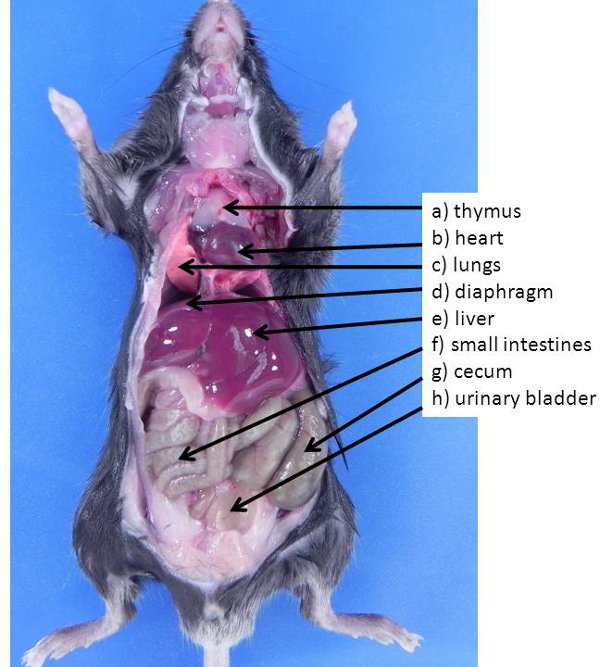
Abbildung 1. Bauch-und Brustorgane in der Maus. Diese Organe sind in der Regel sichtbar, wenn ein Tier zum ersten Mal geöffnet (keines der Organe wurden verschoben, um auch in anderen Organen im Bauchraum aussetzen). A) Thymus, b) Herz, c) Lungen, d) Membran, e) Leber , f) Dünndarm, g) Blinddarm, h) Harnblase.

Abbildung 2. Bauch-und retroperitonealen Organe in der Maus. Wenn der Darm und Leber gehoben und bewegt werden (oder entfernt), diese Organe can gesehen werden. a) Leber (als Referenz), b) Darm (als Referenz), c) Magen, d) Milz, e) Nieren, f) Colon descendens, g) Gebärmutter.
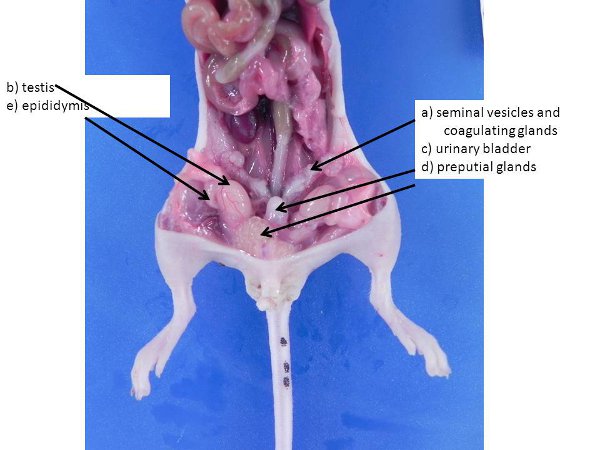
Abbildung 3. Männlichen Geschlechtsorgane. Diese kann größer in größeren, geschlechtsreifen Rüden. A) Samenblasen und Koagulieren Drüsen, b) Hoden (geschoben in die Bauchhöhle vom Hodensack durch den Leistenkanal Ringe, die offen bleiben bei Mäusen und Ratten), c) der Harnblase, d) Präputial Drüsen, e) Nebenhoden.
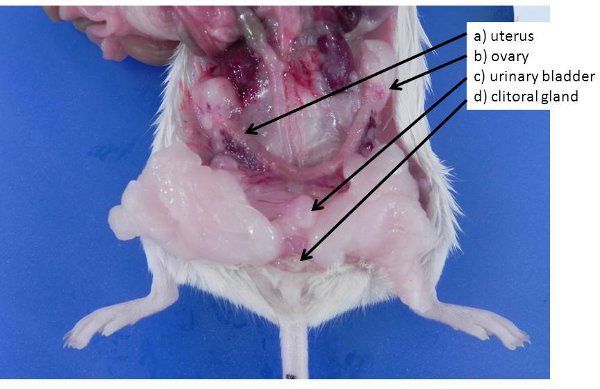
Abbildung 4. Weiblichen Geschlechtsorgane. A) nicht-graviden Uterus (Mäuse und Ratten haben einen Uterus bicornis) b) Eierstock, in einem Eierstock Fettpolster, c begraben) Harnblase, d) der Klitoris Drüsen (analog zu den männlichen Vorhaut Drüsen) .
Diskussion
Die Datensammlung am Ende der Studie kann eine Obduktion der Tiere. Beschreiben Sie auch, was man sieht und denken Sie daran, alle Gewebe zu untersuchen. Diese Verfahren sind in erster Linie auf Autopsie und Probennahme für Infektionskrankheiten Überwachung zu optimieren konzipiert, aber die meisten sind leicht zu konzentrieren Untersuchungen von mutmaßlichen Krankheit Vorfälle oder Ausbrüche, in denen vielleicht nur eine Teilmenge der Prozeduren eingesetzt werden würden angepasst. Viele der Verfahren sind auch f?...
Offenlegungen
Die Autoren sind alle Mitarbeiter von Charles River Labor Nagetier diagnostischen Labor, wo diese Dienste kommerziell angeboten werden.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagent Name | Firma | Katalog-Nummer | Kommentare |
|---|---|---|---|
| Schneidbrett | Thermo Electron Corp Cat # 36114 | Cat # 36114 | |
| Kleine Schere | Roboz | RS-5910, G204 | 23mm Klingen, 3,5 "Länge, gerade |
| Medium Schere | Roboz | RS-6808, G207 | 5 " |
| Große Schere | Roboz | RS-6826, G65 " | 6,25 " |
| Pinzetten-Curved | Roboz | RS-8254 (M1/21004) | 4,5 ", gezahnt, leichten Kurve |
| Pinzetten-Microdissecting | Roboz | RS-5238 | Hudson-(Ewald) |
| Pinzetten-Tissue Zange | Roboz | RS - 8160 | Rat Zahn |
| Flamme Sterilisator | Oxford Labware Produkte | Bacti-Cinerator # 5889-001007 | |
| Skalpell | Cancer Diagnostics, Inc. | Finger Skalpelle Nr. 60, Kat. Nr. FS0060 | |
| Pipetten | VWR | Pasteur Pipettieren Sie 5 4.3 ", Kat. Nr. 14672-400 | |
| Autoclave Taschen | Proper Manufacturing Company | Sterilisator Bag Papier Beutel Cat # 021002 (3100923) E09110 | Für Pasteurpipetten |
| Peleusball | VWR | Cat # 56310-240 | |
| Eppendorf-Röhrchen | Sarstedt | SafeSeal Mikroröhrchen 2ml, Ref # 72,695 | |
| Eppendorf-Röhrchen | Argos | 5 ml Mikroröhrchen Cat # T20765-C | |
| Spritze | BD (Beckton Dickenson) | 1ml-309602 3 ml-300910 5ml-10ml 309603 Cat # 309604 20ml Cat # 309661 | |
| Needles | BD | 26G-18G 309625-305195 | |
| Neutral gepuffertem Formalin | VWR | 20L 10% NBF, Kat. Nr. 16004-128 | |
| Saline | ThermoScientific | Buffered Saline Blood Bank, Kat. Nr. 23-309-178 | |
| Trypticase Soja-Brühe | Becton Dickenson | TSB: Getrocknete, Kat. Nr. 211825 | |
| Phosphat-gepufferte Kochsalzlösung | Sigma Aldrich | HA Buffer, Cat # p3813-10PAK | |
| Formalin Tassen | VWR | 4 Unzen Cat # 36318-852 8 Unzen Cat # 36318-860 16 Unzen Cat # 36318-858 | |
| Große Formalin Tassen | Oakridge Produkte | 32 Unzen-Container Cat # 0432-1100 | |
| Extra große Formalin Tasse | VWR | HDPE Multipurpose 160 Unzen Behälter Cat # 89038-282 | |
| Nahtmaterial | Henry Schein | Geflochtene Seide chirurgisches Nahtmaterial, Ref # 100-5000, M766750 | Für Mauslunge Inflation |
| Schnur | Staples | Cat # QUA-46173 | Für Rattenlunge Inflation |
Referenzen
- AVMA. . AVMA Guidelines on Euthanasia. , (2007).
- Feldman, D. B., Seely, J. C. . Necropsy Guide: Rodents and the rabbit. , (1988).
- King, J. M., Dodd, D. C., Roth, L. . The Necropsy Book. , (2006).
- Kittel, B. Revised guides for organ sampling and trimming in rats and mice--Part 2. A joint publication of the RITA and NACAD groups. Exp Toxicol Pathol. 55, 413-431 (2004).
- Komarek, V., Fox, J. G. Chapter 1. The Mouse in Biomedical Research. , 1-22 (2007).
- Morawietz, G. Revised guides for organ sampling and trimming in rats and mice--Part 3. A joint publication of the RITA and NACAD groups. Exp Toxicol Pathol. 55, 433-449 (2004).
- Popesko, P., Raijtová, V., Horák, J. . Colour Atlas of Anatomy of Small Laboratory Animals. 2, 91-106 (2002).
- Ruehl-Fehlert, C. Revised guides for organ sampling and trimming in rats and mice--part 1. Exp Toxicol Pathol. 55, 91-106 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten