Method Article
基于乙二醇玻璃化冷冻小鼠胚胎的超低温保存
摘要
乙二醇为基础的玻璃化冷冻方法对小鼠胚胎描述。这是有利于它的简单性和胚胎毒性低的其他方法,因此可广泛适用于小鼠多株,包括自交系和基因修饰的小鼠。
摘要
小鼠胚胎冷冻保存是一个技术的基础上,支持生物医学科学,因为多株小鼠已产生遗传修饰和数量一直呈逐年上升趋势。其技术的发展与慢速冷冻方法开始在20世纪70年代,1, 然后在80年代末2制定的玻璃化冷冻方法。一般来说,后者的技术优势在其快速,简便,高生存和回收胚胎。然而,冷冻保护剂中包含有剧毒,可能会影响以后的胚胎发育。因此,该技术并不适用于某些菌株的小鼠,即使解决方案冷却至4 ° C,以减轻毒性作用在胚胎处理。理化学研究所生物资源中心,超过5000个不同的遗传背景和表型的小鼠品系维持 3,所以我们优化了玻璃化冷冻TEchnique与其中,我们可以从许多不同的小鼠株冻存胚胎与胚胎存活率高的好处后,vitrifying和解冻(或液化,更精确),在环境温度4。
在这里,我们提出了一个鼠标,已成功地在我们中心的胚胎玻璃化冷冻方法。冷冻保存的解决方案包含乙二醇代替DMSO的毒性,以尽量减少胚胎5。它还含有预防反玻璃化和渗透调节的聚蔗糖和蔗糖分别。胚胎可以在室温下处理,并转移到液态氮中,5分钟之内。由于原来的方法是优化作为容器的塑料吸管,我们稍微修改了协议cryotubes,这是在实验室中更容易获得和更耐物理损坏。我们还描述了详细的玻璃化冷冻胚胎解冻的过程,因为它是一个关键的STEP为有效的恢复活体小鼠。这些方法将有助于研究人员和技术人员,他们需要在安全和成本效益的方式保存供以后使用小鼠品系。
研究方案
实验的总体方案如图 。 1。
1。试剂准备
- 在100毫升玻璃瓶的基础培养基(在这里为PB1的已知)根据下面的下面的图表:
兆瓦 mM的 mg/100ml 氯化钠 58.4 136.98 800.0 氯化钾 74.6 2.68 20.0 KH 2 PO 4 136.1 1.47 20.0 NA 2 HPO 4 .12 H 2 O 358.14 8.04 288.1 氯化镁2 · 6H 2 O 203.3 0.49 10.0 葡萄糖 180.2 5.56 100.0 钠丙酮酸 110 0.33 3.6 氯化钙2 · 2H 2 O 147 0.9 13.2 青霉素G 6.0(约) - 使聚蔗糖蔗糖(FS)解决方案:
- PB1的解决方案,在50毫升管14毫升以下的化学品。
聚蔗糖70 6.0摹 蔗糖 3.424克 牛血清白蛋白 42.0毫克 - 混合聚蔗糖70和蔗糖PB1的解决方案,直至完全溶解,摇匀。
- 检查以上完全溶解后,加入BSA溶液的表面上,并保持它在直到BSA的摄氏4度完全溶解(> 4小时或过夜)。
- PB1的解决方案,在50毫升管14毫升以下的化学品。
- 设为平衡溶液(EFS20)50毫升管和玻璃化溶液(EFS40):
- EFS20:乙二醇20%(V / V),24%(W / V)聚蔗糖,和0.4 mol / L的蔗糖PB1与BSA
- EFS40:乙二醇40%(V / V),18%(W / V)聚蔗糖,和0.3 mol / L的蔗糖PB1与BSA
*对于胚胎从BALB / C或ICR株,增加蔗糖浓度为0.9 mol / L蔗糖,因为他们更敏感cryodamage 6。
EFS20解决方案 EFS40解决方案 乙二醇 1毫升 2毫升 财政司司长解决方案 4毫升 3毫升 - 使用0.45微米filte的过滤消毒的解决方案河在5毫升的聚苯乙烯管和储存,分装在4 ° C。他们可用于6个月左右。
- 制备的胚胎解冻含有蔗糖(TS1)0.75米的解决方案
- 在PB1的溶解7.7克的蔗糖(在步骤1.1准备),使总体积30毫升。直至蔗糖完全溶解,轻轻摇动混合。
- 在表面上的解决方案中添加牛血清白蛋白90毫克,离开它的立场,直到完全溶解。
- 经过滤消毒的解决方案。
- 分装和储存在4 ° C他们可以用1个月左右。
注:TS1也可以从市售M2的准备。- 溶解7.7克的蔗糖在M2和带来的总体积30毫升。
- 直至蔗糖完全溶解,轻轻摇动混合。
- 经过滤消毒的解决方案。
- 分装和储存在摄氏4度。他们可以用1个月左右。
- TS2(解冻的解决方案含0.25 M蔗糖):
- TS1的10毫升,20毫升PB1或M2量稀释适当。
- 分装和储存在4 ° C他们可以用1个月左右。
2。 2 - 细胞小鼠胚胎玻璃化
- 2 -细胞小鼠胚胎自然交配或常规体外受精技术准备。
- 分装50μL成cryotube EFS40。此后,在室温下进行玻璃化过程的其余部分。
- 分装50μL的EFS20 35毫米或60毫米的塑料培养皿的底部。
- 转移至30胚胎EFS20使用玻璃毛细管培养基的最低金额。启动了2分钟的计时器。
注:下降的底部放置胚胎。这使得胚胎的高效脱水。立体显微镜检查胚胎的形态。脱水胚胎萎缩形态, 如图所示。 2A。如果他们没有足够的脱水,等待1或2分钟。 - 在约1.5分钟,拿起唯一的解决方案的最低金额从EFS20下降的胚胎。他们转移到EFS40在步骤2.1编写的cryotube。注:为了获得最佳效果,调整拿起使所有的胚胎可在2分钟左右转移到EFS40,胚胎的时机。
- 等待1分钟。
- 把cryotube直接进入液氮(第2号法律公告)。
3。解冻陶瓷2 - 细胞小鼠胚胎
- 解冻之前,准备一盘菜,与10μL滴恢复胚胎的胚胎培养液中(见步骤3.13)。盖在二氧化碳培养箱石油和地方菜,直到使用。注:虽然可能会在本实验中使用的常规胚胎培养任何媒体,我们建议具有较高的渗透压,如M16的介质的媒体。
- 暖TS1至37 ° C。
- 戴上口罩,并cryogloves。打开的LN 2吨ANK和检索cryotube含有胚胎。
- 快速打开管的顶部, 并放弃2号法律公告。等待30秒,以防止冻结在下一步TS1。
- 使用1000ul移液器添加到管850μLTS1(37℃),并温柔pipettings在25秒内(约10次)的混合解决方案,直到溶液均匀溶解。
- 传输整个卷管60毫米的塑料培养皿(或手表玻璃)( 图3A)。注:胚胎应在室温(22-25℃)处理,直到它们被放置在CO 2培养箱步骤3.14。
- 启动了3分钟的计时器。
- 在2分钟TS1中左右,轻轻摇晃的菜,直到培养基中含有胚胎是在菜的表面( 图 3B)传播。注:这将有助于胚胎下到谷底,因为它们是浮在表面附近时转移到TS1。
- TS2的三个50μL滴摆上日E盘( 图3C)。
- 3分钟TS1中后,检查胚胎立体显微镜的形态;他们应略有萎缩。请参阅在早期胚胎的形态( 图2B)及更高版本(图2C)TS1中。注:如果胚胎仍然肿,保持TS1中的1至3分钟。
- 拿起胚胎,并将它们传送的TS2的首次下降( 图3D)。开始3分钟定时器
- 3分钟后,转移胚胎到第二个下拉,然后到第三个下拉( 图3E)。
- 胚胎转移到步骤3.1编写的培养基。胚胎是在图所示的形状。 2D。
- 将菜在二氧化碳培养箱。约10分钟后,胚胎转移到未来的培养液洗出蔗糖已经从TS2下降。
- 继续在CO2培养箱中培养直至胚胎移植的文化。
请注意:传输安莉芳操作系统解冻日收件人女性输卵管。 在体外悠久的文化,可能会减少一些菌株在小鼠胚胎的可行性。
4。代表性的成果:
- 体外和体内的胚胎发展后的解冻是在表1和2 。本协议的优点是解冻后和其广泛的适用性,不同品系的小鼠胚胎的高生存能力。
| 应变 | 管总号 | 玻璃化冷冻胚胎号 | 回收(人数(%)) | 形态正常(第(%)) | 发展到囊胚(第(%)) |
| 只C57BL/6J | 20 | 400 | 397(99) | 394(99) | 342(87) |
| BALB / CA | 15 | 300 | 296(99) | 282(95) | 238(84) |
| ICR | 24 | 480 | 474(99) | 443(93) | 398(90) |
表1, 在体外共同小鼠品系胚胎玻璃化冷冻解冻发展
| 胚胎的条件 | 收件人女性号 | 胚胎号转移 | 植入网站(人数(%)) | 现场后代(人数(%)) |
| 新鲜的 | 12 | 180 | 141(78.3) | 110(61.1) |
| 陶瓷 | 16 | 242 | 202(83.5) | 125(51.7) |
表2。C57BL/6J小鼠胚胎玻璃化冷冻解冻体内发展。
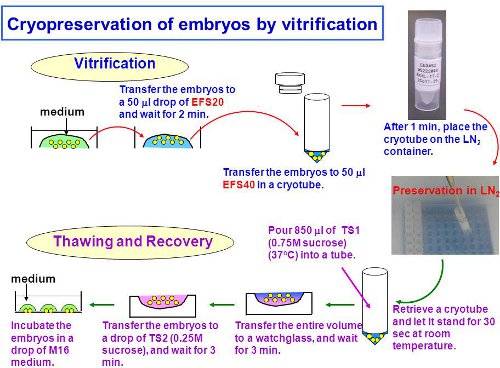
图1包括平衡,玻璃化冷冻,胚胎解冻的实验总体方案。
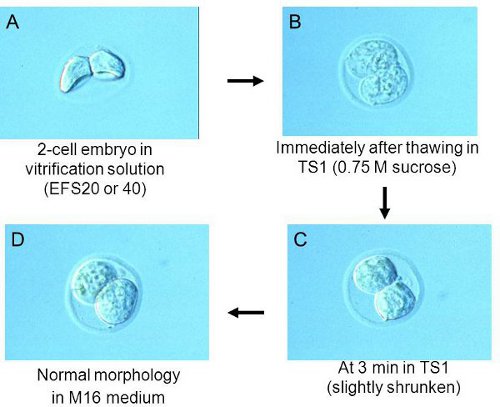
图2。胚胎解冻的每一步的形态。
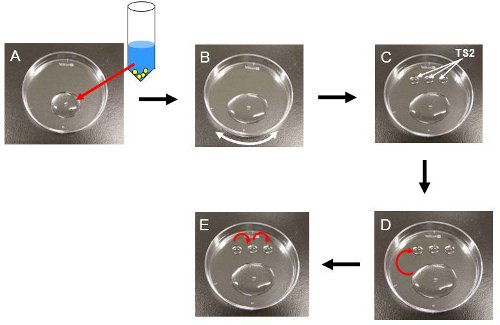
图3。胚胎解冻的过程。所有的程序都在室温下进行。 (一),添加到一个cryotube TS1(37℃)850μl和解决cryotube整个卷转移到一个塑料盘。此时,胚胎看起来肿图所示。 2B。 (二),轻轻摇动的菜表面遍布的解决方案。 (三),放在塑料盘TS2的三个50μL滴。 (四),胚胎转移的TS2的首次下降。 3分钟后,胚胎看shurunken 图所示。 2C。 (五),转移他们的串行在剩下的TS2的LY下降,然后到培养液中。
讨论
以来的第一份报告于1985年2小鼠胚胎玻璃化冷冻曼仕龙和Fahy,取得了一些技术改进,以增加胚胎解冻后的生存能力。最成功的修改之一是通过使用乙二醇作为冷冻保护剂,因为它的低毒性和高膜通透性。这种优势使我们能够处理在室温下4的冷冻胚胎,其他的玻璃化冷冻方法需要胚胎稍凉移交并不总是适用于包括的 BALB / C 6小鼠的一些菌株。第一乙二醇为基础的玻璃化冷冻是由葛西等。在1990年5,7。由于原来的方法是优化作为容器的塑料吸管,我们稍微修改了协议cryotubes,这是在实验室中更容易获得和更耐物理损坏。因此,这里描述的玻璃化冷冻方法可被应用程序licable到许多实验室用小鼠作为研究模型。同样的方法也可用于小鼠胚胎的桑椹胚和囊胚阶段和大鼠胚胎9。然而,我们最近发现的cryotubes质量后,可能会影响冻融胚胎的存活率。因此,有必要检查其前vitrifying胚胎(例如,在特定的试剂和设备表)的平滑的内表面的cryotubes。
玻璃化冷冻方法比传统的慢速冷冻方法有许多优势,但他们本身有一个运输的目的方面的缺点。由于玻璃化冷冻胚胎应保持在低于-120 ° C至维持其可行性,干托运人通常是用于他们的安全运输。干托运人笨重,和他们的往返是昂贵的,特别是国际运输。我们现在目前正在制定一项新的玻璃化冷冻方法玻璃化冷冻胚胎可以保存在干冰的温度(约-80℃)至少7 天 10 。这个方法应该是下一代的玻璃化冷冻。
披露声明
我们什么都没有透露。
致谢
这项研究是在国家生物资源项目的合作,教育部,文化,体育,科学和技术,日本。
材料
| 试剂名称 | 公司 | 目录编号 | 评论(可选) |
| 牛血清白蛋白 | 默克生物科学(Calbiochem) | 12657 | |
| 乙二醇 | 光纯药工业 | 058-00986 | |
| 聚蔗糖70 | GE医疗集团 | 17-0310-10 | |
| 血糖 | 光纯药工业 | 041-00595 | |
| 氯化钠 | 光纯药工业 | 191-01665 | |
| 氯化钾 | 光纯药工业 | 163-03545 | |
| KH 2 PO 4 | 光纯药工业 | 169-04245 | |
| NA 2 HPO 4 · 12H 2 O | 光纯药工业 | 500-04195 | |
| 氯化镁2 · 6H 2 O | 光纯药工业 | 135-00165 | |
| 氯化钙2 · 2H2O | 光纯药工业 | 031-00435 | |
| 青霉素G | Sigma - Aldrich公司 | P - 4687 | |
| 丙酮酸钠 | Sigma - Aldrich公司 | P - 8574 | |
| 蔗糖 | 光纯药工业 | 196-00015 | |
| M16的介质 | Sigma - Aldrich公司 | M7292 | |
| M2培养液 | Sigma - Aldrich公司 | M7167 | |
| Cryotube | 住友电木 | MS - 4501 | "低温小瓶" |
参考文献
- Whittingham, D. G., Leibo, S. P., Mazur, P. Survival of mouse embryos frozen to -196° and -269°C. Science. 187, 411-414 (1972).
- Rall, W. F., Fahy, G. M. Ice-free cryopreservation of mouse embryos at -196°C by vitrification. Nature. 313, 573-575 (1985).
- Yoshiki, A. The mouse resources at the RIKEN BioResource center. Exp. Anim. 58, 85-96 (2009).
- Mochida, K., Ogura, A. Cryopreservation of embryos in laboratory species. J. Mamm. Ova. Res. 27, 87-92 (2010).
- Kasai, M. A simple method for mouse embryos cryopreservation in a low toxicity vitrification solution, without appreciable loss of viability. J. Reprod. Fert. 89, 91-97 (1990).
- Dinnyes, A., Wallace, G. A., Rall, W. F. Effect of genotype on the efficiency of mouse embryo cryopreservation by vitrification or slow freezing methods. Mol. Reprod. Dev. 40, 429-435 (1995).
- Kasai, M., Mukaida, T. Cryopreservation of animal and human embryos by vitrification. Reprod. Biomed. Online. 9, 164-170 (2004).
- Miyake, T. Vitrification of mouse oocytes and embryos at various stages of development in an ethylene glycol-based solution by a simple method. Theriogenology. 40, 121-134 (1993).
- Han, M. S., Niwa, K., Kasai, M. Vitrification of rat embryos at various developmental stages. Theriogenology. 59, 1851-1863 (2003).
- Jin, B. Equilibrium vitrification of mouse embryos. Biol. Reprod. 82, 444-450 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。