Method Article
Cryoconservation d'embryons de souris par base d'éthylène glycol vitrification
Dans cet article
Résumé
Une base d'éthylène glycol méthode de vitrification des embryons de souris est décrite. Il est avantageux à d'autres méthodes dans sa simplicité et une faible toxicité embryonnaire, et ne peut donc être largement applicable à de nombreuses souches de souris, y compris les souris consanguines et génétiquement modifiées.
Résumé
Cryoconservation des embryons de souris est une base technologique qui soutient les sciences biomédicales, car de nombreuses souches de souris ont été produites par des modifications génétiques et le nombre est en augmentation constante d'année en année. Son développement technique a commencé avec méthodes de congélation lente dans les années 1970 1, puis suivie par des méthodes de vitrification développé à la fin des années 1980 2. Généralement, cette dernière technique est avantageuse dans sa rapidité, la simplicité et la survivabilité élevée d'embryons récupérés. Cependant, le contenu cryoprotecteurs sont très toxiques et peuvent affecter le développement embryonnaire ultérieur. Par conséquent, la technique n'est pas applicable à certaines souches de souris, même lorsque les solutions sont refroidies à 4 ° C afin d'atténuer l'effet toxique lors de la manipulation d'embryons. Au Centre RIKEN bioressources, plus de 5000 souches de souris avec différents fonds génétiques et les phénotypes sont maintenues 3, et donc nous avons optimisé une TE de vitrificationchnique avec laquelle nous pouvons cryoconserver embryons de nombreuses souches différentes de souris, avec les avantages de survie des embryons après vitrification haute et la décongélation (ou liquéfaction, plus précisément) à la température ambiante 4.
Ici, nous présentons une méthode de vitrification des embryons de souris qui a été utilisé avec succès dans notre centre. La solution contient de l'éthylène glycol cryoconservation au lieu de DMSO pour minimiser la toxicité pour les embryons 5. Il contient également de Ficoll et de sucrose pour la prévention de dévitrification et l'ajustement osmotique, respectivement. Les embryons peuvent être manipulés à la température ambiante et transféré dans l'azote liquide dans les 5 min. Parce que la méthode originale a été optimisé pour les pailles en plastique comme les conteneurs, nous avons légèrement modifié le protocole pour cryotubes, qui sont plus facilement accessibles dans les laboratoires et les plus résistants aux dommages physiques. Nous décrivons également la procédure de décongélation des embryons vitrifiés en détail parce que c'est un ste critiquesp pour la récupération efficace des souris vivantes. Ces méthodologies serait utile aux chercheurs et aux techniciens qui ont besoin de préservation de souches de souris pour une utilisation ultérieure d'une manière sûre et rentable.
Protocole
Le schéma global de l'expérience est montré dans la Fig. 1.
1. Préparation des réactifs
- Rendre le milieu de base (ici en tant que connue PB1) dans une bouteille de verre de 100 ml selon le tableau ci-dessous:
MW mM mg/100ml NaCl 58,4 136,98 800,0 KCl 74,6 2,68 20,0 KH 2 PO 4 136,1 1,47 20,0 Na 2 HPO 4 0,12 H 2 O 358,14 8,04 288,1 MgCl 2, 6H 2 O 203,3 0,49 10,0 Glucose 180,2 5,56 100,0 Pyruvate de Na 110 0,33 3.6 CaCl 2, 2H 2 O 147 0.9 13,2 La pénicilline G 6,0 (environ) - Faites le Ficoll-sucrose (FS) solution:
- Ajouter les substances chimiques suivantes à 14 ml de PB1 solution dans un tube de 50 ml.
Ficoll 70 6,0 g Saccharose 3,424 g BSA 42,0 mg - Mélanger Ficoll 70 et du saccharose dans PB1 solution et bien agiter jusqu'à dissolution complète.
- Après vérification de la dissolution complète ci-dessus, ajouter la BSA sur la surface de la solution et le conserver à4oC jusqu'à ce BSA est complètement dissous (> 4 heures ou jusqu'au lendemain).
- Ajouter les substances chimiques suivantes à 14 ml de PB1 solution dans un tube de 50 ml.
- Faire la solution d'équilibrage (EFS20) et la solution de vitrification (EFS40) dans un tube de 50 ml:
- EFS20: 20% (v / v) d'éthylène glycol, 24% (p / v) de Ficoll, et de 0,4 mol / L de saccharose dans PB1 avec BSA
- EFS40: 40% (v / v) d'éthylène glycol, 18% (p / v) de Ficoll, et de 0,3 mol / L de saccharose * en PB1 avec BSA
* Pour les embryons de la souche BALB / c ou ICR, augmenter la concentration de saccharose à 0,9 mol / L de saccharose, car ils sont plus sensibles aux cryodamage 6.
EFS20 solution EFS40 solution L'éthylène glycol 1 ml 2 ml Solution de FS 4 ml 3 ml - Stériliser la solution par filtration en utilisant une filte 0,45 umR. Faire aliquotes dans des tubes de 5 ml en polystyrène et conserver à 4 ° C. Ils peuvent être utilisés pendant environ 6 mois.
- Préparation de la solution d'embryon dégel contenant 0,75 M de saccharose (TS1)
- Dissoudre 7,7 g de saccharose dans PB1 (préparé à l'étape 1.1) et porter le volume total à 30 ml. Mélanger en secouant doucement jusqu'à complète dissolution du saccharose.
- Ajoutez 90 mg de BSA sur la surface de la solution et laisser reposer jusqu'à dissolution complète.
- Stériliser la solution par filtration.
- Aliquoter et conserver à 4 ° C. Ils peuvent être utilisés pendant environ un mois.
Note: TS1 peuvent également être préparés à partir de M2 disponibles commercialement.- Dissoudre 7,7 g de saccharose dans M2 et porter le volume total à 30 ml.
- Mélanger en secouant doucement jusqu'à complète dissolution du saccharose.
- Stériliser la solution par filtration.
- Aliquoter et stocker à 4 ° C. Ils peuvent être utilisés pendant environ un mois.
- TS2 (solution dégelcontenant 0,25 M de saccharose):
- Diluer 10 ml avec 20 volumes TS1 ml de PB1 ou M2, le cas échéant.
- Aliquoter et conserver à 4 ° C. Ils peuvent être utilisés pendant environ un mois.
2. La vitrification d'embryons de souris à 2 cellules
- Préparer deux cellules d'embryons de souris par accouplement naturel ou conventionnel dans les techniques de fécondation in vitro.
- Aliquote de 50 ul EFS40 dans un cryotube. Ci-après, exécuter le reste de la procédure de vitrification à la température ambiante.
- Aliquote de 50 pl d'EFS20 sur le fond de 35 mm ou 60 mm en plastique plat de Pétri.
- Transfert jusqu'à 30 embryons à l'aide d'un EFS20 capillaire en verre avec seulement le montant minimum du milieu de culture. Démarrer une minuterie pendant 2 min.
Remarque: les embryons Placer sur le fond de la goutte. Cela rend efficacité de la déshydratation des embryons. Vérifiez la morphologie des embryons par un stéréomicroscope. Embryons déshydratés montrent une morphologie ratatinée, comme indiqué dans la Fig. 2A.Si elles ne sont pas déshydratés assez d'attendre pour plus d'1 ou 2 min. - À environ 1,5 min, ramasser les embryons dans le menu déroulant EFS20 avec seulement le montant minimum de la solution. Transférez-les dans le cryotube EFS40 préparé en 2,1 étapes. Note: Pour les meilleurs résultats, ajuster le calendrier de ramasser des embryons de telle sorte que tous les embryons peuvent être transférés dans EFS40 à environ 2 min.
- Attendre 1 min.
- Mettez le cryotube directement dans l'azote liquide (LN2).
3. La décongélation des embryons de souris vitrifié 2-cellules
- Avant de décongélation, préparer un plat avec 10 gouttes ul de milieu de culture embryonnaire des embryons récupérés (voir l'étape 3.13). Couvrir le plat avec de l'huile et placer dans un incubateur à CO 2 jusqu'à son utilisation. Note: Bien que tous les médias pour la culture d'embryons de routine peuvent être utilisées dans cette expérience, nous recommandons médias avec plus osmolarité tel que le milieu M16.
- TS1 chaud à 37 ° C.
- Mettez un masque visage et cryogloves. Ouvrez la LN 2 tank et récupérer un cryotube contenant des embryons.
- Ouvrir rapidement le haut du tube et jeter LN 2. Attendre 30 secondes pour éviter le gel des TS1 à l'étape suivante.
- Utiliser une pipette 1000ul d'ajouter 850 l de TS1 (37 ° C) dans le tube et mélanger la solution par pipetages douce (environ dix fois en 25 secondes) jusqu'à ce que la solution est uniformément dissoute.
- Transférer la totalité du volume du tube pour un plat en plastique de 60 mm de Pétri (ou un verre de montre) (figure 3A). Remarque: Les embryons doivent être manipulés à la température ambiante (22-25 ° C) jusqu'à ce qu'ils soient placés dans un incubateur à CO 2 à l'étape 3.14.
- Démarrer une minuterie pendant 3 min.
- A environ 2 min dans TS1, secouez doucement la parabole jusqu'à le milieu contenant les embryons est étalé sur la surface de la parabole (figure 3B). Note: Ceci aidera les embryons vont vers le bas parce qu'ils sont flottants près de la surface lors de son transfert à TS1.
- Mettez trois gouttes de 50 pl d'TS2 sur ee plat (figure 3C).
- Après 3 min dans TS1, vérifier la morphologie des embryons par un stéréomicroscope, ils devraient être légèrement rétrécie. Voir la morphologie des embryons en plus tôt (figure 2B) et plus tard (figure 2C) en TS1. Remarque: Si les embryons sont encore gonflées, les garder dans TS1 pour plus de 1 à 3 min.
- Ramassez les embryons et les transférer à la première goutte de TS2 (Fig. 3D). Démarrer une minuterie pendant 3 min
- Après 3 minutes, le transfert des embryons à la baisse de secondes, puis à la troisième baisse (Fig. 3E).
- Transfert des embryons dans le milieu de culture préparé à l'étape 3.1. Les embryons sont dans la forme représentée dans la Fig. 2D.
- Placez-vaisselle dans un incubateur à CO 2. Environ 10 minutes plus tard, le transfert des embryons à la baisse prochaine du milieu de culture pour laver le saccharose qui a été reporté de TS2.
- Poursuivre la culture dans un incubateur à CO2 jusqu'au transfert d'embryon.
Remarque: Le transfert EmbryOS pour les oviductes des femelles receveuses au jour de décongélation. Longue culture in vitro peut diminuer la viabilité des embryons chez certaines souches de souris.
4. Les résultats représentatifs:
In vitro - et in vivo-développement des embryons après décongélation est présenté dans les tableaux 1 et 2. Les avantages de ce protocole sont les chances de survie élevé d'embryons après décongélation et son large applicabilité à différentes souches de souris.
| Souche | Nombre total de tubes | No. d'embryons vitrifiés | Réformé (n ° (%)) | Morphologiquement normaux (n ° (%)) | Développement d'blastocystes (n ° (%)) |
| C57BL/6J | 20 | 400 | 397 (99) | 394 (99) | 342 (87) |
| BALB / ca | 15 | 300 | 296 (99) | 282 (95) | 238 (84) |
| ICR | 24 | 480 | 474 (99) | 443 (93) | 398 (90) |
Tableau 1. In vitro-développement de vitrifiés et décongelés embryons dans des souches de souris commune
| Condition d'embryons | Nombre de femelles receveuses | No. d'embryons transférés | Sites d'implantation (n ° (%)) | Des jeunes vivants (n ° (%)) |
| Fraîches | 12 | 180 | 141 (78.3) | 110 (61.1) |
| Vitrifié | 16 | 242 | 202 (83.5) | 125 (51.7) |
Tableau 2. In vivo, le développement des vitrifiés et décongelés embryons chez des souris C57BL/6J.
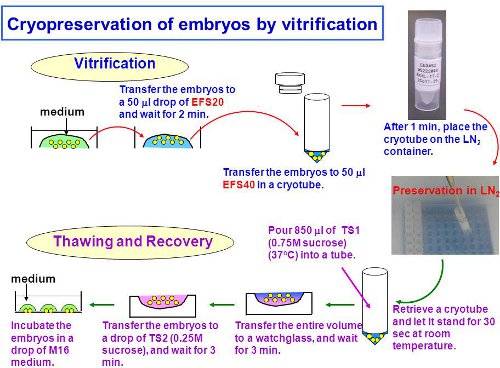
Figure 1. Le schéma d'ensemble de l'expérience, y compris l'équilibration, la vitrification, et la décongélation des embryons.
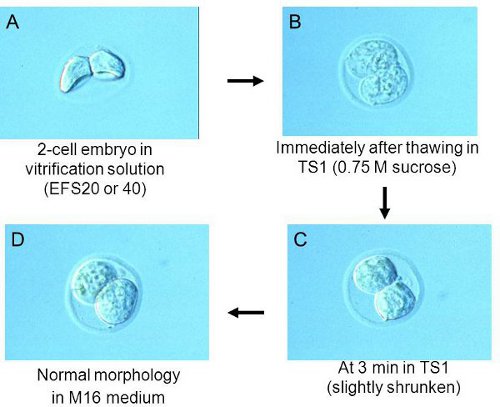
Figure 2. La morphologie des embryons à chaque étape de décongélation.
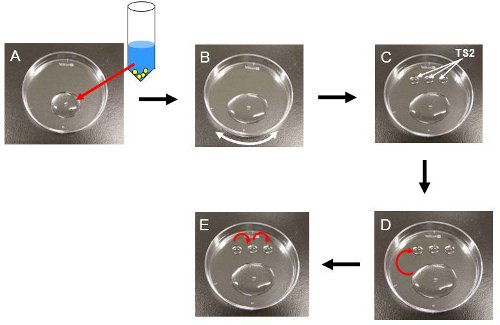
Figure 3. Dégel procédure d'embryons. Toutes les procédures sont réalisées à température ambiante. (A), ajouter 850 l de TS1 (37 ° C) dans un cryotube et le transfert de la totalité du volume de la solution dans le cryotube sur un plat en plastique. A cette époque, les embryons chercher gonflées comme indiqué dans la Fig. 2B. (B), étaler la solution sur la surface du plat en le secouant doucement. (C), 50 gouttes Placer trois pl d'TS2 sur le plat en plastique. (D), le transfert des embryons pour la première goutte de TS2. Après 3 minutes, les embryons chercher shurunken comme indiqué dans la Fig. 2C. (E), les transférer sériement dans le reste TS2 gouttes et puis au milieu de culture.
Discussion
Depuis le premier rapport de la vitrification des embryons de souris par Rall et Fahy, en 1985, 2, plusieurs améliorations techniques ont été faits pour accroître la capacité de survie des embryons après décongélation. Une des modifications les plus réussies a été atteint par l'utilisation de l'éthylène glycol comme un cryoprotecteur en raison de sa faible toxicité et de haute perméabilité membranaire. Ces avantages nous permettent de gérer la congélation d'embryons à 4 température ambiante; méthodes de vitrification d'embryons d'autres nécessitent la remise à des températures plus fraîches et ne sont pas toujours applicables à certaines souches de souris dont BALB / c 6. Vitrification à base de glycol d'éthylène Le premier a été développé par Kasai et al. en 1990 5,7. Parce que la méthode originale a été optimisé pour les pailles en plastique comme les conteneurs, nous avons légèrement modifié le protocole pour cryotubes, qui sont plus facilement accessibles dans les laboratoires et les plus résistants aux dommages physiques. Par conséquent, la méthode de vitrification décrites ici peuvent être applicable à plusieurs laboratoires utilisant des souris comme modèles de recherche. La même méthode peut également être utilisé pour les embryons de souris à la morula et blastocyste étapes 8 et 9 embryons de rat. Toutefois, nous avons récemment constaté que la qualité des cryotubes peuvent affecter le taux de survie des embryons après congélation-décongélation. Ainsi, il est essentiel d'examiner la surface intérieure de la cryotubes pour sa finesse, avant vitrification des embryons (par exemple, voir au tableau des réactifs spécifiques et les équipements).
Méthodes de vitrification ont de nombreux avantages sur les méthodes classiques de congélation lente, mais ils ont intrinsèquement un désavantage par rapport à fin de transport. Comme embryons vitrifiés devrait être maintenu au-dessous de -120 ° C pour maintenir leur viabilité, les expéditeurs secs sont généralement utilisés pour leur transport sécuritaire. Expéditeurs à sec sont lourds et encombrants, et de leur voyage aller-retour coûte cher, surtout pour le transport international. Nous sommes maintenant en train de développer une nouvelle méthode de vitrification pardont les embryons vitrifiés peut être conservé à la température de la glace sèche (environ -80 ° C) pendant au moins 7 jours 10. Cette méthode devrait être la vitrification de la prochaine génération.
Déclarations de divulgation
Nous n'avons rien à révéler.
Remerciements
Cette étude a été menée en collaboration avec le Projet national de bioressources, le Ministère de l'Education, Culture, Sports, Science et Technologie, Japon.
matériels
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
| L'albumine sérique bovine | Merck Biosciences (Calbiochem) | 12657 | |
| L'éthylène glycol | Wako Pure Chemical Industries | 058-00986 | |
| Ficoll 70 | GE Healthcare | 17-0310-10 | |
| Le glucose | Wako Pure Chemical Industries | 041-00595 | |
| NaCl | Wako Pure Chemical Industries | 191-01665 | |
| KCl | Wako Pure Chemical Industries | 163-03545 | |
| KH 2 PO 4 | Wako Pure Chemical Industries | 169-04245 | |
| Na 2 HPO 4 · 12H 2 O | Wako Pure Chemical Industries | 500-04195 | |
| MgCl 2 · 6H 2 O | Wako Pure Chemical Industries | 135-00165 | |
| CaCl2 · 2H2O | Wako Pure Chemical Industries | 031-00435 | |
| La pénicilline G | Sigma-Aldrich | P-4687 | |
| Pyruvate de sodium | Sigma-Aldrich | P-8574 | |
| Saccharose | Wako Pure Chemical Industries | 196-00015 | |
| M16 moyennes | Sigma-Aldrich | M7292 | |
| Milieu M2 | Sigma-Aldrich | M7167 | |
| Cryotube | Sumitomo Bakelite | MS-4501 | «Fiole cryogénique" |
Références
- Whittingham, D. G., Leibo, S. P., Mazur, P. Survival of mouse embryos frozen to -196° and -269°C. Science. 187, 411-414 (1972).
- Rall, W. F., Fahy, G. M. Ice-free cryopreservation of mouse embryos at -196°C by vitrification. Nature. 313, 573-575 (1985).
- Yoshiki, A. The mouse resources at the RIKEN BioResource center. Exp. Anim. 58, 85-96 (2009).
- Mochida, K., Ogura, A. Cryopreservation of embryos in laboratory species. J. Mamm. Ova. Res. 27, 87-92 (2010).
- Kasai, M. A simple method for mouse embryos cryopreservation in a low toxicity vitrification solution, without appreciable loss of viability. J. Reprod. Fert. 89, 91-97 (1990).
- Dinnyes, A., Wallace, G. A., Rall, W. F. Effect of genotype on the efficiency of mouse embryo cryopreservation by vitrification or slow freezing methods. Mol. Reprod. Dev. 40, 429-435 (1995).
- Kasai, M., Mukaida, T. Cryopreservation of animal and human embryos by vitrification. Reprod. Biomed. Online. 9, 164-170 (2004).
- Miyake, T. Vitrification of mouse oocytes and embryos at various stages of development in an ethylene glycol-based solution by a simple method. Theriogenology. 40, 121-134 (1993).
- Han, M. S., Niwa, K., Kasai, M. Vitrification of rat embryos at various developmental stages. Theriogenology. 59, 1851-1863 (2003).
- Jin, B. Equilibrium vitrification of mouse embryos. Biol. Reprod. 82, 444-450 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon