需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
利用经颅磁刺激,以研究人类的神经肌肉系统
摘要
经颅磁刺激(TMS)是一种非侵入性的工具获得洞察力和人体神经系统的生理功能。在这里,我们目前TMS的技术研究上肢和腰部肌肉的皮质兴奋。
摘要
经颅磁刺激(TMS)已经在使用20年以上1,并已越来越流行指数在过去的十年。虽然使用TMS的扩大,在此期间,许多系统和过程的研究,原来的应用程序,或许TMS的最常见的用途之一,涉及到学习的生理,可塑性和人类的神经肌肉系统的功能。单脉冲TMS适用于运动皮层兴奋的锥体神经元transsynaptically 2(图1)和可衡量的肌电反应,可用于研究和评估人类的3皮质脊髓束的完整性和兴奋结果。此外,在磁刺激技术的最新进展现在允许皮层与脊髓兴奋4,5分区。例如,双脉冲TMS的可以用来评估intracortical易化和抑制性能相结合的条件ING刺激和刺激测试,在不同的interstimulus 时间间隔3,4,6-8。在这个视频文章中,我们将演示这些技术的方法和技术方面。具体来说,我们将证明单脉冲和双脉冲TMS的技术,适用于桡侧腕屈(FCR)的肌肉以及竖脊肌(ES)肌肉。我们的实验室研究FCR的肌肉,因为它是利益上腕手的石膏固定减少肌肉性能 6,9影响的研究,我们研究的ES肌肉由于这些肌肉的临床意义,因为它涉及到腰痛8。这说明,我们应该注意到,TMS已被用来研究的手,手臂和腿的许多肌肉,并应重申我们在FCR和ES肌肉群的游行示威,只选择了TMS的例子被用来研究人类神经肌肉制度。
研究方案
1。 FCR和ES肌肉的单和双脉冲TMS
- 基本安全预防措施:在此之前执行TMS在一个人的主体性是必要的,因为它涉及到基本的安全预防措施,他们的第一个屏幕接触磁场。在我们的实验室中,我们遵循筛选磁共振安全, 教育和研究10研究所提出的指导方针。在我们的实验室中,我们也经常与癫痫发作的家族病史的人排除在外。我们还要求受试者接受TMS的ES肌肉戴上耳塞和一张嘴后卫的重点和更有力的刺激强度。
- 电气录音:要检查是必要的记录骨骼肌肌电图(EMG)信号在电机系统TMS的反应。对于FCR肌表面电极放在前臂上使用双极电极在T纵向安排位于他的肌肉光头和磨损皮肤,正如我们先前所描述的7,11。对于竖脊肌的肌肉,我们使用类似的电极位于剃光和磨损皮肤8在L3 - L5椎体水平的肌肉纵向安排。
- TMS线圈方向:主要激活皮质的神经元,transsynaptically它是必要的适当位置的TMS线圈12。对于FCR的肌肉,我们把一个70毫米的数字“8 TMS线圈相切的头皮和中线45度,所以,在侧后方内侧前方向的感应电流的流动。对于ES肌肉中,我们使用一个双锥形线圈,具有更大的穿透深度,是由于这些肌肉homunculus更深的代表性需要。在这里,线圈定位如在眼前的电流流入后的方向。我们有自定义的修改与激光附件系统我们的线圈,以协助我们在Subsequent重新定位的双锥形线圈。
- 识别“热点”:这是必要的,以确定引出最大的运动诱发电位的刺激位置。 FCR的肌肉,我们通过巧妙的移动TMS的线圈周围非常小的增量,并确定在我们观察到的最大的运动诱发电位振幅。一旦找到,我们注意到了不可磨灭的油墨,在头皮或莱卡第这方面。 TMS的ES肌肉TMS上肢肌肉比人类受试者相当多的不舒服。因此,我们简化了我们的ES肌肉的TMS的协议,以增加它的耐受性和可行性。在这里,而不是寻找“热点”我们用人体测量,以确定顶点的头骨。具体来说,我们确定了在矢状交集的头骨顶点(nasinon和枕外隆凸尖之间)和日冕(耳屏之间)飞机。
- 生物力学的定位: 当我们执行TMS FCR的肌肉科目的手臂搁在一个BioDex系统4测功机(图2)扩展位置坐下。但是,我们应该注意,这只是一个可能的设置测量施加力量的例子。为ES肌肉科目要求一个直立的姿势坐下来与他们的手在他们的腿上休息(图3)。他们坐在旋转底座椅子上,大腿90 °相对躯干,小腿〜45 °相对的大腿上,在一个中立的posture8腰椎。
- 量化运动阈值 :FCR的,我们提供单脉冲,在逐步增加刺激强度,直至运动诱发电位峰-峰值幅度超过50%的试验的大于50毫伏(图4)确定电机阈值( MT) 。为了简化的TMS协议和提高耐受性和可行性,我们不运动阈值确定在E与相同的精度,当我们测试上肢肌肉的肌肉。相反,我们开始由50%的最大刺激输出提供一个初始的单脉冲,以确定是否这个刺激的强度是高于或低于运动阈值的TMS的协议。如果MEP是在观察到这种刺激强度的背景水平相对可辨别的MEP定义肌电图强度降低,以刺激输出的40%,以确定是否这个刺激的强度是子或超阈值 8 。
- 我们提供一个单脉冲TMS的强度等于130%运动阈值的“热点”的FCR 量化MEP波幅使用单脉冲TMS:检查电机诱发电位波幅,并计算峰-峰幅度。一般情况下,我们正常化的最大复合肌肉纤维的动作电位超最大的正中神经电刺激后,这一结果。我们应该注意到,MEP的大小是版Ÿ皮质兴奋程度的依赖。因此,当TMS脉冲的背景下收缩期间交付,皮质兴奋性增加时,环境保护部大小将显着增加。对于ES肌肉,我们提供了一个单TMS脉冲强度为40或50%以上子运动阈值烈度8顶点。不幸的是,因为末梢神经支配ES肌肉电刺激不能访问,我们不能够正常化,这些运动诱发电位的复合型肌纤维的动作电位。
- 量化缄默期持续时间,采用单脉冲 TMS的:当一个TMS脉冲皮层交付过程中肌肉收缩,它会产生一个电气静止恢复活动前即指示皮质抑制,通常被称为沉默的运动诱发电位13期(图5)。要量化的缄默期,我们提供一个单一TMS脉冲“热点”等于130%运动阈值的强度,同时研究参与者是其最大强度的15%执行一个屈腕肌肉收缩。以前我们没有量化的ES肌肉的缄默期时间,但是,我们应该注意到,我们有传言称观察它的存在,在这个肌肉群时TMS脉冲ID的背景下收缩期间交付。
- 量化Intracortical便利使用双脉冲TMS的:我们使用双脉冲TMS量化intracortical便利6,7(图6和7的FCR和ES的肌肉,分别代表本测量)。 FCR的肌肉,我们首先要确定需要引出一个运动诱发电位之间的0.5-1.0 mV的刺激强度。下一步,我们提供了一个亚阈值调节脉冲在我们的实验室通常设置为等于70%运动阈值15毫秒阈上测试脉冲前。这一调理在这段时间内的测试脉冲前交付的脉冲将增加,或促进,电机的振幅诱发电位无条件相同的强度比单一脉冲。为ES肌肉群的调节脉冲强度设置为观察到的子运动阈值的强度(40%或50%的刺激输出),并设置测试脉冲强度分运动阈值水平(80%至40%以上或刺激产出的90%)8 。我们应该注意到,调节脉冲的强度可以根据这项研究的目的是多种多样的。同样,脉冲间隔可以改变肌肉和其相对位置的皮层而定。
- 量化短间隔Intracortical抑制使用双脉冲TMS的:我们也使用双脉冲TMS的量化短间隔intracortical抑制6,7(如图6日和7代表的FCR和ES肌肉的测量,分别) 。在这里,无论是FCR和ES的肌肉,程序是相同的测量两个脉冲之间的刺激间隔减少到3毫秒的异常intracortical便利的描述。在这段时间之前的测试脉冲发表这空调脉冲将减少,或抑制,电机的振幅诱发电位无条件相同的强度比单一脉冲。
- 量化长区间Intracortical抑制使用双脉冲TMS:提供两个相同的阈上测试是由100毫秒分开的脉冲也可以用来评估长的时间间隔intracortical 抑制 6,7 。在这种情况下,FCR的肌肉,第二个脉冲的运动诱发电位较小,或抑制更比第一(图8)相关,。我们以前没有量化intracortical抑制长的时间间隔在ES肌肉因超过受耐受关注。
2。代表性的成果:
以下提供一个阈上TMS脉冲,刺激肌肉应该表现出一个很容易观察到的肌电响应(MEP)的(图4-8所示)。尽管它应该刺激发作和环境保护部之间的延迟正在审议的肌肉群之间会有所不同,但FCR的一般是16-19毫秒(图6)和ES的是17-22毫秒(图7;应当指出,明确环境保护部在ES肌肉开始在一些学科更难以直观地识别)。应该指出,当测试的ES肌肉群的其他几个肌肉群也明显随之而来,极大地刺激(包括下肢homunculus一般在同一地区,这是代表肌肉)。在测量intracortical便利MEP波幅通常比单一无条件脉冲(F观察igure 6和7)。然而,这是我们的经验,肌肉群之间的变化与一些肌肉群 - 如FCR显示在很多科目只有轻微的便利程度的便利。对于短间隔和长间隔intracortical抑制测量MEP波幅下降一般是观察比较单一相同的强度(图6-8)无条件脉冲。
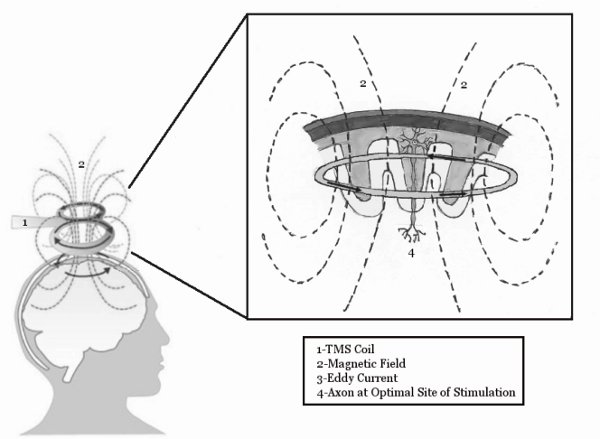
图1。TMS的基本机制。TMS线圈感应磁场,穿透头皮和运动皮层内引起涡流。此涡流能够刺激大脑内的神经元。图转载自麦克金尼和克拉克,按14。
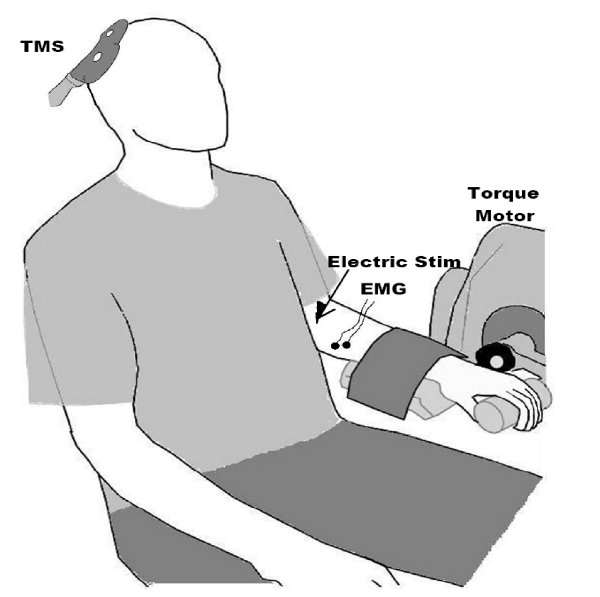
图2 T执行安装。 MS FCR的肌。请注意记录肌电(EMG)从前臂的信号,并在运动皮层的TMS的桨。我们一般也创纪录的肌肉力量,并使用电气周围神经刺激,以获得最大的复合肌纤维动作电位,因为这是在解释振幅值(例如,一个可以表达和MEP相对最大肌肉反应,而不是一个绝对有用mV值可大量皮下脂肪组织,如非生理因素)的影响。从下面的图转载:Clark等。 2008年9月 ,克拉克等,2010年6月 ,和麦克金尼等。 2010年7。

图3。执行TMS上竖spinale肌肉的设置 。戈斯等重印图。 2011 8。
_upload/3387/3387fig4.jpg“/>
图4的运动阈值测定的例子。肌电图的痕迹代表诱发电位(MEP)的反应逐渐增加刺激强度(作为刺激输出(SO)的百分比表示)的电机。请注意,在低强度(28-30%的SO)非常小的MEP引起(亚阈值),但在32%,所以一个MEP引起电机,达到阈值(通常作为一个PP幅度MEP定义> 50μV)。
图转载自麦克金尼和克拉克,按14。

图5的TMS:在收缩运动诱发潜在的缄默期。当对象执行一个单一的刺激,适用于运动皮层的轻微收缩和缄默期。第一部分是缄默期由于脊髓抑制,而后者则部分是由于大脑皮层的抑制,特别是GABA B受体。有没有达成共识的方式来量化的缄默期的持续时间,但我们的研究结果表明,无论是从刺激发作或MEP发病自愿的干扰肌电信号返回定义它是最可靠的的15。
图从2011年16克拉克和快速和麦克金尼和克拉克,按14重印。
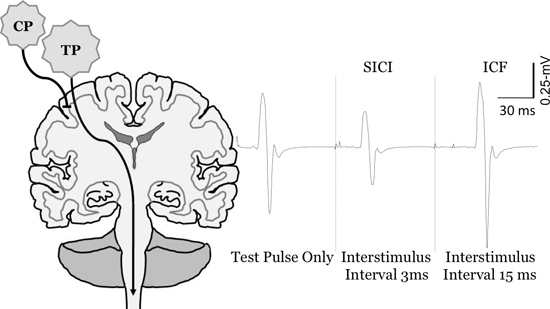
图6:在电机的变化引起的潜力大小的FCR肌肉的第i个成对的脉冲TMS的。测量短的时间间隔intracortical抑制(SICI)和intracortical便利(ICF)。要量化SICI和ICF的调节脉冲(CP)运动阈值以下,并测试脉冲(TP)的设置,以唤起人们之间的0.5-1 mV的MEP的。在很短的interstimulus间隔(例如,3毫秒)CP抑制比较只到TP(SICI)环境保护部,而在较长的interstimulus间隔(如15毫秒),它促进了环境保护部“(ICF)。
CP:调节脉冲,总磷:测试脉冲图重印Clark等,2010年6月 ,麦克金尼等。。 2010 14,克拉克和快速,2011年16麦克金尼和克拉克,按14。

图7。电机的变化诱发电位的ES肌肉配对脉冲TMS的大小。来自竖脊肌的肌肉和测量短的时间间隔intracortical抑制(SICI)和intracortical便利(ICF)的肌电图的痕迹的例子。
戈斯等图再版。 2011 8。
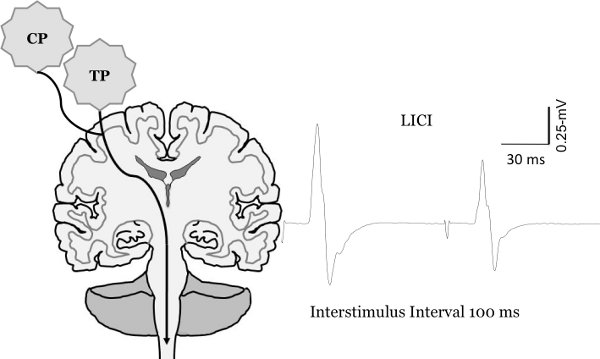
图8电机EVO的变化 。KED配对脉冲TMS的潜力大小。长间隔intracortical抑制的测量(LICI)。 LICI两个量化的测试脉冲刺激间隔100毫秒交付。第二MEP结果抑制比较第一MEP。
Clark等重印图,2010年6月 ,麦克金尼等。 2010年7麦克金尼和克拉克,在出版社14。
讨论
这篇文章的总体目标是提供了我们的实验室,视觉帐户使用经颅磁刺激的科学家和临床医生。然而,除了提供这些实验的可视化,下面我们讨论执行TMS以这种方式时要考虑的基本问题,提供了一个简要介绍TMS的反应的生理,并讨论关于使用TMS的使用别人。
一般的问题要知道当执行条所述的TMS
在执行配对脉冲TMS的时需要注意的几个问题。例如,Magstim BiStim
披露声明
没有利益冲突的声明。
致谢
这项工作是由骨科遗产基金会公元前克拉克的资助部分经费。我们希望国家特别感谢她的协助您玛丽莎麦克金尼创造许多数字图形。
材料
| Name | Company | Catalog Number | Comments |
| 设备名称 | 公司 | 目录编号 | 评论(可选) |
|---|---|---|---|
| 2002年经颅磁刺激 经颅磁刺激双向Stim2 图八70毫米线圈 双锥形线圈 | Magstim公司 | 不适用 | TMS设备(包括线圈) |
| Biodex系统4 | Biodex | 不适用 | 测力计 |
| BIOPAC MP150数据采集系统 | BIOPAC | MP150WSW | AD转换器,肌电图和力 |
| AcqKnowledge 4.0数据采集软件 | BIOPAC | ACK100W | |
| Nikomed跟踪1心电电极 | Nikomed | 2015 | 肌电图电极 |
| 恒定电流刺激器 | Digitimer | DS7A | 周围神经刺激 |
参考文献
- Barker, A. T., Jalinous, R., Freeston, I. L. Non-invasive magnetic stimulation of human motor cortex. Lancet. 1, 1106-1107 (1985).
- Werhahn, K. J., et al. The effect of magnetic coil orientation on the latency of surface EMG and single motor unit responses in the first dorsal interosseous muscle. Electroencephalography and Clinical Neurophysiology. 93, 138-146 (1994).
- Kobayashi, M., Pascual-Leone, A. Transcranial magnetic stimulation in neurology. Lancet. Neurol. 2, 145-156 (2003).
- Reis, J., et al. Contribution of transcranial magnetic stimulation to the understanding of cortical mechanisms involved in motor control. J. Physiol. 586, 325-351 (2008).
- Taylor, J. L. Stimulation at the cervicomedullary junction in human subjects. Journal of Electromyography and Kinesiology: Official Journal of the International Society of Electrophysiological Kinesiology. 16, 215-223 (2006).
- Clark, B. C., Taylor, J. L., Hoffman, R. L., Dearth, D. J., Thomas, J. S. Cast immobilization increases long-interval intracortical inhibition. Muscle & Nerve. 42, 363-372 (2010).
- McGinley, M., Hoffman, R. L., Russ, D. W., Thomas, J. S., Clark, B. C. Older adults exhibit more intracortical inhibition and less intracortical facilitation than young adults. Exp. Gerontol. 45, 671-678 (2010).
- Goss, D. A., Thomas, J. S., Clark, B. C. Novel methods for quantifying neurophysiologic properties of the human lumbar paraspinal muscles. Journal of Neuroscience Methods. 194, 329-335 (2011).
- Clark, B., Issac, L. C., Lane, J. L., Damron, L. A., Hoffman, R. L. Neuromuscular plasticity during and following 3-weeks of human forearm cast immobilization. J. Appl. Physiol. 105, 868-878 (2008).
- Clark, B. C., Issac, L. C., Lane, J. L., Damron, L. A., Hoffman, R. L. Neuromuscular plasticity during and following 3 wk of human forearm cast immobilization. J. Appl. Physiol. 105, 868-878 (2008).
- Brasil-Neto, J. P., et al. Optimal focal transcranial magnetic activation of the human motor cortex: effects of coil orientation, shape of the induced current pulse, and stimulus intensity. J. Clin. Neurophysiol. 9, 132-136 (1992).
- Damron, L. A., Dearth, D. J., Hoffman, R. L., Clark, B. C. Quantification of the corticospinal silent period evoked via transcranial magnetic stimulation. Journal of Neuroscience Methods. 173, 121-128 (2008).
- McGinley, M. P., Clark, B. C. Transcranial magnetic stimulation and the human neuromuscular system. Horizons in Neuroscience Research. , (2012).
- Damron, L. A., Hoffman, R. L., Dearth, D. J., Clark, B. C. Quantification of the corticospinal silent period evoked via transcranial magnetic brain stimulation. J. Neurosci. Methods. 173, 121-128 (2008).
- Clark, B. C., Quick, A. Exploring the pathophysiology of Mal de Debarquement. J. Neurol. 258, 1166-1168 (2011).
- Ortu, E., Deriu, F., Suppa, A., Tolu, E., Rothwell, J. C. Effects of volitional contraction on intracortical inhibition and facilitation in the human motor cortex. J. Physiol. 586, 5147-5159 (2008).
- Dishman, J. D., Greco, D. S., Burke, J. R. Motor-evoked potentials recorded from lumbar erector spinae muscles: a study of corticospinal excitability changes associated with spinal manipulation. J. Manipulative. Physiol. Ther. 31, 258-270 (2008).
- Kuppuswamy, A. Cortical control of erector spinae muscles during arm abduction in humans. Gait. Posture. 27, 478-484 (2008).
- Strutton, P. H., Theodorou, S., Catley, M., McGregor, A. H., Davey, N. J. Corticospinal excitability in patients with chronic low back pain. J. Spinal. Disord. Tech. 18, 420-424 (2005).
- Taniguchi, S., Tani, T. Motor-evoked potentials elicited from human erector spinae muscles by transcranial magnetic stimulation. Spine (Philadelphia. 24, 154-157 (1999).
- Taniguchi, S., Tani, T., Ushida, T., Yamamoto, H. Motor evoked potentials elicited from erector spinae muscles in patients with thoracic myelopathy. Spinal. Cord. 40, 567-573 (2002).
- O'Connell, N. E., Maskill, D. W., Cossar, J., Nowicky, A. V. Mapping the cortical representation of the lumbar paravertebral muscles. Clin. Neurophysiol. 118, 2451-2455 (2007).
- Maeda, F., Pascual-Leone, A. Transcranial magnetic stimulation: studying motor neurophysiology of psychiatric disorders. Psychopharmacology (Berl). 168, 359-376 (2003).
- Ziemann, U. TMS and drugs. Clin. Neurophysiol. 115, 1717-1729 (2004).
- Tergau, F., et al. Complete suppression of voluntary motor drive during the silent period after transcranial magnetic stimulation. Exp. Brain. Res. 124, 447-454 (1999).
- Di Lazzaro, V., et al. The physiological basis of transcranial motor cortex stimulation in conscious humans. Clin. Neurophysiol. 115, 255-266 (2004).
- Iles, J. F., Pisini, J. V. Cortical modulation of transmission in spinal reflex pathways of man. J. Physiol. 455, 425-446 (1992).
- Gandevia, S. C., Petersen, N., Butler, J. E., Taylor, J. L. Impaired response of human motoneurones to corticospinal stimulation after voluntary exercise. J. Physiol. 521 (Pt. 3), 749-759 (1999).
- Hallett, M. Transcranial magnetic stimulation: a primer. Neuron. 55, 187-199 (2007).
- Damron, L. A., Dearth, D. J., Hoffman, R. L., Clark, B. C. Quantification of the corticospinal silent period evoked via transcranial magnetic stimulation. J. Neurosci. Methods. 173, 121-128 (2008).
- Cantello, R. Applications of transcranial magnetic stimulation in movement disorders. J. Clin. Neurophysiol. 19, 272-293 (2002).
- Chen, R. The clinical diagnostic utility of transcranial magnetic stimulation: report of an IFCN committee. Clin. Neurophysiol. 119, 504-532 (2008).
- Edwards, M. J., Talelli, P., Rothwell, J. C. Clinical applications of transcranial magnetic stimulation in patients with movement disorders. Lancet. Neurol. 7, 827-840 (2008).
- Terao, Y., Ugawa, Y. Basic mechanisms of TMS. J. Clin. Neurophysiol. 19, 322-343 (2002).
- McDonnell, M. N., Orekhov, Y., Ziemann, U. The role of GABA(B) receptors in intracortical inhibition in the human motor cortex. Exp. Brain. Res. 173, 86-93 (2006).
- Perez-de-Sa, V., et al. High brain tissue oxygen tension during ventilation with 100% oxygen after fetal asphyxia in newborn sheep. Pediatr. Res. 65, 57-61 (2009).
- Anand, S., Hotson, J. Transcranial magnetic stimulation: neurophysiological applications and safety. Brain. Cogn. 50, 366-386 (2002).
- Chen, R. Depression of motor cortex excitability by low-frequency transcranial magnetic stimulation. Neurology. 48, 1398-1403 (1997).
- Tokay, T., Holl, N., Kirschstein, T., Zschorlich, V., Kohling, R. High-frequency magnetic stimulation induces long-term potentiation in rat hippocampal slices. Neurosci. Lett. 461, 150-154 (2009).
- Taylor, J. L., Gandevia, S. C. Noninvasive stimulation of the human corticospinal tract. J. Appl. Physiol. 96, 1496-1503 (2004).
- Martin, P. G., Hudson, A. L., Gandevia, S. C., Taylor, J. L. Reproducible measurement of human motoneuron excitability with magnetic stimulation of the corticospinal tract. J. Neurophysiol. 102, 606-613 (2009).
- Cohen, L. G., Bandinelli, S., Findley, T. W., Hallett, M. Motor reorganization after upper limb amputation in man. A study with focal magnetic stimulation. Brain. 114 (Pt. 114 1B), 615-627 (1991).
- Penfield, W., Boldrey, E. Somatic motor and sensory representation in cerebral cortex of man as studied by electrical stimulation. Brain. 60, 389-443 (1937).
- Sohn, Y. H., Hallett, M. Motor evoked potentials. Phys. Med. Rehabil. Clin. N. Am. 15, 117-131 (2004).
- Thickbroom, G. W., Mastagliam, F. L., Pascual-Leone, A. . Handbook of Transcranial Magnetic Stimulation. , (2002).
- Wolf, S. L., Butler, A. J., Alberts, J. L., Kim, M. W. Contemporary linkages between EMG, kinetics and stroke rehabilitation. J. Electromyogr. Kinesiol. 15, 229-239 (2005).
- Butler, A. J., Wolf, S. L. Putting the brain on the map: use of transcranial magnetic stimulation to assess and induce cortical plasticity of upper-extremity movement. Phys. Ther. 87, 719-736 (2007).
- Curra, A. Transcranial magnetic stimulation techniques in clinical investigation. Neurology. 59, 1851-1859 (2002).
- Nudo, R. J. Plasticity. NeuroRx. 3, 420-427 (2006).
- Rossini, P. M., Dal Forno, G. Integrated technology for evaluation of brain function and neural plasticity. Phys. Med. Rehabil. Clin. N. Am. 15, 263-306 (2004).
- Lefaucheur, J. P. Methods of therapeutic cortical stimulation. Neurophysiol. Clin. 39, 1-14 (2009).
- Tyvaert, L., et al. The effect of repetitive transcranial magnetic stimulation on dystonia: a clinical and pathophysiological approach. Neurophysiol. Clin. 36, 135-143 (2006).
- Webster, B. R., Celnik, P. A., Cohen, L. G. Noninvasive brain stimulation in stroke rehabilitation. NeuroRx. 3, 474-481 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。