Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mit Hilfe Transkranielle Magnetstimulation auf die menschliche neuromuskuläre System zu studieren
In diesem Artikel
Zusammenfassung
Transkranielle Magnetstimulation (TMS) ist eine nicht-invasive Tool, um Einblick in die Physiologie und Funktion des menschlichen Nervensystems zu gewinnen. Hier präsentieren wir unsere TMS Techniken zur kortikalen Erregbarkeit der oberen Extremität und lumbalen Muskulatur zu studieren.
Zusammenfassung
Transkranielle Magnetstimulation (TMS) wird seit mehr als 20 Jahre 1 gewesen, und hat exponentiell in der Popularität in den letzten zehn Jahren gewachsen. Während die Verwendung von TMS hat das Studium der vielen Systeme und Prozesse in dieser Zeit erweitert, umfasst der ursprünglichen Anwendung und vielleicht eine der häufigsten Anwendungen von TMS Studium der Physiologie, Plastizität und Funktion des menschlichen neuromuskulären Systems. Einzel-Puls-TMS an den Motor angelegte Kortex erregt Pyramidenneuronen transsynaptically 2 (Abbildung 1) und führt zu einer messbaren elektromyographischen Reaktion, die zur Untersuchung und Beurteilung der Integrität und Erregbarkeit der kortikospinalen-Darm-Trakt des Menschen 3 kann. Zusätzlich jüngsten Fortschritte in der magnetischen Stimulation ermöglicht nun für die Partitionierung der kortikalen gegen spinale Erregbarkeit 4,5. Zum Beispiel kann paired-Puls TMS verwendet, um intrakortikale fazilitatorischen und hemmenden Eigenschaften beurteilen durch die Kombination von einem Zustand seinIng. Reiz und ein Testreiz an verschiedenen Interstimuluszeiten 3,4,6-8. In diesem Video-Beitrag zeigen wir Ihnen die methodischen und technischen Aspekte dieser Techniken. Insbesondere werden wir zeigen, single-pulse und gepaarte-pulse TMS Techniken wie der flexor carpi radialis (FCR) Muskel-sowie die Rückenstrecker (ES) Muskulatur angewendet. Unsere Laboruntersuchungen der FCR Muskel, wie es von Interesse für unsere Forschung über die Auswirkungen des Handgelenkes Hand gegossen Immobilisierung auf reduzierte Muskelleistung 6,9 ist, und wir untersuchen die ES Muskeln durch diese Muskeln klinische Relevanz, wie es zu Schmerzen im unteren Rücken bezieht 8. Mit dieser angegeben ist, müssen wir beachten, dass TMS benutzt wurde, um viele Muskeln der Hand, Arm und Beinen zu studieren, und wiederholen soll, dass unsere Demonstrationen in der FCR-und ES Muskelgruppen nur einige Beispiele für TMS genutzt, um das menschliche neuromuskuläre Studie ausgewählt Systems.
Protokoll
1. Einzel-und Paired-Pulse TMS des FCR und ES Muskeln
- Grundlegende Sicherheitshinweise: Vor der Durchführung TMS auf ein menschliches Subjekt ist es notwendig, erste Bildschirm sie für grundlegende Sicherheitsvorkehrungen, wie es um die Exposition gegenüber einem magnetischen Feld bezieht. In unserem Labor haben wir folgen der Screening-Richtlinien her durch das Institut für Magnetresonanz-Sicherheit, Bildung und Forschung 10 gesetzt. In unserem Labor haben wir auch routinemäßig auszuschließen Personen mit einer Familiengeschichte von epileptischen Anfällen. Zudem benötigen wir von Patienten unter TMS der ES Muskeln Ohrstöpsel und ein Mundschutz wegen der weniger Brennweite und stärkere Stimulation Intensitäten tragen.
- Elektrische Recordings: Um TMS Antworten im motorischen System ist es notwendig, elektromyographische (EMG) Signale von Skelettmuskeln aufnehmen zu untersuchen. Für den FCR Muskel legen wir Oberflächenelektroden am Unterarm mit einer bipolaren Elektroden-Anordnung in Längsrichtung über t gelegener Muskel auf rasiert und beanspruchter Haut, wie wir zuvor 7,11 beschrieben. Für die Rückenstrecker verwenden wir eine ähnliche Elektroden-Anordnung in Längsrichtung über die Muskeln an der L3-L5-Ebene auf rasiert und beanspruchter Haut 8 befindet.
- TMS-Spule Orientierung: Um überwiegend aktivieren kortikospinalen Neuronen transsynaptically ist es notwendig, die TMS-Spule entsprechend 12 Positionen. Für den FCR Muskeln legen wir eine 70-mm figure-of-eight TMS-Spule tangential auf die Kopfhaut und 45-Grad zur Mittellinie, so dass der induzierte Strom fließt in eine seitliche-posterior medial-ventral. Für die ES Muskeln benutzen wir ein Doppel-Kegel Spule, die größere Eindringtiefe hat und durch die Darstellung dieser Muskeln wird tiefer in die Homunculus benötigt. Hier ist die Spule so positioniert, dass der Strom fließt in eine vordere Richtung posterior. Wir haben unsere Spule mit einem Laser-Befestigungssystem speziell modifiziert, um uns in s unterstützenubsequent Re-Positionierung des Doppelkegel-Spule.
- Identifizieren 'Hotspot': Es ist notwendig, um die Stimulation Lage, dass der größte motorisch evozierte Potenzial entlockt zu bestimmen. Für den FCR Muskel wir tun dies, indem subtil bewegten die TMS-Spule um in sehr kleinen Schritten und festzustellen, wo wir die größten motorisch evozierte Potential Amplitude zu beobachten. Sobald sich bemerken wir diesen Bereich mit wasserfester Tinte entweder auf der Kopfhaut oder ein Lycra-Mütze. TMS der ES Muskeln ist wesentlich unbequemer zu menschlichen Probanden als TMS der oberen Extremität Muskeln. Dementsprechend haben wir gestrafft TMS-Protokoll für die ES Muskeln, es ist die Verträglichkeit und Machbarkeit zu erhöhen. Hier wird anstelle der Lokalisierung der "Hotspot" verwenden wir anthropometrische Messungen auf den Scheitelpunkt des Schädels zu erkennen. Insbesondere identifizieren wir die Vertex-als Schnittpunkt des Schädels in der sagittalen (zwischen den nasinon und Inion) und koronalen (zwischen dem Tragus)-Ebenen.
- Biomechanische Positionierung: In unserem Labor, als wir TMS des FCR Muskeln Themen durchführen werden mit dem Arm ruht in einer ausgefahrenen Stellung in einem Biodex System 4 Dynamometer (Abbildung 2) sitzt. Wir sollten jedoch beachten, dass dies nur ein Beispiel für eine mögliche Set-up für die Messung ausgeübten Kräfte ist. Für die ES Muskeln Probanden werden gebeten, sich mit einer aufrechten Haltung zu sitzen, während ihre Hände ruhen in ihrem Schoß (Abbildung 3). Sie sind in einem Drehgestell Stuhl mit dem Oberschenkel bei 90 ° in Bezug auf den Rumpf, der untere Schenkel bei ~ 45 Sitzen ° gegenüber der Oberschenkel und der Lendenwirbelsäule in einem neutralen posture8.
- Die Quantifizierung der Motor Threshold: Für den FCR, ermitteln wir Motors Schwelle (MT) durch die Bereitstellung einzelner Impulse am allmählich zunehmenden Stimulationsintensität bis motorisch evozierte Potenziale peak-to-Peak-Amplituden größer als 50 Mikrovolt in mehr als 50% der Versuche (Abbildung 4) haben . Zur Straffung der TMS-Protokoll und die Verträglichkeit und Machbarkeit wir nicht bestimmen, Motor Schwelle in der ES Muskeln mit der gleichen Präzision wie beim testen wir die oberen Extremitäten Muskulatur. Vielmehr beginnen wir mit der TMS-Protokoll durch die Bereitstellung einer ersten einzelnen Puls bei 50% der maximalen Stimulator-Ausgang, um festzustellen, ob dies Reizintensität oberhalb oder unterhalb des Motors Schwelle. Wenn ein Abgeordneter auf diesen Reiz zu beobachten ist, wie erkennbar MdEP bezogen auf das Niveau der Hintergrund-Intensität definiert EMG-Intensität auf 40% der Stimulator Ausgang reduziert, um festzustellen, ob dies Reizintensität ist sub-oder supra-Schwelle 8.
- Die Quantifizierung der MEP Amplitude mit Single-Pulse TMS: Um den Motor zu untersuchen evozierte Potentiale Amplitude des FCR liefern wir eine einzelne TMS-Puls auf die "Hotspot" bei einer Intensität von 130% des Motor-Schwelle, und berechnen Sie die Peak-to-Peak-Amplitude . Im Allgemeinen normalisieren wir dieses Ergebnis auf die maximale Verbindung Muskelfaser Aktionspotentials beobachtet folgenden supramaximale elektrische Stimulation des Nervus medianus. Wir sollten beachten, dass die MEP Größe ver. isty abhängig vom Grad der kortikalen Erregbarkeit. Dementsprechend wird, wenn die TMS-Puls während einer Kontraktion Hintergrund geliefert wird, wenn kortikale Erregbarkeit erhöht wird, wird die MEP Größe drastisch zu erhöhen. Für die ES Muskeln, liefern wir einen einzigen TMS-Impuls auf den Scheitelpunkt mit einer Intensität 40 bis 50% über dem Sub-Motor Schwellenintensität 8. Leider, denn periphere Nerven innervieren die Muskeln ES nicht zugänglich sind elektrische Stimulation sind wir nicht in der Lage, diese motorisch evozierte Potenziale, um die Verbindung Muskelfaser Aktionspotential zu normalisieren.
- Die Quantifizierung der Silent Period Dauer mit Single-Pulse TMS: Wenn ein TMS-Puls auf die Hirnrinde während einer Muskelkontraktion wird ausgeliefert wird es eine motorisch evozierte Potenziale elektrischer Ruhe, bevor die Aktivität wieder auf, die von kortikospinalen Hemmung und gemeinhin als die schweigende bezeichnet wird, gefolgt produzieren Zeitraum 13 (Abbildung 5). Zur Quantifizierung der Ruhephase liefern wir einen einzigenTMS-Puls auf die "Hotspot" bei einer Intensität von 130% des Motor-Schwelle während der Studienteilnehmer ist die Durchführung einer Handgelenkflexion Muskelkontraktion bei 15% ihrer Maximalkraft. Wir haben bisher nicht die stille Periodendauer der ES Muskeln quantifiziert, aber wir sollten beachten, dass wir anekdotisch seine Existenz in dieser Muskelgruppe beobachtet, wenn die TMS-Puls-ID geliefert während im Hintergrund Kontraktion.
- Quantifizierung intrakortikale Facilitation mit Paired-Pulse TMS: Wir verwenden paired-Puls TMS intrakortikale Erleichterung 6,7 (Abb. 6 und 7 stellt diese Messung für die FCR-und ES-Muskeln, jeweils) zu quantifizieren. Für den FCR Muskel bestimmen wir zunächst die Reizintensität benötigt, um eine motorisch evozierte Potenziale, zwischen 0,5-1,0 mV ist zu entlocken. Anschließend liefern wir eine unterschwellige Konditionierung Puls-, die in unserem Labor allgemein gesetzt ist gleich 70% der Motor-Schwelle-15-msec vor dem überschwelligen Test Puls. Diese KonditionierungImpuls an diese Zeit vor dem Test Impuls geliefert wird zunehmen, oder zu erleichtern, rief die Amplitude des Motors Potenzial mehr als eine einzige unbedingte Puls der gleichen Intensität. Für die ES Muskelgruppe die Konditionierung Intensität wird die beobachtete sub-Motor Schwellenintensität (entweder 40% oder 50% der Stimulator Output) gesetzt und der Test Intensität wird zu 40% über dem Sub-Motor Schwellenwert (80% gesetzt oder 90% der Stimulator Ausgang) 8. Wir sollten beachten, dass die Intensität der Klimaanlage Impulse je nach Ziel der Studie variiert werden konnte. Ebenso kann die Pulspausen je nach dem Muskel und seine Position relativ zu den Kortex.
- Die Quantifizierung der Short-Interval intrakortikale Inhibition mit Paired-Pulse TMS: Wir verwenden auch paired-Puls TMS kurz-Intervall intrakortikale Inhibition 6,7 (Abb. 6 und 7 stellt diese Messung für die FCR-und ES-Muskeln, jeweils) zu quantifizieren. Hier, sowohl für dieFCR und ES Muskeln sind die Verfahren das gleiche wie für die Messung intrakortikale Erleichterung mit der Ausnahme, dass die Interstimulus Intervall zwischen den beiden Impulsen zu 3 ms reduziert wird beschrieben. Diese Konditionierung Impuls an diese Zeit vor dem Test Impuls geliefert werden sinken, oder zu hemmen, rief die Amplitude des Motors Potenzial mehr als eine einzige unbedingte Puls der gleichen Intensität.
- Die Quantifizierung der Long-Interval intrakortikale Inhibition mit Paired-Pulse TMS: Delivering zwei identische überschwellige Prüfimpulse, die von 100 Millisekunden getrennt sind, können auch verwendet werden, um lang-Intervall intrakortikale Inhibition 6,7 zu bewerten. In diesem Fall für den FCR Muskel-Motor evozierte Potentiale mit dem zweiten Impuls zugeordnet werden kleiner, oder gehemmt mehr, als dass mit dem ersten (Abbildung 8) verbunden ist. Wir haben vorher nicht lange Intervall intrakortikale Inhibition in der ES Muskeln aufgrund von Bedenken hinsichtlich unterliegen Verträglichkeit quantifiziert.
2. Repräsentative Ergebnisse:
Im Anschluss an die Lieferung einer überschwelligen TMS-Puls, sollten die Muskeln stimuliert zeigen eine leicht beobachtbare EMG Antwort (MEP) (dargestellt in den Abbildungen 4-8). Die Latenz zwischen dem Beginn des Stimulus und der MEP wird zwischen den Muskelgruppen geprüft variieren, aber für den FCR ist es im Allgemeinen 16-19 ms (Abbildung 6) und für die ES ist 17-22 ms (Abbildung 7, obwohl es sollte darauf hingewiesen, dass in einigen Fächern definitive MEP Einsetzen in die ES Muskeln schwieriger visuell zu identifizieren) ist. Anzumerken ist, dass bei der Prüfung der ES Muskelgruppe mehrere andere Muskelgruppen sind auch sichtbar und dramatisch gleichzeitig (einschließlich der Muskeln der unteren Extremitäten, die in derselben Gegend des Homunculus vertreten sind) stimuliert werden. Bei der Messung der intrakortikale Erleichterung der MEP Amplitude ist in der Regel größer als die mit einem einzigen unbedingten Impuls (F beobachtetBBILDUNG 6 und 7). Allerdings ist es unsere Erfahrung, dass der Grad der Erleichterung zwischen Muskelgruppen variiert mit einigen Muskelgruppen-wie der FCR-zeigt nur bescheidene Erleichterung in vielen Fächern. Für die Messung von kurz-Intervall und lang-Intervall intrakortikale Inhibition eine Abnahme der MEP-Amplitude ist in der Regel im Vergleich zu einem unbedingten Puls der gleichen Intensität (Abbildungen 6-8) beobachtet.
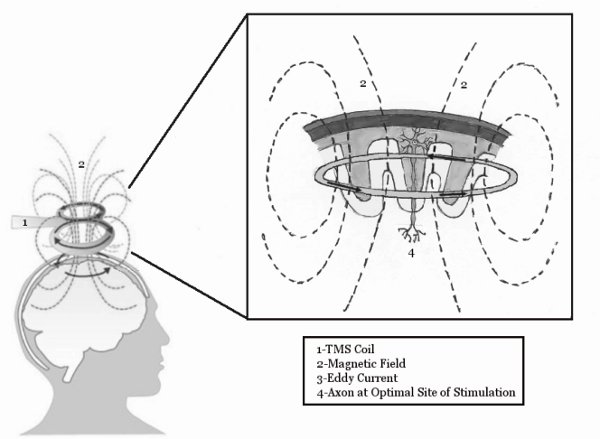
Abbildung 1. Die grundlegenden Mechanismen der TMS. Die TMS-Spule induziert ein Magnetfeld, das die Kopfhaut eindringt und induziert einen Wirbelstrom im motorischen Kortex. Dieser Wirbelstrom wird dann in der Lage, Nervenzellen im Gehirn zu stimulieren. Abbildung von McGinley und Clark nachgedruckt, In Press 14.
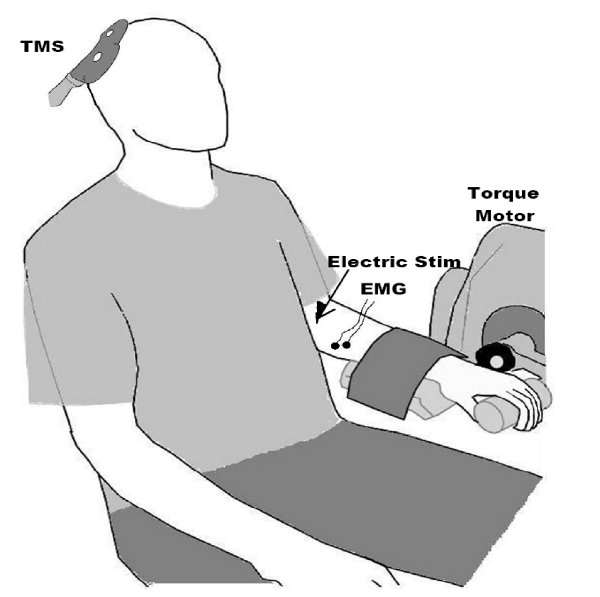
Abbildung 2. Setup für die Durchführung T MS auf den FCR Muskel. Beachten Sie die Aufnahme von Elektromyogramm (EMG) Signale aus dem Unterarm, und die TMS Paddel über den motorischen Kortex. Wir in der Regel auch aufzeichnen Muskelkraft und Einsatz elektrischer peripheren Nervenstimulation, die maximale Verbindung Muskelfaser Aktionspotential zu erzielen, als dies ist nützlich bei der Interpretation Amplitudenwerte (zB kann man zum Ausdruck bringen und MEP in Bezug auf die maximale Muskel-Reaktion als eine absolute Gegensatz mV-Wert, die stark durch nicht-physiologische Faktoren wie subkutanes Fettgewebe) beeinflusst werden kann. Wiedergabe aus den folgenden: Clark et al. 2008 9, Clark et al., 2010 6 und McGinley et al. 2010 7.

Abbildung 3. Setup für die Durchführung TMS auf die erector spinale Muskulatur. Abbildung von Goss et al nachgedruckt. 2011 8.
_upload/3387/3387fig4.jpg "/>
Abbildung 4. Beispiel des Motors Schwelle Entschlossenheit. Die EMG Spuren stellen die motorisch evozierte Potential (MEP) als Reaktion auf schrittweise Erhöhung Reizstärken (dargestellt als Prozentsatz der Stimulator-Ausgang (SO)). Beachten Sie, dass an der unteren Intensitäten (28-30% des SO) sehr klein Abgeordneten ausgelöst wurden (Sub-Threshold), sondern dass bei 32% SO Mitglied des Europäischen Parlaments wurde ausgelöst, der erreicht Motors Schwelle (in der Regel als Europaabgeordneter mit einem pp Amplitude definiert> 50 uV).
Abbildung von McGinley und Clark nachgedruckt, In Press 14.

. Abbildung 5 TMS während einer Kontraktion: motorisch evozierte Potential und Ruhephase. Die stille Zeit wird beobachtet, wenn ein Thema führt eine leichte Kontraktion und einem Reiz auf die motorischen Kortex angewandt. Der erste Teil der stillen Zeit istaufgrund des Rückenmarks Hemmung und den letzten Teil wird die kortikale Hemmung, speziell GABA B-Rezeptoren zugeschrieben. Es gibt keinen Konsens Weg, um die Dauer der Ruhephase zu quantifizieren, aber unsere Ergebnisse deuten darauf hin, dass entweder die Definition aus Beginn des Stimulus oder MEP Beginn der Rückkehr der freiwilligen Störungen Elektromyogramm Signal ist die zuverlässigste 15.
Wiedergabe aus Clark und Quick, 2011 16 und McGinley und Clark, In Press 14.
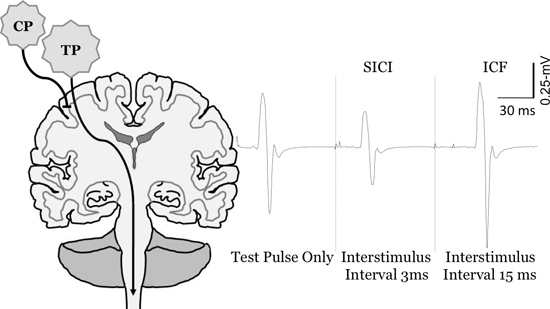
Abbildung 6. Ändern Sie in motorisch evozierte Potential Größe ith gepaart TMS des FCR Muskel. Messung von kurz-Intervall intrakortikale Inhibition (SICI) und intrakortikale Fazilitation (ICF). Zur Quantifizierung SICI und ICF die Konditionierung Impuls (CP) unter Motor Schwelle gesetzt, und der Test-Impuls (TP) ist auf Mitglieder des Europäischen Parlaments zwischen 0,5-1 mV hervorrufen. Bei kurzen Interstimuluszeiten(ZB 3-ms) die CP hemmt die MEP im Vergleich zu den TP nur (SICI), während bei längeren Interstimuluszeiten (zB 15-msec) ist die MdEP (ICF) erleichtert.
CP: Klimaanlage Puls, TP: Testpuls Abbildung von Clark et al nachgedruckt, 2010 6, McGinley et al.. 2010 14, Clark und Quick, 2011 16 und McGinley und Clark, In Press 14.

Abbildung 7. Ändern Sie in motorisch evozierte Potential Größe gepaart mit TMS der ES Muskel. Beispiel EMG Spuren aus der Rückenstrecker und die Messung von kurz-Intervall intrakortikale Inhibition (SICI) und intrakortikale Fazilitation (ICF).
Wiedergabe aus Goss et al. 2011 8.
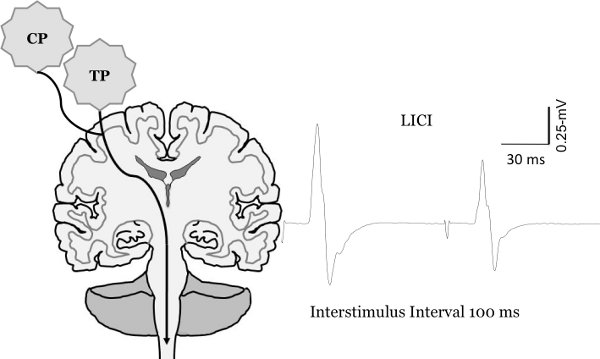
Abbildung 8. Veränderungen der motorischen evoked potenzielle Größe gepaart mit TMS. Die Messung der langen Intervall intrakortikale Inhibition (LICI). Zur Quantifizierung LICI zwei Test-Impulse werden in einem Intervall von Interstimulus 100-ms ausgeliefert. Dies führt in der zweiten MEP ist im Vergleich zu den ersten MEP gehemmt.
Abbildung von Clark et al nachgedruckt., 2010 6, McGinley et al. 2010 7 und McGinley und Clark, In Press 14.
Diskussion
Das übergeordnete Ziel dieses Artikels ist es, Wissenschaftler und Kliniker eine visuelle Darstellung unserer Laboratorien der transkraniellen Magnetstimulation bieten. Doch neben der Bereitstellung einer Visualisierung dieser Experimente, unten diskutieren wir grundlegende Fragen, die bei der Durchführung von TMS auf diese Weise einen kurzen Überblick über die Physiologie des TMS Antworten und diskutieren auch unsere Verwendung von TMS in Bezug auf die Nutzung von andere.
Allgemeine Proble...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde zum Teil durch einen Zuschuss aus dem Osteopathic Heritage Foundations zu BC Clark finanziert. Wir möchten Staat ein besonderes Dankeschön an Marissa McGinley für ihre Unterstützung bei der Schaffung von vielen der Figur Grafiken.
Materialien
| Name | Company | Catalog Number | Comments |
| Name der Ausrüstung | Firma | Katalog-Nummer | Kommentare (optional) |
|---|---|---|---|
| Transkranielle Magnetstimulation Stimulator 2002 Transkranielle Magnetstimulation Stimulator Bi-STIM2 Figure-Eight-70-mm-Spule Doppelkegel Coil | Die Magstim Unternehmen | NA | TMS Geräte (einschließlich Spulen) |
| Biodex System 4 | Biodex | NA | Dynamometer |
| Biopac MP150 Data Acquisition System | Biopac | MP150WSW | AD-Wandler für EMG und Kraft |
| AcqKnowledge 4.0 Data Akquisition Software | Biopac | ACK100W | |
| Nikomed Trace 1 EKG-Elektroden | Nikomed | 2015 | EMG-Elektroden |
| Constant Current Stimulator | Digitimer | DS7A | Peripheral Nervenstimulator |
Referenzen
- Barker, A. T., Jalinous, R., Freeston, I. L. Non-invasive magnetic stimulation of human motor cortex. Lancet. 1, 1106-1107 (1985).
- Werhahn, K. J., et al. The effect of magnetic coil orientation on the latency of surface EMG and single motor unit responses in the first dorsal interosseous muscle. Electroencephalography and Clinical Neurophysiology. 93, 138-146 (1994).
- Kobayashi, M., Pascual-Leone, A. Transcranial magnetic stimulation in neurology. Lancet. Neurol. 2, 145-156 (2003).
- Reis, J., et al. Contribution of transcranial magnetic stimulation to the understanding of cortical mechanisms involved in motor control. J. Physiol. 586, 325-351 (2008).
- Taylor, J. L. Stimulation at the cervicomedullary junction in human subjects. Journal of Electromyography and Kinesiology: Official Journal of the International Society of Electrophysiological Kinesiology. 16, 215-223 (2006).
- Clark, B. C., Taylor, J. L., Hoffman, R. L., Dearth, D. J., Thomas, J. S. Cast immobilization increases long-interval intracortical inhibition. Muscle & Nerve. 42, 363-372 (2010).
- McGinley, M., Hoffman, R. L., Russ, D. W., Thomas, J. S., Clark, B. C. Older adults exhibit more intracortical inhibition and less intracortical facilitation than young adults. Exp. Gerontol. 45, 671-678 (2010).
- Goss, D. A., Thomas, J. S., Clark, B. C. Novel methods for quantifying neurophysiologic properties of the human lumbar paraspinal muscles. Journal of Neuroscience Methods. 194, 329-335 (2011).
- Clark, B., Issac, L. C., Lane, J. L., Damron, L. A., Hoffman, R. L. Neuromuscular plasticity during and following 3-weeks of human forearm cast immobilization. J. Appl. Physiol. 105, 868-878 (2008).
- Clark, B. C., Issac, L. C., Lane, J. L., Damron, L. A., Hoffman, R. L. Neuromuscular plasticity during and following 3 wk of human forearm cast immobilization. J. Appl. Physiol. 105, 868-878 (2008).
- Brasil-Neto, J. P., et al. Optimal focal transcranial magnetic activation of the human motor cortex: effects of coil orientation, shape of the induced current pulse, and stimulus intensity. J. Clin. Neurophysiol. 9, 132-136 (1992).
- Damron, L. A., Dearth, D. J., Hoffman, R. L., Clark, B. C. Quantification of the corticospinal silent period evoked via transcranial magnetic stimulation. Journal of Neuroscience Methods. 173, 121-128 (2008).
- McGinley, M. P., Clark, B. C. Transcranial magnetic stimulation and the human neuromuscular system. Horizons in Neuroscience Research. , (2012).
- Damron, L. A., Hoffman, R. L., Dearth, D. J., Clark, B. C. Quantification of the corticospinal silent period evoked via transcranial magnetic brain stimulation. J. Neurosci. Methods. 173, 121-128 (2008).
- Clark, B. C., Quick, A. Exploring the pathophysiology of Mal de Debarquement. J. Neurol. 258, 1166-1168 (2011).
- Ortu, E., Deriu, F., Suppa, A., Tolu, E., Rothwell, J. C. Effects of volitional contraction on intracortical inhibition and facilitation in the human motor cortex. J. Physiol. 586, 5147-5159 (2008).
- Dishman, J. D., Greco, D. S., Burke, J. R. Motor-evoked potentials recorded from lumbar erector spinae muscles: a study of corticospinal excitability changes associated with spinal manipulation. J. Manipulative. Physiol. Ther. 31, 258-270 (2008).
- Kuppuswamy, A. Cortical control of erector spinae muscles during arm abduction in humans. Gait. Posture. 27, 478-484 (2008).
- Strutton, P. H., Theodorou, S., Catley, M., McGregor, A. H., Davey, N. J. Corticospinal excitability in patients with chronic low back pain. J. Spinal. Disord. Tech. 18, 420-424 (2005).
- Taniguchi, S., Tani, T. Motor-evoked potentials elicited from human erector spinae muscles by transcranial magnetic stimulation. Spine (Philadelphia. 24, 154-157 (1999).
- Taniguchi, S., Tani, T., Ushida, T., Yamamoto, H. Motor evoked potentials elicited from erector spinae muscles in patients with thoracic myelopathy. Spinal. Cord. 40, 567-573 (2002).
- O'Connell, N. E., Maskill, D. W., Cossar, J., Nowicky, A. V. Mapping the cortical representation of the lumbar paravertebral muscles. Clin. Neurophysiol. 118, 2451-2455 (2007).
- Maeda, F., Pascual-Leone, A. Transcranial magnetic stimulation: studying motor neurophysiology of psychiatric disorders. Psychopharmacology (Berl). 168, 359-376 (2003).
- Ziemann, U. TMS and drugs. Clin. Neurophysiol. 115, 1717-1729 (2004).
- Tergau, F., et al. Complete suppression of voluntary motor drive during the silent period after transcranial magnetic stimulation. Exp. Brain. Res. 124, 447-454 (1999).
- Di Lazzaro, V., et al. The physiological basis of transcranial motor cortex stimulation in conscious humans. Clin. Neurophysiol. 115, 255-266 (2004).
- Iles, J. F., Pisini, J. V. Cortical modulation of transmission in spinal reflex pathways of man. J. Physiol. 455, 425-446 (1992).
- Gandevia, S. C., Petersen, N., Butler, J. E., Taylor, J. L. Impaired response of human motoneurones to corticospinal stimulation after voluntary exercise. J. Physiol. 521 (Pt. 3), 749-759 (1999).
- Hallett, M. Transcranial magnetic stimulation: a primer. Neuron. 55, 187-199 (2007).
- Damron, L. A., Dearth, D. J., Hoffman, R. L., Clark, B. C. Quantification of the corticospinal silent period evoked via transcranial magnetic stimulation. J. Neurosci. Methods. 173, 121-128 (2008).
- Cantello, R. Applications of transcranial magnetic stimulation in movement disorders. J. Clin. Neurophysiol. 19, 272-293 (2002).
- Chen, R. The clinical diagnostic utility of transcranial magnetic stimulation: report of an IFCN committee. Clin. Neurophysiol. 119, 504-532 (2008).
- Edwards, M. J., Talelli, P., Rothwell, J. C. Clinical applications of transcranial magnetic stimulation in patients with movement disorders. Lancet. Neurol. 7, 827-840 (2008).
- Terao, Y., Ugawa, Y. Basic mechanisms of TMS. J. Clin. Neurophysiol. 19, 322-343 (2002).
- McDonnell, M. N., Orekhov, Y., Ziemann, U. The role of GABA(B) receptors in intracortical inhibition in the human motor cortex. Exp. Brain. Res. 173, 86-93 (2006).
- Perez-de-Sa, V., et al. High brain tissue oxygen tension during ventilation with 100% oxygen after fetal asphyxia in newborn sheep. Pediatr. Res. 65, 57-61 (2009).
- Anand, S., Hotson, J. Transcranial magnetic stimulation: neurophysiological applications and safety. Brain. Cogn. 50, 366-386 (2002).
- Chen, R. Depression of motor cortex excitability by low-frequency transcranial magnetic stimulation. Neurology. 48, 1398-1403 (1997).
- Tokay, T., Holl, N., Kirschstein, T., Zschorlich, V., Kohling, R. High-frequency magnetic stimulation induces long-term potentiation in rat hippocampal slices. Neurosci. Lett. 461, 150-154 (2009).
- Taylor, J. L., Gandevia, S. C. Noninvasive stimulation of the human corticospinal tract. J. Appl. Physiol. 96, 1496-1503 (2004).
- Martin, P. G., Hudson, A. L., Gandevia, S. C., Taylor, J. L. Reproducible measurement of human motoneuron excitability with magnetic stimulation of the corticospinal tract. J. Neurophysiol. 102, 606-613 (2009).
- Cohen, L. G., Bandinelli, S., Findley, T. W., Hallett, M. Motor reorganization after upper limb amputation in man. A study with focal magnetic stimulation. Brain. 114 (Pt. 114 1B), 615-627 (1991).
- Penfield, W., Boldrey, E. Somatic motor and sensory representation in cerebral cortex of man as studied by electrical stimulation. Brain. 60, 389-443 (1937).
- Sohn, Y. H., Hallett, M. Motor evoked potentials. Phys. Med. Rehabil. Clin. N. Am. 15, 117-131 (2004).
- Thickbroom, G. W., Mastagliam, F. L., Pascual-Leone, A. . Handbook of Transcranial Magnetic Stimulation. , (2002).
- Wolf, S. L., Butler, A. J., Alberts, J. L., Kim, M. W. Contemporary linkages between EMG, kinetics and stroke rehabilitation. J. Electromyogr. Kinesiol. 15, 229-239 (2005).
- Butler, A. J., Wolf, S. L. Putting the brain on the map: use of transcranial magnetic stimulation to assess and induce cortical plasticity of upper-extremity movement. Phys. Ther. 87, 719-736 (2007).
- Curra, A. Transcranial magnetic stimulation techniques in clinical investigation. Neurology. 59, 1851-1859 (2002).
- Nudo, R. J. Plasticity. NeuroRx. 3, 420-427 (2006).
- Rossini, P. M., Dal Forno, G. Integrated technology for evaluation of brain function and neural plasticity. Phys. Med. Rehabil. Clin. N. Am. 15, 263-306 (2004).
- Lefaucheur, J. P. Methods of therapeutic cortical stimulation. Neurophysiol. Clin. 39, 1-14 (2009).
- Tyvaert, L., et al. The effect of repetitive transcranial magnetic stimulation on dystonia: a clinical and pathophysiological approach. Neurophysiol. Clin. 36, 135-143 (2006).
- Webster, B. R., Celnik, P. A., Cohen, L. G. Noninvasive brain stimulation in stroke rehabilitation. NeuroRx. 3, 474-481 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten