É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Utilizando Estimulação Magnética Transcraniana para o Estudo do sistema neuromuscular humano
Neste Artigo
Resumo
A estimulação magnética transcraniana (TMS) é uma ferramenta não invasiva para obter uma visão sobre a fisiologia ea função do sistema nervoso humano. Aqui, apresentamos nossas técnicas de TMS para estudar a excitabilidade cortical do membro superior e musculatura lombar.
Resumo
A estimulação magnética transcraniana (EMT) tem sido usado por mais de 20 anos 1, e tem crescido exponencialmente em popularidade na última década. Enquanto o uso de TMS tem se expandido para o estudo de muitos sistemas e processos durante este tempo, a aplicação original e talvez um dos usos mais comuns do TMS envolve o estudo da fisiologia, plasticidade e função do sistema neuromuscular humano. TMS de pulso único aplicado ao córtex motor excita neurônios piramidais transsynaptically 2 (Figura 1) e resulta em uma resposta mensurável eletromiográfica que pode ser usado para estudar e avaliar a integridade e excitabilidade do trato corticoespinhal em seres humanos 3. Além disso, os recentes avanços na estimulação magnética permite agora para o particionamento de excitabilidade cortical contra espinhal 4,5. Por exemplo, pares de pulso-TMS pode ser usado para avaliar intracortical propriedades facilitador e inibitórios através da combinação de uma condiçãoing estímulo e um estímulo de teste, em intervalos diferentes 3,4,6-8. Neste artigo vamos demonstrar vídeo os aspectos metodológicos e técnicos destas técnicas. Especificamente, vamos demonstrar pulso único e técnicas emparelhado pulso-TMS, aplicada ao flexor radial (FCR) muscular, bem como a musculatura eretores da espinha (ES). O nosso laboratório estuda o músculo FCR, uma vez que é de interesse para nossa pesquisa sobre os efeitos do pulso de mão-imobilização gessada sobre o desempenho muscular reduzido 6,9, e estudamos os músculos ES devido a estes músculos relevância clínica no que se refere à dor lombar 8. Com este declarou, devemos notar que TMS foi usado para estudar muitos músculos da mão, braço e pernas, e deve repetir que a nossa manifestações na FCR e grupos musculares ES estão selecionados apenas exemplos de TMS sendo usado para estudar a neuromuscular humano do sistema.
Protocolo
1. TMS único e emparelhados Pulse-dos Músculos do FCR e ES
- Precauções de segurança básicas: Antes de executar TMS em um sujeito humano é necessário para a tela primeiro-las para as precauções básicas de segurança no que se refere à exposição a um campo magnético. Em nosso laboratório que siga as diretrizes estabelecidas pela triagem do Instituto de Educação Magnetic Resonance Segurança e Investigação 10. Em nosso laboratório também rotineiramente excluir indivíduos com história familiar de convulsões epilepsia. Também exigimos indivíduos sujeitos a TMS dos músculos ES usar tampões de ouvido e um protetor bucal devido à intensidade de estimulação menos focal e mais forte.
- Gravações Elétricas: Estudar respostas TMS no sistema motor é necessário registro eletromiográfico (EMG) sinais de músculos esqueléticos. Para o músculo FCR nós colocamos os eletrodos de superfície no antebraço usando um arranjo de eletrodos bipolares localizados longitudinalmente ao longo tEle muscular na pele raspada e desgastados como temos descrito anteriormente 7,11. Para os músculos eretores da coluna, usamos um arranjo de eletrodos semelhantes localizados longitudinalmente ao longo dos músculos ao nível L3-L5 vertebral na pele raspada e desgastados 8.
- TMS Orientação da bobina: Para ativar os neurônios piramidais predominantemente transsynaptically é necessário para posicionar a bobina TMS apropriadamente 12. Para os músculos FCR colocamos uma de 70 mm figura de oito bobina TMS tangente ao couro cabeludo e de 45 graus para a linha média, para que os fluxos de corrente induzida em um lateral-posterior ao médio-anterior direcção. Para os músculos ES usamos uma bobina de cone duplo que tem maior profundidade de penetração e é necessária devido à representação destes músculos que estão sendo mais profundo no homúnculo. Aqui, a bobina é posicionada de tal forma que a corrente flui em uma direção antero-posterior. Temos costume modificado a nossa bobina com um sistema de fixação de laser para nos ajudar a subsequent re-posicionamento da bobina de duplo cone.
- Identificar 'Hotspot': É necessário determinar a localização estímulo que provoca o maior potencial evocado motor. Para o músculo FCR fazemos isso sutilmente mover a bobina TMS volta em incrementos muito pequenos e determinar onde observamos o maior amplitude evocado motor em potencial. Uma vez localizado podemos notar nesta área, com tinta indelével em cada couro cabeludo ou um boné de lycra. TMS dos músculos ES é consideravelmente mais desconfortável do que seres humanos TMS dos músculos dos membros superiores. Assim, temos o nosso protocolo simplificado TMS para os músculos para aumentar a ES é tolerabilidade e exeqüibilidade. Aqui, em vez de localizar o "hotspot" que usamos medidas antropométricas para identificar o vértice do crânio. Especificamente, nós identificamos o vértice como a intersecção do crânio no sagital (entre os nasinon e ínion) e coronal (entre o tragus) aviões.
- Posicionamento biomecânica: Em nosso laboratório quando realizamos TMS dos músculos dos sujeitos FCR estão sentados com o braço apoiado em uma posição estendida em um Biodex System 4 Dinamômetro (Figura 2). No entanto, devemos observar que este é apenas um exemplo de um possível set-up para medir forças exercidas. Para o ES assuntos músculos são convidados a sentar-se com uma postura ereta enquanto seu descanso as mãos em seu colo (Figura 3). Eles estão sentados em uma cadeira de base giratória com a coxa em 90 ° em relação ao tronco, a perna em ~ 45 ° em relação à coxa, e da coluna lombar em um posture8 neutro.
- Quantificar Threshold Motor: Para o FCR, determinamos do motor limiar (MT), entregando pulsos única no aumento gradual intensidade de estimulação até potenciais evocados motores têm de pico a pico amplitudes superiores a 50 microvolts em mais de 50% dos ensaios (Figura 4) . Para simplificar o protocolo de TMS e aumentar a tolerabilidade ea viabilidade não determinar o limiar motor na ES músculos com a mesma precisão de quando testamos a musculatura dos membros superiores. Em vez disso, nós começamos o protocolo TMS, fornecendo um pulso inicial única de 50% da produção máxima estimulador para determinar se este intensidade do estímulo está acima ou abaixo do limiar motor. Se um deputado é observado neste estímulo de intensidade definida como MEP perceptível em relação ao nível do fundo EMG-a intensidade é reduzida para 40% da produção estimulador para determinar se este intensidade do estímulo é sub ou supra-limiar de 8.
- Quantificar Amplitude MEP utilizando um único pulso TMS: Para examinar o evocado motor amplitude potencial do FCR nós entregamos um pulso TMS único para o "hotspot" em uma intensidade igual a 130% do limiar motor, e calcular a amplitude de pico a pico . Geralmente, nós normalizar este resultado para o composto potencial muscular máxima ação da fibra observada após a estimulação elétrica supramáxima do nervo mediano. Devemos notar que o tamanho MEP é very dependente do grau de excitabilidade cortical. Assim, quando o pulso TMS é entregue durante uma contração de fundo, quando a excitabilidade cortical é maior, o tamanho do MEP irá aumentar dramaticamente. Para os músculos ES, nós entregamos um pulso TMS único para o vértice, a uma intensidade de 40 ou 50% acima do limiar de intensidade sub-motor 8. Infelizmente, por causa dos nervos periféricos que inervam os músculos ES não são acessíveis à estimulação elétrica não somos capazes de normalizar esses potenciais evocados motores para o composto potencial de ação das fibras musculares.
- Duração quantificar período silencioso usando um único pulso TMS: Quando um pulso TMS para o córtex é entregue durante uma contração muscular que irá produzir um potencial evocado motor seguido por quiescência elétrica antes de retomar sua atividade que é indicativo da inibição córtico e comumente referido como o silêncio período de 13 (Figura 5). Para quantificar o período de silêncio que entregamos um únicoTMS de pulso para o "hotspot" em uma intensidade igual a 130% do limiar motor, enquanto o participante do estudo é realizar uma contração muscular de flexão do punho em 15% de sua força máxima. Nós ainda não tenham quantificado a duração do período de silêncio dos músculos ES, no entanto, devemos notar que temos observado anecdotally sua existência neste grupo muscular quando a TMS de pulso ID entregue durante uma contração de fundo.
- Quantificar facilitação intracortical usando emparelhados-Pulse TMS: Usamos emparelhado-TMS de pulso para quantificar facilitação intracortical 6,7 (Figura 6 e 7 representa esta medida para a FCR e músculos ES, respectivamente). Para o músculo FCR, primeiro determinar a intensidade do estímulo necessária para provocar um potencial evocado motor que está entre 0,5-1,0 mV. Em seguida, nós entregamos um condicionamento subliminar de pulso, que em nosso laboratório é comumente definida como igual a 70% do motor limiar-15-ms antes do pulso de teste suprathreshold. Este condicionamentopulso entregues neste período de tempo antes do pulso de teste irá aumentar, ou facilitar, a amplitude do evocado motor mais potencial do que um único pulso incondicional da mesma intensidade. Para o grupo muscular ES a intensidade de pulso condicionado é definida como a intensidade de limiar observado sub-motor (ou 40% ou 50% da produção estimulador) ea intensidade de pulso de teste é definida como 40% acima do nível do limiar sub-motor (80% ou 90% da produção estimulador) 8. Devemos notar que a intensidade dos pulsos condicionado pode ser variado, dependendo do objetivo do estudo. Da mesma forma, os intervalos de pulso pode variar dependendo do músculo e sua localização em relação ao córtex.
- Quantificar curto intervalo de inibição intracortical usando emparelhados-Pulse TMS: Nós também usamos emparelhado-TMS de pulso para quantificar curto intervalo de inibição intracortical 6,7 (Figura 6 e 7 representa esta medida para os músculos FCR e ES, respectivamente). Aqui, tanto para oFCR e músculos ES, os procedimentos são os mesmos descritos para medir a facilitação intracortical com a ressalva de que o intervalo interstimulus entre os dois pulsos é reduzido para 3 ms. Este pulso condicionado entregue neste período de tempo antes do pulso de teste irá diminuir ou inibir, a amplitude do evocado motor mais potencial do que um único pulso incondicional da mesma intensidade.
- Quantificação de longo intervalo inibição intracortical usando emparelhados-Pulse TMS: Disponibilizar dois pulsos suprathreshold idênticos de teste que estão separados por 100 milissegundos também pode ser usado para avaliar longo intervalo de inibição intracortical 6,7. Neste caso para o FCR músculo-o potencial evocado motor associado ao segundo pulso será menor, ou inibido mais, do que a associada com o primeiro (Figura 8). Nós ainda não tenham quantificado longo intervalo de inibição intracortical nos músculos ES devido a preocupações sobre assunto tolerabilidade.
2. Resultados representativos:
Após a entrega de um TMS suprathreshold pulso, os músculos sendo estimulada deve demonstrar uma resposta EMG facilmente observáveis (o deputado) (ilustrados nas Figuras 4-8). A latência entre o início do estímulo e do MEP irá variar entre os grupos musculares que estão sendo examinados, mas para o FCR é geralmente 16-19 ms (Figura 6) e para o ES é 17-22 ms (Figura 7; embora se deva se notar que em alguns indivíduos início MEP definitiva nos músculos ES é mais difícil de identificar visualmente). Deve-se notar que quando o teste muscular ES grupo vários outros grupos musculares também são visivelmente e dramaticamente estimulados concomitantemente (incluindo os músculos dos membros inferiores, que são representados dentro da mesma região geral do homúnculo). Durante a medição da facilitação intracortical a amplitude MEP é geralmente maior do que a observada com um único pulso incondicionada (FIGURA 6 e 7). No entanto, é nossa experiência que o grau de facilitação varia entre os grupos de músculos com alguns grupos musculares, tais como o FCR-mostrando apenas a facilitação modesto em muitos assuntos. Para a medição de curto e longo intervalo de intervalo de inibição intracortical uma diminuição na amplitude MEP é geralmente observada em comparação com um único pulso incondicionado de mesma intensidade (Figuras 6-8).
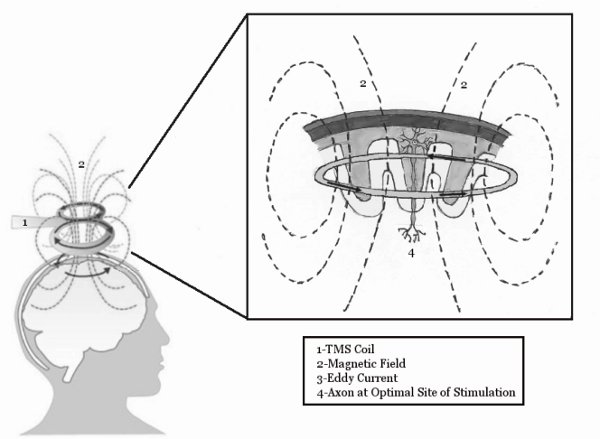
Figura 1. Os mecanismos básicos da TMS. A bobina TMS induz um campo magnético, que penetra no couro cabeludo e induz uma corrente Eddy dentro do córtex motor. Esta corrente de eddy é então capaz de estimular os neurônios dentro do cérebro. Figura reproduzida de McGinley e Clark, In Press 14.
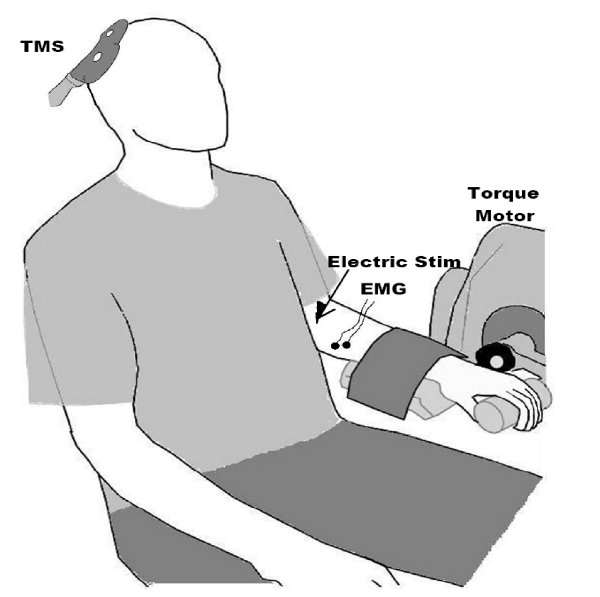
Figura 2. Instalação para a realização de T MS no músculo FCR. Observe a gravação de eletromiograma (EMG) dos sinais a partir do antebraço, eo paddle TMS sobre o córtex motor. Nós geralmente também gravar as forças musculares, e usar a estimulação do nervo periférico elétrica para obter o máximo potencial de ação muscular composto de fibra, já que esta é útil na interpretação de valores de amplitude (por exemplo, pode-se expressar e MEP, relativamente à resposta muscular máxima em oposição a uma absoluta mV valor que pode ser fortemente influenciado por fatores não-fisiológicos, tais como tecido adiposo subcutâneo). Figura reproduzida a partir do seguinte: Clark et al. 2008 9, Clark et al., 2010 6, e McGinley et al. 2010 7.

Figura 3. Setup para a realização de TMS sobre os músculos eretores Spinale. Figura reproduzida de Goss et al. 2011 8.
_upload/3387/3387fig4.jpg "/>
Figura 4. Exemplo de determinação do limiar motor. Os traços representam o EMG evocado motor de resposta (MEP) potencial para intensidades de estímulos a aumentar gradualmente (representado como uma porcentagem da produção estimulador (SO)). Observe que no intensidades mais baixas (28-30% de SO) deputados foram muito pequena provocou (limiar sub-), mas que em 32% SO um deputado foi provocada limiar motor que chegou (geralmente definida como um deputado com uma amplitude pp> 50 mV).
Figura reproduzida de McGinley e Clark, In Press 14.

. Figura 5 TMS durante uma contração: potencial evocado motor período e em silêncio. O período de silêncio é observado quando um sujeito realiza uma contração leve e um único estímulo é aplicado para o córtex motor. A primeira parte do período de silêncio édevido à inibição da medula espinhal e na última parte é atribuída à inibição cortical, receptores GABA B especificamente. Não há como quantificar o consenso para a duração do período de silêncio, mas nossos resultados indicam que tanto definindo-o de início do estímulo ou início MEP para o retorno do sinal de interferência voluntária eletromiograma é o 15 mais confiável.
Figura reproduzida de Clark e Quick, 2011 16, e McGinley e Clark, In Press 14.
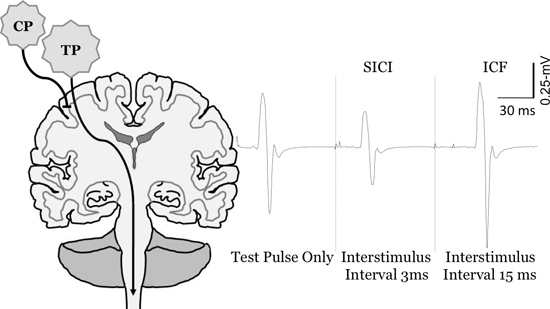
Figura 6. Variação do potencial evocado motor tamanho om TMS de pulso emparelhado do músculo FCR. Medição de curto intervalo de inibição intracortical (SICI) e facilitação intracortical (ICF). Para quantificar SICI e ICF o pulso condicionado (CP) é definido abaixo do limiar motor, eo pulso de teste (TP) é definido para evocar MEP, entre 0,5-1 mV. , Em intervalos curtos(Por exemplo, 3-ms) do CP inibe o MEP em comparação com o TP apenas (SICI), enquanto que em intervalos mais longos interstimulus (por exemplo, 15 ms) que facilita o MEP (ICF).
CP: pulso condicionado, TP: teste de pulso Figura reproduzida de Clark et al, 2010 6, McGinley et al.. 2010 14, Clark e Quick, 2011 16, e McGinley e Clark, In Press 14.

Figura 7. Mudança no tamanho potencial evocado motor com TMS de pulso emparelhado do músculo ES. Exemplo de traços EMG dos músculos eretores da coluna e da medição de curto intervalo de inibição intracortical (SICI) e facilitação intracortical (ICF).
Figura reproduzida de Goss et al. 2011 8.
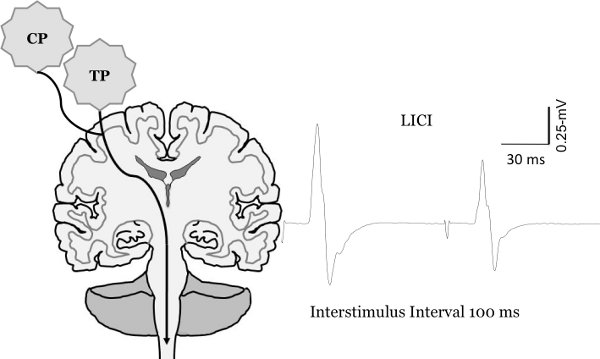
Figura 8. Mudança no motor evopotencial ked porte, com TMS de pulso pareado. Medição de longo intervalo de inibição intracortical (Lici). Para quantificar Lici dois pulsos de teste são entregues em um intervalo interstimulus de 100 ms. Isso resulta no segundo MEP ser inibido em comparação com o MEP em primeiro lugar.
Figura reproduzida de Clark et al., 2010 6, McGinley et al. 2010 7 e McGinley e Clark, In Press 14.
Discussão
O objetivo geral deste artigo é fornecer cientistas e clínicos uma conta de visual de nossos laboratórios uso da estimulação magnética transcraniana. No entanto, além de proporcionar uma visualização desses experimentos, a seguir discutimos questões básicas a serem consideradas ao executar TMS desta maneira, apresentar um breve panorama da fisiologia da resposta TMS, e também discutir o nosso uso da TMS no que diz respeito ao uso de os outros.
Questões gerais Para estar ciente de q...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado em parte por uma concessão das Fundações Heritage Osteopathic para BC Clark. Gostaríamos de indicar um agradecimento especial a Marissa McGinley por sua assistência na criação de muitos dos gráficos figura.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do Equipamento | Companhia | Número de catálogo | Comments (opcional) |
|---|---|---|---|
| Estimulador magnético transcraniano 2002 Estimulador magnético transcraniano Bi-Stim2 Figure-Eight 70 milímetros-coil Bobina Cone Duplo | A Companhia Magstim | NA | TMS equipamento (incluindo bobinas) |
| Biodex System 4 | Biodex | NA | Dinamômetro |
| Biopac MP150 Sistema de Aquisição de Dados | Biopac | MP150WSW | AD conversor para EMG e força |
| AcqKnowledge 4,0 software de aquisição de dados | Biopac | ACK100W | |
| Nikomed Rastreamento uma eletrodos ECG | Nikomed | 2015 | Eletrodos EMG |
| Estimulador atual constante | Digitimer | DS7A | Estimulador de nervo periférico |
Referências
- Barker, A. T., Jalinous, R., Freeston, I. L. Non-invasive magnetic stimulation of human motor cortex. Lancet. 1, 1106-1107 (1985).
- Werhahn, K. J., et al. The effect of magnetic coil orientation on the latency of surface EMG and single motor unit responses in the first dorsal interosseous muscle. Electroencephalography and Clinical Neurophysiology. 93, 138-146 (1994).
- Kobayashi, M., Pascual-Leone, A. Transcranial magnetic stimulation in neurology. Lancet. Neurol. 2, 145-156 (2003).
- Reis, J., et al. Contribution of transcranial magnetic stimulation to the understanding of cortical mechanisms involved in motor control. J. Physiol. 586, 325-351 (2008).
- Taylor, J. L. Stimulation at the cervicomedullary junction in human subjects. Journal of Electromyography and Kinesiology: Official Journal of the International Society of Electrophysiological Kinesiology. 16, 215-223 (2006).
- Clark, B. C., Taylor, J. L., Hoffman, R. L., Dearth, D. J., Thomas, J. S. Cast immobilization increases long-interval intracortical inhibition. Muscle & Nerve. 42, 363-372 (2010).
- McGinley, M., Hoffman, R. L., Russ, D. W., Thomas, J. S., Clark, B. C. Older adults exhibit more intracortical inhibition and less intracortical facilitation than young adults. Exp. Gerontol. 45, 671-678 (2010).
- Goss, D. A., Thomas, J. S., Clark, B. C. Novel methods for quantifying neurophysiologic properties of the human lumbar paraspinal muscles. Journal of Neuroscience Methods. 194, 329-335 (2011).
- Clark, B., Issac, L. C., Lane, J. L., Damron, L. A., Hoffman, R. L. Neuromuscular plasticity during and following 3-weeks of human forearm cast immobilization. J. Appl. Physiol. 105, 868-878 (2008).
- Clark, B. C., Issac, L. C., Lane, J. L., Damron, L. A., Hoffman, R. L. Neuromuscular plasticity during and following 3 wk of human forearm cast immobilization. J. Appl. Physiol. 105, 868-878 (2008).
- Brasil-Neto, J. P., et al. Optimal focal transcranial magnetic activation of the human motor cortex: effects of coil orientation, shape of the induced current pulse, and stimulus intensity. J. Clin. Neurophysiol. 9, 132-136 (1992).
- Damron, L. A., Dearth, D. J., Hoffman, R. L., Clark, B. C. Quantification of the corticospinal silent period evoked via transcranial magnetic stimulation. Journal of Neuroscience Methods. 173, 121-128 (2008).
- McGinley, M. P., Clark, B. C. Transcranial magnetic stimulation and the human neuromuscular system. Horizons in Neuroscience Research. , (2012).
- Damron, L. A., Hoffman, R. L., Dearth, D. J., Clark, B. C. Quantification of the corticospinal silent period evoked via transcranial magnetic brain stimulation. J. Neurosci. Methods. 173, 121-128 (2008).
- Clark, B. C., Quick, A. Exploring the pathophysiology of Mal de Debarquement. J. Neurol. 258, 1166-1168 (2011).
- Ortu, E., Deriu, F., Suppa, A., Tolu, E., Rothwell, J. C. Effects of volitional contraction on intracortical inhibition and facilitation in the human motor cortex. J. Physiol. 586, 5147-5159 (2008).
- Dishman, J. D., Greco, D. S., Burke, J. R. Motor-evoked potentials recorded from lumbar erector spinae muscles: a study of corticospinal excitability changes associated with spinal manipulation. J. Manipulative. Physiol. Ther. 31, 258-270 (2008).
- Kuppuswamy, A. Cortical control of erector spinae muscles during arm abduction in humans. Gait. Posture. 27, 478-484 (2008).
- Strutton, P. H., Theodorou, S., Catley, M., McGregor, A. H., Davey, N. J. Corticospinal excitability in patients with chronic low back pain. J. Spinal. Disord. Tech. 18, 420-424 (2005).
- Taniguchi, S., Tani, T. Motor-evoked potentials elicited from human erector spinae muscles by transcranial magnetic stimulation. Spine (Philadelphia. 24, 154-157 (1999).
- Taniguchi, S., Tani, T., Ushida, T., Yamamoto, H. Motor evoked potentials elicited from erector spinae muscles in patients with thoracic myelopathy. Spinal. Cord. 40, 567-573 (2002).
- O'Connell, N. E., Maskill, D. W., Cossar, J., Nowicky, A. V. Mapping the cortical representation of the lumbar paravertebral muscles. Clin. Neurophysiol. 118, 2451-2455 (2007).
- Maeda, F., Pascual-Leone, A. Transcranial magnetic stimulation: studying motor neurophysiology of psychiatric disorders. Psychopharmacology (Berl). 168, 359-376 (2003).
- Ziemann, U. TMS and drugs. Clin. Neurophysiol. 115, 1717-1729 (2004).
- Tergau, F., et al. Complete suppression of voluntary motor drive during the silent period after transcranial magnetic stimulation. Exp. Brain. Res. 124, 447-454 (1999).
- Di Lazzaro, V., et al. The physiological basis of transcranial motor cortex stimulation in conscious humans. Clin. Neurophysiol. 115, 255-266 (2004).
- Iles, J. F., Pisini, J. V. Cortical modulation of transmission in spinal reflex pathways of man. J. Physiol. 455, 425-446 (1992).
- Gandevia, S. C., Petersen, N., Butler, J. E., Taylor, J. L. Impaired response of human motoneurones to corticospinal stimulation after voluntary exercise. J. Physiol. 521 (Pt. 3), 749-759 (1999).
- Hallett, M. Transcranial magnetic stimulation: a primer. Neuron. 55, 187-199 (2007).
- Damron, L. A., Dearth, D. J., Hoffman, R. L., Clark, B. C. Quantification of the corticospinal silent period evoked via transcranial magnetic stimulation. J. Neurosci. Methods. 173, 121-128 (2008).
- Cantello, R. Applications of transcranial magnetic stimulation in movement disorders. J. Clin. Neurophysiol. 19, 272-293 (2002).
- Chen, R. The clinical diagnostic utility of transcranial magnetic stimulation: report of an IFCN committee. Clin. Neurophysiol. 119, 504-532 (2008).
- Edwards, M. J., Talelli, P., Rothwell, J. C. Clinical applications of transcranial magnetic stimulation in patients with movement disorders. Lancet. Neurol. 7, 827-840 (2008).
- Terao, Y., Ugawa, Y. Basic mechanisms of TMS. J. Clin. Neurophysiol. 19, 322-343 (2002).
- McDonnell, M. N., Orekhov, Y., Ziemann, U. The role of GABA(B) receptors in intracortical inhibition in the human motor cortex. Exp. Brain. Res. 173, 86-93 (2006).
- Perez-de-Sa, V., et al. High brain tissue oxygen tension during ventilation with 100% oxygen after fetal asphyxia in newborn sheep. Pediatr. Res. 65, 57-61 (2009).
- Anand, S., Hotson, J. Transcranial magnetic stimulation: neurophysiological applications and safety. Brain. Cogn. 50, 366-386 (2002).
- Chen, R. Depression of motor cortex excitability by low-frequency transcranial magnetic stimulation. Neurology. 48, 1398-1403 (1997).
- Tokay, T., Holl, N., Kirschstein, T., Zschorlich, V., Kohling, R. High-frequency magnetic stimulation induces long-term potentiation in rat hippocampal slices. Neurosci. Lett. 461, 150-154 (2009).
- Taylor, J. L., Gandevia, S. C. Noninvasive stimulation of the human corticospinal tract. J. Appl. Physiol. 96, 1496-1503 (2004).
- Martin, P. G., Hudson, A. L., Gandevia, S. C., Taylor, J. L. Reproducible measurement of human motoneuron excitability with magnetic stimulation of the corticospinal tract. J. Neurophysiol. 102, 606-613 (2009).
- Cohen, L. G., Bandinelli, S., Findley, T. W., Hallett, M. Motor reorganization after upper limb amputation in man. A study with focal magnetic stimulation. Brain. 114 (Pt. 114 1B), 615-627 (1991).
- Penfield, W., Boldrey, E. Somatic motor and sensory representation in cerebral cortex of man as studied by electrical stimulation. Brain. 60, 389-443 (1937).
- Sohn, Y. H., Hallett, M. Motor evoked potentials. Phys. Med. Rehabil. Clin. N. Am. 15, 117-131 (2004).
- Thickbroom, G. W., Mastagliam, F. L., Pascual-Leone, A. . Handbook of Transcranial Magnetic Stimulation. , (2002).
- Wolf, S. L., Butler, A. J., Alberts, J. L., Kim, M. W. Contemporary linkages between EMG, kinetics and stroke rehabilitation. J. Electromyogr. Kinesiol. 15, 229-239 (2005).
- Butler, A. J., Wolf, S. L. Putting the brain on the map: use of transcranial magnetic stimulation to assess and induce cortical plasticity of upper-extremity movement. Phys. Ther. 87, 719-736 (2007).
- Curra, A. Transcranial magnetic stimulation techniques in clinical investigation. Neurology. 59, 1851-1859 (2002).
- Nudo, R. J. Plasticity. NeuroRx. 3, 420-427 (2006).
- Rossini, P. M., Dal Forno, G. Integrated technology for evaluation of brain function and neural plasticity. Phys. Med. Rehabil. Clin. N. Am. 15, 263-306 (2004).
- Lefaucheur, J. P. Methods of therapeutic cortical stimulation. Neurophysiol. Clin. 39, 1-14 (2009).
- Tyvaert, L., et al. The effect of repetitive transcranial magnetic stimulation on dystonia: a clinical and pathophysiological approach. Neurophysiol. Clin. 36, 135-143 (2006).
- Webster, B. R., Celnik, P. A., Cohen, L. G. Noninvasive brain stimulation in stroke rehabilitation. NeuroRx. 3, 474-481 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados