需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
分离人脐静脉内皮细胞和水流条件下其使用中的中性粒细胞轮回研究
摘要
本文首先介绍了人类脐静脉内皮细胞的分离的过程,然后演示如何使用这些细胞检查流量条件下的中性粒细胞轮回。通过使用低体积流量室从玻璃的光学特性的聚合物制成,活细胞荧光成像罕见的细胞群也是可能的。
摘要
中性粒细胞白血细胞中最丰富的类型。它们形成了一个1的先天免疫系统的重要组成部分。在急性炎症,中性粒细胞的炎性细胞迁移到损伤部位。损伤部位的中性粒细胞的招聘是一个循序渐进的过程,包括第一,扩张血管,增加血流量;第二,微血管结构变化和血浆蛋白从血液中逸出;第三,滚动,粘附和对面的中性粒细胞的轮回内皮细胞;和第四积累的中性粒细胞在损伤2,3网站。宽阵列在体内和体外方法已发展到使这些过程的研究,4。这种方法侧重于在人类内皮细胞中性粒细胞轮回。
检查中性粒细胞的轮回中所涉及的分子过程的一个流行的方法是利用人Neutrophils相互作用与原代人脐静脉内皮细胞(HUVEC)5。中性粒细胞分离已直观地描述在别处6,因此本文将显示HUVEC的隔离方法。一旦分离,成长为汇合,内皮细胞被激活,产生粘附和活化分子的上调。例如,激活内皮细胞与细胞因子如TNF-α的结果增加了E-选择素和IL-8表达7。 E-选择素介导中性粒细胞和IL-8介导的激活和坚定的中性粒细胞粘附的捕获和滚动。后粘附中性粒细胞的轮回。轮回可以paracellularly发生,通过内皮细胞路口或transcellularly通过内皮细胞本身。在大多数情况下,这些相互作用的发现在血管7,8流条件下发生的。
平行板流动腔是一种广泛使用的系统,MI液力剪切应力话筒,发现在体内和体外 9,10水流条件下使中性粒细胞招聘研究。有几家公司生产平行平板流室和每个人都有优点和缺点。如果荧光成像是必要的,需要使用玻璃或光学类似的聚合物。内皮细胞不生长在玻璃上。
在这里,我们提出了一个简便,快速的中性粒细胞轮回相衬,DIC和荧光成像的方法,用低量ibidi通道幻灯片,支持快速的人血管内皮细胞的粘附和生长,并具有光学质量相媲美的聚合物制成的玻璃。在此方法中,内皮细胞生长和刺激在ibidiμslide。中性粒细胞被引入流量条件下,轮回进行了评估。路口旁程度与决心使实时荧光成像跨细胞轮回。
研究方案
1。人血管内皮细胞的分离和维护
- 与人体血液和组织工作时,必须使用2级生物安全程序。用剪刀剪线从胎盘的血块和在分娩过程中夹紧电线造成的损害,然后仔细检查电线。切出并丢弃这些线部分。
- 准备在1毫克/毫升,50毫升温线缓冲管,含有50毫克胶原酶注入新鲜的胶原酶溶液。
- 变成无菌手套和消毒钝套管,电线钳,剪刀,三路停止旋塞,在层流罩纱布打开蒸压仪器托盘。
- 确定两个动脉和单一静脉目前在脊髓。动脉较小,往往是紧紧收缩,而静脉大,容易cannulate。从静脉血液冲洗,轻轻插入鼻导管连接到它的双向活塞,我NTO一端的静脉和地点周围套管钳,坚决要保持恰当的位置。通过静脉灌注线缓冲区。重复,直到流经是明确的,然后夹紧线结束。
- 静脉灌注胶原酶,关闭活塞,放入烧杯中包含10分钟的温暖线缓冲和孵育线。 10分钟后,取下电源线,并轻轻按摩放松内皮细胞,从静脉管腔线。排入管内皮细胞介质(ECM)解决方案。线缓冲区刷新两次,以除去剩余的细胞。排入同一管的解决方案。
- 在350 XG离心10分钟沉淀内皮细胞的细胞。
- 去除上清,加入10毫升的ECM沉淀。轻轻地悬浮在ECM的细胞,然后将其转移到的T75瓶前用0.2%明胶涂层的细胞。与明胶涂层前已经做了至少1个小时,在37°C生长的细胞在37°C和5%CO 2。
- 第二天,轻轻地摇动烧瓶驱逐任何红血细胞,然后取出上清液,用温暖汉克的平衡盐溶液(HBSS中)。删除HBSS中,喂10毫升温暖的ECM细胞。检查,以确保去除红细胞,在显微镜下的细胞。评估的汇合程度和血管内皮细胞的形态。内皮细胞在此阶段应拉长无空泡标志。
- 继续改变媒体的每三天,直到细胞达到汇合,然后分裂的细胞,用含1mM的EDTA的0.08%的胰蛋白酶溶液。所需的菜盘内皮细胞预先涂有0.2%的明胶。细胞应达到3-6天的汇合处。
- 当使用预涂层ibidi商会,每个商会与0.2%的明胶。去除多余的明胶和纤维连接蛋白,然后添加1.5×10 6 /毫升进入燃烧室的内皮细胞在ECM暂停。改变媒体的每一天,直到Confluent。细胞应该在2-3天,根据线汇合。
2。中性粒细胞的制备
- 人类健康志愿者,采用密度梯度离心分离外周血中性粒细胞。中性粒细胞的分离与视觉示范一个详细的协议,可以发现在6本杂志的早期问题。一旦隔离,在浓度为1×10 6 /毫升含0.5%的人血白蛋白的HBSS悬浮的中性粒细胞。
3。设立Ibidi商会
- 血管内皮细胞生长在明胶涂层ibidi的腔。检查他们每天用相差显微镜,直到他们成为紧密融合。
- 刺激血管内皮细胞粘附和活化分子表达增加。对于这个协议的目的,刺激内皮细胞10毫微克/毫升重组肿瘤坏死因子-α四个小时37°C和5%CO 2之前设立流动条件下的成像ibidi室。
- 准备显微镜,注射泵作为视觉维泽和同事11空ibidi厅。
- 这个协议和维泽程序之间的主要区别包括预填充管,以防止血管内皮细胞暴露在空气中,保持缓冲区37℃,用水浴,使用PharMed油管从失去温度保持缓冲区和使用不同上取决于是否成像相衬或荧光显微镜的目标。
- 一旦显微镜设立HBSS中,关闭所有的活塞充满油管,并删除空ibidi室。
- 连接ibidi室含肿瘤坏死因子-α刺激血管内皮细胞油管。
4。中性粒细胞的招聘和化境
- 可视化在microsc的内皮细胞单层OPE使用10X相衬物镜。
- 设置注射泵撤出,并开始在HBSS中所需的剪应力流(通常介于0.5到2达因/厘米2)。
- 在进气侧,开关从孤立的中性粒细胞(1×10 6 /毫升)的HBSS转动三路站公鸡。
- 使用CCD相机连接到DVD刻录机或直接连接到电脑,开始记录。中性粒细胞进入会议厅时,启动计时器。四分钟灌注中性粒细胞。共有3毫升的中性粒细胞悬浮为一个单一的实验是足够的。
- 4分钟后,切换回HBSS以防止新的中性粒细胞附着。如果需要总相互作用,滚动和坚定的附着力数据,图像每10秒6的随机域使用一个10X相衬的目标4和5分钟之间。
- 切换到40倍的目标和记录的单场5分钟和10分钟之间。 10分钟,收集5和10之间的角度随机领域。
- 停止流和移动到下腔。
5。使用一个Ibidi商会的流量条件下荧光成像
- 标签或者内皮细胞或中性粒细胞与荧光探针的利益。反VE-cadherin的抗体结合到网站的[547]例如,可用于可视化内皮细胞路口。
- 组装ibidi室,显微镜上的微分干涉对比(DIC)和荧光能力。我们使用与环境室1,FluoView 1000聚焦(奥林巴斯)。集中使用DIC和荧光工作设计的目标。
- 使用由供应商提供的软件,而在第4节所述的时间当然,收购的同时DIC和荧光图像。
6。中性粒细胞招聘分析
- 维泽等 11滚动和互动细胞分析描述。
- 为了测量的单层内皮细胞计数,提出在5秒内直径超过一格的中性粒细胞的数量上滚动的中性粒细胞的百分比。这个数字除以在该领域的白细胞总数来确定滚动细胞的百分比。推而广之,其余的细胞被认为是牢固附着。
- 通过计算中性粒细胞在一个特定的时间内前往,然后在几秒钟的时间除以它的距离测量的中性粒细胞的滚动速度。
- 轮回,是由数已经改变形状和下方的单层10迁移的中性粒细胞的数量。这些中性粒细胞是相明亮改变的事实,他们确定了单层相暗下单层10时的时候。 transmigrated细胞数可以表示为视野中的细胞总数的百分比,或作为原料的麻木ER的单位面积transmigrated细胞。在这个模型系统,通常为50%,中性粒细胞10分钟后轮回。
7。代表结果
不支持无刺激血管内皮细胞中性粒细胞招聘。相比之下,刺激血管内皮细胞与肿瘤坏死因子-α在中性粒细胞的滚动,坚定的粘附和轮回的结果。这些数据的一个例子是在图1和图2所示。 图1A显示中性粒细胞与TNF-α刺激的血管内皮细胞相互作用。可以量化这些相互作用,揭示了相互作用的中性粒细胞与内皮细胞的总数,以及滚动,牢固地附着或transmigrated( 图2)中性粒细胞的数量。轮回的中性粒细胞,可发生于细胞的路口或通过内皮细胞本身。要区分这两个条件,血管内皮细胞标记抗-VE,-C发生paracellularly或transcellularly( 图1B和C)取得黏附的抗体和轮回。在这种模式下,几乎所有的轮回旁7。
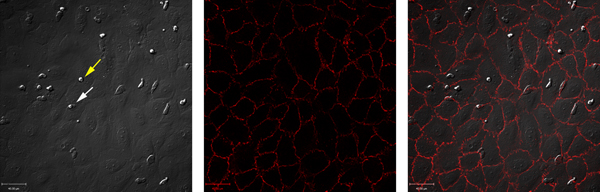
图1。同时使用ibidi室的条件下流动的DIC和荧光成像。 (一)DIC的形象新鲜分离的人中性粒细胞,在人类脐静脉内皮细胞迁移。黄色箭头显示粘附中性粒细胞,白色箭头显示了一个轮回的中性粒细胞。 (二)染色内皮细胞结与抗体共轭反VE-cadherin的网站[547]和影像。 (C)显示通道A和B透露,几乎所有在这个模型中的轮回,是旁覆盖。 点击这里查看大图 。
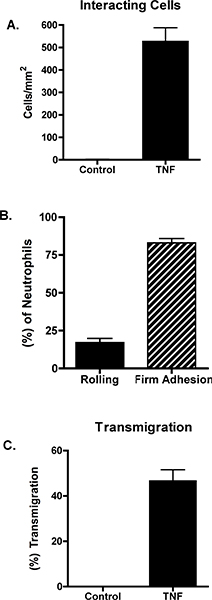
图2。无刺激或10毫微克/毫升的TNF-α刺激内皮细胞离开。 4小时后,平行板流动腔组装和中性粒细胞灌注跨1达因/厘米2。 (一)中性粒细胞的相互作用进行了研究,并采用从NIH ImageJ的软件。 (二)轧,牢固地粘附或(C)轮回的总相互作用的细胞进行了表征。数据代表的3至5次实验的平均+ SEM。面板A和C之间的控制和肿瘤坏死因子的差异显着(P <0.001)。
讨论
研究人员经常使用不同血管床的血管内皮细胞研究中性粒细胞的招聘和轮回。例子包括,但不仅限于,真皮微血管内皮细胞,肝窦内皮细胞13和10人脐静脉内皮细胞。其中,人脐静脉内皮细胞获得了广受欢迎,因为它们相对容易隔离和可用性。 HUVEC的是一个强大的体外模型系统,可以模仿许多发生在体内的内皮进程。这个模型系统已帮助识别粘附分子和趋化因子?...
披露声明
没有利益冲突的声明。
致谢
我们感谢的翩Colarusso博士和协助成像和图像分析活细胞成像设备;女士为她的技术援助Lailey和单位在提供人类脐带在卡尔加里,AB山麓医院51。川崎病帕特尔博士是艾伯塔创新:健康解决方案的科学家。这项工作是从加拿大健康研究,并从加拿大创新和阿尔伯塔省科学和研究的权威机构的基础设备和基础设施补助机构的经营拨款支持。
材料
| Name | Company | Catalog Number | Comments |
| 试剂和设备 | 公司 | 目录编号 | 评论 |
| 型胶原酶1 | 沃辛顿 | 4197 | |
| 线缓冲区 | 成分:140毫米氯化钠4毫米氯化钾10毫米,1毫米的NaH 2 PO 4 /的Na 2 HPO 4在pH 7.4的缓冲D-葡萄糖 | ||
| 内皮细胞介质(ECM) | M199与鹰盐辅以16%的人血清中含100单位的青霉素,链霉素100微克和0.3毫克L-glutamine/ml | ||
| M199 | GIBCO公司 | 31100-035 | |
| 青霉素链霉素谷氨酸(100X) | Invitrogen公司 | 10378-016 | |
| ibidi商会 | ibidi | 80606 | |
| 肿瘤坏死因子-α | 预编程技术 | 300-01A | |
| 人血白蛋白20%的解决方案 | 双子座生物制品 | 800120050 | |
| HBSS中没有的Ca 2 +和Mg 2 + | 西格玛 | H2487-10X | |
| HBSS中使用的Ca 2 +和Mg 2 + | 西格玛 | H1387-10X |
参考文献
- Nathan, C. Neutrophils and immunity: challenges and opportunities. Nat. Rev. Immunol. 6, 173-182 (2006).
- Diacovo, T. G. Neutrophil rolling, arrest, and transmigration across activated, surface-adherent platelets via sequential action of P-selectin and the beta 2-integrin CD11b/CD18. Blood. 88, 146-157 (1996).
- Ley, K. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat. Rev. Immunol. 7, 678-689 (2007).
- Petri, B. Endothelial LSP1 is involved in endothelial dome formation, minimizing vascular permeability changes during neutrophil transmigration in vivo. Blood. 117, 942-952 (2011).
- Chavakis, T. The junctional adhesion molecule-C promotes neutrophil transendothelial migration in vitro and in vivo. J. Biol. Chem. 279, 55602-55608 (2004).
- Oh, H., Siano, B., Diamond, S. Neutrophil Isolation Protocol. J. Vis. Exp. (17), e745 (2008).
- Liu, Y. Regulation of leukocyte transmigration: cell surface interactions and signaling events. J. Immunol. 172, 7-13 (2004).
- Alcaide, P. Neutrophil recruitment under shear flow: it's all about endothelial cell rings and gaps. Microcirculation. 16, 43-57 (2009).
- Jutila, M. A. Measurement of neutrophil adhesion under conditions mimicking blood flow. Neutrophil Methods and Protocols. 412, 239-256 (2007).
- Cuvelier, S. L., Patel, K. D. Studying leukocyte rolling and adhesion in vitro under flow conditions. Basic Cell Culture Protocols. 290, 331-342 (2005).
- Wiese, G., Barthel, S. R., Dimitroff, C. J. Analysis of Physiologic E-Selectin-Mediated Leukocyte Rolling on Microvascular Endothelium. J. Vis. Exp. (24), e1009 (2009).
- Petzelbauer, P. Heterogeneity of dermal microvascular endothelial cell antigen expression and cytokine responsiveness in situ and in cell culture. J. Immunol. 151, 5062-5072 (1993).
- Bonder, C. S., Kubes, P. Modulating leukocyte recruitment to splanchnic organs to reduce inflammation. Am J Phys - Gastrointestinal and Liver Phys. 284, G729-G733 (2003).
- Cuvelier, S. L. Eosinophil adhesion under flow conditions activates mechanosensitive signaling pathways in human endothelial cells. J. Exp. Med. 202, 865-876 (2005).
- Massia, S. P., Hubbell, J. A. Human endothelial cell interactions with surface-coupled adhesion peptides on a nonadhesive glass substrate and two polymeric biomaterials. J. Biomed. Mat. Res. 25, 223-242 (1991).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。