É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento de Células endoteliais da veia umbilical humana e sua utilização no estudo de transmigração de Neutrófilos sob condições de fluxo
Neste Artigo
Resumo
Este artigo primeiro descreve um procedimento para isolar células endoteliais humanas a partir de veias umbilicais e, em seguida, mostra como usar estas células para examinar transmigração de neutrófilos em condições de escoamento. Ao utilizar uma câmara de fluxo de baixo volume feita a partir de um polímero com as características ópticas do vidro, ao vivo de células imagem fluorescente de populações de células raras é também possível.
Resumo
Os neutrófilos são o tipo mais abundante de células brancas do sangue. Eles formam uma parte essencial do sistema imune inato 1. Durante a inflamação aguda, os neutrófilos são as primeiras células inflamatórias para migrar para o local da lesão. Recrutamento dos neutrófilos para um local da lesão é um processo gradual que inclui a dilatação, primeiro de vasos sanguíneos para aumentar o fluxo sanguíneo; segundo, microvasculares alterações estruturais e escapar de proteínas do plasma a partir da corrente sanguínea, o terceiro, aderência, laminagem e transmigração de neutrófilos através do endotélio; e quarta acumulação de neutrófilos no local da lesão 2,3. Uma vasta gama de in vivo e in vitro evoluiu para permitir o estudo destas 4 processos. Este método enfoca a transmigração de neutrófilos através de células endoteliais humanas.
Um método popular para examinar os processos moleculares envolvidos na transmigração de neutrófilos utiliza n humanoeutrophils interagindo com primários células endoteliais da veia umbilical humana (HUVEC) 5. Isolamento dos neutrófilos tem sido descrito em outro lugar visualmente 6; assim, este artigo vai mostrar o método para o isolamento de HUVEC. Uma vez isolado e crescidas até à confluência, as células endoteliais são activados resultando na regulação positiva de moléculas de adesão e de activação. Por exemplo, a activação das células endoteliais com citoquinas como TNF-a resulta em aumento E-selectina e IL-8 expressão 7. E-selectina medeia de captura e de rolamento de neutrófilos e IL-8 de activação e medeia a adesão firme dos neutrófilos. Depois de neutrófilos adesão transmigrar. Transmigração pode ocorrer paracellularly (através de junções de células endoteliais) ou transcellularly (através da célula endotelial em si). Na maioria dos casos, estas interacções ocorrer sob condições de fluxo encontrados na vasculatura 7,8.
A câmara de fluxo de placas paralelas é um sistema muito usado que mimicrofones o cisalhamento hidrodinâmico tensões encontrado in vivo e permite o estudo do recrutamento dos neutrófilos sob condição de fluxo in vitro 9,10. Várias empresas produzem câmaras de fluxo de placas paralelas e cada um tem vantagens e desvantagens. Se fluorescente de imagem é necessário, de vidro ou um polímero opticamente semelhante precisa de ser utilizado. As células endoteliais não crescem bem em vidro.
Apresentamos aqui um método fácil e rápido para a imagiologia de contraste de fase, DIC e fluorescentes de transmigração de neutrófilos utilizando um baixo volume de corrediça canal ibidi feito de um polímero que suporta a adesão rápida e crescimento de células endoteliais humanas e tem qualidades ópticas que são comparáveis aos vidro. Neste método, as células endoteliais foram cultivadas e estimuladas em um μslide ibidi. Os neutrófilos foram introduzidos sob condições de escoamento e transmigração foi avaliada. Imagem fluorescente das junções activado em tempo real determinação da extensão de paracelular contratransmigração transcelular.
Protocolo
1. Isolamento e Manutenção de Humanos As células endoteliais vasculares
- Nível 2 procedimentos de biossegurança devem ser usados quando se trabalha com sangue humano e do tecido. Usando uma tesoura cortar o cordão da placenta e, em seguida, analisar atentamente o cabo de coágulos sanguíneos e danos causados por clampeamento do cordão durante o parto. Recorte e descartar essas porções do cordão umbilical.
- Preparar solução de colagenase fresco a 1 mg / ml por vazamento 50 ml de tampão de cordão quente em um tubo que contém 50 mg de colagenase.
- Mude para uso de luvas estéreis e abrir uma bandeja de instrumentos esterilizados em autoclave contendo cânulas grossas, pinças, tesouras, cabo de três vias de galos e gaze em uma capela de fluxo laminar.
- Identifique as duas artérias e do presente única veia no cordão umbilical. As artérias são menores e tendem a ser firmemente apertada, enquanto que a veia é grande e de fácil utilização para canular. Para liberar o sangue da veia, gentilmente inserir uma cânula com uma torneira de duas vias ligado a ele into uma extremidade da veia e lugar uma braçadeira em torno da cânula para segurá-la firmemente em posição. Perfundir tampão cabo através da veia. Repita até que o fluxo através é clara e, em seguida, fixar a extremidade do cordão umbilical.
- Colagenase perfundir na veia, fechar a torneira, colocar o cabo a um copo contendo tampão de cordão quente e incubar durante 10 minutos. Após 10 minutos, retire o cabo e massageie suavemente o cabo para soltar as células endoteliais a partir do lúmen da veia. Drenar a solução para dentro do tubo contendo meios de células endoteliais (ECM). Lavar com tampão de cabo de duas vezes para remover as células restantes. Drenar a solução para o mesmo tubo.
- Centrifugar as células a 350 xg durante 10 minutos para sedimentar as células endoteliais.
- Remover o sobrenadante e adicionar 10 ml de ECM para o sedimento. Suavemente ressuspender as células em ECM, em seguida, transferir as células para um balão T75 pré-revestida com 0,2% de gelatina. Pré-revestimento com gelatina foi feito durante pelo menos 1 hora a 37 ° C. Crescer as células a 37 ° C e 5% De CO 2.
- No dia seguinte, agitar suavemente o frasco para desalojar quaisquer células vermelhas do sangue, em seguida, remover o sobrenadante e lava-se com solução de Hank quente de sal equilibrada (HBSS). Remover HBSS e alimentar as células com 10 ml de ECM quente. Examinar as células ao microscópio para assegurar que as células vermelhas do sangue foram removidas. Avaliar o grau de confluência e morfologia das células endoteliais. As células endoteliais nesta fase deve ser alongada sem nenhum sinal de vacúolos.
- Continuam a mudar os meios de comunicação de três em três dias até atingir confluência, as células de células, em seguida, dividido usando uma solução 0,08% de tripsina contendo 1 mM de EDTA. As células endoteliais da placa em pratos desejados pré-revestida com 0,2% de gelatina. As células devem atingir confluência em 3-6 dias.
- Ao utilizar ibidi câmaras, revestimento pré-cada câmara com 0,2% de gelatina. Remover o excesso de gelatina e fibronectina e, em seguida adicionar 1,5 X 10 6 / ml de células endoteliais em suspensão em ECM para dentro da câmara. Troque a mídia todos os dias até confluent. As células devem ser confluentes em 2-3 dias, dependendo do cabo.
2. Preparação de Neutrófilos
- Os neutrófilos foram isolados a partir do sangue periférico de voluntários humanos saudáveis, utilizando centrifugação de densidade. Um protocolo detalhado com uma demonstração visual para o isolamento dos neutrófilos pode ser encontrada na edição anterior deste periódico 6. Uma vez isolados, os neutrófilos Ressuspenda a uma concentração de 1x10 6 / ml em HBSS contendo 0,5% de albumina humana.
3. Configurando a Câmara Ibidi
- Crescer as células endoteliais em uma câmara de ibidi gelatina-revestido. Examiná-los todos os dias usando microscopia de contraste de fase até que se tornem bem confluentes.
- Estimular as células endoteliais para aumentar a expressão de moléculas de adesão e de activação. Para os fins deste protocolo, as células endoteliais foram estimuladas com 10 ng / mL de recombinante de TNF-α durante quatro horas a 37 ° C e 5% CO 2 antes da criação da câmara ibidi para imagens em condições de escoamento.
- Preparar o microscópio, e bomba de seringa como descrito por visualmente Wiese e colegas 11 utilizando uma câmara de ibidi vazio.
- As principais diferenças entre este protocolo eo procedimento Wiese incluem pré-enchimento do tubo para evitar a exposição das células endoteliais para a atmosfera, mantendo o tampão a 37 ° C utilizando um banho de água, utilizando tubagem PharMed para manter o tampão de perder temperatura e utilizando diferentes objectivos sobre o microscópio, dependendo se de imagem com contraste de fase ou de fluorescência.
- Uma vez que o microscópio está configurado eo tubo é preenchido com HBSS, feche todas as torneiras e retire a câmara ibidi vazio.
- Ligar a câmara de ibidi contendo o TNF-α estimulada células endoteliais para a tubagem.
4. Recrutamento de neutrófilos e Transmigração
- Visualize a monocamada de células endoteliais no MicroscOpe usando um objectivo contraste 10x fase.
- Ajustar a bomba seringa para retirar e começar o fluxo de HBSS na tensão de cisalhamento desejada (normalmente entre 0,5-2 dines / cm 2).
- No lado de entrada de chave, a partir de HBSS a neutrófilos isolados (1x10 6 / mL), rodando a forma de três paradas galo.
- Começar a gravar com uma câmera CCD ligados a um gravador de DVD ou conectado diretamente ao computador. Inicie o temporizador quando neutrófilos entrar na câmara. Perfundir neutrófilos para quatro minutos. Um total de 3 mL da suspensão de neutrófilos é suficiente para uma única experiência.
- Depois de quatro minutos, voltar a HBSS para evitar a fixação de novos neutrófilos. Se os dados de interações totais, rolamento e adesão firme são desejados, imagem 6 campos aleatórios por 10 segundos cada uma usando uma objetiva 10x contraste de fase entre 4 e 5 minutos.
- Mudar para uma objetiva de 40x e gravar um único campo de visão entre 5 e 10 minutos. Aos 10 minutos, recolherentre 5 e 10 campos aleatórios de vista.
- Parar o fluxo e passar para próxima câmara.
5. Imagem fluorescente sob condições de fluxo utilizando uma câmara de Ibidi
- Células endoteliais ou etiqueta ou neutrófilos com uma sonda fluorescente de interesse. Por exemplo, um anticorpo anti-VE caderina conjugada com Alexa-[547] pode ser usado para visualizar junções celulares endoteliais.
- Montar câmara ibidi num microscópio de contraste de interferência diferencial (DIC) e capacidades fluorescentes. Usamos um FluoView 1000 confocal (Olympus) com uma câmara ambiental. Concentre-se usando um objetivo projetado para o trabalho DIC e fluorescentes.
- Adquirir imagens simultâneas DIC e fluorescente usando o software fornecido pelo vendedor, enquanto seguindo o curso do tempo descrito na seção 4.
6. Análise de recrutamento dos neutrófilos
- Análise de laminagem e interagindo células é descrita por Wiese et al 11.
- Para medir a percentagem de neutrófilos de rolamento sobre a monocamada endotelial contar o número de neutrófilos que se moveram mais do que um diâmetro da célula em um período de 5 segundos. Dividir este número pelo número total de leucócitos no campo para determinar a percentagem de células de rolamento. Por extensão, as células restantes são considerados firmemente aderente.
- Medir a velocidade de rolamento de neutrófilos através do cálculo da distância percorrida a neutrófilos em um determinado período de tempo e, em seguida, dividindo-o pelo que o tempo em segundos.
- Transmigração é determinada pela contagem do número de neutrófilos que foram alterados de forma e migrou sob a monocamada 10. Estes neutrófilos são identificados pelo facto de eles mudar de ser fase brilhante quando no topo da monocamada de ser escuro fase quando debaixo da monocamada 10. O número de células transmigradas pode ser expresso como uma percentagem do total de células no campo de visão ou como um dormente brutoer de células transmigradas por unidade de área. Neste sistema de modelo, tipicamente 50% de neutrófilos transmigrar após 10 minutos.
7. Os resultados representativos
Não estimuladas as células endoteliais não suportam o recrutamento de neutrófilos. Em contraste, estimulando as células endoteliais com TNF-a resultados em neutrófilos de rolamento, adesão firme e transmigração. Um exemplo destes dados é mostrado nas Figuras 1 e 2. A Figura 1A mostra neutrófilos que interagem com o TNF-α-estimuladas células endoteliais. Estas interacções podem ser quantificados, revelando o número total de neutrófilos que interagem com as células endoteliais, bem como o número de neutrófilos de rolamento, firmemente aderente ou transmigrou (Figura 2). Transmigração de neutrófilos pode ocorrer em junções celulares ou através das células endoteliais em si. Para diferenciar entre estas duas condições, as células endoteliais são rotulados com um anti-VE-c adherin anticorpo e transmigração é pontuada como ocorrendo paracellularly ou transcellularly (Figura 1B e C). Neste modelo, virtualmente toda a transmigração é paracelular 7.
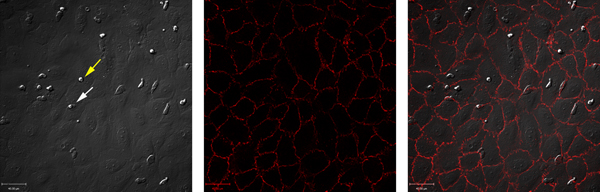
Figura 1. DIC simultânea e imagens de fluorescência sob condições de fluxo utilizando uma câmara de ibidi. (A) imagem DIC recém isolado neutrófilos humanos que migram através de células endoteliais da veia umbilical humana. A seta amarela mostra um adepto de neutrófilos, a seta branca mostra uma neutrófilos transmigrando. (B) junções celulares endoteliais foram coradas com um anticorpo anti-VE caderina conjugada com Alexa-[547] e imagens. (C) mostra overlay do canal A e B revela que praticamente transmigrando tudo neste modelo é paracelular. Clique aqui para ver maior figura .
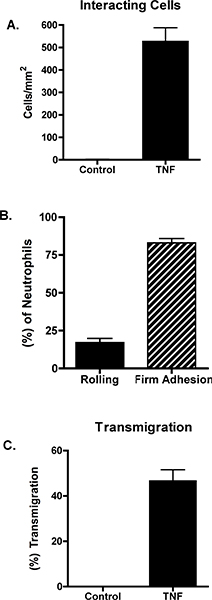
Figura 2. As células endoteliais foram deixados não estimulada ou foram estimulados com 10 ng / mL de TNF-α. Após 4 horas, uma câmara de fluxo paralelo placa foi montado e neutrófilos foram perfundidos através de um dines / cm 2. (A) interacções neutrófilos foram examinados e medida utilizando software ImageJ de NIH. As células interagindo totais foram caracterizadas como (B) de rolamento, firmemente aderente ou (C) transmigrando. Os dados representam a média + SEM de entre 3 e 5 experiências. A diferença entre controle e TNF em painéis A e C foi significativa (p <0,001).
Discussão
Os pesquisadores têm utilizado rotineiramente células endoteliais de diversos leitos vasculares para estudar o recrutamento de neutrófilos e transmigração. Os exemplos incluem, mas não estão limitados a, células endoteliais microvasculares dérmicas 12, fígado sinusoidais células endoteliais 13 e células endoteliais da veia umbilical humana 10. Entre eles HUVEC ganharam popularidade devido à sua largura relativa facilidade de isolamento e de disponibilidade. HUVEC são ...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Agradecemos ao Dr. Pina Colarusso eo Mecanismo de imagens de células vivas para sua colaboração com a imagem e análise de imagem; Ms. Lailey por sua assistência técnica; e unidade 51 no Hospital Foothills, em Calgary, AB pela prestação de cordões umbilicais humanos. Dr. KD Patel é um Inova Alberta: Saúde Scientist Solutions. Este trabalho foi financiado por uma subvenção de funcionamento do Canadian Institutes for Health Research e doações de equipamentos e infra-estrutura da Fundação Canadense para Inovação e da Ciência e da Autoridade de Alberta Research.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagente e Equipamentos | Companhia | Número de catálogo | Comentários |
| Colagenase tipo 1 | Worthington | 4197 | |
| Tampão cabo | Composição: 140 mM de NaCl 4 mM de KCl 10 mM D-glucose em 1 mM de NaH 2 PO 4 / Na 2 HPO 4 tampão a pH 7,4 | ||
| Endoteliais mídia celular (ECM) | M199 com sais de águia suplementado com 16% de soro humano contendo 100 unidades de penicilina 100 ug de estreptomicina e 0,3 mg de L-glutamine/ml | ||
| M199 | GIBCO | 31100-035 | |
| Penicilina glutamato estreptomicina (100X) | Invitrogen | 10378-016 | |
| Ibidi câmaras | Ibidi | 80606 | |
| TNF-α | Prepro Tecnologia | 300-01A | |
| Solução de albumina humana a 20% | Bioproducts Gêmeos | 800120050 | |
| HBSS sem Ca 2 + e Mg 2 + | Sigma | H2487-10X | |
| HBSS com Ca2 + e Mg2 + | Sigma | H1387-10X |
Referências
- Nathan, C. Neutrophils and immunity: challenges and opportunities. Nat. Rev. Immunol. 6, 173-182 (2006).
- Diacovo, T. G. Neutrophil rolling, arrest, and transmigration across activated, surface-adherent platelets via sequential action of P-selectin and the beta 2-integrin CD11b/CD18. Blood. 88, 146-157 (1996).
- Ley, K. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat. Rev. Immunol. 7, 678-689 (2007).
- Petri, B. Endothelial LSP1 is involved in endothelial dome formation, minimizing vascular permeability changes during neutrophil transmigration in vivo. Blood. 117, 942-952 (2011).
- Chavakis, T. The junctional adhesion molecule-C promotes neutrophil transendothelial migration in vitro and in vivo. J. Biol. Chem. 279, 55602-55608 (2004).
- Oh, H., Siano, B., Diamond, S. Neutrophil Isolation Protocol. J. Vis. Exp. (17), e745 (2008).
- Liu, Y. Regulation of leukocyte transmigration: cell surface interactions and signaling events. J. Immunol. 172, 7-13 (2004).
- Alcaide, P. Neutrophil recruitment under shear flow: it's all about endothelial cell rings and gaps. Microcirculation. 16, 43-57 (2009).
- Jutila, M. A. Measurement of neutrophil adhesion under conditions mimicking blood flow. Neutrophil Methods and Protocols. 412, 239-256 (2007).
- Cuvelier, S. L., Patel, K. D. Studying leukocyte rolling and adhesion in vitro under flow conditions. Basic Cell Culture Protocols. 290, 331-342 (2005).
- Wiese, G., Barthel, S. R., Dimitroff, C. J. Analysis of Physiologic E-Selectin-Mediated Leukocyte Rolling on Microvascular Endothelium. J. Vis. Exp. (24), e1009 (2009).
- Petzelbauer, P. Heterogeneity of dermal microvascular endothelial cell antigen expression and cytokine responsiveness in situ and in cell culture. J. Immunol. 151, 5062-5072 (1993).
- Bonder, C. S., Kubes, P. Modulating leukocyte recruitment to splanchnic organs to reduce inflammation. Am J Phys - Gastrointestinal and Liver Phys. 284, G729-G733 (2003).
- Cuvelier, S. L. Eosinophil adhesion under flow conditions activates mechanosensitive signaling pathways in human endothelial cells. J. Exp. Med. 202, 865-876 (2005).
- Massia, S. P., Hubbell, J. A. Human endothelial cell interactions with surface-coupled adhesion peptides on a nonadhesive glass substrate and two polymeric biomaterials. J. Biomed. Mat. Res. 25, 223-242 (1991).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados