A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בידודו של האדם וריד טבורי תאים אנדותל והשימוש בהם לחקר גלגול נשמות נויטרופילים בתנאי זרימה
In This Article
Summary
מאמר זה מתאר 1 נוהל בידוד לתאי אנדותל אנושיים מן הוורידים הטבור ולאחר מכן מראה כיצד להשתמש בתאים אלו כדי לבחון גלגול נויטרופילים בתנאי זרימה. באמצעות תא בנפח נמוך זרימת עשוי פולימר עם מאפיינים אופטיים של הזכוכית, חי תאים הדמיה הניאון של אוכלוסיות תאים נדירות הוא גם אפשרי.
Abstract
הנויטרופילים הם סוג השכיח ביותר של תא דם לבן. הם מהווים חלק בלתי נפרד של מערכת החיסון המולדת 1. במהלך דלקת חריפה, הנויטרופילים הם תאים דלקתיים הראשונים לעבור באזור הפציעה. גיוס של נויטרופילים לאתר הפציעה הוא תהליך הדרגתי, הכולל התרחבות 1, של כלי הדם כדי להגביר את זרימת הדם, השנייה, שינויים מבניים כלי הדם ולברוח של חלבונים פלזמה מזרם הדם, 3, הדבקה מתגלגל, גלגול של נויטרופילים פני האנדותל, ו 4 הצטברות נויטרופילים באתר הפגיעה 2,3. מגוון רחב של in vivo ו בשיטות חוץ גופית התפתח כדי לאפשר את לימוד התהליכים האלה 4. שיטה זו מתמקדת גלגול נויטרופילים פני לתאי אנדותל אנושיים.
שיטה פופולארית לבחינת התהליכים המולקולריים המעורבים גלגול נויטרופילים מנצל n אדםeutrophils אינטראקציה עם תאים ראשוניים אדם וריד הטבור אנדותל (HUVEC) 5. בידוד נויטרופילים תוארה חזותית במקום אחר 6, ולכן מאמר זה יציג את שיטת הבידוד של HUVEC. מבודדים אחת גדלה המפגש, בתאי האנדותל מופעלים וכתוצאה מכך הגברת הביטוי של מולקולות הדבקה והפעלה. כך, למשל, הפעלה של תאים אנדותל עם ציטוקינים כגון TNF-אלפא גורם selectin-E מוגברת IL-8 הביטוי 7. E-selectin מתווכת ללכוד וגלגול של נויטרופילים ו IL-8 מתווכת הפעלה הידבקות חברה של נויטרופילים. לאחר הידבקות הנויטרופילים מתגלגלות. גלגול יכול להתרחש paracellularly (דרך צמתים תא האנדותל) או transcellularly (דרך תא האנדותל את עצמו). ברוב המקרים, אינטראקציות אלה מתרחשות בתנאים תזרים שנמצאו 7,8 בכלי הדם.
החדר במקביל זרימת צלחת היא מערכת בשימוש נרחב כי mimics גזירה הידרודינמית מדגיש למצוא vivo ומאפשרת לימוד גיוס נויטרופילים בתנאי זרימת במבחנה 9,10. מספר חברות לייצר במקביל הזרימה לתאי צלחת וכל אחד מהם יש יתרונות וחסרונות. אם ניאון הדמיה יש צורך, זכוכית או פולימר דומה אופטית צריך לשמש. בתאי האנדותל אינם גדלים היטב על זכוכית.
כאן אנו מציגים שיטה קלה ומהירה הדמיה שלב לעומת זאת, DIC ו הניאון של גלגול נויטרופילים באמצעות בנפח נמוך ibidi ערוץ שקופיות עשוי פולימר, אשר תומך הידבקות מהירה וצמיחה של תאים אנדותל אנושיים ויש לו תכונות אופטיות, כי הם דומים זכוכית. בשיטה זו, בתאי האנדותל גדלו ועורר ב μslide ibidi. נויטרופילים הוכנסו בתנאים הזרימה ואת גלגול הוערך. הדמיה הניאון של צמתים לאפשר בזמן אמת קביעת היקף paracellular לעומתtranscellular גלגול.
Protocol
1. בידוד ותחזוקה של אדם לתאי אנדותל כלי דם
- רמה 2 הליכים biosafety יש להשתמש בעת עבודה עם דם ברקמות האדם. מספריים חותכים את כבל מן השליה ולאחר מכן לבדוק מקרוב את חבל על קרישי דם ונזק נגרם על ידי לחיצה כבל במהלך הלידה. לגזור וזורקים אלה חלקים של חוט.
- הכן פתרון collagenase טרי על 1 מ"ג / מ"ל ידי לשפוך 50 מ"ל של חיץ כבל חם לתוך צינור המכיל 50 מ"ג collagenase.
- שנה לתוך כפפות סטריליות ולפתוח מגש כלי autoclaved המכיל cannulas קהים מעוקרות, Clamps חוט, מספריים, 3-way Stop-תרנגולים גזה בשכונה זרימה למינרית.
- לזהות את שני העורקים וההווה וריד אחד בחוט. העורקים הם קטנים נוטים להיות מכווץ בחוזקה, בעוד וריד גדול וקל cannulate. כדי לשטוף את הדם מעורק, בעדינות להכניס צינורית עם שסתום דו כיווני קשור אליו אניn כדי קצה אחד של הווריד ומקום מלחציים סביב צינורית להחזיק אותו היטב במצב. Perfuse חיץ כבל דרך הווריד. חזור על הפעולה עד לזרום דרך ברורה, ואז להדק את קצה החוט.
- Collagenase Perfuse לווריד, לסגור את שסתום, מקם את כבל לתוך מבחנה המכילה מאגר כבל דגירה חמים למשך 10 דקות. אחרי 10 דקות, הסר את כבל לעסות בעדינות את כבל כדי לשחרר לתאי אנדותל של לומן של הווריד. מסננים את הפתרון לתוך צינור המכיל מדיה תא האנדותל (ECM). לשטוף עם חיץ כבל פעמיים כדי להסיר את התאים הנותרים. מסננים את הפתרון לתוך צינור אחד.
- בצנטריפוגה תאים ב XG 350 במשך 10 דקות עד גלולה לתאי אנדותל.
- הסר את supernatant ולהוסיף 10 מ"ל של ECM על גלולה. בעדינות resuspend התאים ECM, ואז להעביר את התאים בקבוק T75 מראש מצופה עם 0.2% ג'לטין. מראש עם ציפוי ג'לטין נעשה במשך שעה לפחות 1 ב 37 ° C. לגדל את התאים ב 37 ° C ו 5% CO 2.
- למחרת, לנער את הבקבוק בעדינות כדי לסלק את כל כדוריות דם אדומות ולאחר מכן להסיר את supernatant לשטוף עם תמיסת מלח מאוזנת של האנק חם (HBSS). הסר HBSS ולהאכיל את התאים עם 10 מ"ל של ECM חם. לבחון את התאים תחת מיקרוסקופ על מנת להבטיח כי תאי דם אדומים הוסרו. להעריך את מידת מפגש ומורפולוגיה של בתאי האנדותל. לתאי אנדותל בשלב זה צריך להיות מוארך ללא כל סימן של vacuoles.
- להמשיך לשנות את התקשורת כל שלושה ימים עד אשר התאים מגיעים confluency, פיצול תאים ולאחר מכן באמצעות פתרון של 0.08% טריפסין המכיל EDTA 1 מ"מ. בתאי אנדותל פלייט בצלחות הרצויות מראש מצופה 0.2% ג'לטין. תאים צריך להגיע למפגש ב 3-6 ימים.
- בעת שימוש בתאי ibidi, מעיל מראש כל תא עם 0.2% ג'לטין. הסרת עודפי ג'לטין ו fibronectin ולאחר מכן להוסיף 1.5 X 10 6 / mL של בתאי האנדותל המרחפים ECM לתוך החדר. לשנות את התקשורת כל יומיים עד גonfluent. תאים צריכים להיות confluent ב 2-3 ימים, תלוי בחוט.
2. הכנת נויטרופילים
- נויטרופילים בודדו מדם היקפי של אדם מתנדבים בריאים בעזרת צנטריפוגה צפיפות. פרוטוקול מפורט עם הדגמה חזותית בידוד נויטרופילים ניתן למצוא בגיליון קודם של היומן הזה 6. מבודדים פעם, נויטרופילים resuspend בריכוז של 1x10 מ"ל / 6 ב HBSS המכילים אלבומין אנושי 0.5%.
3. הקמת לשכת Ibidi
- לגדול לתאי אנדותל בתא ibidi ג'לטין מצופה. לבחון אותם מדי יום באמצעות מיקרוסקופ לעומת שלב עד שהם הופכים confluent בחוזקה.
- לעורר את התאים אנדותל להגדיל את הביטוי של מולקולות הדבקה והפעלה. למטרות פרוטוקול זה, לתאי אנדותל היו מגורה עם 10 ng / mL רקומביננטי של TNF-α במשך ארבע שעות ב 37 ° C ו-CO 5% 2 לפני הקמת חדר ibidi הדמיה בתנאי זרימה.
- הכן את המיקרוסקופ, ואת משאבת מזרק כמתואר חזותית על ידי ויזה ועמיתיו 11 באמצעות תא ריק ibidi.
- ההבדלים העיקריים בין פרוטוקול זה הליך ויזה כוללים מראש למלא צינורות, כדי למנוע חשיפה של תאים אנדותל אוויר, שמירה על מאגר של 37 מעלות צלזיוס באמצעות אמבט מים, באמצעות צינור PharMed לשמור על חיץ בין לאבד את הטמפרטורה באמצעות אחר מטרות על המיקרוסקופ תלוי אם הדמיה עם ניגודיות שלב או פלואורסצנטי.
- לאחר המיקרוסקופ הוא להגדיר את צינור מלא HBSS, לסגור את כל והברזים למיניהם ולהסיר את החדר ריק ibidi.
- חבר לשכת ibidi המכיל TNF-α גירוי בתאי האנדותל כדי צינורות.
4. גיוס גלגול נשמות נויטרופילים ו
- דמיינו monolayer תא האנדותל ב microscאופ באמצעות המטרה 10x לעומת שלב.
- הגדר את משאבת מזרק לסגת ולהתחיל את זרימת HBSS על הלחץ גזירה הרצוי (בדרך כלל בין 0.5-2 ס"מ / Dyn 2).
- בצד כניסת, לעבור מן HBSS כדי נויטרופילים מבודדים (1x10 6 / ml) על ידי סיבוב משולש הפסקת הזין.
- בגין הקלטה באמצעות מצלמת ה-CCD מחובר או כדי מקליט DVD או מחובר ישירות למחשב. הפעל את שעון העצר כאשר הנויטרופילים להיכנס לחדר. Perfuse נויטרופילים במשך ארבע דקות. סך של 3 מ"ל של השעיה נויטרופילים מספיק עבור ניסוי בודד.
- אחרי ארבע דקות, לחזור HBSS כדי למנוע את הקובץ המצורף של נויטרופילים חדשים. אם הנתונים עבור אינטראקציות הכל, התגלגלו הדבקה החברה הם הרצוי, 6 שדות תמונה אקראית למשך 10 שניות כל אחד באמצעות המטרה 10x לעומת זאת בשלב דקות בין 4 ו -5.
- מעבר למטרה 40X ולהקליט שדה אחד של נוף בין 5 ל 10 דקות. לאחר 10 דקות, לאסוףבין 5 ל 10 שדות אקראיות של תצוגה.
- לעצור את זרימת ולעבור לחדר הבא.
5. דימות פלואורסצנטי בתנאי זרימה באמצעות לשכת Ibidi
- תווית לתאי אנדותל או נויטרופילים עם החללית ניאון של עניין. כך, למשל, נוגדנים נגד VE-cadherin מצומדות ל-Alexa [547] ניתן להשתמש כדי להמחיש צמתים תא האנדותל.
- הרכב חדר ibidi על מיקרוסקופ עם ניגודיות ההפרש התערבות (DIC) ויכולות ניאון. אנחנו משתמשים 1000 FluoView confocal (אולימפוס) עם תא הסביבה. פוקוס באמצעות המטרה המיועדת עבודה DIC ניאון.
- לרכוש תמונות הקית"ם ניאון בו זמנית באמצעות תוכנה המסופקת על ידי ספק תוך ביצוע מהלך הזמן המתואר בסעיף 4.
6. ניתוח של גיוס נויטרופילים
- ניתוח מתגלגל ואינטראקציה תאים מתואר על ידי ויזה ואח' 11.
- כדי למדוד את אחוז נויטרופילים מתגלגל על monolayer האנדותל לספור את מספר הנויטרופילים אשר עברו יותר בקוטר תא לתקופה של 5 שניות. מחלקים את המספר הזה של המספרים הכוללים של leukocytes בתחום על מנת לקבוע את אחוז התאים מתגלגל. ובהרחבה, התאים הנותרים נחשבים חסיד בתוקף.
- למדוד את מהירות גלגול של נויטרופילים על ידי חישוב המרחק נויטרופילים נסע פרק זמן מסוים ולאחר מכן וחלוקתו ב אז בתוך שניות.
- גלגול נקבע על פי ספירת הנויטרופילים שעברו שינוי צורה להעביר מתחת monolayer 10. נויטרופילים אלו מזוהים על ידי העובדה כי הם משתנים מלהיות בשלב בהיר כאשר על גבי monolayer להיות כהה בשלב כאשר מתחת monolayer 10. מספר תאים transmigrated ניתן לבטא כאחוז התאים הכל בתחום הראייה או תחושה גלםאה של תאים transmigrated ליחידת שטח. במערכת מודל זה, בדרך כלל 50% נויטרופילים מתגלגלות לאחר 10 דקות.
7. נציג תוצאות
לתאי אנדותל Unstimulated אינם תומכים בגיוס נויטרופילים. לעומת זאת, גירוי לתאי אנדותל עם TNF-אלפא גורם נויטרופילים מתגלגל, הדבקה איתן גלגול. דוגמה של נתונים אלה מוצגת במספרים 1 ו -2. איור 1 א מראה נויטרופילים אינטראקציה עם TNF-α-מגורה לתאי אנדותל. אינטראקציות אלה ניתן לכמת, חושף את המספר הכולל של נויטרופילים באינטראקציה עם לתאי אנדותל, כמו גם מספר הנויטרופילים מתגלגל, חסיד בתוקף או transmigrated (איור 2). גלגול נויטרופילים יכול להתרחש בצמתים התא או דרך בתאי האנדותל עצמם. כדי להבדיל בין שני מצבים, לתאי אנדותל מסומנים עם אנטי VE-C נוגדנים adherin ואת גלגול הוא הבקיע כפי שקורה paracellularly או transcellularly (איור 1B ו-C). במודל זה, כמעט כל גלגול הוא paracellular 7.
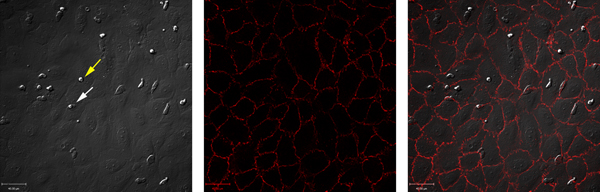
באיור 1. DIC סימולטני דימות פלואורסצנטי בתנאים זרימה באמצעות תא ibidi. (א) התמונה DIC מבודד טרי נויטרופילים אדם נודדים על פני תאים אנושיים וריד הטבור אנדותל. ראש חץ צהוב מראה נויטרופילים חסיד, ראש חץ לבן מראה נויטרופילים מתגלגלת. (ב) צמתים תא האנדותל הוכתמו נוגדנים נגד VE-cadherin מצומדות ל-Alexa [547] וכן הדמיה. (ג) מראה כיסוי של ערוץ A ו-B עולה כי כמעט כל מתגלגלת במודל זה paracellular. לחץ כאן כדי להציג דמות גדולה .
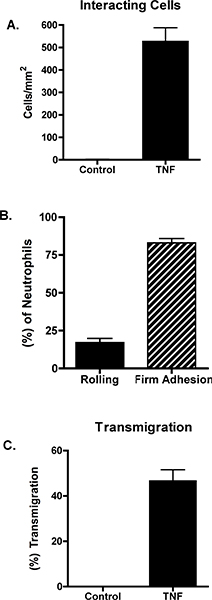
איור 2. לתאי אנדותל נותרו unstimulated או היו מגורה עם 10 ng / mL של TNF-α. לאחר 4 שעות, חדר במקביל זרימת צלחת הורכב ו נויטרופילים היו perfused לעבר Dyn 1/2 ס"מ. (א) אינטראקציות נויטרופילים נבדקו ונמדדו באמצעות ImageJ תוכנה NIH. התאים אינטראקציה בסך הכל היו לאפיין מתגלגל (ב '), חסיד בתוקף או (ג) מתגלגלת. הנתונים מייצגים + SEM ממוצע של בין 3 ל 5 ניסויים. ההבדל בין שליטה TNF ב לוחות ו-C היה משמעותי (p <0.001).
Discussion
החוקרים השתמשו באופן קבוע לתאי אנדותל של כלי הדם מיטות שונות ללמוד גיוס גלגול נויטרופילים ו. דוגמאות כוללות, אך לא רק, עורי לתאי אנדותל כלי הדם, 12 סינוסי הכבד ותאי אנדותל 13 ותאי האנדותל מווריד הטבור האדם 10. ביניהם HUVEC לפופולריות רחבה בגלל הקלות היח...
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
אנו מודים לד"ר פינה Colarusso לבין תא חי מתקן הדמיה על עזרתם עם הדמיה ניתוח התמונה: גב 'Lailey לקבלת סיוע טכני שלה, היחידה 51 בבית החולים שפלת בקלגרי, א.ב. למתן חבלי הטבור אדם. ד"ר KD פאטל היא מתפתחת אלברטה: המדען Health Solutions. עבודה זו נתמכה על ידי מענק ההפעלה של המכון הקנדי למחקר בריאות מענקי ציוד ותשתיות מן הקרן הקנדית חדשנות המדע אלברטה רשות המחקר.
Materials
| Name | Company | Catalog Number | Comments |
| מגיב וציוד | חברה | מספר קטלוגי | תגובות |
| Collagenase סוג 1 | וורטינגטון | 4197 | |
| כבל חיץ | הרכב: 140 מ"מ NaCl 4 מ"מ KCl 10 mM D-גלוקוז במאגר 1mm לאא 2 PO 4 / Na 2 HPO 4 ב-pH 7.4 | ||
| פלאפון תקשורת אנדותל (ECM) | M199 עם מלחים נשר השלימו עם סרום אנושי 16% המכיל 100 יחידות של פניצילין 100 מיקרוגרם של סטרפטומיצין ו 0.3 מ"ג L-glutamine/ml | ||
| M199 | GIBCO | 31100-035 | |
| פניצילין גלוטמט סטרפטומיצין (100x) | Invitrogen | 10378-016 | |
| Ibidi בתאי | Ibidi | 80606 | |
| TNF-α | Prepro טק | 300-01A | |
| הפתרון האנושי 20% אלבומין | מזל תאומים Bioproducts | 800120050 | |
| HBSS ללא Ca 2 + ו - Mg 2 + | סיגמא | H2487-10X | |
| HBSS עם Ca 2 + ו - Mg 2 + | סיגמא | H1387-10X |
References
- Nathan, C. Neutrophils and immunity: challenges and opportunities. Nat. Rev. Immunol. 6, 173-182 (2006).
- Diacovo, T. G. Neutrophil rolling, arrest, and transmigration across activated, surface-adherent platelets via sequential action of P-selectin and the beta 2-integrin CD11b/CD18. Blood. 88, 146-157 (1996).
- Ley, K. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat. Rev. Immunol. 7, 678-689 (2007).
- Petri, B. Endothelial LSP1 is involved in endothelial dome formation, minimizing vascular permeability changes during neutrophil transmigration in vivo. Blood. 117, 942-952 (2011).
- Chavakis, T. The junctional adhesion molecule-C promotes neutrophil transendothelial migration in vitro and in vivo. J. Biol. Chem. 279, 55602-55608 (2004).
- Oh, H., Siano, B., Diamond, S. Neutrophil Isolation Protocol. J. Vis. Exp. (17), e745 (2008).
- Liu, Y. Regulation of leukocyte transmigration: cell surface interactions and signaling events. J. Immunol. 172, 7-13 (2004).
- Alcaide, P. Neutrophil recruitment under shear flow: it's all about endothelial cell rings and gaps. Microcirculation. 16, 43-57 (2009).
- Jutila, M. A. Measurement of neutrophil adhesion under conditions mimicking blood flow. Neutrophil Methods and Protocols. 412, 239-256 (2007).
- Cuvelier, S. L., Patel, K. D. Studying leukocyte rolling and adhesion in vitro under flow conditions. Basic Cell Culture Protocols. 290, 331-342 (2005).
- Wiese, G., Barthel, S. R., Dimitroff, C. J. Analysis of Physiologic E-Selectin-Mediated Leukocyte Rolling on Microvascular Endothelium. J. Vis. Exp. (24), e1009 (2009).
- Petzelbauer, P. Heterogeneity of dermal microvascular endothelial cell antigen expression and cytokine responsiveness in situ and in cell culture. J. Immunol. 151, 5062-5072 (1993).
- Bonder, C. S., Kubes, P. Modulating leukocyte recruitment to splanchnic organs to reduce inflammation. Am J Phys - Gastrointestinal and Liver Phys. 284, G729-G733 (2003).
- Cuvelier, S. L. Eosinophil adhesion under flow conditions activates mechanosensitive signaling pathways in human endothelial cells. J. Exp. Med. 202, 865-876 (2005).
- Massia, S. P., Hubbell, J. A. Human endothelial cell interactions with surface-coupled adhesion peptides on a nonadhesive glass substrate and two polymeric biomaterials. J. Biomed. Mat. Res. 25, 223-242 (1991).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved