Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Akış Koşullarında İnsan umbilikal ven endotel hücreleri ve nötrofil Transmigration Çalışmaları Kullanılması İzolasyonu
Bu Makalede
Özet
Bu makale ilk umblikal damarlar, insan endotel hücreleri izole etmek için bir yordam açıklanır ve sonra akış koşullarında nötrofil göçü incelemek için bu hücreleri nasıl kullanılacağını gösterir. Camın optik karakteristikler ile bir polimer elde edilen bir düşük hacimli akış odası kullanılarak, nadir hücre popülasyonlarının canlı-hücre flüoresan görüntüleme da mümkündür.
Özet
Nötrofiller beyaz kan hücresi en bol türüdür. Bunlar doğuştan gelen bağışıklık sistemi 1 önemli bir parçasını oluştururlar. Akut iltihap süresince, nötrofiller yaralanma siteye geçirmek için ilk enflamatuvar hücreler. Arasında nötrofil üçüncü, haddeleme, yapışma ve hicret, ikinci, mikrovasküler yapısal değişiklikler ve kan dolaşımından plazma proteinlerine kaçmasını önlemek için; bir yaralanma siteye nötrofil alımı kan akışını arttırmak için kan damarları, ilk dilatasyon içeren bir basamaklı bir işlemdir endotel; yaralanma 2,3 yerinde nötrofil ve dördüncü birikimi. In vivo ve in vitro geniş bir dizi bu işlemler 4 çalışma sağlamak için gelişmiştir. Bu yöntem, insan endotel hücreleri arasında nötrofil göçü üzerinde duruluyor.
Nötrofil göçü rol oynayan moleküler süreçleri inceleyerek Bir popüler yöntemi, insan n kullanırbirincil insan umbilikal ven endotel hücreleri (HUVEC) 5 ile etkileşim eutrophils. Nötrofil izolasyon başka bir yerde 6 görsel olarak tarif edilmiştir, dolayısıyla bu makalenin HUVEC izolasyonu için yöntem gösterecektir. Izole edilip birleştiği yetiştirilen, endotel hücreleri yapışma ve aktivasyon moleküllerinin uyarılması sonucu aktive edilir. Örneğin, artan E-selektin ve IL-8 ifadesi 7 TNF-α sonuçları gibi sitokinler ile endotel hücrelerinin aktivasyonu. E-selektin aracılık nötrofiller ve IL-8 aracılık aktivasyonu ve nötrofil firma yapışma yakalama ve haddeleme. Yapışma nötrofiller göçmek sonra. Âlemden (endotelyal hücre kendisi üzerinden) transcellularly paracellularly oluşabilir (endotelyal hücre kavşak aracılığıyla) veya. Çoğu durumda, bu etkileşimlerin damar 7,8 bulundu akış koşullarda oluşur.
Paralel plakalı akışı odası yaygın olarak kullanılan bir sistem olduğunu mihidrodinamik kayma in vivo ve in vitro bulundu 9,10 akış koşullarında nötrofil işe alınma çalışması sağlar. stresleri mikrofon Bazı şirketler paralel plakalı akışı odaları üretmek ve her avantaj ve dezavantajları var. Flüoresan görüntüleme gerekli ise, cam veya optik olarak benzer bir polimerin kullanılması gerekmektedir. Endotel hücreleri cam üzerinde iyi büyümez.
Burada hızlı yapışma ve insan endotel hücrelerinin büyümesini destekler ve karşılaştırılabilir optik niteliklere sahip bir polimer düşük hacimli ibidi kanalı slayt kullanarak nötrofil göçü faz-kontrast, DIC ve floresan görüntüleme için kolay ve hızlı bir yöntem sunmak cam. Bu yöntemde, endotel hücreleri yetiştirildi ve bir ibidi μslide uyarılmış. Nötrofiller akış koşullarında tanıtıldı ve hicret değerlendirildi. Kavşaklarından Floresan görüntüleme karşı paracellular ölçüde gerçek zamanlı belirlenmesi etkintranssellüler âlemden.
Protokol
1. İnsan Vasküler Endotelyal Hücre İzolasyonu ve Bakım
- Insan kan ve doku çalışırken Düzey 2 biyogüvenlik prosedürleri kullanılmalıdır. Kullanımı makas plasenta kablosunu kesip sonra yakından kan pıhtılaşması ve doğum sırasında kordon sıkma kaynaklanan zararlar için kordon inceleyin. Kes ve kordon bu kısımlarını atın.
- 50 mg Kollajenaz içeren bir tüp içine sıcak kord tampon 50 ml dökülerek 1 mg / ml taze kollajenaz çözeltisi hazırlayın.
- Steril eldiven içine değiştirin ve sterilize künt kanüller, kordon kelepçeler, makas, üç yollu dur-musluklar ve laminer akış kaputu gazlı bez içeren bir otoklavlanmış alet tepsisine açın.
- Iki arter ve kablosunu tek ven mevcut tanımlayın. Arterler küçük ve büyük damar ve kanüle kolay iken, sıkı dar olma eğilimindedir. Damardan kan temizlemek için hafifçe bağlı iki yollu bir kanül takın ipozisyonda sıkıca tutmak için kanül etrafında mengene ven ve yer nGoogle'a bir ucunu. Ven yoluyla kablosunu tampon serpmek. Akış netleşene kadar tekrarlayın ve sonra kablosunun ucunu kelepçe.
- Damar içine yayma kollajenaz, musluk kapatın, 10 dakika boyunca ılık kablosu tampon ve inkübe içeren bir behere kablosunu yerleştirin. 10 dakika sonra, kordon kaldırın ve yavaşça ven lümeni gelen endotel hücreleri gevşetmek için kordon masaj yapın. Endotel hücre ortam (ECM) içeren tüp içine akmasını çözeltisi. Iki kez kalan hücreleri çıkarmak için kordon tampon ile yıkayın. Aynı tüpe çözüm boşaltın.
- Pelet 10 dakika endotel hücreleri için 350 xg'de hücreleri santrifüjleyin.
- Süpernatantı ve pelet için ECM 10 ml ekleyin. Yavaşça ECM içinde tekrar süspansiyon hücreleri, daha sonra% 0.2 jelatin ile önceden kaplanmış bir şişeye T75 hücre transfer. Jelatin ile ön-kaplama 37 ° C'de en az 1 saat süreyle yapılmıştır 37 de hücrelerin büyümesine ve 5 ° C% 2 CO.
- Ertesi gün, yavaşça herhangi bir kırmızı kan hücreleri daha sonra süpernatant kaldırmak ve sıcak Hank'in dengeli tuz solüsyonu (HBSS) ile yıkayın çıkarmak için şişeyi sallayın. HBSS çıkartın ve ılık ECM 10 ml ile hücreleri besler. Kırmızı kan hücreleri çıkarıldı emin olmak için, hücreleri mikroskopta inceleyin. Endotel hücreleri birleştiği ve morfoloji derecesini değerlendirin. Bu aşamada endotel hücreleri vakuollerinin belirtisi uzamış olmalıdır.
- Hücreler 1 mM EDTA içeren tripsin bir% 0.08 çözümünü kullanarak konfluense, sonra bölmek hücreleri ulaşana kadar üç günde ortamı değiştirmek için devam edin. İstediğiniz yemekleri Plaka endotel hücreleri% 0.2 jelatin ile önceden kaplanmıştır. Hücreler 3-6 gün izdiham ulaşmalıdır.
- % 0,2 jelatin ile her odası ibidi odaları, ön kat kullanırken. Kaldırmak aşırı 1,5 X haznesine ECM içinde süspansiyon endotel hücreleri 10 6 / ml ilave sonra jelatin ve fibronektin ve. Her gün medya değiştirin c kadaronfluent. Hücreler kord bağlı olarak 2-3 gün konfluent olmalıdır.
2. Nötrofiller hazırlanması
- Nötrofiller yoğunluğu santrifüj kullanılarak sağlıklı gönüllü insanların periferik kandan izole edilmiştir. Nötrofil izolasyonu için görsel bir gösteri ile ayrıntılı bir protokol, bu derginin 6 önceki sayısında bulunabilir. % 0.5 'i, insan albumin içeren HBSS içinde 1x10 6 / mL' lik bir konsantrasyonda bir kez izole, Pastör pipetiyle nötrofiller.
3. Ibidi Odası ayarlama
- Bir jelatin kaplı ibidi odasında endotel hücreleri büyümek. Onlar sıkıca konfluent olana kadar faz kontrast mikroskopi kullanılarak her gün bunları inceleyin.
- Yapışma ve aktivasyon moleküllerinin ifadesi arttırmak için endotel hücreleri uyarır. Bu protokolün amaçları için, endotel hücreleri, 37, dört saat boyunca 10 ng / rekombinant TNF-α mL ile stimüle edildi ° C'de ve% 5 CO 2 önceki akış koşullarında görüntüleme için ibidi odası kurma.
- Mikroskobu ve görsel olarak boş bir ibidi odalarını kullanarak Wiese ve arkadaşları 11 tarafından açıklandığı gibi şırınga pompası hazırlayın.
- Bu protokol ve Wiese prosedür arasında önemli farklar ön dolum, hava endotelyal hücrelerin maruziyeti önlemek için hortum 37 tampon muhafaza ° C sıcaklık kaybetme tampon tutmak için PharMed tüp kullanarak ve kullanarak, bir su banyosu kullanarak farklı dahil faz kontrast ve flüoresan ile olsa görüntüleme bağlı mikroskop hedefler.
- Mikroskop kurmak ve boru yakın HBSS, tüm stopcocks dolu ve boş ibidi odasına çıkarın sonra.
- TNF-α içeren ibidi odasına hortuma endotel hücreleri uyarılır bağlayın.
4. Nötrofil İşe Alım ve Transmigration
- Microsc alan endotel hücre monolayer görselleştirin10x faz kontrast objektif kullanarak ope.
- Istenilen kayma gerilmesi de HBSS akışını (genellikle 0.5 ila 2 dyn / cm 2 arasında) çekme ve başlamak için şırınga pompası ayarlayın.
- Üç-yollu durdur-horoz çevirerek izole nötrofiller (1x10 6 / mL) ile HBSS gelen giriş tarafına, anahtarı.
- Bir DVD kaydedici ya bağlı veya doğrudan bilgisayara bağlı bir CCD kamera ile kayıt başlayın. Nötrofiller odası girdiğinizde zamanlayıcı başlayın. Dört dakika nötrofillerin serpmek. Nötrofil süspansiyon 3 mL toplam tek bir deney için yeterli olur.
- Dört dakika sonra, yeni nötrofillerin eki önlemek HBSS geri dönün. Toplam etkileşimleri, haddeleme ve sağlam yapışma için veri istenirse, 10 saniye her biri için görüntü 6 rasgele alanları dakika 4 ile 5 arasında bir 10x faz kontrast objektif kullanarak.
- Bir 40x objektif geçin ve 5 ile 10 dakika arasında bir görüş tek bir alan kaydedin. 10 dakika, toplamakbakış rastgele alanları 5 ila 10.
- Akışını durdurun ve sonraki odasına taşıyın.
5.. Bir Ibidi Odası kullanarak Akım Altında Floresan Görüntüleme
- Bir ilgi floresan prob ile Etiket Gerek endotel hücreleri veya nötrofil. Örneğin, Alexa-[547] ile konjuge edilmiş anti-ve-cadherin antikoru endotel hücre eklemleri canlandırmak için kullanılabilir.
- Diferansiyel girişim kontrast (DIC) ve floresan özellikleri olan bir mikroskop ibidi odası birleştirin. Biz bir kazanı olan bir FluoView 1000 konfokal (Olympus) kullanın. DIC ve floresan iş için tasarlanmış bir objektif kullanarak odaklanın.
- Bölüm 4'te açıklandığı zaman ders takip ederken satıcı tarafından verilen yazılım ile eş zamanlı DIC ve floresan resim al.
6. Nötrofil İşe Analizi
- Hücreleri, haddeleme ve etkileşim analizi Wiese ark 11 tarafından tarif edilir.
- Endotel tek tabakalı 5 saniyelik bir süre içinde birden fazla hücre çapı taşındı nötrofil sayıları saymak yuvarlanarak nötrofillerin yüzdesini ölçmek için. Haddeleme hücrelerin yüzdesi belirlemek için alanda lökositlerin toplam sayısı ile bu sayı böler. Uzantısı olarak, kalan hücreler sıkıca yapışık olarak kabul edilir.
- Nötrofil belirli bir süre içinde gitti ve sonra saniyeler içinde o zaman da bölünerek mesafeyi hesaplayarak nötrofil haddeleme hızı ölçün.
- Hicret şekli değişti ve tek tabakalı 10 altında göç etmiş nötrofil sayısını sayarak belirlenir. Bunlar nötrofiller onlar faz olmanın parlak değiştirmek gerçeği ile tespit zaman zaman tek tabakalı 10 altında faz karanlık olmasının tek tabaka üstüne. Nakledildi hücrelerin sayısı görüş alanı içindeki toplam hücrelerin yüzdesi olarak ya da ham bir uyuşmuş olarak ifade edilebilirbirim alan başına nakledildi hücrelerin er. Bu model sistem olarak, nötrofillerin tipik olarak% 50 10 dakika sonra göçmek.
7. Temsilcisi Sonuçlar
Unstimulated endotelyal hücreler nötrofil göçünü desteklemez. Buna karşılık, nötrofil haddeleme, firma yapışma ve geçişe TNF-α sonuçları ile endotel hücreleri uyarmak. Bu verilerin bir örneği, Şekil 1 ve 2 'de gösterilmiştir. Şekil 1A TNF-α-uyarılmış endotel hücreleri ile etkileşen nötrofiller gösterir. Bu etkileşimler endotel hücreleri ile etkileşim nötrofil sayısı gibi (Şekil 2) sıkıca yapışık veya nakledildi, haddeleme nötrofil sayısı açığa ölçülebilir. Nötrofil göçü hücre kavşaklarda veya endotel hücreleri kendileri aracılığıyla oluşabilir. Bu iki durum arasında ayrım yapmak, endotelyal hücreler bir anti-VE-c ile etiketlenir adherin antikor ve hicret (Şekil 1B ve C) paracellularly veya transcellularly meydana olarak kaydedilecektir. Bu modelde, hemen hemen tüm âlemden 7 paracellular olduğunu.
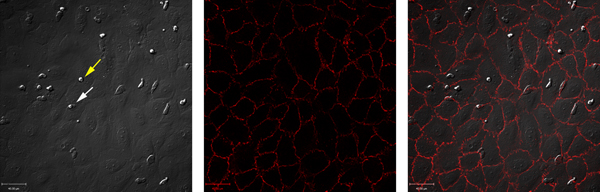
Şekil 1. Bir ibidi odalarını kullanarak akış koşullarında Eşzamanlı DIC ve floresan görüntüleme. (A) DIC görüntü taze insan umbilikal ven endotel hücreleri arasında göç eden insan nötrofil izole. Sarı ok ucu yapışık, nötrofil gösterir; beyaz ok ucu bir transmigrating nötrofil gösterir. (B) endotel hücre kavşaklar Alexa-[547] ve görüntülü konjuge anti-VE-cadherin antikor ile boyandı. (C) Kanal A ve B bu model neredeyse tüm transmigrating paracellular olduğunu ifşa yerleşim gösterir. büyük rakam görmek için buraya tıklayın .
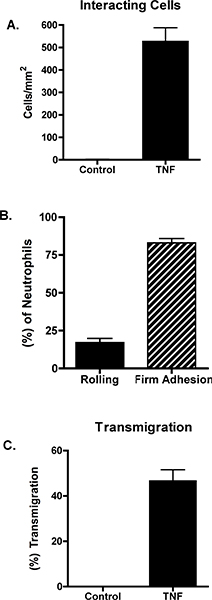
Şekil 2. Endotel hücreleri unstimulated bırakılan veya TNF-α 10 ng / ml ile uyarıldı. 4 saat sonra, paralel bir plaka akış odası toplandı ve nötrofiller 1 dyn / cm 2 azından boyunca perfüze edilmiştir. (A) Nötrofil etkileşimleri incelenmiş ve NIH ImageJ yazılımı kullanılarak ölçüldü. Toplam etkileşen hücreleri (B) haddeleme, sıkıca yapışık veya (C) transmigrating olarak karakterize edilmiştir. Veri 3 ila 5 deneyler ortalama + SEM temsil eder. Paneller A ve C kontrolü ve TNF arasındaki fark anlamlıydı (p <0,001).
Tartışmalar
Araştırmacılar rutin nötrofil göçünü ve hicret incelemek için farklı vasküler yatak endotel hücreleri kullandık. Örnekleri arasında, bunlarla dermal mikrovasküler endotel hücreleri 12, insan göbek ven 10 den karaciğer sinüzoidal endotel hücreleri 13 ve endotelyal hücreler, bunlarla sınırlı değildir. Aralarında HUVEC çünkü izolasyon ve durumu kendi göreceli kolaylığı geniş popülerlik kazandı. HUVEC in vivo olarak ortaya çıkan birçok e...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Onu teknik yardım için Bayan Lailey;; ve insan kordon sağlamak için Calgary, AB içinde Foothills Hastanesi'nde 51 birim Biz Dr Pina Colarusso görüntüleme ve görüntü analizi ile yardım için Canlı Hücre Görüntüleme Tesis teşekkür ederim. Dr KD Patel bir Alberta yenilikler yaratır şudur: Sağlık Çözümleri Scientist. Bu çalışma, Yenilikçilik ve Alberta Bilim ve Araştırma Kurumu için Kanada Vakfı Sağlık Araştırma ve altyapı ve ekipman hibeleri için Kanada Enstitüleri bir işletme hibesi tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif ve Ekipmanları | Şirket | Katalog numarası | Yorumlar |
| Kollajenaz Tip 1 | Worthington | 4197 | |
| Kordon tampon | Kompozisyon: 7.4 pH'da 1mM NaH 2 PO 4/2 Na HPO 4 tampon 140 mM NaCl 4 mM KCl 10 mM D-glukoz | ||
| Endotel Hücre Medya (ECM) | Penisilin 100 adet streptomisin 100 mikrogram ve L-glutamine/ml 0,3 mg% 16 insan serumu kartal tuzları ile M199 | ||
| M199 | GIBCO | 31100-035 | |
| Penisilin Streptomisin Glutamat (100X) | Invitrogen | 10378-016 | |
| Ibidi odaları | Ibidi | 80606 | |
| TNF-α | Prepro Tech | 300-01A | |
| Human Albumin% 20 çözüm | İkizler Bioproducts | 800120050 | |
| + Ve Mg 2 Ca 2 olmadan HBSS + | Sigma | H2487-10X | |
| Ca 2 + ve Mg 2 + HBSS | Sigma | H1387-10X |
Referanslar
- Nathan, C. Neutrophils and immunity: challenges and opportunities. Nat. Rev. Immunol. 6, 173-182 (2006).
- Diacovo, T. G. Neutrophil rolling, arrest, and transmigration across activated, surface-adherent platelets via sequential action of P-selectin and the beta 2-integrin CD11b/CD18. Blood. 88, 146-157 (1996).
- Ley, K. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat. Rev. Immunol. 7, 678-689 (2007).
- Petri, B. Endothelial LSP1 is involved in endothelial dome formation, minimizing vascular permeability changes during neutrophil transmigration in vivo. Blood. 117, 942-952 (2011).
- Chavakis, T. The junctional adhesion molecule-C promotes neutrophil transendothelial migration in vitro and in vivo. J. Biol. Chem. 279, 55602-55608 (2004).
- Oh, H., Siano, B., Diamond, S. Neutrophil Isolation Protocol. J. Vis. Exp. (17), e745 (2008).
- Liu, Y. Regulation of leukocyte transmigration: cell surface interactions and signaling events. J. Immunol. 172, 7-13 (2004).
- Alcaide, P. Neutrophil recruitment under shear flow: it's all about endothelial cell rings and gaps. Microcirculation. 16, 43-57 (2009).
- Jutila, M. A. Measurement of neutrophil adhesion under conditions mimicking blood flow. Neutrophil Methods and Protocols. 412, 239-256 (2007).
- Cuvelier, S. L., Patel, K. D. Studying leukocyte rolling and adhesion in vitro under flow conditions. Basic Cell Culture Protocols. 290, 331-342 (2005).
- Wiese, G., Barthel, S. R., Dimitroff, C. J. Analysis of Physiologic E-Selectin-Mediated Leukocyte Rolling on Microvascular Endothelium. J. Vis. Exp. (24), e1009 (2009).
- Petzelbauer, P. Heterogeneity of dermal microvascular endothelial cell antigen expression and cytokine responsiveness in situ and in cell culture. J. Immunol. 151, 5062-5072 (1993).
- Bonder, C. S., Kubes, P. Modulating leukocyte recruitment to splanchnic organs to reduce inflammation. Am J Phys - Gastrointestinal and Liver Phys. 284, G729-G733 (2003).
- Cuvelier, S. L. Eosinophil adhesion under flow conditions activates mechanosensitive signaling pathways in human endothelial cells. J. Exp. Med. 202, 865-876 (2005).
- Massia, S. P., Hubbell, J. A. Human endothelial cell interactions with surface-coupled adhesion peptides on a nonadhesive glass substrate and two polymeric biomaterials. J. Biomed. Mat. Res. 25, 223-242 (1991).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır