Method Article
一个协议,用于基于蛋白质 - 蛋白质相互作用的鉴定
摘要
我们提出了一个快速(的定量免疫共沉淀结合击倒)的方法,前面介绍的区分真假蛋白质 - 蛋白质相互作用的变化。我们的做法是根据 15N代谢标记,ATP,免疫沉淀,并定量质谱的存在/不存在的蛋白质 - 蛋白质相互作用的亲和力的调制。
摘要
许多生物过程在细胞内蛋白质 - 蛋白质相互作用的基本。因此,他们的特性中起着重要的作用,目前的研究和大量的方法,他们的调查的情况1。蛋白质-蛋白质相互作用往往是高度动态的,可能取决于亚细胞定位,翻译后修饰的蛋白环境2。因此,他们应该在自然的环境中进行调查,免疫共沉淀的方法的方法选择3。无目标的方式有针对性的方法,或通过质谱法(LC-MS/MS)的免疫共沉淀的互动合作伙伴确定。后一种策略往往带来不利影响,大量的假阳性发现,主要来自现代质谱仪的高灵敏度,自信地检测非特异性沉淀蛋白质的痕迹。一个recen吨来克服这个问题的方法是基于这样一种想法,减少量的特异性相互作用伙伴将共沉淀物,而与给定的目标蛋白的细胞浓度降低通过RNAi非特异性沉淀蛋白质的量应该是不受影响。这种做法,被称为快速为定量免疫共沉淀结合击倒4,采用稳定同位素标记的氨基酸在细胞培养(SILAC)和MS量化的从野生型和敲株免疫沉淀的蛋白质。以1:1的比例发现的蛋白质可以被认为是污染物,从野生型的靶蛋白的特异性相互作用伙伴沉淀富集。虽然创新,QUICK不承担一些限制:第一,SILAC成本密集型的和有限的,理想的做法是营养缺陷型的精氨酸和/或赖氨酸的生物体。此外,当供给重精氨酸,精氨酸 - 脯氨酸的相互转换结果在ADDIT有理质量位移的每个脯氨酸肽,稍微冲淡了重与轻的精氨酸,这使得量化比较繁琐的,不准确的5,6。其次,QUICK要求抗体滴定,使得它们不会成为击倒突变体的提取物与目标蛋白的饱和。
在这里,我们介绍一种改良的快速协议,它克服了上述局限性,快速取代SILAC为15 N代谢标记,利用RNA干扰技术敲除蛋白质-蛋白质相互作用的亲和调制取代。我们展示了适用本协议使用的单细胞绿藻莱茵衣藻作为模式生物为目标蛋白7( 图1)的的叶绿体HSP70B伴侣。是已知的HSP70s互动的与特定的合作伴侣和基板仅在ADP状态8。我们利用该特性作为一种手段来验证的具体与核苷酸交换因子CGE1 9,互动的HSP70B。
研究方案
1。抗体吸附
- 称取120毫克的15毫升锥形管(Falcon)中,在蛋白A Sepharose。 15毫克蛋白A琼脂糖需要为每个免疫沉淀(IP),这个量是足够的八组。加入5毫升0.1M磷酸盐缓冲液(pH 7.4)中,并让蛋白A Sepharose溶胀30分钟,在4℃下
(请注意,所有步骤,从这个角度上需要进行了手套,以避免污染与角蛋白和冰,以避免蛋白质降解/复杂的解离。)
- 在1,000 xg和4℃下沉淀溶胀蛋白A Sepharose离心60秒。小心除去上清液,并重新悬浮在5ml 0.1M磷酸缓冲液(pH值7.4)的珠粒。重复此步骤三次彻底洗的珠子。
- 在最后的离心步骤,除去上清液,留下约0.5毫升的磷酸盐缓冲液。添加0.9毫升0.5 M磷酸盐缓冲液(pH7.4),400微升亲和纯化的针对目标蛋白(这里HSP70B),和16μl对照蛋白的抗(这里CF1β)的初级抗体(50微升每IP)。填写DDH 2 O至总体积为5 ml。
(注意,亲和纯化的抗体应使用,以减少污染的非特异性的IgG与纳米-LC-MS的分析,这将干扰-一个协议,请参阅Willmund等人(2005)10。CF1β作为装载控制沉淀和被选择因为它是丰富的,细胞裂解后,呈现可溶性和膜组分中,可替换地,可以使用污染蛋白水平正常化为不相等的加载。)
- 允许吸附的IgG蛋白A Sepharose珠期间的管辊(CAT RM5W,36转)上在25℃下孵育1小时。
- 在1,000 xg和4℃下沉淀的蛋白A Sepharose珠离心60秒。小心地取出上清液和resuspend5毫升0.1M的硼酸钠缓冲液(pH值9.0)中的小珠。重复此步骤三次,以彻底清除胺,解渴的交联剂。
- 称取25.9毫克的新鲜,的固体dimethylpimelimidate和重新悬浮在0.1M的5毫升硼酸钠缓冲液(pH9.0)中,得到最终浓度为20mM。蛋白A Sepharose磁珠将此解决方案。
- 允许的IgG交联蛋白A在25°C为30分钟,管辊上。
- 离心60秒,以1,000 xg和4℃下沉淀的珠。小心除去上清液,并重新悬浮在5ml 1M的Tris-HCl(pH值7.5)中,以便淬灭自由交联剂珠粒。重复此步骤一次,孵育2小时,在25°C或12-24小时,在4°C管辊上。
- 可选:如果蛋白A Sepharose磁珠连接到的IgG不直接使用IP,存储长达一个星期是可能的。对于这一点,离心60秒在1000 XG和4°C颗粒的珠子,小心取出supernatant重悬珠在5ml 0.1M磷酸缓冲液(pH 7.5)中,含有0.02%叠氮化钠和储存于4℃直至进一步使用。
2。细胞裂解,交联和样品制备
- 长出两种衣藻培养培养基中含有7.5 mM的14的NH 4 Cl或NH 4 Cl作为氮源〜5×10 6细胞/ ml的密度15。细胞需要通过至少十代的完整的标签。在这里,细胞生长photomixotrophically在TAP介质11上的旋转摇动器在25℃下连续照射30μE米-2 s -1的白色光()。
- 两等份各14个N-15 N-标记的细胞传送至4的GSA的管和收获细胞,由4 -在4,000 xg和4℃(收获各等分试样的细胞数量取决于蜂窝的目标浓度 min离心蛋白质和需要确定Ëmpirically提前,以确保有足够的靶蛋白被沉淀。一个好的起点是10 9个细胞,每等份, 即 5×10 6个细胞/毫升,200毫升的文化。)
仅用于交联:蛋白质复合物的情况下将被交联到IP之前,细胞需要被清洗,以除去存在于培养基中的胺。对于这一点,在40毫升的预冷却的KH液重悬细胞(的20mM HEPES-KOH(pH值7.2),80 mM KCl中),并将它们传送到50毫升Falcon管中。离心60秒在1,000 xg和4℃。重复此步骤一次。 - 悬浮细胞在2毫升的裂解缓冲液(20mM的HEPES-KOH(pH 7.2)中,1毫摩尔MgCl 2,10 mM KCl中,154 mM氯化钠)预冷却至4℃,并将它们传送到15毫升Falcon管中。收集剩余的细胞加入1ml裂解缓冲液,在GSA管中。加入50μl的25×蛋白酶抑制剂和12.5微升1 M的MgCl 2(终浓度为3.5 mM的),每个等分试样。
- 加入150微升裂解缓冲液,12.5微升1 M的ATP,833微升270 mM的磷酸肌酸和7微升5微克/微升的肌酸磷酸激酶(最终浓度为2.5mM的ATP,45 mM的磷酸肌酸,和7微克/毫升的肌酸磷酸激酶)的一个含有14 N-15 N-标记的细胞(这些是+ ATP等分试样)的等分试样。
- 加入930微升裂解缓冲液和70μl1 U /μl的腺苷三磷酸双磷酸其他含有14的N-15 N-标记的细胞(这些是-ATP的等分试样)的等分试样。
- 孵育在25℃下2分钟的管辊建立ATP消耗及ATP的充满状态。如果在交联步骤被省略,添加另一个1毫升裂解缓冲液中。
仅用于交联:是瞬态的情况下,调查的蛋白质-蛋白质相互作用,它最好是由交联步骤中捕捉到他们。对于这一点,加入500微升的20mM二硫代双(琥珀酰亚胺基丙酸酯)(DSP)溶解在DMSO中(终浓度为2mM的)到e的ACH管直接前超声。 - 超声波清洗4次,每次20秒的冰,,打破细胞与20秒的冷却休息,在两者之间。 (我们使用的Bandelin Sonoplus的HD2070与KE76尖为75%和60%占空比的输出控制。其他机械/设备/提示了必要的设置,以确保完整的细胞裂解和避免溢出,需要事先确定的。 )
仅用于交联:允许蛋白质复合体进行交联,通过在4℃下孵育1小时的管辊上。交联后,用500μl1 M甘氨酸和孵育补充每个管的管上辊,其用于另一个15分钟,在4℃,淬灭自由交联剂。 - 准备四个6毫升蔗糖垫中(20mM HEPES-KOH(pH值7.2),0.6M蔗糖)SW41 Ti薄膜壁管(Beckman Coulter公司产品编号:344059)中,小心地将整个〜5.5毫升的细胞裂解物中到蔗糖靠垫裂解缓冲液(平衡)和20万XG 30分钟和4°C,在SW41钛鼓式离心机河
- 转移分为四个15毫升Falcon管中(避免蔗糖座垫传输份)含有可溶性的蛋白质复合物的梯度的顶部,添加350微升10%的Triton X-100至终浓度为0.5%,对他们每一个,混合仔细添加裂解缓冲液至总体积7毫升。
(每个可溶性细胞提取物的70微升转移至新的1.5-ml锥形管(Eppendorf管中),并添加70微升2×SDS样品缓冲液(4%SDS,125毫摩尔Tris-HCl(pH值6.8)中,20%甘油,10 %2 -巯基乙醇)进行SDS-PAGE和免疫印迹分析。) - 丢弃的蔗糖垫和膜颗粒悬浮在3毫升的裂解缓冲液。添加至每1毫升10%的Triton X-100至终浓度为2%,在冰上超声溶解颗粒,并加入裂解缓冲液各5毫升的总体积。
- 准备4个6毫升蔗糖垫SW41钛薄壁管,奠定〜5毫升溶解膜小心地从步骤2.10的蔗糖垫子上,在200,000 xg和4℃下,在SW41 Ti转子离心30分钟。
- 传输分为四个15毫升Falcon管中含有膜蛋白质复合物的梯度的顶部,并添加到新鲜的裂解缓冲液(含2%的Triton X-100)(传输每个可溶性细胞提取物的70微升最终体积为每个7毫升。 Eppendorf管中并加入70微升2×SDS样品的每个进行SDS-PAGE和免疫印迹分析。)
3。免疫沉淀
- 颗粒蛋白A Sepharose磁珠,加上抗体(1.8或1.9)的60秒,在1000 XG离心和4°C,小心地取出上清,重悬珠裂解缓冲液4毫升。重复此步骤两次裂解缓冲液中平衡珠。
- 填补8毫升用裂解缓冲液和1毫升的悬浮液转移到各8个15毫升Falcon管含有水溶性或膜的蛋白复合物充满从ATP和ATP消耗14 N和15 N标记的细胞(从步骤2.9和2.12)。
- 在4℃下孵育2小时以沉淀蛋白质配合物的管辊。
- 颗粒珠由一个60秒的离心在1,000 xg和4℃,并丢弃上清液。珠粒上留下一个小体积的液体,以便传输。
- 将珠粒转移从每个Falcon管中,以1.5-ml锥形管(Eppendorf管中)。要收集Falcon管中的所有剩余的珠,添加另外0.8毫升裂解缓冲液为每个含有0.1%Triton,涡轻轻地,离心60秒在1,000 xg和4℃,并转移缓冲与残留的Eppendorf管中的珠。管交换是必要的,以防止从蛋白质的污物附着到塑料壁。
- 颗粒珠由一个15秒的离心16,100 XG和4°C,小心地取出上清液重悬珠裂解缓冲液130毫升含0.1%Triton。重复此步骤两次裂解缓冲区FER含有Triton两次裂解缓冲液缺乏的Triton彻底清洗的珠子。珠粒上留下一个小体积的液体,以便传输。
- 再次珠转移到新的1.5毫升的Eppendorf管,,去除蛋白质秉承的塑料墙。洗旧管1 ml裂解缓冲液中缺乏的Triton,将所有剩余的新鲜的管珠。
- 离心机在16,100 xg离心15秒和4°C,删除先用一个正常的移液管的上清液,然后完全除去任何剩余的上清液,用50微升的Hamilton注射器。
4。样品制备nano-LC-MS/MS
- 向每个试管中加入100微升新鲜制备的洗脱缓冲液(8M尿素,25 mM的NH 4 HCO 3),使用100微升洗脱缓冲液,以800rpm的转速,以洗掉粘附Hamilton注射器和孵育10分钟,在一个恒温的珠和65℃,和另外的20分钟,在30℃的(一个更完整洗脱结合的蛋白质是通过2%SDS和随后的沉淀用80%丙酮洗脱)。
- 在16,100 xg和25℃下离心15秒上清转移到新鲜的管,用50μL微量注射器。
- 到珠粒中加入50μl的洗脱缓冲液,使用50微升洗脱缓冲液洗掉珠粘Hamilton注射器和重复孵化和离心步骤4.1和4.2,分别。游泳池相应的洗脱液。
(30微升的洗脱物转移到新鲜的Eppendorf管中,加入30μl的2×SDS样品缓冲液中进行SDS-PAGE和免疫印迹分析为每个)。 - 合并洗脱的沉淀物从+ /-ATP处理,14 N和15 N-标记的可溶性蛋白和膜蛋白如下:
120微升15 N / + ATP和120微升14 N /-ATP
120微升14 N / + ATP和120微升15 N /-ATP
120微升15 N / + ATP和120微升14 N /-ATPBR /> 120微升14 N / + ATP和120微升15 N /-ATP - 加入1.5微升新鲜制备的1 M DTT至终浓度为6.5 mM的四种组合中的每一个,以减少二硫键(包括那些在交联剂),并温育30分钟,在25℃下
- 加入10.5微升新鲜制备的0.6M的碘乙酰胺最终浓度为25 mM的carboxymethylate硫醇和减少在黑暗中20分钟,在25℃下孵育。
- 加入256微升40毫米NH 4 HCO 3和4μL赖氨酸-C(0.1微克/微升),用封口膜密封管,并培养一个旋转轮上至少有16个小时通宵在37°C。
- 加入470微升的20mM NH 4 HCO 3,加入10μl的100%乙腈(至终浓度为1%)和8μl胰蛋白酶珠,并孵育至少16小时,在37℃下的旋转轮
- 离心机在16,100 xg离心5分钟,4℃,并转移上清至新的2 - 毫升的Eppendorf浴盆ES。洗旧管与50微升的20mM NH 4 HCO 3,0.5%乙酸,与第一上清液和游泳池。
- 脱盐,准备了两盘,用注射器针头从Empore C 18材料,将它们放置在200微升移液器吸头,国产C 18-StageTips的。在这种方式准备200-μL的提示。打孔到4个2毫升的Eppendorf管中插入提示的盖子。
- 前提条件的C 18-,用50μl溶液B(80%乙腈,0.5%乙酸)StageTips。离心机在800克3分钟和25℃下
- 平衡的C 18-StageTips用100微升的溶液A(0.5%乙酸,2%乙腈)。离心机在800克3分钟和25℃下重复此步骤一次。
- 装入100微升上清液从胰蛋白酶消化(4.9)上的C 18-StageTips和离心机在800克3分钟和25℃下重复此步骤,直到被应用到完整的上清列。
- 洗净的C 18 - StageTips离心3分钟用100微升的溶液A在800克和25℃。重复此步骤两次。
- 洗脱到新鲜的1.5 ml Eppendorf管中的胰蛋白酶肽与50μl的溶液B中离心机在800克3分钟和25℃下的重复此步骤一次。的速度完成,真空干肽。
- 可选:密封封口膜并储存在-80°C至Eppendorf管继续使用。
- 重悬干燥用20μl解的肽A和在冰上至少1小时,中断由两个超声波仪,浴中的15分钟,孵育孵育。在16,100 xg和4℃下离心20分钟,并适用上清液nano-LC-MS/MS。
5。代表性的成果
如示例性地示出为14 N标记的细胞提取物,在图2A中,HSP70B CGE1几乎完全本地化的可溶部分,独立的ATP状态。在相反,CF1β定位于可溶性和膜富集的部分,,超声剪的一部分,它位于膜的CFØ,因此,作为加载控制两个组分。如在图2B中所示,相似量的HSP70B与抗-HSP70B抗体沉淀源自14 N-15 N-标记的可溶性提取物,独立的ATP状态。相反,只有很少HSP70B原产从ATP贫膜组分与稍大的量相比ATP充满馏分从膜组分的沉淀,因此证实先前的结果9。没有CGE1沉淀HSP70B ATP充满可溶性或膜组分,而大量的CGE1共沉淀与HSP70B从ATP耗竭的可溶部分,和小ATP耗尽膜组分。
也观察到的相互作用CGE1与仅在ADP状态HSP70BMS分析:在图3中,代表MS1光谱HSP70B CGE1从沉淀的肽从可溶性细胞提取物与HSP70B抗血清产生被示出。在图3A中所示的实验中,析出物,在14 N标记的缺乏ATP和15的N-标记的含有ATP的提取物的提取物的混合物。虽然重和轻的HSP70B肽标记的形式以相等的强度进行检测,只有光标记形式的CGE1肽(从-ATP提取)被发现。示在图3B中相同的肽从反HSP70B的沉淀来自往复标记的可溶性细胞提取物的混合物的。因此,这个时候只重标记的形式CGE1肽(从-ATP提取物)检测,而这是再次的情况下都,光和重标记HSP70B的肽。
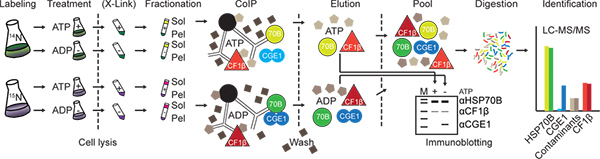
图1。实验的工作流程。细胞代谢标记,14 N和15 N的至少10代,收获和供给或从ATP耗尽。细胞裂解后的蛋白质复合物,可任选被交联的(X-链接)与DSP。然后将裂解的细胞中分离可溶性(溶胶)和膜富集(贝利)馏分的。靶蛋白(这里HSP70B)和一个控制蛋白(这里CF1β)耦合到蛋白A琼脂糖珠(黑色)的特异性抗体的免疫沉淀。清洗后,沉淀的蛋白质被洗脱,可直接通过免疫印迹分析,或相应的14 N和15 N标记的分数+ ATP和ATP的状态池,消化,并分析nano-LC-MS/MS。在这里所示的例子的情况下的15个 N-标记的馏分从ATP耗尽。因此,标记重标记(暗颜色的强度的比率)来点亮(光色)从控制蛋白质的肽(CF1β),靶蛋白(HSP70B)和非特异性结合的污染物应该是围绕一个,而这个比例是非常高的蛋白质,特别是与目标的蛋白(CGE1)交互。 点击此处查看大图 。

图2。一个分析的输入为HSP70B免疫沉淀总蛋白提取水溶性(SOL)和富氧膜(PEL)部分耗尽或补充三磷酸腺苷(ATP)ATP和ATP再生系统(ATP)。 0.01%的蛋白提取物在10%SDS-聚丙烯酰胺凝胶上进行分离,并通过免疫印迹法进行了分析HSP70B,相对装载控制CF1β和CGE1蛋白水平的乙分析免疫沉淀物。HSP70B进行免疫沉淀从14 N-和N-15标记的可溶性和的富膜细胞提取物含有或缺乏ATP。 3.3%的免疫蛋白相应的10%SDS-聚丙烯酰胺凝胶和HSP70B水平和CGE1相对加载的免疫印迹分析控制CF1β被分离。 点击此处查看大图 。
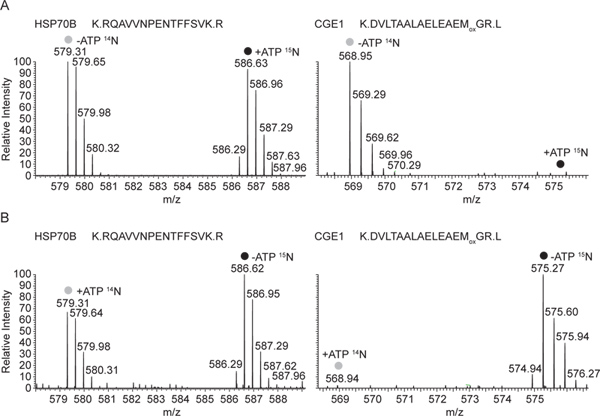
图3。全MS谱图,14 N和15 N标记的肽,对应于-ATP和+ 甲代表质谱HSP70B,从反-HSP70B的和CGE1肽免疫沉淀上进行混合的可溶性级 分(14个N-ATP / 15 N + ATP)。 ATP的状态,分别示从HSP70B和共同免疫沉淀CGE1的。这两种肽三重充电,HSP70B肽含有22个氮原子,CGE1 PEPTIDE 19,对应于7.33和6.33 M / Z的质量位移,分别从往复的实验(14 N + ATP / 15 N-ATP),B代表质谱 。全MS谱相同的14 N和15 N标记肽段,在这里+ ATP和ATP,分别从HSP70B和免疫沉淀的合作CGE1。 点击此处查看大图 。
讨论
我们最近推出了两项改进的快速方法:为捕获瞬态蛋白质-蛋白质相互作用(QUICK-X),交联步骤和控制沉淀正常化不平等的沉淀效率。在这里,我们提出了一个协议,包含更多的改进的QUICK:第一,我们用SILAC 5 15 N代谢标记。它的优点是,15 N代谢标记是便宜得多的SILAC 15 N,如果是简单的无机盐。此外,用15 N代谢标签QUICK可以施加到生物体的原养型可用于所有的氨基酸,,类似大多数植物,真菌和细菌。最后,精氨酸-脯氨酸的相互转换固有的SILAC 5,6不提出一个问题15 N标记的肽进行定量。为15 N蛋白组学数据的定量评估合适的工具的例子是MSQUANT 12或IOMIQS 13。
第二,我们引入亲和调制作为一个装置,用于具体地在一个样品中,与另一个与一个给定的靶蛋白相互作用的蛋白质的量降低。这种方法的优点是,它绕过敲除突变体的建造,这对于一些模型系统是难以生成,或在所有必需的靶蛋白的情况下,无法生成。此外,它避免了可能发生作为敲减的靶蛋白的细胞响应的差异蛋白质表达所引起的误解:如果其他蛋白质下调和交叉反应的抗血清用于免疫沉淀,它们将被解释真正的互动合作伙伴的目标蛋白。最后,亲和调制废除找到一个适当的抗体的抗原比的需要。
虽然我们我们的协议作为模式生物衣藻,它可以容易地适应于任何其他有机体,可以在细胞培养中生长,并且能够使用铵盐或硝酸盐作为氮源。亲和的蛋白质复合物的调制由ATP / ADP可能直接被施加到其他的分子伴侣,其依赖于ATP的状态与基板和队列的蛋白质的相互作用,,像GroEL/HSP60/Cpn60或HSP90分子伴侣系统14,15,或以任何其他系统约束力的亲和力调制ATP。亲和调制也应该工作由特定的药物,如根赤壳菌素或格尔德霉素在HSP90的系统15的情况下被改变的情况下蛋白质的相互作用之间的亲和度。
我们的协议的明确的限制是它需要已知是敏感到一个特定的处理/调制其亲和性的伴侣蛋白的药物对靶蛋白的亲和纯化的抗体。因此,它是没有的高通量方法。
披露声明
没有利益冲突的声明。
致谢
我们感谢奥利维尔博瓦隆的抗血清CF1β。这项工作是由马克斯·普朗克学会和德意志研究联合会(薛定谔617/5-1)和Bundesministerium的教化和Forschung(献给系统生物学计划FORSYS的项目GoFORSYS)的补助。
材料
| Name | Company | Catalog Number | Comments |
| 的试剂的名称 | 公司 | 目录编号 | 评论(可选) |
| 蛋白A琼脂糖凝胶 | Sigma-Aldrich公司 | P3391 | |
| DMP(二pimelimidate) | Sigma-Aldrich公司 | D8388 | 储存在-20°C干燥,在使用前直接溶解 |
| 蛋白酶抑制剂(完整的,无EDTA) | 罗氏应用科学部 | 11873580001 | |
| ATP(腺苷-5'-三磷酸) | 卡尔·罗斯 | K054 | |
| 磷酸肌酸 | Sigma-Aldrich公司 | 27920 | |
| 肌酸磷酸激酶 | Sigma-Aldrich公司 | C7886 | ; |
| DSP二硫代二[琥珀酰丙酸] | 热几点思考 | 22585 | 存放在4°C干燥 |
| 15 NH 4 Cl的 | Andover,麻萨诸塞州剑桥同位素实验室, | NLM-467 | |
| LYS-C(内切酶 LYS-C) | 罗氏应用科学部 | 11047825001 | |
| 胰珠(Poroszyme固定化胰蛋白酶) | 美国应用生物系统公司 | 2-3127-00 | 大力直接使用前混合 |
| Empore C 1847毫米的磁盘 | 瓦里安 | 12145004 |
参考文献
- Perrakis, A., Musacchio, A., Cusack, S., Petosa, C. Investigating a macromolecular complex: the toolkit of methods. J. Struct. Biol. 175, 106-112 (2011).
- Gavin, A. C., Maeda, K., Kuhner, S. Recent advances in charting protein-protein interaction: mass spectrometry-based approaches. Curr. Opin. Biotechnol. 22, 42-49 (2011).
- Markham, K., Bai, Y., Schmitt-Ulms, G. Co-immunoprecipitations revisited: an update on experimental concepts and their implementation for sensitive interactome investigations of endogenous proteins. Anal. Bioanal. Chem. 389, 461-473 (2007).
- Selbach, M., Mann, M. Protein interaction screening by quantitative immunoprecipitation combined with knockdown (QUICK. Nat Methods. 3, 981-983 (2006).
- Ong, S. E., Mann, M. A practical recipe for stable isotope labeling by amino acids in cell culture (SILAC). Nat Protoc. 1, 2650-2660 (2006).
- Heide, H. Application of quantitative immunoprecipitation combined with knockdown and cross-linking to Chlamydomonas reveals the presence of vesicle-inducing protein in plastids 1 in a common complex with chloroplast HSP90C. Proteomics. 9, 3079-3089 (2009).
- Nordhues, A., Miller, S. M., Muhlhaus, T., Schroda, M. New insights into the roles of molecular chaperones in Chlamydomonas and Volvox. International review of cell and molecular biology. 285, 75-113 (2010).
- Mayer, M. P., Bukau, B. Hsp70 chaperones: cellular functions and molecular mechanism. Cell Mol. Life Sci. 62, 670-684 (2005).
- Schroda, M., Vallon, O., Whitelegge, J. P., Beck, C. F., Wollman, F. A. The chloroplastic GrpE homolog of Chlamydomonas: two isoforms generated by differential splicing. The Plant Cell. 13, 2823-2839 (2001).
- Willmund, F., Schroda, M. HEAT SHOCK PROTEIN 90C is a bona fide Hsp90 that interacts with plastidic HSP70B in Chlamydomonas reinhardtii. Plant Physiol. 138, 2310-2322 (2005).
- Harris, E. H. The Chlamydomonas Sourcebook: Introduction to Chlamydomonas and Its Laboratory Use. , Elsevier, Academic Press. San Diego, CA. (2008).
- Mortensen, P. MSQuant, an open source platform for mass spectrometry-based quantitative proteomics. J. Proteome Res. 9, 393-403 (2010).
- M?hlhaus, T., Weiss, J., Hemme, D., Sommer, F., Schroda, M. Quantitative Shotgun Proteomics Using a Uniform 15N-Labeled Standard to Monitor Proteome Dynamics in Time Course Experiments Reveals New Insights into the Heat Stress Response of Chlamydomonas reinhardtii. Mol. Cell Proteomics. 10, (2011).
- Bukau, B., Horwich, A. L. The Hsp70 and Hsp60 chaperone machines. Cell. 92, 351-366 (1998).
- Wandinger, S. K., Richter, K., Buchner, J. The Hsp90 chaperone machinery. J. Biol. Chem. 283, 18473-18477 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。