Method Article
을 바탕으로 단백질 - 단백질 상호 작용의 확인에 프로토콜
요약
우리는 TRUE와 FALSE 단백질 단백질 상호 작용을 구별하기 이전에 도입 된 QUICK (최저과 결합하여 정량 Immunoprecipitation) 접근 방식의 변화를 제시한다. 우리 접근 방식은 기반으로합니다 15N 신진 대사 라벨, ATP, immunoprecipitation, 그리고 양적 질량 분광법의 존재 / 부재에 의한 단백질 단백질 상호 작용의 동질성의 변조.
초록
단백질 - 단백질 상호 작용은 세포의 많은 생물학적 과정에 대한 기본입니다. 따라서, 그들의 특성은 조사 1 확인할 수 있습니다 방법을 현재의 연구 및 과다에 중요한 역할을합니다. 단백질 - 단백질 상호 작용은 종종 매우 역동적이며, subcellular 지방화, 포스트 병진 수정과 지역 단백질 환경이에 따라 달라질 수 있습니다. 따라서, 그들은 공동 immunoprecipitation 접근 방식이 선택 (3)의 방법입니다있는 그들의 자연 환경에서 조사해야합니다. 공동 시켰던 상호 작용 파트너는 타겟이 불분명 한 방식으로 타겟팅 된 접근, 또는 질량 분석법 (LC-MS/MS)에 의해 immunoblotting 중 하나로 식별됩니다. 후자의 전략은 종종 부정적인 주로 자신 unspecifically precipitating 단백질의 흔적을 감지 현대적인 질량 분석기의 높은 감도에서 파생 된 잘못된 긍정적 인 발견의 많은에 의해 영향을받습니다. recen이 문제를 극복 할 수 t의 접근 방식은 아이디어에 기초 unspecifically precipitating 단백질의 양이 영향을받지 않습니다 동안 특정 상호 작용 파트너의 감소 금액은, 세포 농도 RNAi에 의해 감소 주어진 대상 단백질과 공동 침전물 할 것입니다. 이 방법은, 최저 4 결합 양적 Immunoprecipitation에 대한 QUICK 칭했다 야생 유형과 노크 다운 긴장에서 immunoprecipitated 단백질의 양을 정량화하는 안정적인 동위 원소 전지 문화에 아미노산의 라벨링 (SILAC) 5 MS을 사용합니다. 1:1 비율에서 발견 된 단백질은 오염 물질, 대상 단백질의 특정 상호 작용 파트너로 야생 유형에서 침전물에 풍부한 사람들로 간주 될 수 있습니다. 혁신, QUICK 일부 제한이지지하지만 : 먼저, SILAC 비용이 많이 이상적 아르기닌 및 / 또는 리신에 대한 auxotrophic 아르 생물로 제한됩니다. addit에 또한, 무거운 아르기닌이 공급 될 때, 아르기닌 - 투 - 프롤린 interconversion 결과ional 질량이 펩타이드 각 프롤린에 대한 연속 근무 약간 정량화 더 지루하고 5,6 정확도가 떨어질 수 있습니다 빛 아르기닌과 무거운 dilutes. 둘째, QUICK는 항체 그들이 노크 다운 뮤턴트에서 추출의 대상 단백질과 포화가되지 않는 등 titrated되어 있어야합니다.
여기 15 N 신진 대사 라벨에 SILAC을 대체하여, 단백질 - 단백질 상호 작용의 연관성 변조에 대한 RNAi로 인한 똑 다운 대체하여 QUICK의 abovementioned 한계를 극복 수정 QUICK 프로토콜을 소개합니다. 우리는 단세포 녹색 alga의 Chlamydomonas이 모델 생물 및 대상 단백질 7 (그림 1)과 엽록체의 HSP70B의 보호자로 reinhardtii 사용하여이 프로토콜의 적용을 보여줍니다. HSP70s는 특정 공동 보호자 만 ADP 상태 8 기판과 상호 작용하는 것으로 알려져 있습니다. 우리는 특정을 확인하는 수단으로이 속성을 이용의 염기 교환 요소 CGE1 9 HSP70B의 상호 작용.
프로토콜
1. 항체 흡착
- 단백질 15 ML 원뿔 튜브 (팔콘)의 세 파로스 120 밀리그램을 무게. 세 파로스는 각 immunoprecipitation (IP)에 필요한 15 MG의 단백질로이 금액은 8 IP를 충분합니다. 5 ML 0.1 M 인산 버퍼 (산도 7.4)를 추가하고 단백질 4 대 ° C.에 30 분을위한 세 파로스의 팽창하게
(에이 시점에서 모든 단계가 단백질 저하 / 복잡한 분리를 피하기 위해 각질과과 얼음의 오염을 방지하기 위해 장갑을 착용 한 채로 수행해야합니다.)
- 1000 XG, 4 펠릿에 ° C 부어 단백질 세 파로스에서 60 초에 원심 분리기. 조심스럽게 표면에 뜨는을 제거하고 5 ML 0.1 M 인산 버퍼 (산도 7.4)에 구슬을 resuspend. 철저하게 구슬을 씻으이 단계 세 번을 반복합니다.
- 마지막 원심 분리 단계 후, 인산염 버퍼의 약 0.5 ML를 표면에 뜨는 제거하고 출발합니다. 0.9 ML 0.5 M 인산 버퍼 (산도 7.4), 400을 추가μl 화성 대상 단백질 (여기 HSP70B) 및 제어 단백질 (여기 CF1β)에 대한 16 μl 항체에 대해 (IP 당 50 μl) 차 항체를 정화. 5 ML의 총 볼륨에 ddH 2 O 따라 입력합니다.
(화성 - 정화 항체는 나노 LC-MS 분석에 방해가 불특정 IgGs에 의해 오염을 줄이기 위해 사용되어야합니다 -.. 프로토콜 CF1β가로드 관리로 유발되며, 선정 된 Willmund 외 (2005) 10를 참조하십시오위한 이 풍부하고 있기 때문에 세포 용해 후, 가용성 및 막 분수에 제시한다. 또는 오염 단백질의 수준이 불평등로드에 정상화하는 데 사용할 수 있습니다.)
- 관 롤러 (CAT RM5W, 36 RPM)에서 25 ° C에서 1 시간의 부화 기간 동안 단백질 adsorb의 IgGs에 대한 세 파로스 구슬 할 수 있습니다.
- 1000 XG, 4 펠릿에 ° C 단백질 세 파로스 비즈에서 60 초에 원심 분리기. 조심스럽게 표면에 뜨는 및 R를 제거5 ML 0.1 M 나트륨 borate 버퍼 (산도 9.0)에 구슬을 esuspend. 이 단계에게 철저하게 crosslinker을 해소 것이다 아민을 제거하는 세 번 반복합니다.
- 의 25.9 MG를 무게 신선한, 고체 dimethylpimelimidate 20 mm의 최종 농도를 얻기 위해 5 ML 0.1 M 나트륨 borate 버퍼 (산도 9.0)에 resuspend. 단백질 세 파로스 비즈에이 솔루션을 추가 할 수 있습니다.
- IgGs 교차 링크 관 롤러에서 25 ° C에서 30 분을위한 단백질을 할 수 있습니다.
- 1000 XG, 4 펠릿에 ° C 비즈에서 60 초에 원심 분리기. 조심스럽게 표면에 뜨는을 제거하고 5 ML 1 M 트리스 - HCL (산도 7.5)이 무료 crosslinker을 해소 할 수있는 구슬을 resuspend. 한 번이 단계를 반복합니다 25에서 2 시간에 품다 4에 ° C 또는 12-24 시간 ° C 관 롤러 있습니다.에게
- 선택 사항 : IgGs에 연결된 세 파로스 비즈가 직접 최대 일주일에 IP, 스토리지에 사용하지 않는 단백질 경우 가능합니다. 이를 위해 1000 XG, 4 60 초 동안 원심 분리기는 ° C 펠릿에 구슬, 잘 supern를 제거4에 0.02 % 나트륨 azide 및 매장을 포함 5 ML 0.1 M 인산 버퍼에 atant 및 resuspend 비즈 (산도 7.5) ° C 더 사용까지.
2. 세포 용해, Crosslinking 및 샘플 준비
- 7.5 MM를 포함하는 중간에 두 Chlamydomonas 문화를 성장 14 NH 4 CIA 같으니 또는 15 NH ~ 5 × 10 6 세포 / ML의 밀도 질소 소스로 네 망할 CIA.주세요 세포는 전체 라벨 최소 10 세대를 통과해야합니다. 여기 셀은 흰색 빛으로 연속 조사 (30 μE m -2 S -1)에서 25 회전 흔드는 ° C에서 TAP 매체 11 photomixotrophically 성장했다.
- 4000 XG, 4 ° C (각 나누어지는에 수확 휴대폰 번호 타겟의 세포 농도에 따라시 4 분 원심 분리 × 4 GSA 튜브 및 수확 셀에 두 개의 aliquots (14)의 각 N-15 N-라벨 세포를 전송 단백질과 전자를 결정해야합니다mpirically 수 있도록 사전에 충분한 대상 단백질이 유발됩니다. 좋은 출발점이 나누어지는 당 10 9 세포, 즉, 5 X 10 6 세포 / ML와 문화의 200 ML입니다.)
crosslinking 만 : 단백질 단지가 이전 IP에 대한 가교 될 것입니다 경우, 세포는 매체에 존재하는 아민을 제거하는 세척해야합니다. 이를 위해 resuspend 40 ML 미리 냉각 KH 버퍼의 셀 (20 MM HEPES - 코 (산도 7.2), 80 MM KCl)과 50 ML 팔콘 튜브로 전송할 수 있습니다. 1000 XG, 4 ° C.에 60 초에 원심 분리기 한 번이 단계를 반복합니다. - 두 ML의 용해 버퍼에 Resuspend 세포가 (20 MM HEPES - 코 (산도 7.2), 1 음 MgCl 2, 10 MM KCl, 154 MM NaCl) 4 사전 냉각 ° C와 15 ML 팔콘 튜브로 전송할 수 있습니다.에게 추가 한 ML의 용해 버퍼 각각 GSA 튜브에 남아있는 세포를 수집합니다. 각 나누어지는 50 μl 25 X 프로테아제 억제제와 12.5 μl 1 M MgCl 2 (3.5 mm의 최종 농도)를 추가합니다.
- 150 추가μl 용해 버퍼, 12.5 μl 1 M ATP의 하나 833 μl 270 밀리미터 크레아틴 인산과 7 μl 5 μg / μl 크레아틴의 phosphokinase (최종 농도가 ATP, 45 밀리미터 크레아틴 인산, 7 μg / ML 크레아틴의 phosphokinase 2.5 MM입니다) 14 N-15 N-라벨 세포를 (이은 + ATP aliquots 있습니다)이 포함 된 aliquots.
- 14 N-15 N-라벨 세포를 (이은-ATP의 aliquots입니다)이 포함 된 다른 aliquots에 930 μl 용해 버퍼 70 μl 한 U / μl apyrase을 추가합니다.
- ATP는 - 고갈 및 ATP-가득 차 국가 수립 할 수있는 관 롤러에 25 2 분 ° C에 품다. crosslinking 단계가 생략되면 용해 버퍼의 또 다른 한 ML을 추가합니다.
crosslinking 만 : 조사 단백질 단백질 상호 작용이 과도 아르 경우는 crosslinking 단계 기준으로 결과를 캡처하는 것이 좋습니다. 이를 위해 전자에 DMSO에 용해 500 μl 20 MM dithio - 비스 (succinimidyl 프로 피오 네이트) (DSP)을 (최종 농도가 2 MM)을 추가직접 sonication 전에 ACH 관. - 냉각 사이에 20 초 휴식과 세포를 깨고 얼음에 네 번 20 초를 Sonicate. (우리는 75 % 60 % 듀티 사이클의 출력 제어에서 KE76 팁과 Bandelin Sonoplus HD2070을 사용합니다. 다른 기계 / 장치 / 팁에 필요한 설정이 완료 세포 용해을 보장하고 흘리고 방지하기 위해 사전에 결정해야합니다. )
crosslinking 만 4에서 1 시간에 잠복기 ° C를 관 롤러에 의해 단백질 단지는 상호 링크 할 수 있습니다. crosslinking 후, ° C 무료 crosslinker을 해소하기 4에 또 다른 15 분 동안 튜브 롤러에 500 μl 1 M 글리신과 알을 품다 각 관을 보충. - SW41 티 얇은 벽 튜브 (없음 Beckman 보습 바로 앞에 달린 풀 베는 날 항목 : 344059)에 모두 6 ML 자당 방석 (20 MM HEPES - 코 (산도 7.2), 0.6 M의 자당)를 준비, 잘하다 전체 ~ 자당로 세포 lysates 5.5 ML 쿠션 (용해 버퍼와 균형) 30 200,000 XG의 분, 4 ° C SW41 티 로토에 대한 원심 분리기연구.
- 네 15 ML 팔콘 튜브 (자당 쿠션의 일부가 전송되지 않도록)에 용해 단백질 복합체를 포함하는 그라디언트의 상단을 전송, 그들 각각에 0.5 %의 최종 농도 350 μl 10% 튼 X-100을 추가 조심스럽게 혼합 7 ML 각각의 총 볼륨에 용해 버퍼를 추가합니다.
(신선한 1.5 ML 원뿔 튜브 (Eppendorf 튜브)에 70 μl이 X SDS - 샘플 버퍼 (4 % SDS, 125 MM 트리스 - HCL (산도 6.8), 20 % 글리세롤, 10을 추가 송금 각 용해 세포 추출물의 70 μl를 % 2 - 메르 캅토 에탄올) SDS-PAGE와 immunoblot 분석을위한 각합니다.) - 자당 방석을 삭제 하시겠습니까 3 ML의 용해 버퍼 각각에 막 알약을 resuspend. 2 %의 최종 농도에 각 1 ML 10% 튼 X-100에 추가, 알약을 분해하기 위해 얼음에 sonicate, 5 ML 각각의 총 볼륨에 용해 버퍼를 추가합니다.
- SW41 티 얇은 벽 튜브에 다른 네 6 ML 자당 방석을 준비 단계 2.10에서 solubilized 멤브레인의 ~ 5 ML은 자당에주의하다200,000 XG, 4 ° C SW41 티 회 전자에 30 분을위한 쿠션, 그리고 원심 분리기.
- 네 15 ML 팔콘 튜브로 막 단백질 복합체를 포함하는 그라디언트의 상단을 전송하고 신선한 7 ~ ML 각각의 최종 볼륨입니다. (양도 각각의 용해 세포 추출물의 70 μl에 용해 버퍼를 (2 % 트리톤 X-100을 포함)을 추가 Eppendorf 튜브와 SDS-PAGE와 immunoblot 분석을위한 각 70 μl이 X SDS-샘플을 추가 할 수 있습니다.)
3. Immunoprecipitation
- 펠렛 단백질 60 초 1,000 XG에서 원심 분리 및 4에 의해 커플 링 항체를 (단계 1.8 또는 1.9에서)이 포함 된 세 파로스 비즈 ° C,주의 깊게 네 ML의 용해 버퍼에있는 표면에 뜨는 및 resuspend 구슬을 제거합니다. 용해 버퍼에 구슬 평형 두 번이 단계를 반복합니다.
- 용해 버퍼 8 ML까지 작성 14 ATP-가득 차 및 ATP-고갈에서 용해 또는 막 단백질 복합체를 포함하는 8 15 ML 팔콘 튜브의 각 정지 1 ML을 전송 N-15 N-라벨 세포 (단계 2.9 및 2.12에서).
- 석출물 단백질 단지에 관 롤러에 4 ° C에서 2 시간에 품다.
- 1000 XG, 4에서 60 초 원심 분리하여 펠렛은 구슬 ° C와 supernatants 폐기합니다. 전송을 촉진하기 위하여 구슬의 상단에 액체의 작은 볼륨을 둡니다.
- 각 팔콘 튜브에서 1.5-ML 원뿔 튜브 (Eppendorf 튜브)에 구슬을 전송합니다. 팔콘 튜브에 남아있는 모든 구슬을 수집하려면 부드럽게 각각 0.1 % 트리톤을 포함하는 또 다른 0.8 ML의 용해 버퍼, 소용돌이, 1,000 XG, 4 60 초 동안 원심 분리기를 추가 ° C와 Eppendorf 튜브에 잔류 구슬로 버퍼를 전송합니다. 튜브 교환 플라스틱 벽에 준수 단백질에서 contaminations을 방지 할 필요가 있습니다.
- 펠렛 15 초 16,100 XG에서 원심 분리 및 4로 구슬 ° C, 신중 0.1 % 트리톤을 포함하는 1.3 ML의 용해 버퍼에 supernatants 및 resuspend 구슬을 제거합니다. 용해 buf에 두 번이 단계를 반복합니다튼을 포함 남았다 그리고 두 번이나 용해 버퍼 부족 튼을 철저하게 구슬을 씻어합니다. 전송을 촉진하기 위하여 구슬의 상단에 액체의 작은 볼륨을 둡니다.
- 다시 플라스틱 벽에 준수 단백질을 제거하는 새로운 1.5 ML Eppendorf 튜브에 구슬을 전송하기 만하면됩니다. 한 ML의 용해 버퍼 부족 튼으로 이전 튜브를 세척하고 신선한 튜브에 대한 모든 잔류 구슬을 전송할 수 있습니다.
- 16,100 XG 15 초 동안 원심 분리기, 4 ° C, 일반 피펫으로 먼저 supernatants를 제거 후 50 μl 해밀턴 주사기로 완전히 남아있는 표면에 뜨는을 제거합니다.
4. nano-LC-MS/MS을위한 샘플 준비
- 각 튜브에 100 μl 신선하게 준비된 용출 버퍼를 (8 M 우레아, 25 MM NH 4 HCO 3) 추가, 800 rpm으로 thermomixer의 10 분의 해밀턴 주사기와 배양를 지키는 구슬을 씻어 100 μl 용출 버퍼를 사용하여 65 ° C, 30에서 다른 20 분에 대한 ° C. (A 더 많은 전체바인딩 단백질의 용출은 80 % 아세톤으로 2퍼센트 SDS와 후속 강수량과 용출에 의해 달성된다.)
- 16,100 XG 25 ° C.에 15 초에 원심 분리기 50 μl 해밀턴 주사기와 신선한 튜브에 supernatants를 전송합니다.
- 구슬 50 μl 용출 버퍼를 추가 해밀턴 주사기를 지키는 구슬 씻어 각각, 부화 및 원심 분리 단계 4.1 및 4.2 반복 50 μl 용출 버퍼를 사용합니다. 각각의 eluates을 수영장을 보유하고 있습니다.
(신선한 Eppendorf 튜브에 전송 eluates 30 μl를 30 μl이 SDS-PAGE와 immunoblot 분석을위한 각각에 X SDS-샘플 버퍼를 추가 할 수 있습니다.) - 용출은 + /-ATP-처리에서 침전물 결합, 14 N-15 N-라벨 다음과 같은 가용성 및 멤브레인 단백질 :
120 μl 15 N / + ATP 120 μl 14 N /-ATP
120 μl 14 N / + ATP 120 μl 15 N /-ATP
120 μl 15 N / + ATP 120 μl 14 N /-ATP
120 μl 14 N / + ATP 120 μl 15 N /-ATP - 갓 이황화 채권을 (crosslinker에 포함) 절감 및 25에서 30 분 동안 배양하기 위해 네 개의 조합 각각에 6.5 mm의 최종 농도에 1 M의 DTT를 준비 1.5 μl ° C.를 추가합니다
- 갓 감소 thiols을 carboxymethylate과 어둠 속에서 25 20 분 ° C에 품다 25 mm의 최종 농도에 0.6 M의 iodoacetamide을 준비 10.5 μl를 추가합니다.
- 256 μl 40 MM NH 4 HCO 3, 4 μl LYS-C (0.1 μg / μl), parafilm으로 밀봉 튜브, 그리고 37 회전 휠에 밤새 적어도 16 시간에 품다 ° C.를 추가합니다
- 37 적어도 16 시간에 대한 회전 휠에 470 μl 20 MM NH 4 HCO 3, 10 μl의 100 % 아세토 니트릴 (1 %의 최종 농도까지), 8 μl 트립신 비즈 및 배양을 추가 ° C.
- 5 16,100 XG에서 분, 4 ° C, 및 전송 supernatants에 신선한 2 ML Eppendorf 욕조에 원심 분리기에스. 50 μl 20 MM NH 4 HCO 3, 0.5 % 아세트산, 첫 supernatants있는 수영장 기존의 튜브를 씻으십시오.
- 탈염를 들어, 주사기 바늘로 Empore C 18 소재에서 두 디스크를 절단하고 200 μl 피펫 팁에서 그들을 배치하여 C 18 StageTips을 만든 준비합니다. 이런 식으로 네 개의 200 μl 팁 준비합니다. 펀치 네 2 ML Eppendorf 튜브 및 삽입 팁 뚜껑에 구멍.
- 전제 조건 50 μl 솔루션 B와 C 18 StageTips (80 % 아세토 니트릴, 0.5 % 아세트산). 800g 3 분, 25 ° C.를위한 원심 분리기
- 100 μl 솔루션 A (0.5 % 아세트산, 2 % 아세토 니트릴)와 C 18 StageTips을 평형. 800g 3 분, 25 ° C.를위한 원심 분리기 한 번이 단계를 반복합니다.
- 800g 3 분, 25 ° C.의 C 18 StageTips과 원심 분리기에 tryptic digestions (4.9)에서 supernatants 100 μl를로드 전체 supernatants이 적용되었습니다 때까지이 단계를 반복열.
- 800g 25 ° C.에서 3 분 100 μl 솔루션 A. 원심 분리기와 C 18 StageTips을 씻으십시오 이 단계를 두 번 반복합니다.
- 800g 3 분, 25 ° C. 50 μl 솔루션 B. 원심 분리기와 신선한 1.5 ML Eppendorf 튜브에 tryptic 펩티드를 Elute 한 번이 단계를 반복합니다. VAC 속도 완료로 드라이 펩티드.
- 선택 사항 : 자세한 사용까지 -80에서 parafilm 및 매장 ° C와 인감 Eppendorf 튜브.
- 20 μl 솔루션으로 건조 펩티드를 Resuspend하고 sonicator 욕조에 두 15 분 incubations에 의해 중단 얼음에 적어도 1 시간에 대한 품다. 16,100 XG, 4 ° C에서 20 분을위한 원심 분리기 및 nano-LC-MS/MS에 표면에 뜨는 적용됩니다.
5. 대표 결과
으로 그림 2A에서 14 N-라벨 세포 추출물에 대한 exemplarily 표시, HSP70B 및 CGE1는 거의 대부분 ATP 상태의 독립적 인 수용성 분율로 번역되어 있습니다. 에sonication이 막 자리 잡고 CF O에서의 일부를 가위, 따라서 모두 분수에 대한 제어를로드 역할로 대비, CF1β는 가용성과 막 강화 분수로 번역되어 있습니다. 으로 그림 2B에 도시 된 바와 같이, HSP70B에서 비슷한 양의 14 N-15 ATP 상태의 독립적 인 N-라벨 수용성 추출물에서 반 HSP70B 항체를 유발했다. 대조적으로 만 약간 HSP70B은 따라서 이전에 검색 할 때 9 corroborating, ATP 가득 분수에 비해 약간 큰 금액은 ATP-소모 막 분수에서 발생을 막 분수에서 유발되었다. 어떤 CGE1는 CGE1 많은 양의은 ATP-소모 용해 분수에서 HSP70B와 공동 유발하는 동안, ATP-가득 용해 또는 막 분수에 HSP70B와 공동 유발 없으며, 약간의 ATP-소모 막 분수에서했습니다.
만 ADP 상태에서 HSP70B과 CGE1의 상호 작용도 관찰 할 수 있습니다MS 분석 : 그림 3, 대표 HSP70B의 MS1 스펙트럼과 수용성 세포 추출물에서 HSP70B 항혈청으로 생성 침전물에서 CGE1 펩티드에 표시됩니다. 도 3a에 도시 된 실험에서, 침전물 ATP 15 ATP가 포함 된 추출물 N-라벨이 부족한 14 N-라벨 추출물의 혼합물로부터이었다. HSP70B 펩타이드의 무거운 가벼운 라벨 양식이 동일 농도에서 발견되었습니다 동안 CGE1 펩타이드 만 빛 라벨 양식 (에서 - ATP 추출물) 발견되었습니다. 그림 3B에서 서로이라는 수용성 세포 추출물의 혼합물에서 파생 된 안티 - HSP70B 침전물에서 같은 펩티드가 표시됩니다. 이 다시 빛과 무거운 표시 HSP70B의 펩티드 모두의 경우 동안 따라서,이 시간은 CGE1의 펩타이드 (에서 - ATP 추출물)의 무거운 라벨 양식이 감지되었습니다.
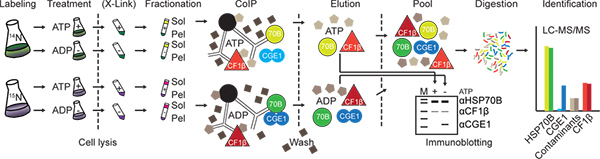
그림 1. 실험 워크 플로우. 셀 metabolically, 최소 10 세대에 14 N 15 N으로 표시 수확과 함께 제공된 또는 ATP에서 고갈되어 있습니다. 세포 용해 단백질 단지 한 후 선택적으로 DSP와 (X-링크) 가교 될 수 있습니다. Lysed 셀은 다음 가용성에 분리 (솔)와 막 부화 (펠) 분수입니다. 대상 단백질 (여기 HSP70B)과 제어 단백질은 (여기 CF1β) 단백질 세 파로스 비즈 (검은 색)에 커플 링 된 특정 항체와 immunoprecipitated 있습니다. 세척 후, 유발 단백질이 용출하고 직접 분석 immunoblotting에 의해, 또는 각각의 14 N-15는 + ATP 및 ATP 상태가 풀링 된 소화하고 nano-LC-MS/MS에 의해 분석됩니다.에서 분수 N-로 표시됩니다 예를 들어 경우 15 N-라벨 일부는 ATP에서 소진되었다 여기에 표시. 제어 단백질의 따라서, 빛으로 무거운 표시 (어두운 색)의 농도의 비율 (밝은 색)이라는 펩티드이 비율은 특히 대상 단백질 (CGE1)와 상호 작용하는 단백질에 대한 매우 높은 것으로 예상되는 동안 (CF1β), 대상 단백질 (HSP70B) 및 비 구체적으로는 바운드 오염 물질은 하나의 주위해야합니다. 큰 그림을 보려면 여기를 클릭하십시오 .

그림 2. HSP70B의 immunoprecipitation에 대한 입력의 분석. 총 단백질은 가용성 (솔)와 막 부화 (펠) 또는 ATP (-ATP)에서 고갈 또는 ATP 및 ATP 재생 시스템 (+ ATP)와 보충 분수에서 추출되었다. 단백질 추출물의 0.01 %가 10 % SDS-polyacrylamide 젤에서 분리되었고, HSP70B와로드 제어 CF1β에 비해 CGE1 단백질의 수준은 immunoblotting에 의해 분석 하였다. immunoprecipitates의 B 분석. HSP70B이 14에서 immunoprecipitated N-및되었습니다15 수용성 N-라벨 및 멤브레인 강화 셀은 포함하거나 ATP 부족한 압축을 풉니 다. immunoprecipitates의 3.3 %에 해당하는 단백질이 제어 CF1β은 immunoblotting에 의해 분석 된로드에 10 % SDS-polyacrylamide 젤과 HSP70B의 수준과 CGE1 상대에 분리되었다. 큰 그림을 보려면 여기를 클릭하십시오 .
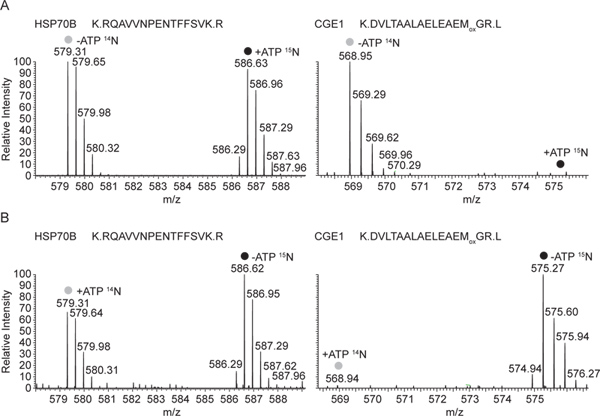
그림 3. 대표 질량 HSP70B의 스펙트럼 및 안티 HSP70B에서 CGE1 펩티드는 혼합 용해 분수 (14 N-ATP / 15 N + ATP)에 수행 immunoprecipitates. 14 N 15 N 표시 펩티드,-ATP에 해당하는 및 전체 MS의 스펙트럼이 + HSP70B와 공동 immunoprecipitated CGE1에서 각각 ATP 상태는, 표시됩니다. 두 펩티드는 triply 비용이 청구됩니다 HSP70B의 펩타이드 22 질소 원자, CGE1 pept을 포함IDE 19 상호 실험 (14 N + ATP / 15 N-ATP)에서 각각 질량 7.33의 이동 및 6.33 m / Z,. B 대표 질량 스펙트럼에 해당. + ATP 및 ATP HSP70B와 공동 immunoprecipitated CGE1에서 각각 상태, 여기에 해당하는 동일한 14 N 15 N 분류 펩티드의 전체 MS의 스펙트럼이 표시됩니다. 큰 그림을 보려면 여기를 클릭하십시오 .
토론
과도 단백질 단백질 상호 작용 (QUICK-X)를 캡처하기위한 crosslinking 단계, 그리고 불평등 침전 효율 6 정상화 할 수있는 제어 강수량 : 우리는 최근 QUICK 방법 두 가지 개선을 도입했습니다. 다음은 QUICK의 두 개선이 포함 된 프로토콜 제시 : 먼저, 우리는 15 N 신진 대사 라벨링에 대한 SILAC 5 바꿉니다. 장점은 15 N은 단순 무기 소금으로 제공되는 경우 15 N 신진 대사 라벨이 SILAC보다 훨씬 저렴하다고합니다. 또한, 15 N 신진 대사와 QUICK 라벨 대부분의 식물, 곰팡이 및 박테리아처럼, 모든 아미노산에 대한 생물의 prototrophic에 적용 할 수 있습니다. 그리고 마지막으로, SILAC 5,6에 내재 아르기닌 - 투 - 프롤린 interconversion 15 N이라는 펩티드의 정량화에 대한 문제를 제시하지 않습니다. 15 N의 단백질 체학 데이터의 양적 평가에 적합한 도구 예를 들면 MSQUANT 12 I 아르OMIQS 13.
둘째, 우리는 특별히 다른 비해 한 샘플에서 주어진 목표 단백질과 상호 작용하는 단백질의 양을 감소시키기위한 수단으로 친화력 변조를 소개합니다. 이 방법의 장점은 일부 모델 시스템을 생성하기가 어렵습니다 또는 모든 필수 대상 단백질의 경우에서 생성 할 수없는 최저의 돌연변이의 건설을 circumvents한다는 점입니다. 또한, 잠재적 대상 단백질을 쓰러 뜨린에 세포의 응답으로 발생하는 차동 단백질 발현에 의한 misinterpretations을 방지 : 다른 단백질뿐만 아니라 다운 규제하고 immunoprecipitation에 사용 된 항혈청과 교차 반응하는 경우, 그들은 해석 될 대상 단백질의 진정한 상호 작용 파트너 있습니다. 마지막으로, 화성 변조는 적절한 항체 - 투 - 항원 비율을 찾는 필요성을 시킨다는.
우리는 모델 생물로 Chlamydomonas reinhardtii의 우리의 프로토콜을 적용되지만, 그것은 쉽게 세포 배양에서 재배 및 질소 소스로 암모니아 또는 질산을 사용 할 수 있습니다 할 수있는 다른 생물체에 적용 할 수 있습니다. ATP / ADP에 의한 단백질 단지의 연관성 변조는 직접 GroEL/HSP60/Cpn60 또는 HSP90 자야 시스템 14,15 같은 그의 상호 작용 기판과 일대 단백질과 ATP 상태에 따라 다른 보호자에 적용, 또는 다른 시스템에 위치 할 수 있습니다 바인딩 동질성은 ATP에 의해 조절됩니다. 화성 변조는 또한 단백질 상호 작용 사이의 동질성이 HSP90 시스템 (15)의 경우 radicicol 또는 geldanamycin 같은 특정 약물에 의해 변경 된 경우에 작동합니다.
우리 프로토콜의 명확한 제한이 필요하다는 것입니다 친화 - 정화 특정 치료 / 파트너 단백질위한 친화력을 변조 약물에 민감한 것으로 알려진 대상 단백질에 대한 항체를. 따라서 더 높은 처리량 방법이다.
공개
관심 없음 충돌이 선언 없습니다.
감사의 말
우리는 CF1β에 대한 항혈청을위한 올리비에 Vallon 감사드립니다. 이 작업은 최대 플랑크 사회와 독일 Forschungsgemeinschaft (Schr 617/5-1)와 Bundesministerium 털 Bildung 숙녀 Forschung (시스템 생물 이니셔티브 FORSYS, 프로젝트 GoFORSYS)에서 보조금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 코멘트 (선택 사항) |
| ProteinA 세 파로스 | 시그마 - 알드리치 | P3391 | |
| DMP (디메틸 pimelimidate) | 시그마 - 알드리치 | D8388 | -20 ° C에서 말라 저장, 사용하기 전에 직접 분해 |
| (전체, EDTA (에틸렌 다이아 민 테트라 초산) - 무료) 프로테아제 억제제 | 로슈 응용 과학 | 11873580001 | |
| ATP (Adenosin-5'-triphosphat) | 칼 로스 | K054 | |
| 크레아틴 인산 | 시그마 - 알드리치 | 27,920 | |
| 크리 phosphokinase | 시그마 - 알드리치 | C7886 | ; |
| DSP Dithiobis [succinimidyl 프로 피오 네이트] | Sientific 열 | 22,585 | 4에 말라 저장 ° C |
| 15 NH 4 망할 CIA | 캠브리지 동위 원소 실험실, 앤도버, MA | NLM-467 | |
| LYS-C (Endoproteinase LYS-C) | 로슈 응용 과학 | 11047825001 | |
| 트립신 비즈 (Poroszyme는 트립신을 고정) | 응용 Biosystems | 2-3127-00 | 직접 사용하기 전에 힘차게 믹스 |
| Empore C 18 47mm 디스크 | Varian | 12145004 |
참고문헌
- Perrakis, A., Musacchio, A., Cusack, S., Petosa, C. Investigating a macromolecular complex: the toolkit of methods. J. Struct. Biol. 175, 106-112 (2011).
- Gavin, A. C., Maeda, K., Kuhner, S. Recent advances in charting protein-protein interaction: mass spectrometry-based approaches. Curr. Opin. Biotechnol. 22, 42-49 (2011).
- Markham, K., Bai, Y., Schmitt-Ulms, G. Co-immunoprecipitations revisited: an update on experimental concepts and their implementation for sensitive interactome investigations of endogenous proteins. Anal. Bioanal. Chem. 389, 461-473 (2007).
- Selbach, M., Mann, M. Protein interaction screening by quantitative immunoprecipitation combined with knockdown (QUICK. Nat Methods. 3, 981-983 (2006).
- Ong, S. E., Mann, M. A practical recipe for stable isotope labeling by amino acids in cell culture (SILAC). Nat Protoc. 1, 2650-2660 (2006).
- Heide, H. Application of quantitative immunoprecipitation combined with knockdown and cross-linking to Chlamydomonas reveals the presence of vesicle-inducing protein in plastids 1 in a common complex with chloroplast HSP90C. Proteomics. 9, 3079-3089 (2009).
- Nordhues, A., Miller, S. M., Muhlhaus, T., Schroda, M. New insights into the roles of molecular chaperones in Chlamydomonas and Volvox. International review of cell and molecular biology. 285, 75-113 (2010).
- Mayer, M. P., Bukau, B. Hsp70 chaperones: cellular functions and molecular mechanism. Cell Mol. Life Sci. 62, 670-684 (2005).
- Schroda, M., Vallon, O., Whitelegge, J. P., Beck, C. F., Wollman, F. A. The chloroplastic GrpE homolog of Chlamydomonas: two isoforms generated by differential splicing. The Plant Cell. 13, 2823-2839 (2001).
- Willmund, F., Schroda, M. HEAT SHOCK PROTEIN 90C is a bona fide Hsp90 that interacts with plastidic HSP70B in Chlamydomonas reinhardtii. Plant Physiol. 138, 2310-2322 (2005).
- Harris, E. H. The Chlamydomonas Sourcebook: Introduction to Chlamydomonas and Its Laboratory Use. , Elsevier, Academic Press. San Diego, CA. (2008).
- Mortensen, P. MSQuant, an open source platform for mass spectrometry-based quantitative proteomics. J. Proteome Res. 9, 393-403 (2010).
- M?hlhaus, T., Weiss, J., Hemme, D., Sommer, F., Schroda, M. Quantitative Shotgun Proteomics Using a Uniform 15N-Labeled Standard to Monitor Proteome Dynamics in Time Course Experiments Reveals New Insights into the Heat Stress Response of Chlamydomonas reinhardtii. Mol. Cell Proteomics. 10, (2011).
- Bukau, B., Horwich, A. L. The Hsp70 and Hsp60 chaperone machines. Cell. 92, 351-366 (1998).
- Wandinger, S. K., Richter, K., Buchner, J. The Hsp90 chaperone machinery. J. Biol. Chem. 283, 18473-18477 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유