Method Article
部分原位肝移植大鼠模型的肝动脉重建的外科手术
摘要
大鼠原位肝移植是不可缺少的生物医学研究的实验模型。在这里,我们提出我们的程序使用了50%的部分移植肝动脉重建的大鼠原位肝移植手术。
摘要
在整体或局部移植的大鼠原位肝移植(OLT)是一个不可缺少的实验模型,移植的研究,如对移植物的保存和缺血再灌注损伤1,2,免疫反应3,4 5,6血流动力学的研究,为小尺寸综合征7。大鼠肝移植动物模型的实验性手术中最困难的,需要先进的显微外科技术,需要很长的时间来学习。因此,该模型的使用受到了限制。由于可靠性和可重复性的结果是在这种复杂的动物模型用于实验的重要组成部分,它是必不可少的外科医生参与培训的标准化和复杂的程序,这种模式在大鼠OLT。
虽然不同的技术和修改的OLT的影响已报道8月以来的第一个模型是describLee 等人于1973年9的消除肝动脉重建10和袖套吻合技术引进由镰田等人。11人在这个模型中的一个重大进步,因为他们在很大程度上简化了重建的程序。在该模型中由镰田等人。,肝rearterialization也被淘汰。由于老鼠可以存活肝移植无肝动脉血流后,有相当大的争议肝动脉的价值。然而,生理的动脉模型的优势已经日益认识到,特别是在维护胆管系统8,12和肝脏完整性8,13,14。
在这篇文章中,我们提出了详细的手术过程OLT与肝动脉重建的大鼠模型中使用了50%的部分离体肝脏移植后resecTION。每个容器和胆管的重建程序,执行由以下方法:7-0聚丙烯连续缝合为超和肝下腔静脉,门静脉的袖带技术和肝动脉的支架技术和胆管。
研究方案
1。基本技术和通用程序
- 所有的程序都干净,但非无菌条件下进行。
- 一旦大鼠的腹部被打开,所有的程序下进行的外科显微镜在16倍的倍率。例外的是体外肝切除,其中执行在10x,和下面的过程,这是在25倍进行:插入到胆管和肝动脉的支架,和肝动脉的重建,肝下腔静脉(IHVC),和胆管。
- 使用棉签温和的操作的器官,组织的钝性分离,并压迫止血。 (5×5厘米),乳酸林格氏液浸泡的纱布拭子收回的肝,肠,并保持器官的湿润。朝向左侧或大鼠的尾部以扩大手术野周围IHVC纱布覆盖肠子缩回可用于Satinsky钳位。
- 所有的肝蒂叶在体外肝切除术,用4-0丝线除了用6-0丝线结扎进行。可以拉到结扎的结扎点的狄见贝基斗牛犬钳或其他工具,以提供足够的张力第二结扎,这样可以在距离第一个,两个结扎点之间的分工可以做适当的。
- 通过阴茎静脉进行静脉注射。
- 肝上下腔静脉(SHVC),门静脉,肝动脉和胆管,一个小疙瘩油基粘土在重建程序将手指握环的周边血管钳或蚊钳保持固定的位置。
2。术前准备
- 作为肝移植供体和受体为雄性Lewis大鼠,体重230和250克之间。这些老鼠都欠免费获得水和食物,直到麻醉诱导。
- 袖口袖口为门静脉门静脉(图1):准备11号手术刀片,在显微镜下切割14号导管。压脉袋包括一个主体和一个扩展,长度为2mm中的每一个。使袖带上的周向槽,由一个线程可以使压脉袋上坚固地拧紧而不滑落用蚊子钳子圆周夹紧的压脉袋的步骤的步骤的壁。
- 支架胆管和肝动脉(图1):剪切24隔距的导管,在显微镜下用手术刀产生斜面的导管两端的长度为4毫米的肝动脉和胆管5毫米。
3。供体手术
从供体大鼠肝脏的去除是在图2中所示的架构。此过程大约需要imately 30-35分钟。
- 与4体积%异氟烷在4升/分钟的流速在100%的氧气诱导麻醉,和1.5%(体积)在2升/分钟的维护吸入麻醉大鼠。注射丁丙诺啡(0.1毫克/千克)作为镇痛剂皮下。上一个加热垫,将大鼠固定在上臂使用的磁性固定器回缩系统(图3a)。刮皮毛整个腹部区域的影响,并用聚维酮碘溶液消毒相应的皮肤。
- 打开腹部正中切口双边扩展。将5-ml注射器下的大鼠的背部,使腹侧SHVC升高。使用的蚊子钳,钳,拉剑突向头部,并适用于肋下拉钩打开手术视野(图3a)。
- 解剖镰状韧带和左三角韧带。接下来,左膈静脉结扎和分裂。
- RETR行动中位数和左外侧叶,用湿纱布拭向上。使用双极钳,凝聚和分裂段食管血管之间的左外侧和前侧尾状叶。
- 肠道以外的腹部移动到大鼠的左侧,并用湿纱布拭子覆盖它们。向上缩回右外叶,用湿纱布拭。隔离IHVC从腹膜后组织,和结扎右肾上腺静脉,这将被划分购买之前接枝去除。
- 要插入支架胆管(图3b):
- 胆管结扎胃十二指肠动脉分支的水平。胆管周围的软组织,应尽可能地被保留,并分离来自肝动脉的胆管,应避免使用,以确保足够的动脉供应胆管。
- 直显微剪,做一个小切口,在anteri或墙壁的胆管结扎点近侧。前壁的切口,直在左手的微型镊子,插入支架管使用弯曲的微型镊子在右手,用6-0丝线固定。之一的切断端部的螺纹上的胆管被保持在4毫米的长度,使该线程可以被保持在购买吻合。
- 解放门静脉的幽门和脾静脉的结扎和分裂他们。
- 胃十二指肠动脉结扎和分裂,然后分离出肝总动脉(CHA)从胰头到它的根。旋转肝脏的右侧用棉签,并剖析后面的肝,食道周围的韧带。
- 在肝切除的准备工作完成后,取出的牵开器,蚊子钳子剑突进程,和背面下的大鼠的5-ml注射器。返回肠子的abdomina升腔。
- 通过阴茎静脉注射500 IU的肝素 - 钠在2毫升生理盐水溶液。约3分钟后,5毫升的注射器,蚊子钳,拉钩复位。它的根近端结扎查。查看一个结束的切割长的CHA结扎的线程。
- 在夹紧IHVC接近右肾静脉一只蚊子钳,钳,门静脉,脾静脉残端的一次性微型血管钳下面。切开前壁门静脉,插入18号导管进入门静脉。
- 在原位肝灌注用60毫升冷组氨酸-色氨酸-酮戊二酸(HTK)溶液在静水压力为20 cm H 2 O。紧接着,切割膜片和横切胸腔内的腔静脉,并切断前壁的IHVC打开以允许灌注溶液被冲洗掉的肝脏(图3c)。
- 二,夹紧IHVCsposable微血管钳只是下面的肝脏。稍低于肝脏和右肾静脉之间的中间点的IHVC通过解剖肝切除,门静脉脾静脉残端下面,隔膜,其余的在后面的肝脏韧带,右肾上腺静脉,和CHA的根源。将切除的肝在寒冷的HTK溶液在金属杯安装在塑料盒中充满碎冰。
4 体外移植准备。
肝移植的所有程序进行在用冰冷的HTK溶液的金属杯装满。在活体外的移植准备大约需要30分钟。
- 对于附着到门静脉(图4)的压脉袋:
与狄见贝基牛头犬夹子夹住门静脉主干。将钳在杯(图件4a,b)中的桥接位置。将门静脉的袖口,和钳位门静脉再次一起扩展的压脉袋在12点钟的位置(图4c)。埃弗特在袖口的位置在墙上的门静脉脾静脉残端,并确保在7点钟的位置(图4d)的袖口外门静脉用6-0丝线(图4E) 。 - 进入肝动脉插入支架(图5):
夹紧两边的隔膜产钳,修复肝和拉动的CHA,直持有该连接的线程与狄见贝基斗牛犬钳(图5a)。直显微剪,做一个小切口,在前壁的CHA。用左手,按住前壁的切口的直链的微钳子,并用右手,进入CHA使用弯曲的微钳子插入一个支架。预先用肝素-钠溶液(100国际单位/毫升)(图5B-D)的支架。小号用6-0丝线ecure的支架,并保持一个切割结束的线程,在一个长度为4mm。冲洗肝脏通过用5毫升冷HTK溶液的动脉导管。 - 对于50%的肝切除术(图6):
- 它固定在一只蚊子钳子夹住后尾状叶。 ,其蒂(图7a)以4-0丝线结扎后切除肺叶。以相同的方式,删除前的尾叶。
- 塑料盒旋转90度。夹住隔膜的右边缘和左侧部位的中位数叶。中叶的双边部的边界的上边缘处作一小切口,然后取出结扎后的左侧部分(图7b)。左外叶蒂以4-0丝线结扎后取出。烧灼切除的肝脏表面,小心地用双极钳。其结果是,是减少了肝脏质量pproximately 50%15(图7C,D)。
- 对于,成形术SHVC(图8):
通过夹紧用:蚊子钳子(图8a)的振动板的两个边缘的位置固定的肝脏。修剪的SHVC前壁通过除去相应的隔膜。两个7-0聚丙烯缝线连接在两个角作为从外部到内部的住宿缝线为后来的吻合(图8b)。然后修剪后壁的SHVC。 - 肝移植存放在4℃在HTK溶液在冷水浴。
5。接收方操作
收件人大鼠的移植在图9中所示的架构。受体手术需要60-70分钟,其中包括10-11分钟的无肝期时间约23日至24日夹紧时间IHVC分钟。
- 执行相同的程序在do也没有操作(3.1至3.4),除了开幕的腹部正中切口,不需双边扩展(图10a)。
- 超过十二指肠和整个肠道的右侧放置一个湿纱布拭子,以获得手术周围IHVC领域。将左外侧叶和中位数左膈下腔,右侧叶,用湿纱布拭向上收回。从腹膜后组织IHVC隔离。结扎和分裂右肾上腺静脉(图10b)。用湿纱布,棉签,旋转到左侧,肝脏并解剖肝的背面的周围的韧带。
- 右侧叶的解剖位置。将湿纱布棉签支付和收回的中位数和左外侧叶向上。在下面的分支,尾状叶胆管断面。胆管周围的软组织,应尽可能地被保留。查看一个的切割端部的第在4毫米长,读胆管结扎。
- 3毫米的距离CHA分支从胃十二指肠动脉和肝动脉结扎和分裂。然后,使动脉的Y结构在结束的CHA。查看一个切口端的适当的肝动脉结扎的线程,在4毫米长。向右侧旋转肝脏用棉签,并解剖肝从左侧的背面周围的韧带。
- 后静脉注射乳酸林格氏液2毫升,用金属微的正上方右侧肾静脉血管钳钳的IHVC。钳位在其分岔水平在肝脏肺门由蚊子钳子从左侧的大鼠门静脉。钳位SHVC通过外围血管钳从右侧与隔膜一起,并夹紧在油基粘土一次性修复指环。
- 减少麻醉与异氟醚0.4%(体积)在无肝期时间(持续时间交叉夹紧门静脉)。海关本地的收件人肝SHVC,门静脉,IHVC在以下几个层次:SHVC SHVC和肝脏之间的边界,在门静脉的解剖,只是上面的蚊子下颚钳; IHVC,稍低于肝脏和右肾静脉(图10c)之间的中间点。原位肝移植。
- 对于通过连续的缝合线(图11)吻合的SHVC:
- 抓血管壁或持有的缝合针在缝合过程中使用的弯曲的微钳在左手。首先,将留在收件人SHVC从内到外的缝合打结(或者你可以将它毕竟缝合手续齐全)在右上角的移植,使用附带的7-0聚丙烯。接着,以同样的方式放置住所述第二缝合在左侧玉米呃,这将是连续缝合针。为了扩大吻合,把握和使用狄见贝基斗牛犬夹在两个角落,温柔的的牵引superiolaterally(图11A,B)保持缝合。
- 皮尔斯左上角的缝合线在通过从外部对接枝侧的壁的内部紧密地外面的结,缝合后的行的SHVC腔内7到8个线圈的右角落(图11c)。使第一几针仔细使内部流明互相面对。出右侧角球,皮尔斯7-0聚丙烯通过血管移植侧的外。
- 接着,从外部的前行缝合,由右至左,与约10针(图11d)。完成前的前行,冲洗内乳酸林格氏液,以消除气泡。进行最后的封针在接近前行可能停留在左上角缝合,然后绑在一起。
- 对于重建门静脉的袖套法(图12):
- 向上缩回的中位数和左外侧叶,用湿纱布拭。收件人夹在它的合流与幽门静脉门静脉使用的一次性微型血管钳从右边。修正蚊子的的镊子夹门静脉粘土,拉尖钳向肝门部(图12A,B)。
- 门静脉前壁切开下颌下方的蚊子钳。收件人门静脉的内侧和压脉袋与乳酸林格氏溶液洗净。握住的切口与在左手和一个扩展的压脉袋具有弯曲的微钳在右手的直链的微钳子前壁。将袖带到受体门静脉深,它与固定周6-0丝线(如图12c-F)。
- 门静脉和SHVC夹具松开,然后再灌注肝。移除的5-ml注射器从大鼠的背面,和异氟醚0.8%(体积)的浓度增加。
- 重建肝动脉的支架技术16(图13):
- 首先,持有由蚊子钳子从左侧收件人正确的肝动脉的线程,它拉向肝脏肺门,然后夹紧收件人CHA从右侧接近胰腺(图13a)。
- 的直链的微钳子,在分叉的Y结构作一小切口,结束时的收件人CHA使一个漏斗形的开口。握住支架上,放入一个弯曲的微型镊子在移植CHA。与肝素 - 钠溶液(100国际单位/毫升)洗涤后,每个管腔,进入再滑动支架cipient CHA,用6-0丝线固定。在收件人CHA此主题的一端和4毫米的螺纹上的接枝CHA配合在一起,从而使这两个CHAS得到彼此更接近的吻合部位(图13b)的张力减少。在那之后,松开夹子。
- 对于通过连续的缝合线(图14)的吻合的IHVC的:
吻合与为SHVC相同的方式,但使用更多的线圈与更精细的咬(图14A-D)。绑在最后一针的缝合线可被消除,或避免吻合口狭窄引起的绑得太紧,可以完成与捆扎的一种生长因子。开模后,增加麻醉的浓度为1.0%(体积)。 ,如果吻合看起来狭窄,扩张吻合部位拉双边住宿的缝合线或扩大轻轻地前行扩大吻合。 - 管理0.5毫升8.4%的碳酸氢钠搜索解决方案n与1.0毫升乳酸林格氏液中静脉滴注。
- 适用于小的片段Tachosil封肝表面,以防止出血和胆漏。
- 重建胆管支架的技术:
- 保持收件人胆管线程从左侧由蚊子钳子。修复蚊子的钳子在粘土中,并拉向肝门部的钳子尖。
- 在适当的水平,所以,做一个小切口在胆管重建胆管不会太长。将在移植胆管支架上,放入到收件人管小心注意,以避免扭曲,并用6-0丝线固定。配合这个线程对收件人的导管和4毫米的螺纹上的接枝导管在一起,以便这两个导管得到彼此更接近与吻合部位的张力降低。
- 重建程序完成时,注入1米升5%葡萄糖溶液中静脉滴注(图15)。
- 确认足够的止血,然后关闭腹部切口,连续4-0薇乔缝线在两层。
6。术后治疗和后续
紧随该操作后,治疗的收件人大鼠皮下注射头孢呋辛钠(16毫克/千克)和丁丙诺啡(0.1毫克/千克)在1.5ml的生理盐水溶液的总。允许的大鼠恢复60分钟,在一个特殊的深切治疗部笼与温热的空气(30-35℃)和氧供应。注射丁丙诺啡(0.1毫克/千克),皮下作为镇痛药,每12小时,3天。之后将老鼠到正常笼,并提供水和食物随意访问。
结果
所有受体大鼠组(n = 20)的成活,无明显的并发症,直到计划安乐死采血1,3,24,和168小时(7天)后,门静脉灌注组(n = 5在每个时间点)。用27号针头直接穿刺从IHVC收集血液样本的。 5,340 xg离心10分钟,离心后,血清样品和丙氨酸氨基转移酶(ALT)水平,这反映了移植后的肝细胞损伤程度进行分析。血清ALT水平的变化的是,在图16中所示的时间-过程。 ALT水平达到高峰,24小时(平均值±标准差:212.6±67.9 IU / L),然后在正常范围之内下降到168小时(33.6±6.8 IU / L)。

图1。袖口门静脉(PV)从14号导管,肝动脉(HA)和胆管(BD)24号导管和支架。
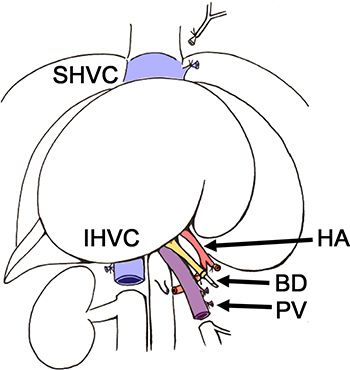
图2。 BD,胆管,HA,肝动脉; IHVC,肝下下腔静脉,PV,门静脉; SHVC,肝上下腔静脉切除的肝脏供体鼠的架构 。

图3。供体手术。一个将大鼠放置在一个加热垫用磁力固定器回缩系统。腹部正中切口,打开双边扩展的胆管支架插入的。经门静脉灌注肝脏。缩写解释在图2中 。

图4。扣押的门静脉压脉袋。 A,B,狄见贝基斗牛犬钳,抓住门静脉主干被放置在金属杯。将杯安装在填充有碎冰的塑料盒,门静脉通过袖带。D,门静脉的壁在压脉袋与在7以外的压脉袋的脾静脉残端外翻点的位置,并在12点钟位置延伸的袖口电子门静脉固定的圆周6-0丝线袖口上。黑色箭头表示的脾静脉残端。
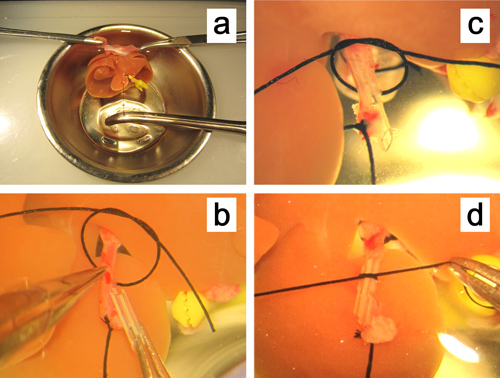
图5。 体外插入到肝动脉的支架。 。肝脏被固定通过夹紧的振动板的两个边缘,和肝动脉被直线牵拉保持动脉结扎的线程。的小切口上的肝动脉的前壁具有直微钳子举行C,D。肝动脉的支架插入,并用6-0丝线固定。

图6。被删除的架构体外 50%的肝切除术。瓣灰色。 ACL,尾状叶; PCL前,后尾状叶; LLL,左外叶; LML,左中叶的部分; RML,右侧部分中叶,SRL,卓越的右侧肺叶,IRL,右下侧叶。
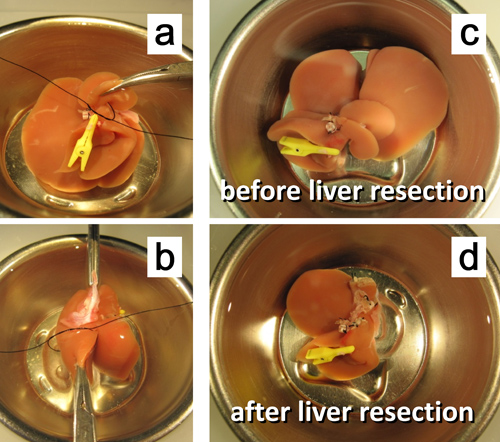
图7 50%。 体外肝切除。 。椎弓根的后尾叶结扎。中叶。C的左部的椎弓根结扎前50%的肝切除。50%后的肝切除。
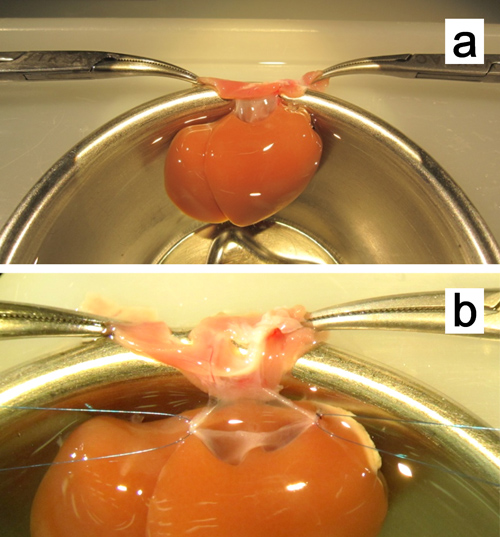
图8。 体外肝上下腔静脉成形术。 。肝脏被固定通过夹紧的振动板的两个边缘与蚊子钳子。,。保持缝合线用7-0聚丙烯的连接在两个角的。
图9所示。接枝收件人大鼠植入的架构。重建程序进行超和肝下腔静脉(SHVC和IHVC)与7-0连续缝合,通过压脉袋的技术,门静脉(PV)和肝动脉(HA)和胆管(BD)的支架技术。
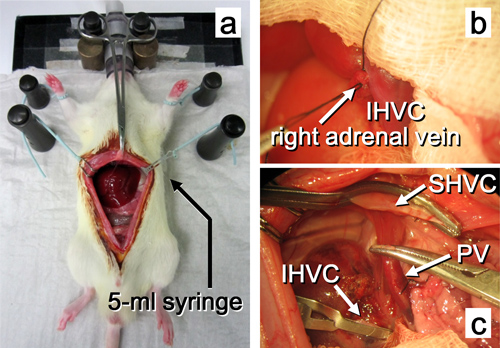
图10。直到本机肝除去受 体手术。 。腹部正中切口打开。右肾上腺静脉结扎。本机的肝脏被切除。在图2中,缩写的解释。
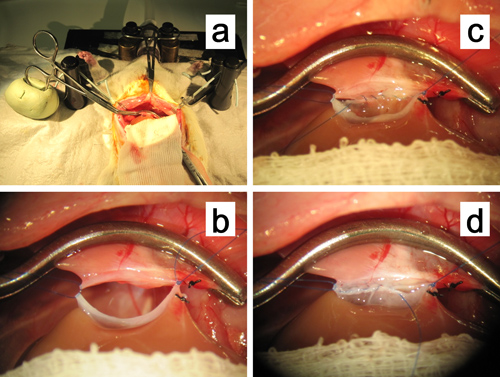
图11。吻合的suprahe的patic腔静脉。 ,为肝上腔静脉的末梢血管钳固定在油基粘土疙瘩。在两个角的住宿缝合保持,轻轻牵引superiolaterally,以扩大吻合。连续腔内缝合后的行进步。。正在进行中前行连续缝合。
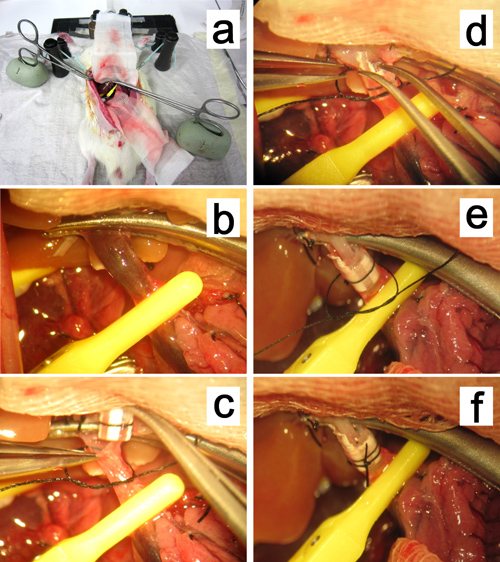
图12。门静脉的重建。 ,。蚊子钳子夹持门静脉被固定在油基粘土被拉向肝脏肺门。 比照袖带进入门静脉中的插入。

图13。肝动脉重建。 A,B。 G>插入到受体肝总动脉分叉处,肝固有动脉(PHA)和胃十二指肠动脉(GDA)(CHA)的支架。

图14。肝下腔静脉吻合。一个在两个角的住宿缝合。连续缝合后的行。C。连续缝合前行。再灌注损伤的肝下腔静脉。在图2中,缩写的解释。
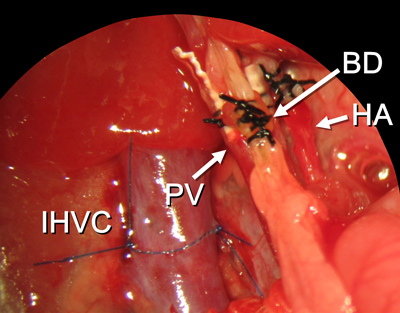
图15。所有重建程序完成。在图2中,缩写的解释。
“图16”SRC =“/ files/ftp_upload/4376/4376fig16.jpg”/>
图16。术后血清丙氨酸转氨酶(ALT)水平的变化的时间过程(= 20,N = 5在每个时间点)。数据被表示为与误差棒表示标准偏差的装置。 ALT水平在24小时达到高峰(212.6±67.9 IU / L),然后在正常范围之内下降到168小时(33.6±6.8 IU / L)。
讨论
Lee 等人报道的第一个模型大鼠OLT于1973年9,所有船只,包括肝动脉重建手工缝制的方法和使用的门体分流术,体外循环。这种模式在技术上是复杂和难以执行。接下来的模型是一个无肝动脉重建和体外分流,开发由同一作者1975年的10。随后在1979年,镰等人介绍了袖套吻合技术的模型无肝rearterialization 11。与这些修改,OLT在大鼠缩短无肝在收件人的操作的时间,简化了,并已被广泛地用作一个公认的实验模型。
然而,相当大的争议,自那时以来,在大鼠肝移植的肝动脉8的意义,因为动脉是一个艰巨的任务,但二倒是不影响移植后的生存。肝动脉,使用各种重建技术的许多研究已报道8,如主动脉段主动脉吻合3,9,17,袖套吻合技术18,19,20,一个可伸缩技术5,支架技术13, 16,以及一个套筒吻合技术12,21-23。虽然该技术对大鼠肝移植仍是不规范的今天,越来越多的动脉模型在其生理优势8,12,13,14的青睐。在上述的技术中,这是简单的和快速的执行的支架技术报道Lehmann 等人在2005年16。该研究显示了优异的成绩:,没有重建肝动脉闭塞率观察8小时,24小时,再灌注后6个月。因此,我们采用了这种技术对肝动脉。
我们PERFOR马手工缝制的吻合重建的SHVC和IHVC。这种方法提供了一个最佳的生理条件下,这会导致血栓形成的发生率降低8吻合部位,并且是最好的显微对外科医生的模拟和训练。此外,吻合口可以是可能的,即使短的容器树桩。关于的吻合IHVC,此方法并不需要很长的IHVC接枝侧与袖带吻合技术相比。因此,当供肾静脉解剖长时间来使接枝IHVC,此方法是适用于一个小的移植物的移植需要一种的长IHVC,如30%的接枝,由右横向和尾状叶和一个短的肝内腔静脉没有SHVC 2。
关于肝切除术的实验研究,至今几种方法的技术已经报道了两个主要技术是的经典质量结扎技术和船舶技术24。我们执行50%肝切除15古典绑带的技术,但在手术显微镜下使程序更细,和剩余的裂片和结构,以避免损坏。
我们描述了具有代表性的结果,在我们的模型中的受体大鼠,大鼠存活在7天的观察期,没有明显的并发症。实验不同的目的选择不同的设置,如长时间冷藏,热缺血时间延长,其中包括捐赠心脏死亡后,使用较小的肝移植或移植的肝损伤或疾病的实验模型,该模型可以修改。
在我们的经验,整个程序可能会影响移植后的生存,最可靠的参数结果大鼠OLT的三个关键因素:失血量,手术时间,Ë特别的门静脉和IHVC的阻断时间,和重建每艘船舶的充分性,这可能会导致管腔狭窄,血栓形成或出血。这种模式在培训期间,大部分故障可能会涉及到这些因素。在这个视频文章中,我们提出了一步一步的指示,为我们的模型大鼠的肝动脉重建的部分OLT的外科手术。 ,虽然大鼠模型的OLT是复杂的,需要先进的显微外科技术,本文提供了大量的实用信息,将其作为这种模式的培训和学习的一个很好的指导。学习此模型有效地缩短的学习期间,减少的数量的动物和实践所需的成本,和购买再现可靠的实验结果是特别重要的。这是符合3R的概念(替代,减少和细化)的动物实验推测,这是由Russell和Burch在1959年25。
披露声明
我们没有利益冲突的披露。大鼠被安置在无特定病原体的情况下,根据实验动物科学协会(FELASA),联合会的指导方针。所有的实验都按照德国联邦法律中有关保护动物的“实验动物护理和使用指南”(美国国立卫生出版物号86-23,1985年修订)。
致谢
该的作者感谢Pascal Paschenda和Mareike舒尔茨提供的技术援助。
材料
| Name | Company | Catalog Number | Comments |
| 名称 | 公司 | 目录编号 | 评论 |
| 手术显微镜 | 徕卡 | M651 | |
| 光源 | 肖特 | KL1500LCD | |
| 棉签 | NOBA Verbandmittel | 974202 | |
| 纱布拭子(5x5厘米) | FUHRMANN | 10002 | |
| 聚维酮碘溶液 | Mundipharma | 6108022.00.01 | |
| 石油为基础的粘土 | Debika公司 | 090148 | |
| TachoSil | 武田制药国际贸易有限责任公司 | EU/1/04/277/001-004 | 适用于肝表面 |
| 手术刀片11号 | pfm医疗 | 200130011 | 的袖口和支架的制备 |
| 14号导管 | 贝朗 | 4268210S | 袖口为PV |
| 18号导管 | 贝朗 | 4268130S | 灌注通过PV |
| 24号导管 | 贝朗 | 4269071S | 支架BD和HA |
| 4-0丝线缝合 | Resorba | H3F | 肝切除术 |
| 6-0丝线缝合 | Resorba | H1F | |
| 7-0聚丙烯缝线(聚丙烯)缝合 | 爱惜 | 8701H | SHVC和IHVC |
| 4-0薇乔缝线 | 爱惜 | V304H | 腹部闭合 |
| 5-ml注射器 | 泰尔茂 | SS + T05ES1 | 背枕 |
| 加热垫 | 热 | 190 x 260毫米 | |
| 磁性固定支架回缩系统 | 精细科学工具有限公司 | 18200-01 18200-02 18200-03 18200-12 | |
| 冷水浴 | 胡贝尔 | 740.000X | 移植保护 |
| 双极钳 | Söring | MBC-200 | |
| 蚊式钳 | BONIMED | 451-476-03 | 使用两对 |
| ADSON微镊子 | Dimeda | 10.176.12 | |
| 弯曲英里CRO钳 | 蛇牌 | FD281R | |
| 直微型镊子 | Bonimed | 451-476-03 | |
| 弯曲的微型剪刀 | Medicon | 83年5月15日 | |
| 直显微剪 | 蛇牌 | FD12 | 精细切口 |
| 剪刀 | 蛇牌 | BC211W | |
| 微针持有人 | 蛇牌 | FD241R | 重建 |
| 市长Hegar持针器 | 瑞穗Ikakogyo | 06-798-00 | 腹部闭合 |
| 狄见贝基斗牛犬钳(直) | ULRICH | CV3054 | |
| 狄见贝基斗牛犬钳(弯) | 科德曼 | 37-1062 | |
| Satinsky钳 | Mizuhoika | 09-230-24 | |
| 周围血管钳 | 泰利福医疗 | 353494 | 收件人SHVC |
| 微血管钳(一次性) | AROSurgical仪器公司 | TKM-1-60克的 | PV,移植IHVC,收件人HA |
| 微型血管夹(金属) | 精细科学工具有限公司 | 18052-01 | 收件人IHVC |
| 乳酸林格氏液 | 费森尤斯卡比 | 6150917.00.00 | |
| 生理盐水溶液 | DeltaSelect | 1299.99.99 | |
| HTK液 | 弗朗茨·克勒博士Chemie GmbH公司 | 31268.00.00 | 保护解决方案 |
| 肝素钠 | Ratiopharm公司 | 5394.02.00 | 500 IU前移植灌注 |
| 8.4%的碳酸氢钠 | 费森尤斯卡比 | 4399.97.99 | 0.5 ml后,再灌注 |
| 5%葡萄糖溶液 | 贝朗 | 6714567.06.00 | 1.0 ml后,再灌注 |
| Cefuroxim钠 | 费森尤斯卡比 | 38985.01.00 | 抗生素,16毫克/公斤 |
| 丁丙诺啡 | 埃塞克斯医药 | 997.00.00 | 止痛药,0.1毫克/千克 |
| 重症监护病房笼 | Brinsea制品有限公司 | Vetario S10 | 术后护理 |
参考文献
- Puhl, G., et al. Low viscosity histidine-tryptophan-ketoglutarate graft flush improves subsequent extended cold storage in University of Wisconsin solution in an extracorporeal rat liver perfusion and rat liver transplantation model. Liver Transpl. 12, 1841-1849 (2006).
- Yagi, S., et al. Improved Preservation and Microcirculation with POLYSOL After Partial Liver Transplantation in Rats. J Surg Res. 167, e375-e383 (2011).
- Engemann, R., Ulrichs, K., Thiede, A., Muller-Ruchholtz, W., Hamelmann, H. Value of a physiological liver transplant model in rats. Induction of specific graft tolerance in a fully allogeneic strain combination. Transplantation. 33, 566-568 (1982).
- Sumimoto, R., Shinomiya, T., Yamaguchi, A. Influence of hepatic arterial blood flow in rats with liver transplants. Examination of donor liver-derived serum class I MHC antigen in rats with liver transplants with or without hepatic arterial reconstruction. Transplantation. 51, 1138-1139 (1991).
- Chaland, P., et al. Orthotopic liver transplantation with hepatic artery anastomoses. Hemodynamics and response to hemorrhage in conscious rats. Transplantation. 49, 675-678 (1990).
- Imamura, H., Rocheleau, B., Cote, J., Huet, P. M. Long-term consequence of rat orthotopic liver transplantation with and without hepatic arterial reconstruction: a clinical, pathological, and hemodynamic study. Hepatology. 26, 198-205 (1997).
- Zhong, Z., Theruvath, T. P., Currin, R. T., Waldmeier, P. C., Lemasters, J. J. NIM811, a mitochondrial permeability transition inhibitor, prevents mitochondrial depolarization in small-for-size rat liver grafts. Am. J. Transplant. 7, 1103-1111 (2007).
- Spiegel, H. U., Palmes, D. Surgical techniques of orthotopic rat liver transplantation. J. Invest. Surg. 11, 83-96 (1998).
- Lee, S., Charters, A. C., Chandler, J. G., Orloff, M. J. A technique for orthotopic liver transplantation in the rat. Transplantation. 16, 664-669 (1973).
- Lee, S., Charters, A. C. 3rd, Orloff, M. J. Simplified technic for orthotopic liver transplantation in the rat. Am. J. Surg. 130, 38-40 (1975).
- Kamada, N., Calne, R. Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 28, 47-50 (1979).
- Howden, B., Jablonski, P., Grossman, H., Marshall, V. C. The importance of the hepatic artery in rat liver transplantation. Transplantation. 47, 428-431 (1989).
- Gao, W., Lemasters, J. J., Thurman, R. G. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 56, 19-24 (1993).
- Zhao, D., Zimmermann, A., Wheatley, A. M. Morphometry of the liver after liver transplantation in the rat: significance of an intact arterial supply. Hepatology. 17, 310-317 (1993).
- Omura, T., Ascher, N. L., Emond, J. C. Fifty-percent partial liver transplantation in the rat. Transplantation. 62, 292-293 (1996).
- Lehmann, T. G., Bunzendahl, H., Langrehr, J. M., Neuhaus, P. Arterial reconstruction in rat liver transplantation--development of a new tubing technique of the common hepatic artery. Transpl. Int. 18, 56-64 (2005).
- Reck, T., et al. Impact of arterialization on hepatic oxygen supply, tissue energy phosphates, and outcome after liver transplantation in the rat. Transplantation. 62, 582-587 (1996).
- Hasuike, Y., et al. A simple method for orthotopic liver transplantation with arterial reconstruction in rats. Transplantation. 45, 830-832 (1988).
- Steffen, R., Ferguson, D. M., Krom, R. A. A new method for orthotopic rat liver transplantation with arterial cuff anastomosis to the recipient common hepatic artery. Transplantation. 48, 166-168 (1989).
- Knoop, M., Bachmann, S., Keck, H., Steffen, R., Neuhaus, P. Experience with cuff rearterialization in 600 orthotopic liver grafts in the rat. Am. J. Surg. 167, 360-363 (1994).
- Hickman, R., Engelbrecht, G. H., Duminy, F. J. A technique for liver transplantation in the rat. Transplantation. 48, 1080(1989).
- Liu, T., Freise, C. E., Ferrell, L., Ascher, N. L., Roberts, J. P. A modified vascular "sleeve" anastomosis for rearterialization in orthotopic liver transplantation in rats. Transplantation. 54, 179-180 (1992).
- Li, J., et al. Modified sleeve anastomosis for reconstruction of the hepatic artery in rat liver transplantation. Microsurgery. 22, 62-68 (2002).
- Martins, P. N., Theruvath, T. P., Neuhaus, P. Rodent models of partial hepatectomies. Liver Int. 28, 3-11 (2008).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. , Methuen & Co. Ltd. London. reprinted by UFAW (1992).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。