Method Article
Procedure chirurgiche per un modello di Rat parziale trapianto di fegato con la ricostruzione arteriosa epatica
In questo articolo
Riepilogo
Trapianto di fegato nei ratti è un modello sperimentale indispensabile per la ricerca biomedica. Qui vi presentiamo le nostre procedure chirurgiche per il trapianto ortotopico di fegato di ratto con la ricostruzione arteriosa epatica con un trapianto parziale del 50%.
Abstract
Trapianto di fegato (OLT) nei ratti utilizzando un innesto totale o parziale, è indispensabile un modello sperimentale per la ricerca trapianto, come ad esempio gli studi sulla conservazione del trapianto e ischemia-riperfusione 1,2 lesioni, risposte immunologiche 3,4, 5,6 emodinamica, e di piccole dimensioni per la sindrome di 7. La OLT ratto è tra i modelli animali più difficili in chirurgia sperimentale e microchirurgia richiede competenze avanzate che richiedono molto tempo per imparare. Di conseguenza, l'uso di questo modello è stato limitato. Dal momento che l'affidabilità e la riproducibilità dei risultati sono componenti chiave degli esperimenti in cui si utilizzano tali modelli animali complessi, è fondamentale per i chirurghi che sono coinvolti nel OLT ratto per essere addestrato nelle procedure ben standardizzate e sofisticata per questo modello.
Mentre varie tecniche e modifiche di OLT nei ratti sono stati riportati 8 Poiché il primo modello è stato descried da Lee et al. 9 nel 1973, l'eliminazione della arteria epatica ricostruzione 10 e l'introduzione della tecnica anastomosi bracciale da Kamada et al. 11 erano un avanzamento importante in questo modello, perché semplificato le procedure di ricostruzione in grande misura . Nel modello da Kamada et al., Il rearterialization epatica è stato eliminato. Dal momento che i ratti possono sopravvivere in assenza di flusso in arteria epatica dopo trapianto di fegato, vi è stata polemica considerevole rispetto al valore di arterialization epatica. Tuttavia, la superiorità del modello fisiologico arterializzato è stato sempre più riconosciuto, soprattutto in termini di preservazione del sistema biliare 8,12 e dell'integrità fegato 8,13,14.
In questo articolo, vi presentiamo dettagliate procedure chirurgiche per un modello murino di OLT con ricostruzione arteriosa epatica con un innesto parziale del 50% dopo resezione epatica ex vivozione. Le procedure di ricostruzione per ciascuna nave e il dotto biliare vengono eseguite con i seguenti metodi: un 7-0 sutura in polipropilene continuo per la sovra-e sottoepatica vena cava; una tecnica bracciale per la vena porta, e una tecnica di stent per l'arteria epatica e il dotto biliare.
Protocollo
1. Tecniche di base e procedure comuni
- Tutte le procedure vengono eseguite in condizioni di pulizia, ma non sterili.
- Una volta che l'addome del ratto è aperto, tutte le procedure sono eseguite sotto un microscopio chirurgico a un ingrandimento di 16x. Eccezioni sono la resezione epatica ex vivo, che viene eseguita a 10x, e le procedure seguenti, che vengono realizzate a 25x: inserimento di uno stent nel dotto biliare e l'arteria epatica, e la ricostruzione dell'arteria epatica, la vena cava sottoepatica (IHVC), e il dotto biliare.
- Tamponi di cotone vengono utilizzati per la manipolazione delicata di organi, scollamento dei tessuti, emostasi e compressione. Tamponi di garza (5 x 5 cm) imbevuti di soluzione di Ringer lattato vengono utilizzate per ritrarre il fegato o l'intestino, e per mantenere gli organi umido. Il morsetto Satinsky può essere utilizzato per la retrazione di garza ricoperte intestini verso sinistra o la coda del topo di ampliare il campo chirurgico intorno IHVC.
- Tutti legature sono eseguite con un filo di seta 6-0 esclusi i peduncoli di lobi di fegato durante la resezione epatica ex vivo, in cui sono utilizzati fili di seta 4-0. La legatura può essere tirato da un morsetto DeBakey Bulldog o altri strumenti per fornire adeguata tensione al punto ligato in modo che la seconda legatura può essere effettuata ad una distanza alla prima, e la divisione tra i due punti ligato può essere fatto correttamente.
- Tutte le iniezioni endovenose vengono effettuate attraverso la vena del pene.
- Durante le procedure di ricostruzione relativo sovraepatica vena cava (SHVC), la vena porta, l'arteria epatica, e il dotto biliare, un piccolo nodulo di argilla a base di olio è usato per tenere un anello di dito di una pinza vascolare periferica o un forcipe zanzare per mantenerli in posizione fissa.
2. Preparazione prechirurgica
- Ratti Lewis maschi di peso compreso tra 230 e 250 g vengono utilizzati come donatori e riceventi di trapianto di fegato. I ratti sono tuttidovuto il libero accesso all'acqua e al cibo fino a quando l'induzione dell'anestesia.
- Bracciale per la vena porta (Figura 1): Preparare il bracciale per la vena porta, tagliando un 14-gauge catetere con una lama di bisturi No. 11 al microscopio. Il bracciale è costituito da un corpo e un interno, ciascuno con una lunghezza di 2 mm. Eseguire scanalature circonferenziali sul manicotto serrando la parete del manicotto passo per passo circonferenziale con una pinza zanzara modo che un filo può essere fissato saldamente sul bracciale senza scivolare.
- Stent per il dotto biliare e dell'arteria epatica (Figura 1): Cut 24-gauge cateteri con un bisturi al microscopio per produrre smussi ad entrambe le estremità dei cateteri con una lunghezza di 4 mm per l'arteria epatica e 5 mm per il dotto biliare .
3. Donatori di funzionamento
Lo schema della rimozione del fegato di ratto dal donatore è mostrato in Figura 2. Questa procedura richiede circacarta di circa 30-35 min.
- Anestetizzare il ratto con l'inalazione del 4% vol isoflurano in ossigeno al 100% ad una portata di 4 L / min per l'induzione di anestesia, e 1,5% vol a 2 L / min per la manutenzione. Iniettare buprenorfina (0,1 mg / kg) per via sottocutanea come analgesico. Posizionare il ratto su una piastra elettrica, e fissare i bracci superiori con il sistema di retrazione magnetico fissatore (Figura 3a). Accorciare il pelo da tutta l'area addominale del ratto, e sterilizzare la pelle corrispondente con un povidone-iodio soluzione.
- Aprire l'addome con una incisione mediana con estensioni bilaterali. Inserire un 5-ml siringa sotto la parte posteriore del ratto in modo che il SHVC è elevato ventralmente. Utilizzando una pinza zanzara, bloccare e tirare il processo xifoideo verso la testa, e applicare le sottocostale divaricatori per aprire il campo operatorio (Figura 3a).
- Sezionare il legamento falciforme e sinistra legamento triangolare. Avanti, legare e sezionare la vena sinistra frenico.
- Retragiscono i lobi mediani e laterali a sinistra verso l'alto con un tampone di garza bagnata. Utilizzando pinze bipolari, coagulare e dividere i para-esofageo navi tra il lobo caudato sinistro laterale e anteriore.
- Spostare l'intestino fuori dell'addome sul lato sinistro del ratto, e coprire con un tampone di garza bagnata. Ritrarre il lobo laterale destro verso l'alto con un tampone di garza bagnata. Isolare la IHVC dal tessuto retroperitoneale, e legare la vena surrenalica destra, che verrà successivamente diviso appena prima della rimozione dell'innesto.
- Per inserire uno stent nel dotto biliare (Figura 3b):
- Legare il dotto biliare a livello della ramificazione dell'arteria gastroduodenale. I tessuti molli circostanti dotto biliare dovrebbe essere preservata il più possibile, e la separazione del dotto biliare dall'arteria epatica deve essere evitato per garantire sufficiente fornitura di sangue arterioso al dotto biliare.
- Con le forbici rette micro, fare una piccola incisione nel anterio parete del dotto biliare prossimale al punto ligato. Tenendo la parete anteriore della incisione con una pinzetta dritto micro nella mano sinistra, inserire uno stent nel dotto utilizzando un micro pinze curve nella mano destra, e fissarla con un filo di seta 6-0. Una delle estremità tagliate del filo sul dotto biliare è mantenuto ad una lunghezza di 4 mm in modo che il filo può essere tenuta durante la successiva anastomosi.
- Liberate la vena porta dalle vene pilorico e splenico legando e dividendoli.
- Legare e sezionare l'arteria gastroduodenale, quindi isolare l'arteria epatica comune (CHA) dalla testa pancreatica alla sua radice. Ruotare il fegato a destra con tamponi di cotone, e sezionare il legamento intorno alla parte posteriore del fegato e dell'esofago.
- Al completamento della preparazione per escissione fegato, rimuovere i divaricatori, la pinza zanzara per il processo xifoideo, e il 5-ml siringa sotto la parte posteriore del ratto. Ritorna l'intestino al abdominal cavità.
- Iniettare 500 UI di eparina-Natrium in 2 ml di soluzione fisiologica attraverso la vena del pene. Circa 3 minuti dopo, reimpostare la siringa da 5 ml, la pinza di zanzara, e divaricatori. Legare il CHA prossimali alla sua radice. Mantenere una delle estremità tagliate del filo ligato per il CHA lungo.
- Dopo aver fissato la chiusura IHVC alla vena renale destra con una pinza zanzara, bloccare la vena porta con una fascetta monouso nave micro sotto il moncone della vena splenica. Incidere la parete anteriore della vena porta, e inserire un 18-gauge catetere nella vena porta.
- Perfusione del fegato in situ con 60 ml di freddo istidina-triptofano-chetoglutarato (HTK) soluzione ad una pressione idrostatica di 20 cm H 2 O. Subito dopo, tagliare il diaframma e il transetto intratoracica vena cava, e tagliare la parete anteriore del IHVC aperta per consentire alla soluzione di perfusione essere risciacquata del fegato (figura 3c).
- Bloccare il IHVC con una disposable nave micro pinza appena sotto il fegato. Accise fegato da dissezione del IHVC leggermente al di sotto del punto di mezzo tra il fegato e la vena renale destra, la vena porta al di sotto del moncone della vena splenica, il diaframma, i legamenti restanti nella parte posteriore del fegato, la vena surrenalica destra, e il CHA alla radice. Mettere il fegato asportato in soluzione HTK freddo in una tazza di metallo montato in una scatola di plastica piena di ghiaccio tritato.
4. Ex vivo innesto Preparazione
Tutte le procedure di trapianto di fegato vengono eseguite in tazza metallico riempito con soluzione ghiacciata HTK. L'ex preparazione trapianto in vivo richiede circa 30 min.
- Per il fissaggio di un bracciale alla vena porta (Figura 4):
Fissare il tronco venoso portale con una fascetta DeBakey Bulldog. Posizionare il morsetto in posizione superare la tazza (Figura 4a, b). Mettete la vena porta attraverso il bracciale, e serrarela vena porta di nuovo insieme con l'estensione del bracciale nella posizione ore 12 (Figura 4c). Evert parete della vena porta sul bracciale per posizionare il moncone della vena splenica esterno del manicotto nella posizione 7:00 (figura 4d), e fissare la vena porta con un filo di seta 6-0 (Figura 4e) . - Per inserire uno stent nell'arteria epatica (Figura 5):
Fissare il fegato fissando entrambi i bordi del diaframma con il forcipe, e tirare il CHA dritto tenendo il filo ligato con il Bulldog DeBakey pinza (Figura 5a). Con le forbici rette micro, fare una piccola incisione nella parete anteriore del CHA. Con la mano sinistra, tenere la parete anteriore della incisione con un forcipe micro diritte, e con la mano destra, inserire uno stent nelle CHA usando un micro pinze curve. Lo stent viene preventivamente lavata con eparina-Natrium soluzione (100 UI / ml) (Figura 5b-d). Secure lo stent con filo di seta 6-0, e mantenere una delle estremità tagliate del filo ad una lunghezza di 4 mm. Lavare il fegato attraverso il catetere arterioso con 5 ml di soluzione di HTK freddo. - Per resezione epatica 50% (Figura 6):
- Bloccare il lobo posteriore caudato con una pinza di zanzara per risolvere il problema posto. Resecare il lobo dopo la legatura del peduncolo con un filo di seta 4-0 (figura 7a). Allo stesso modo, rimuovere il lobo anteriore caudato.
- Ruotare la scatola di plastica di 90 gradi. Serrare il bordo destro del diaframma e la porzione sinistra del lobo mediano. Una piccola incisione sul bordo superiore del bordo delle porzioni bilaterali del lobo mediano, e quindi rimuovere la porzione sinistra dopo legatura (figura 7b). Rimuovere il lobo laterale sinistro dopo la legatura del peduncolo con un filo di seta 4-0. Cauterizzare la superficie epatica resecata accuratamente con pinza bipolare. Come risultato, la massa fegato è ridotto di unapproximately 50% 15 (figura 7c, d).
- Per plasty del SHVC (Figura 8):
Fissare la posizione del fegato serrando i due lati della membrana con una pinza zanzara (Figura 8a). Tagliare la parete anteriore del SHVC rimuovendo il diaframma corrispondente. Collegare due 7-0 suture in polipropilene dall'esterno verso l'interno in entrambi gli angoli come rimanere punti di sutura per l'anastomosi successiva (figura 8b). Poi tagliare la parete posteriore della SHVC. - Memorizzare l'innesto fegato a 4 ° C in soluzione HTK in un bagno di acqua fredda.
5. Destinatario di funzionamento
Lo schema del fissaggio dell'innesto nel ratto ricevente è illustrato nella Figura 9. L'operazione richiede destinatario 60-70 min, che comprende 10-11 min di tempo anepatica e circa 23-24 min di IHVC tempo di bloccaggio.
- Eseguire le stesse procedure in doné il funzionamento (da 3.1 a 3.4), tranne per l'apertura dell'addome da una incisione mediana, senza estensioni bilaterali (Figura 10a).
- Inserire un tampone umido garza sul lato destro del duodeno e nell'intestino interi per ottenere un campo chirurgico intorno IHVC. Mettere i lobi laterali di sinistra e mediana nella cavità sinistra subfrenico, e ritirare il lobo destro laterale verso l'alto con un tampone di garza bagnata. Isolare il IHVC dal tessuto retroperitoneale. Legare e sezionare la vena surrenalica destra (Figura 10b). Con tamponi bagnati garza e cotone, ruotare il fegato a sinistra, e sezionare il legamento intorno alla parte posteriore del fegato.
- Riportare il lobo laterale destro in posizione anatomica. Collocare un tampone di garza bagnata per coprire e ritrarre i lobi mediani e laterali a sinistra verso l'alto. Transetto del dotto biliare appena sotto il ramo dal lobo caudato. I tessuti molli circostanti dotto biliare dovrebbe essere preservata il più possibile. Mantenere una delle estremità tagliate del thleggere legato per via biliare a 4-mm di lunghezza.
- Legare e sezionare l'arteria gastroduodenale e l'arteria epatica propria a 3 mm la distanza dalla diramazione dal CHA. Poi a Y-struttura dell'arteria alla fine del CHA. Mantenere una delle estremità tagliate del filo ligato per l'arteria epatica propria a 4 mm. Ruotare il fegato a destra con tamponi di cotone, e sezionare il legamento intorno alla parte posteriore del fegato dal lato sinistro.
- Dopo l'iniezione endovenosa di 2 ml di soluzione di Ringer lattato, bloccare il IHVC con una fascetta metallica micro nave appena sopra la vena renale destra. Fissare la vena porta al livello della biforcazione nel ilo epatico da una pinza zanzara dal lato sinistro del ratto. Bloccare il SHVC insieme con il diaframma dal lato destro da una pinza vascolare periferica, e fissare l'anello dito della pinza in un grumo di olio a base di argilla.
- Ridurre l'anestesia con isoflurano al 0,4% vol durante il tempo anepatica (la duratadi bloccaggio trasversale della vena porta). Accisa del destinatario fegato nativo sezionando il SHVC, la vena porta, e la IHVC ai livelli seguenti: il SHVC, al confine tra la SHVC e il fegato, e la vena porta, appena sopra la mascella della pinza zanzare, e la IHVC, leggermente al di sotto del punto di mezzo tra il fegato e la vena renale destra (Figura 10c). Posizionare l'innesto del fegato ortotopicamente.
- Per l'anastomosi del SHVC da una sutura continua (Figura 11):
- Utilizzare una pinza curva micro nella mano sinistra durante la procedura di sutura per afferrare la parete del vaso o tenendo l'ago di sutura. In primo luogo, inserire la sutura soggiorno in SHVC destinatario dall'interno verso l'esterno utilizzando l'allegato 7-0 polipropilene nell'angolo destro del trapianto seguito da un nodo (o si può legare dopo che tutte le procedure sono state completate sutura). Quindi, posizionare la sutura secondo soggiorno in modo analogo al mais sinistraer, che sarà il punto di partenza di una sutura continua. Per ampliare l'anastomosi, afferrare e mantenere le suture con DeBakey fascette bulldog ad entrambi gli angoli con una leggera trazione superiolaterally (figura 11 a, b).
- Pierce la sutura nell'angolo sinistro attraverso la parete sul lato innesto dall'esterno verso l'interno verso l'esterno da vicino nodo, e suturare la fila posteriore del SHVC endoluminale con 7-8 punti verso l'angolo destro (Figura 11c). Effettuare i primi punti con attenzione in modo che i lumi interni sono uno di fronte all'altro. All'angolo destro, forare il 7-0 polipropilene attraverso la nave sul lato dell'innesto verso l'esterno.
- Successivamente, suturare la riga anteriore dall'esterno, da destra a sinistra, con circa 10 punti (Figura 11d). Prima del completamento della fila anteriore, lavare l'interno con soluzione di Ringer lattato per rimuovere le bolle d'aria. Fare l'ultimo punto nella fila anteriore, il più vicinopossibile la sutura soggiorno al sinistro, e poi legarli insieme.
- Per la ricostruzione della vena porta mediante una tecnica di bracciale (Figura 12):
- Ritrarre i lobi mediani e laterali a sinistra verso l'alto con un tampone di garza bagnata. Bloccare la vena porta destinatario a sua confluenza con la vena pilorica utilizzando una fascetta monouso micro nave da destra. Fissare la pinza zanzara che blocca la vena porta in argilla, e tirare la punta della pinza verso l'ilo del fegato (Figura 12a, b).
- Incidere la parete anteriore della vena porta appena sotto la mascella della pinza zanzara. Lavare l'interno della vena porta ricevente e il bracciale con soluzione di Ringer lattato. Tenere la parete anteriore della incisione con un forcipe diritte micro nella mano sinistra e un ampliamento del bracciale con pinze curve micro nella mano destra. Inserire la cuffia nella vena porta del destinatario profondamente, e fissarlo con unacirconferenziale 6-0 filo di seta (Figura 12c-f).
- Rilasciare i morsetti della vena porta e SHVC, e poi reperfuse il fegato. Rimuovere il 5-ml siringa dal retro del ratto, e aumentare la concentrazione di isoflurano a 0,8% vol.
- Per la ricostruzione dell'arteria epatica mediante una tecnica di stent 16 (Figura 13):
- In primo luogo, tenere il filo del proprio dell'arteria epatica destinatario da una pinza zanzara dal lato sinistro, e tirarlo verso l'ilo del fegato, e quindi bloccare i CHA destinatario dalla chiusura lato destro per il pancreas (Figura 13a).
- Con una pinza micro diritte, fare una piccola incisione nella biforcazione della Y-struttura alla fine del CHA destinatario di un imbuto di apertura. Tenere lo stent collocati nelle CHA innesto con una pinza curva micro. Dopo lavaggio con ciascun lume Heparin Natrium-soluzione (100 UI / ml), far scorrere lo stent nella reCHA cipient e fissarla con un filo di seta 6-0. Tie una fine di questo thread sul CHA destinatario e il 4-mm filettatura dei CHA innestare insieme in modo che entrambi Chas avvicinarsi l'uno all'altro con tensione ridotta del sito di anastomosi (Figura 13b). Dopo di che, allentare il morsetto.
- Per l'anastomosi del IHVC da una sutura continua (Figura 14):
Anastomizzano nello stesso modo come per il SHVC, ma utilizzare più punti con morso più fine (Figura 14a-d). Legatura delle suture presso l'ultimo punto può essere eliminato, o legatura può essere realizzato con un fattore di crescita per evitare la stenosi dell'anastomosi causato legando troppo stretto. Dopo declamping, aumentare la concentrazione di anestesia al 1,0% vol. Se l'anastomosi appare stenotico, dilatano il sito anastomosi tirando le suture bilaterali o ampliando la fila anteriore delicatamente per espandere l'anastomosi. - Somministrare 0,5 ml di bicarbonato di sodio 8,4% solution con 1,0 ml di soluzione di Ringer lattato per via endovenosa.
- Applicare piccoli frammenti di TachoSil per sigillare la superficie del fegato resecata per prevenire le emorragie e perdite biliari.
- Per la ricostruzione del dotto biliare mediante una tecnica di stent:
- Tenere il filo del dotto biliare destinatario da una pinza zanzara dal lato sinistro. Fissare la pinza zanzara nella creta, e tirare la punta della pinza verso l'ilo del fegato.
- Fai una piccola incisione nel dotto biliare al livello appropriato in modo che il dotto biliare ricostruito non sarebbe troppo lungo. Inserire lo stent inserito nel dotto biliare innesto nel condotto destinatario con attenzione al fine di evitare una torsione, e fissarla con un filo di seta 6-0. Legare questo thread sul condotto destinatario e il 4-mm filetto sul condotto dell'innesto insieme in modo che entrambi i condotti avvicinarsi l'uno all'altro con tensione ridotta del sito di anastomosi.
- Al termine delle procedure di ricostruzione, iniettare 1 ml di soluzione di glucosio 5% per via endovenosa (Figura 15).
- Conferma emostasi adeguata, e quindi chiudere l'incisione addominale da continui punti di sutura Vicryl 4-0 in due strati.
6. Il trattamento postoperatorio e follow-up
Subito dopo l'operazione, trattare il ratto ricevente con una iniezione sottocutanea di cefuroxima sodica (16 mg / kg) e buprenorfina (0,1 mg / kg) in un totale di 1,5 ml di soluzione fisiologica. Permettono di recuperare il ratto per 60 min in una gabbia speciale unità di terapia intensiva con aria calda (30-35 ° C) e una fornitura di ossigeno. Iniettare buprenorfina (0,1 mg / kg) per via sottocutanea come analgesico ogni 12 ore per 3 giorni. Poi spostare il topo in una gabbia normale, e di fornire l'accesso ad libitum ad acqua e cibo.
Risultati
Tutti i ratti destinatario (n = 20) sono sopravvissuti senza complicazioni apparenti fino a quando l'eutanasia previsto per il prelievo del sangue a 1, 3, 24, e 168 ore (7 giorni) dopo la riperfusione portale (n = 5 ad ogni tempo). I campioni di sangue sono stati prelevati dalla IHVC da una puntura diretta con un ago di calibro 27. Dopo la centrifugazione a 5340 xg per 10 minuti, i campioni di siero sono stati ottenuti e analizzati per alanina aminotransferasi (ALT), che riflettono il grado di danno epatocellulare dopo il trapianto. Il tempo impiegato per cambiamenti nei livelli sierici di ALT è mostrato in Figura 16. I livelli di ALT ha raggiunto un picco a 24 ore (media ± deviazione standard: 212,6 ± 67,9 IU / L), per poi scendere entro i limiti normali a 168 ore (33,6 ± 6,8 UI / L).

Figura 1. A bracciale per la vena porta (PV) da 14-calibro del catetere, e stent per l'arteria epatica (HA) e del dotto biliare (BD) da 24-gauge cateteri.
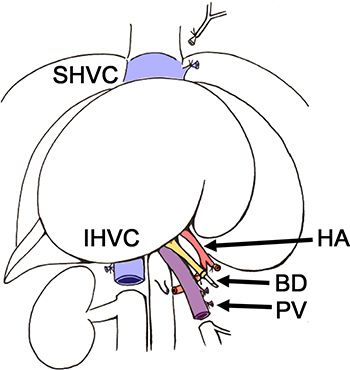
Figura 2. Schema della rimozione del fegato da donatore ratto BD, del dotto biliare,. HA, arteria epatica; IHVC, sottoepatica vena cava, PV, della vena porta, SHVC, sovraepatica vena cava.

Figura 3. Donatore funzionamento. a. Il ratto viene posto su una piastra elettrica con un sistema magnetico retrazione fissatore. L'addome viene aperto da una incisione mediana con estensioni bilaterali. B. Inserimento dello stent nel dotto biliare. C. Perfusione del fegato attraverso la vena porta. Abbreviazioni sono spiegareed in Figura 2.

Figura 4. Fissaggio di un bracciale alla vena porta. a, b. La pinza DeBakey Bulldog che afferra il tronco venoso portale viene posta sopra la tazza di metallo. La coppa è montato nella scatola di plastica riempito di ghiaccio tritato. C. La vena porta è messa attraverso il bracciale. D. La parete della vena porta è rovesciato sopra il bracciale con il moncone della vena splenica fuori il bracciale al 7 posizione ore e l'estensione del bracciale nella posizione delle ore 12. e. La vena porta è fissata con un filo di seta circonferenziale 6-0 sul bracciale. Le frecce nere indicano il moncone della vena splenica.
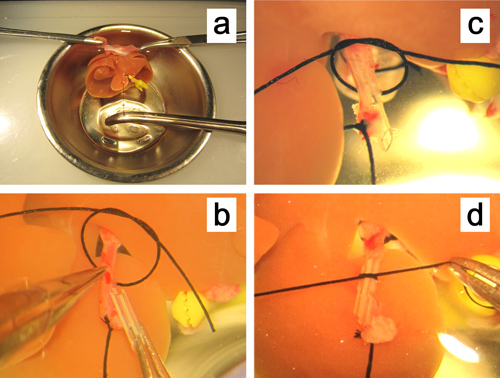
Figura 5. Ex vivoinserimento di uno stent nell'arteria epatica. a. Il fegato è fissata serrando entrambi i bordi del diaframma, e l'arteria epatica viene tirato dritto tenendo il filo ligato per l'arteria. b. La parete anteriore della piccola incisione sulla arteria epatica è tenuto con una pinza diritte micro . c, d. Lo stent viene inserito nell'arteria epatica e fissato con un filo di seta 6-0.

Figura 6. Lo schema di resezione epatica ex vivo al 50%. Lobi in colore grigio vengono rimossi. ACL, anteriore lobo caudato, PCL, lobo caudato posteriore; LLL, lobo sinistro laterale; LML, parte sinistra del lobo mediano, RML, parte destra del lobo mediano, SRL, superiore del lobo laterale destro, IRL, inferiore del lobo laterale destro.
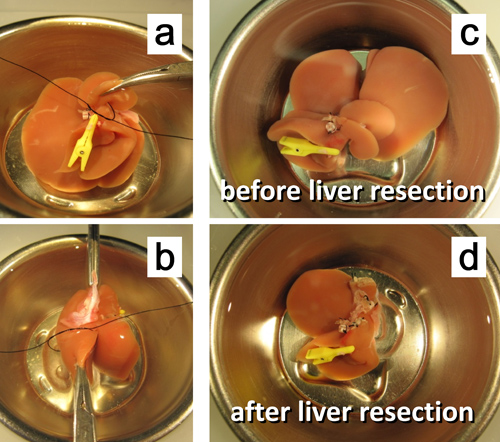
Figura 7. Ex resezione epatica vivo 50%. un. legatura del peduncolo del lobo caudato posteriore. b. legatura del peduncolo della porzione sinistra del lobo mediano. c. Il fegato prima 50% resezione. d. fegato dopo resezione 50%.
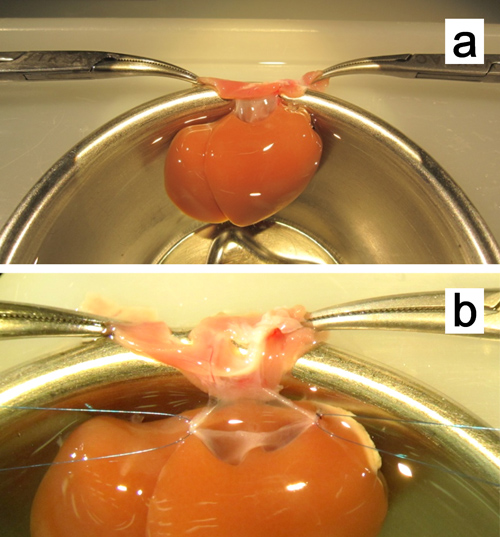
Figura 8. Ex vivo plasty del sovraepatica vena cava. a. Il fegato è fissata serrando i due lati della membrana con le pinzette zanzara. b. Soggiorno con suture 7-0 polipropilene sono collegati ad entrambi gli angoli.

Figura 9. Schema di impianto dell'innesto nel ratto ricevente. Le procedure di ricostruzione vengono eseguite per il sovra-e sottoepatica vena cava (SHVC e IHVC) con una sutura 7-0 continuo, la vena porta (PV) mediante una tecnica di bracciale, e l'epatica arteria (HA) e del dotto biliare (BD) mediante una tecnica stent.
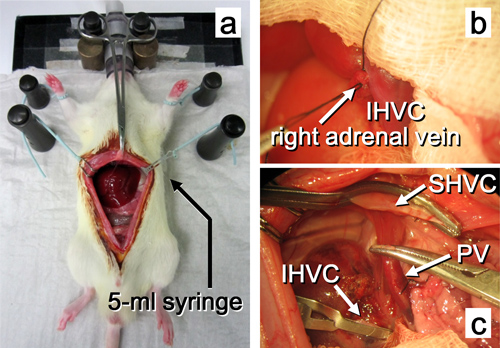
Figura 10. Funzionamento beneficiario fino alla rimozione del fegato nativo. a. L'addome viene aperto da una incisione mediana. b. La vena surrenalica destra è legato. c. il fegato nativo viene asportato. Abbreviazioni sono illustrate nella Figura 2.
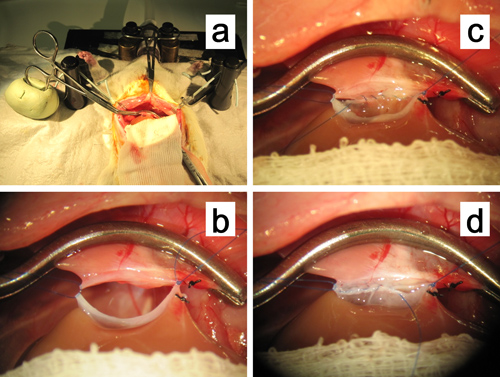
Figura 11. Anastomosi del suprahepatico vena cava. a, b. La pinza vascolare periferica per la vena cava sovraepatica è fissato in un grumo di olio a base di argilla. Le suture in entrambi gli angoli sono mantenuti con una leggera trazione superiolaterally per allargare l'anastomosi. C. Continua sutura intraluminale della fila posteriore in corso. D. Sutura continua della fila anteriore in corso.
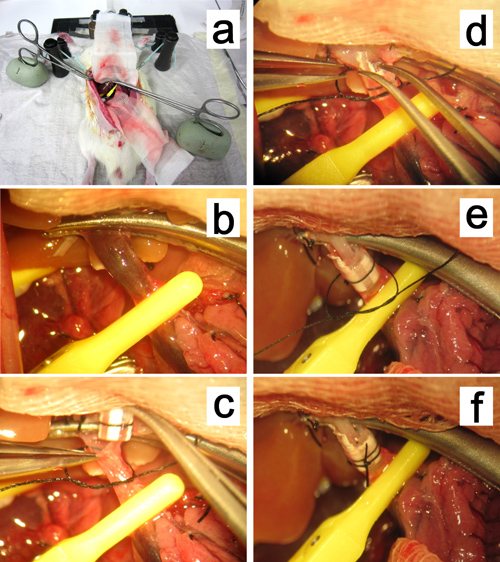
Figura 12. Ricostruzione della vena porta. a, b. La pinza di serraggio zanzara vena porta è fissato in argilla a base di olio e tirato verso l'ilo epatico. cf. Inserimento del bracciale nella vena porta.

Figura 13. Ricostruzione dell'arteria epatica. a, b. g inserimento> di uno stent nell'arteria epatica comune destinatario (CHA) alla biforcazione dell'arteria epatica propria (PHA) e dell'arteria gastroduodenale (GDA).

Figura 14. Anastomosi del sottoepatica vena cava. a. Le suture in entrambi gli angoli. b. sutura continua della fila posteriore. c. sutura continua della fila anteriore. d. riperfusione del sottoepatica vena cava. Abbreviazioni sono illustrate nella Figura 2.
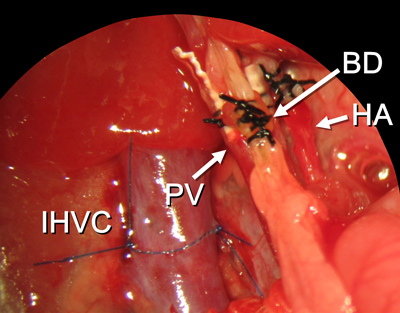
Figura 15. Tutte le procedure di ricostruzione sono finiti. Abbreviazioni sono illustrate nella Figura 2.
"Figura 16" src = "/ files/ftp_upload/4376/4376fig16.jpg" />
Figura 16 postoperatoria time-course delle variazioni di sierici di alanina aminotransferasi (ALT) (n = 20; n = 5 in ogni punto).. I dati sono espressi come medie con barre di errore che indicano deviazioni standard. I livelli di ALT ha raggiunto un picco a 24 ore (212,6 ± 67,9 IU / L), per poi scendere entro i limiti normali a 168 ore (33,6 ± 6,8 UI / L).
Discussione
Il primo modello di OLT ratto è stato riportato da Lee et al. Nel 1973 9, in cui tutte le navi comprese dell'arteria epatica sono stati ricostruiti da un cucita a mano e il metodo shunt porto extracorporeo è stato utilizzato. Questo modello era tecnicamente complicato e difficile da eseguire. Il modello successivo è stato uno senza ricostruzione arteriosa epatica e lo shunt extracorporea, sviluppato dagli autori stessi 10 nel 1975. Successivamente, nel 1979, Kamada et al. Ha introdotto la tecnica di anastomosi bracciale per il modello senza rearterialization epatica 11. Con queste modifiche, OLT nei ratti è stato semplificato con un tempo anepatica abbreviato in operazioni destinatario ed è stato ampiamente utilizzato come modello sperimentale accettato.
Tuttavia, non vi è stata da allora notevoli controversie sul significato di arterialization epatica nel ratto OLT 8 perché il arterialization è stato un compito impegnativo, ma did non influenzano la sopravvivenza dopo il trapianto. Numerosi studi su arterialization epatica utilizzando varie tecniche di ricostruzione sono stati riportati 8, ad esempio un segmento aortico-to-aorta anastomosi 3,9,17, una tecnica di anastomosi bracciale 18,19,20, una tecnica telescopica 5, una tecnica stent 13, 16, e una tecnica di anastomosi manicotto 12,21-23. Mentre la tecnica di OLT ratto non è ancora standardizzata oggi, il modello arterializzato è stata sempre favorita in termini di superiorità fisiologica 8,12,13,14. Tra le tecniche sopra menzionate, una tecnica stent che era semplice e veloce per eseguire stata riportata da Lehmann et al. 16 del 2005. Lo studio ha mostrato ottimi risultati: no rate occlusione è stata osservata in arteria epatica ricostruito a 8 ore, 24 ore, e 6 mesi dopo la riperfusione. Abbiamo quindi adottato questa tecnica per arterialization epatica.
Abbiamo Performa cucito a mano anastomosi per la ricostruzione del SHVC e IHVC. Questo metodo fornisce il sito anastomosi con una condizione ottimale fisiologica, che porta alla ridotta incidenza di trombosi 8, ed è la migliore simulazione microchirurgia e formazione per i chirurghi. Inoltre, l'anastomosi può essere possibile anche con ceppi vaso brevi. Concernente l'anastomosi di IHVC, questo metodo non richiede una lunga IHVC sul lato dell'innesto rispetto alla tecnica anastomosi bracciale. Pertanto, quando la vena renale donatore è sezionato per rendere il IHVC innesto lungo, questo metodo è applicabile al trapianto di un piccolo innesto che necessita di un IHVC lungo, come un innesto 30% che consiste di lobi laterali destra e caudato con intraepatico breve vena cava senza SHVC 2.
Per quanto riguarda le tecniche di resezione del fegato nei ratti, fino ad oggi diversi metodi sono stati segnalati, le due tecniche principali sono la classica tecnica della legatura di massae la nave orientato tecnica 24. Abbiamo eseguire la tecnica classica legatura per resezione epatica 50% 15, ma sotto un microscopio chirurgico per rendere la procedura più fine, e per evitare danni ai lobi rimanenti e strutture.
Abbiamo descritto i risultati rappresentativi dei ratti destinatario nel nostro modello, i topi sono sopravvissuti durante il periodo di 7 giorni di osservazione senza complicazioni apparenti. Il modello può essere modificato per scopi diversi esperimenti scegliendo le impostazioni diverse, come prolungato stoccaggio a freddo, prolungata ischemia calda che comprende donazione dopo morte cardiaca, e l'utilizzo di fegati piccole o innesti di modelli sperimentali di danno al fegato o malattie.
Nella nostra esperienza, ci sono tre fattori chiave delle procedure che possono influenzare la sopravvivenza dopo il trapianto, il parametro più affidabile per i risultati di OLT ratto: la quantità di perdita di sangue, il tempo di funzionamento, gli eappositamente bloccaggio tempo della vena porta e IHVC, e l'adeguatezza della ricostruzione di una nave, che potrebbe causare una stenosi, trombosi, o sanguinamento. In un periodo di formazione di questo modello, la maggior parte dei fallimenti potrebbe probabilmente essere correlato a tali fattori. In questo articolo video, vi presentiamo passo-passo le istruzioni per le procedure chirurgiche per il nostro modello di ratto di OLT parziale con ricostruzione arteriosa epatica. Mentre un modello di ratto di OLT è complicato e richiede competenze avanzate di microchirurgia, in questo articolo fornisce un sacco di informazioni pratiche, che dovrebbe servire come una buona guida per la formazione e l'apprendimento di questo modello. Apprendimento questo modello efficiente è particolarmente importante per abbreviare il periodo di apprendimento, riducendo il numero di animali e costi necessari per la pratica, e poi riprodurre risultati affidabili in esperimenti. Ciò è in linea con il concetto delle 3R (sostituzione, riduzione e perfezionamento) degli esperimenti sugli animali, che è stata postulata da Russel e Burch nel1959 25.
Divulgazioni
Non ci sono conflitti di interesse da dichiarare. I ratti sono alloggiati sotto specifica-esenti da organismi patogeni condizioni secondo le linee guida della Federazione Associazioni di Laboratorio Scienza animali (FELASA). Tutti gli esperimenti sono stati condotti in conformità con la legge federale tedesca in materia di protezione degli animali e della "Guida per la cura e l'uso di animali da laboratorio" (National Institutes of Health pubblicazione n ° 86-23, riveduta 1985).
Riconoscimenti
Gli autori ringraziano Pascal Paschenda e Mareike Schulz per la loro assistenza tecnica.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome | Azienda | Numero di catalogo | Commenti |
| Microscopio chirurgico | Leica | M651 | |
| Sorgente di luce | Schott | KL1500LCD | |
| Tamponi di cotone | NOBA Verbandmittel | 974202 | |
| Tamponi di garza (5x5 cm) | Fuhrmann | 10002 | |
| povidone-iodio soluzione | Mundipharma | 6108022.00.01 | |
| Olio a base di argilla | Debika società | 090148 | |
| TachoSil | Takeda Pharmaceuticals International GmbH | EU/1/04/277/001-004 | Applicato al fegato superficie resecata |
| Bisturi lama n ° 11 | Pfm medico | 200130011 | Preparazione del bracciale e stent |
| Calibro 14 catetere | B. Braun | 4268210S | Bracciale per il fotovoltaico |
| 18-gauge catetere | B. Braun | 4268130S | Perfusione via PV |
| 24-gauge catetere | B. Braun | 4269071S | Stent per BD e HA |
| Seta filo di sutura 4-0 | Resorba | H3F | Resezione epatica |
| 6-0 seta sutura | Resorba | H1F | |
| 7-0 Prolene (polipropilene) sutura | Ethicon | 8701H | SHVC e IHVC |
| 4-0 sutura Vicryl | Ethicon | V304H | Chiusura addominale |
| Siringa da 5 ml | Terumo | SS + T05ES1 | Eseguire il cuscino |
| Riscaldamento pad | Thermo | 190 x 260 mm | |
| Magnetico fissatore retrazione | Belle Science Tools Inc. | 18200-01 18200-02 18200-03 18200-12 | |
| Bagno di acqua fredda | Huber | 740.000X | Conservazione Graft |
| Pinza bipolare | Promotrice | MBC-200 | |
| Pinza Mosquito | BONIMED | 451-476-03 | Due coppie usate |
| Adson micro pinza | Dimeda | 10.176.12 | |
| Mi curvocro pinza | AESCULAP | FD281R | |
| Dritti pinza micro | Bonimed | 451-476-03 | |
| Curve forbici micro | Medicon | 05.15.83 | |
| Dritti forbici micro | AESCULAP | FD12 | Incisione fine |
| Forbici | AESCULAP | BC211W | |
| Micro supporto dell'ago | AESCULAP | FD241R | Ricostruzione |
| Il sindaco-Hegar Porta aghi | Mizuho Ikakogyo | 06-798-00 | Chiusura addominale |
| DeBakey Bulldog morsetto (diritto) | ULRICH | CV3054 | |
| DeBakey Bulldog morsetto (curva) | Codman | 37-1062 | |
| Satinsky morsetto | Mizuhoika | 09-230-24 | |
| Pinza vascolare periferica | Teleflex Medical | 353494 | Destinatario SHVC |
| Nave morsetto Micro (usa e getta) | AROSurgical Instruments Corporation | TKM-1-60 g | PV, IHVC innesto, e il destinatario HA |
| Nave fascetta Micro (metallo) | Belle Science Tools Inc. | 18052-01 | Destinatario IHVC |
| Soluzione di Ringer lattato | Fresenius Kabi | 6150917.00.00 | |
| Normale soluzione salina | DeltaSelect | 1299.99.99 | |
| HTK soluzione | Dr. Franz Köhler Chemie GmbH | 31268.00.00 | Conservazione soluzione |
| Eparina-Natrium | Ratiopharm | 5394.02.00 | 500 UI prima di perfusione innesto |
| Bicarbonato di sodio 8,4% | Fresenius Kabi | 4399.97.99 | 0,5 ml dopo la riperfusione |
| Soluzione di glucosio 5% | B. Braun | 6714567.06.00 | 1,0 ml dopo la riperfusione |
| Cefuroxim sodio | Fresenius Kabi | 38985.01.00 | Antibiotico, 16 mg / kg |
| Buprenorfina | Essex Pharma | 997.00.00 | Painkiller, 0,1 mg / kg |
| Intensive Care Cage Unità | Brinsea Products Ltd. | Vetario S10 | Cura postoperatoria |
Riferimenti
- Puhl, G., et al. Low viscosity histidine-tryptophan-ketoglutarate graft flush improves subsequent extended cold storage in University of Wisconsin solution in an extracorporeal rat liver perfusion and rat liver transplantation model. Liver Transpl. 12, 1841-1849 (2006).
- Yagi, S., et al. Improved Preservation and Microcirculation with POLYSOL After Partial Liver Transplantation in Rats. J Surg Res. 167, e375-e383 (2011).
- Engemann, R., Ulrichs, K., Thiede, A., Muller-Ruchholtz, W., Hamelmann, H. Value of a physiological liver transplant model in rats. Induction of specific graft tolerance in a fully allogeneic strain combination. Transplantation. 33, 566-568 (1982).
- Sumimoto, R., Shinomiya, T., Yamaguchi, A. Influence of hepatic arterial blood flow in rats with liver transplants. Examination of donor liver-derived serum class I MHC antigen in rats with liver transplants with or without hepatic arterial reconstruction. Transplantation. 51, 1138-1139 (1991).
- Chaland, P., et al. Orthotopic liver transplantation with hepatic artery anastomoses. Hemodynamics and response to hemorrhage in conscious rats. Transplantation. 49, 675-678 (1990).
- Imamura, H., Rocheleau, B., Cote, J., Huet, P. M. Long-term consequence of rat orthotopic liver transplantation with and without hepatic arterial reconstruction: a clinical, pathological, and hemodynamic study. Hepatology. 26, 198-205 (1997).
- Zhong, Z., Theruvath, T. P., Currin, R. T., Waldmeier, P. C., Lemasters, J. J. NIM811, a mitochondrial permeability transition inhibitor, prevents mitochondrial depolarization in small-for-size rat liver grafts. Am. J. Transplant. 7, 1103-1111 (2007).
- Spiegel, H. U., Palmes, D. Surgical techniques of orthotopic rat liver transplantation. J. Invest. Surg. 11, 83-96 (1998).
- Lee, S., Charters, A. C., Chandler, J. G., Orloff, M. J. A technique for orthotopic liver transplantation in the rat. Transplantation. 16, 664-669 (1973).
- Lee, S., Charters, A. C., Orloff, M. J. Simplified technic for orthotopic liver transplantation in the rat. Am. J. Surg. 130, 38-40 (1975).
- Kamada, N., Calne, R. Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 28, 47-50 (1979).
- Howden, B., Jablonski, P., Grossman, H., Marshall, V. C. The importance of the hepatic artery in rat liver transplantation. Transplantation. 47, 428-431 (1989).
- Gao, W., Lemasters, J. J., Thurman, R. G. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 56, 19-24 (1993).
- Zhao, D., Zimmermann, A., Wheatley, A. M. Morphometry of the liver after liver transplantation in the rat: significance of an intact arterial supply. Hepatology. 17, 310-317 (1993).
- Omura, T., Ascher, N. L., Emond, J. C. Fifty-percent partial liver transplantation in the rat. Transplantation. 62, 292-293 (1996).
- Lehmann, T. G., Bunzendahl, H., Langrehr, J. M., Neuhaus, P. Arterial reconstruction in rat liver transplantation--development of a new tubing technique of the common hepatic artery. Transpl. Int. 18, 56-64 (2005).
- Reck, T., et al. Impact of arterialization on hepatic oxygen supply, tissue energy phosphates, and outcome after liver transplantation in the rat. Transplantation. 62, 582-587 (1996).
- Hasuike, Y., et al. A simple method for orthotopic liver transplantation with arterial reconstruction in rats. Transplantation. 45, 830-832 (1988).
- Steffen, R., Ferguson, D. M., Krom, R. A. A new method for orthotopic rat liver transplantation with arterial cuff anastomosis to the recipient common hepatic artery. Transplantation. 48, 166-168 (1989).
- Knoop, M., Bachmann, S., Keck, H., Steffen, R., Neuhaus, P. Experience with cuff rearterialization in 600 orthotopic liver grafts in the rat. Am. J. Surg. 167, 360-363 (1994).
- Hickman, R., Engelbrecht, G. H., Duminy, F. J. A technique for liver transplantation in the rat. Transplantation. 48, 1080 (1989).
- Liu, T., Freise, C. E., Ferrell, L., Ascher, N. L., Roberts, J. P. A modified vascular "sleeve" anastomosis for rearterialization in orthotopic liver transplantation in rats. Transplantation. 54, 179-180 (1992).
- Li, J., et al. Modified sleeve anastomosis for reconstruction of the hepatic artery in rat liver transplantation. Microsurgery. 22, 62-68 (2002).
- Martins, P. N., Theruvath, T. P., Neuhaus, P. Rodent models of partial hepatectomies. Liver Int. 28, 3-11 (2008).
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1992).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon