Method Article
Interventions chirurgicales pour un modèle de rat de transplantation hépatique orthotopique partielle avec reconstruction artérielle hépatique
Dans cet article
Résumé
Transplantation hépatique orthotopique chez le rat est un modèle expérimental indispensable pour la recherche biomédicale. Nous présentons ici nos procédures chirurgicales de transplantation hépatique orthotopique chez le rat à la reconstruction de l'artère hépatique à l'aide d'une greffe partielle de 50%.
Résumé
Transplantation hépatique orthotopique (OLT) chez le rat en utilisant une greffe totale ou partielle est un modèle indispensable pour la recherche en transplantation expérimentale, telles que les études sur la préservation du greffon et 1,2 lésions d'ischémie-reperfusion, les réponses immunologiques 3,4, 5,6 hémodynamique et petit-for-size syndrome 7. Le BTA rat est l'un des modèles animaux les plus difficiles de la chirurgie expérimentale et exige des compétences de microchirurgie de pointe qui prennent beaucoup de temps à apprendre. Par conséquent, l'utilisation de ce modèle a été limité. Depuis la fiabilité et la reproductibilité des résultats sont des éléments clés des expériences dans lesquelles ces modèles animaux complexes sont utilisés, il est essentiel pour les chirurgiens qui sont impliqués dans le BTA rat d'être formés à des procédures bien standardisés et sophistiqués pour ce modèle.
Bien que les techniques diverses variantes et modifications du BTA chez le rat ont été rapportés 8 depuis le premier modèle était décrivanted par Lee et al. 9 en 1973, la suppression de la reconstruction de l'artère hépatique 10 et l'introduction de la technique d'anastomose brassard en Kamada et al. 11 ont été une avancée majeure dans ce modèle, car ils ont simplifié les procédures de reconstruction dans une grande mesure . Dans le modèle de Kamada et al., Le rearterialization hépatique a également été éliminé. Les rats ne pourrait survivre sans flux artériel hépatique après transplantation hépatique, il ya eu une controverse considérable sur la valeur de artérialisation hépatique. Cependant, la supériorité physiologique du modèle artérialisée a été de plus en plus reconnu, notamment en termes de préservation du système biliaire et l'intégrité 8,12 8,13,14 foie.
Dans cet article, nous présentons détaillées des interventions chirurgicales pour un modèle de rat de BTA à la reconstruction de l'artère hépatique à l'aide d'une greffe partielle de 50% après résection du foie ex vivotion. Les procédures de reconstruction pour chaque navire et le canal biliaire sont réalisées par les méthodes suivantes: une suture 7-0 polypropylène continue pour le supra-et infrahepatic la veine cave; une technique brassard pour la veine porte, et une technique de stent pour l'artère hépatique et la voie biliaire.
Protocole
1. Techniques de base et procédures communes
- Toutes les procédures sont effectuées dans des conditions propres mais non stérile.
- Une fois l'abdomen du rat est ouverte, toutes les procédures sont effectuées sous un microscope chirurgical à un grossissement de 16x. Les exceptions sont la résection du foie ex vivo, qui est effectuée à 10x, et les procédures suivantes, qui sont effectuées à 25x: insertion d'une endoprothèse dans le canal biliaire et l'artère hépatique, et la reconstruction de l'artère hépatique, la veine cave infrahepatic (IHVC), et le canal biliaire.
- Des cotons-tiges sont utilisées pour la manipulation en douceur des organes, des tissus dissection et l'hémostase de compression. Tampons de gaze (5 x 5 cm) imbibés d'une solution de Ringer lactate sont utilisés pour rétracter le foie ou les intestins, et de garder les organes humide. La pince Satinsky peut être utilisé pour le retrait de gaze recouvertes de l'intestin vers la gauche ou la queue du rat à élargir le champ opératoire autour de la IHVC.
- Toutes les ligatures sont réalisées avec un fil de soie 6-0, sauf pour les pédicules des lobes du foie pendant la résection du foie ex vivo, où des fils de soie 4-0 sont utilisées. La ligature peut être tiré par une pince DeBakey Bulldog ou d'autres instruments pour fournir une tension suffisante au point de ligature de sorte que la seconde ligature peut être effectué à une distance de la première, et la division entre les deux points ligaturés peut être fait correctement.
- Toutes les injections intraveineuses sont effectuées via la veine du pénis.
- Durant les procédures de reconstruction de la veine cave sus-hépatique (SHVC), la veine porte, l'artère hépatique et la voie biliaire, un petit morceau d'argile à base d'huile est utilisée pour maintenir une bague d'une pince vasculaire périphérique ou une pince mosquito pour les maintenir en position fixe.
2. Préparation préopératoire
- Des rats mâles de Lewis pesant entre 230 et 250 g sont utilisés comme donneur et le receveur d'une transplantation hépatique. Les rats sont tousdue accès libre à l'eau et de la nourriture jusqu'à ce que l'induction de l'anesthésie.
- Brassard pour la veine porte (figure 1): Préparer le brassard de la veine porte en coupant un cathéter de calibre 14 avec une lame de bistouri n ° 11 sous le microscope. Le manchon se compose d'un corps et d'une extension, chacun ayant une longueur de 2 mm. Faire des rainures circonférentielles sur la manchette de serrage par la paroi de la manchette étape par étape de manière circonférentielle avec une pince moustiques telle sorte qu'un fil peut être fixé de manière étanche sur le manchon, sans glisser.
- Endoprothèses pour la voie biliaire et de l'artère hépatique (figure 1): 24-Cut jauge cathéters avec un scalpel sous le microscope pour produire des chanfreins aux deux extrémités des sondes d'une longueur de 4 mm à l'artère hépatique et 5 mm pour les voies biliaires .
3. Fonctionnement des bailleurs de fonds
Le schéma de la suppression du foie chez le rat donneur est montré dans la figure 2. Cette procédure nécessite environron 30-35 min.
- Anesthésier le rat à l'inhalation de 4% en volume isoflurane dans 100% d'oxygène à un débit de 4 L / min pour l'induction de l'anesthésie, et de 1,5% en volume à 2 L / min pour l'entretien. Injecter la buprénorphine (0,1 mg / kg) par voie sous cutanée comme analgésique. Placez le rat sur un coussin chauffant, et de fixer les bras en utilisant le système de rétraction magnétique fixateur (figure 3a). Raser les poils de toute la zone abdominale du rat, et stériliser la peau correspondant avec une solution de povidone-iode.
- Ouvrez l'abdomen par une incision médiane avec des extensions bilatérales. Placer une seringue 5-ml sous le dos du rat de sorte que le SHVC est élevée ventralement. En utilisant une pince de moustiques, de serrage et prener le processus xiphoïde vers la tête, et d'appliquer les rétracteurs de sous-costales pour ouvrir le champ opératoire (figure 3a).
- Disséquer le ligament falciforme et ligament triangulaire gauche. Ensuite, ligaturer et diviser la veine phrénique gauche.
- Récupagir les lobes médians et latéraux gauche vers le haut avec un tampon de gaze humide. En utilisant des pinces bipolaires, coaguler et séparer les vaisseaux para-oesophagiennes entre le lobe caudé latéral et antérieur gauche.
- Déplacez les intestins dehors de l'abdomen sur le côté gauche du rat, et recouvrez-les avec un tampon de gaze humide. Rentrer le lobe latéral droit vers le haut avec un tampon de gaze humide. Isoler le IHVC du tissu rétropéritonéal, et ligaturer la veine surrénale droite, qui sera divisé plus tard, juste avant le retrait du greffon.
- Pour insérer une endoprothèse dans le canal biliaire (figure 3b):
- Ligaturer le canal biliaire, au niveau de la ramification de l'artère gastro-duodénale. Les tissus mous qui entourent la voie biliaire doit être préservée autant que possible, et la séparation des voies biliaires de l'artère hépatique devra être évitée pour assurer une alimentation suffisante en sang artériel à la voie biliaire.
- Avec des ciseaux micro droites, faire une petite incision dans le Anteriou la paroi de la voie biliaire proximale au point ligaturé. Tout en maintenant la paroi antérieure de l'incision avec une pince droites micro dans la main gauche, insérer une endoprothèse dans le canal à l'aide d'une pince courbe micro dans la main droite, et le fixer avec un fil de soie 6-0. L'une des extrémités coupées du fil sur la voie biliaire est maintenu à une longueur de 4 mm de sorte que le fil peut être maintenu au cours de l'anastomose tard.
- Libérez la veine porte dans les veines pyloriques et de la rate en ligaturant et en les divisant.
- Ligaturer et de diviser l'artère gastro-duodénale, puis isoler l'artère hépatique commune (CHA) à partir de la tête du pancréas à sa racine. Tournez le foie à droite, avec des cotons-tiges, et de disséquer le ligament autour de l'arrière du foie et de l'oesophage.
- À la fin de la préparation de l'excision du foie, retirez les écarteurs, les pinces de moustiques pour le processus xiphoïde, et la seringue de 5 ml sous le dos du rat. Retour intestins au abdominacavité l.
- Injecter 500 UI d'héparine-Natrium dans 2 ml de solution saline normale à travers la veine du pénis. Environ 3 minutes plus tard, réinitialiser la seringue de 5 ml, les pince mosquito, et les écarteurs. Ligaturer les CHA proximales à sa racine. Gardez l'une des extrémités coupées du fil ligature de l'ACH longtemps.
- Après avoir fixé la clôture IHVC à la veine rénale droite avec une pince mosquito, serrer la veine porte avec une pince micro navire se situe en dessous de la souche de la veine splénique. Inciser la paroi antérieure de la veine porte, et insérer un cathéter de calibre 18 dans la veine porte.
- Perfuser le foie in situ avec 60 ml d'eau froide histidine-tryptophane-cétoglutarate (HTK) solution à une pression hydrostatique de 20 cm H 2 O. Immédiatement après, couper la membrane et le transect intrathoracique la veine cave, et couper la paroi antérieure de l'ouverture IHVC pour permettre à la solution de perfusion doit être rincée du foie (Figure 3c).
- Fixer le IHVC avec un disposable navire micro pince juste au-dessous du foie. D'accise le foie par la dissection de la IHVC légèrement en dessous du point médian entre le foie et la veine rénale droite, la veine porte au-dessous de la souche de la veine splénique, le diaphragme, le reste des ligaments à l'arrière du foie, la veine surrénale droite, et l'ACH à sa racine. Placez le foie excisé en solution HTK froide dans une tasse en métal monté dans un boîtier en plastique rempli de glace pilée.
4. Préparation Ex vivo du greffon
Toutes les procédures pour la greffe du foie sont effectuées dans la tasse en métal remplie de solution glacée HTK. La préparation ex vivo du greffon nécessite environ 30 min.
- Pour la fixation d'une manchette à la veine porte (figure 4):
Fixer le tronc veineux portal avec une pince DeBakey Bulldog. Placer la pince dans une position de pontage au-dessus de la cuvette (figure 4a, b). Mettre à travers la veine porte le brassard, et serrerla veine porte de nouveau avec le prolongement de la coiffe dans la position de 12 heures (Figure 4c). Evert la paroi de la veine porte sur la manchette pour positionner le tronc de la veine splénique à l'extérieur de la manchette à la position 7 heures (figure 4d), et d'assurer la veine porte avec un fil de soie 6-0 (figure 4e) . - Pour insérer une endoprothèse dans l'artère hépatique (figure 5):
Fixer le foie en serrant les deux bords de la membrane par forceps, et tirez la LCS droite en tenant le fil ligaturé avec la pince DeBakey Bulldog (figure 5a). Avec des ciseaux micro droites, faire une petite incision dans la paroi antérieure de l'ACH. Avec la main gauche, maintenez la paroi antérieure de l'incision avec une pince micro droites, et avec la main droite, insérer un stent dans l'ACH à l'aide d'une pince micro courbes. Le stent est préalablement lavée avec de l'héparine Natrium solution (100 UI / ml) (Figure 5b-d). Secure l'extenseur avec un fil de soie 6-0, et de garder une des extrémités coupées du fil à une longueur de 4 mm. Rincez le foie par le cathéter artériel avec 5 ml de solution HTK froid. - Pour une résection hépatique de 50% (figure 6):
- Fixer le lobe caudé postérieure avec une pince mosquito pour le fixer en place. Résection du lobe après la ligature de son pédicule avec un fil de soie 4-0 (figure 7a). De la même manière, enlever le lobe caudé antérieur.
- Tournez la boîte en plastique de 90 degrés. Serrer le bord droit de la membrane et la partie gauche du lobe médian. Faire une petite incision sur le bord supérieur de la frontière des parties bilatérales du lobe médian, puis retirez la partie gauche après la ligature (figure 7b). Retirez le lobe latéral gauche après la ligature du pédicule avec un fil de soie 4-0. Cautériser la surface du foie réséqué soigneusement avec une pince bipolaire. En conséquence, la masse du foie est réduite par unenviron 50% 15 (figure 7c, d).
- Pour plastie du SHVC (Figure 8):
Fixer la position de serrage par le foie et d'autre du diaphragme avec une pince moustique (figure 8a). Couper la paroi antérieure de l'SHVC en enlevant la membrane correspondante. Fixez les deux points de suture en polypropylène 7-0 de l'extérieur vers l'intérieur aux deux angles que rester sutures pour l'anastomose plus tard (Figure 8b). Puis couper la paroi postérieure de la SHVC. - Rangez la greffe du foie à 4 ° C dans une solution HTK dans un bain d'eau froide.
5. Fonctionnement du destinataire
Le schéma de l'implantation du greffon chez le rat destinataire est illustré à la figure 9. L'opération destinataire a besoin de 60-70 min, ce qui comprend 10-11 min de temps anhépatique et environ 23-24 min de temps de serrage IHVC.
- Effectuez les mêmes procédures que dans le doni opération (3,1 à 3,4) à l'exception de l'ouverture de l'abdomen par une incision médiane, sans prolongements bilatéraux (figure 10a).
- Placer un écouvillon gaze humide sur le côté droit du duodénum et l'intestin entiers pour obtenir un champ opératoire autour de la IHVC. Mettez les lobes latéraux gauche et médiane dans la cavité gauche sous-phrénique, et rétracter le lobe latéral droit vers le haut avec un tampon de gaze humide. Isoler le IHVC du tissu rétropéritonéal. Ligaturer et diviser la veine surrénale droite (figure 10b). Avec un tampons de gaze et de coton humide, tourner le foie à gauche, et de disséquer le ligament autour de l'arrière du foie.
- Retour au lobe latéral droit à la position anatomique. Placer un écouvillon gaze humide pour couvrir et retirer les lobes médians et latéraux gauche vers le haut. Transect la voie biliaire juste en dessous de la branche du lobe caudé. Les tissus mous qui entourent la voie biliaire doit être préservée autant que possible. Gardez l'une des extrémités coupées de la elire ligaturé pour la voie biliaire à 4 mm de long.
- Ligaturer et de diviser l'artère gastroduodénale et de l'artère hépatique propre à une distance de 3 mm pour le branchement de l'ACH. Ensuite, faire une structure en Y de l'artère, à la fin de l'ACS. Garder une des extrémités coupées du fil de ligature de l'artère hépatique propre à 4-mm de long. Tournez le foie à droite, avec des cotons-tiges, et de disséquer le ligament autour de l'arrière du foie du côté gauche.
- Après l'injection intraveineuse de 2 ml de solution de Ringer lactate, serrer le IHVC avec un collier de récipient en métal micro juste au-dessus de la veine rénale droite. Serrer la veine porte au niveau de sa bifurcation dans le hile du foie par une pince mosquito du côté gauche du rat. Fixer le SHVC avec la membrane du côté droit par une pince vasculaire périphérique, et de fixer la bague de la pince dans une motte de terre cuite à base d'huile.
- Réduire l'anesthésie avec l'isoflurane à 0,4% en volume au cours du temps anhépatique (la duréede clampage de la veine porte). D'accise du destinataire foie natif en disséquant le SHVC, la veine porte, et le IHVC aux niveaux suivants: le SHVC, à la frontière entre le SHVC et le foie, et la veine porte, juste au-dessus de la mâchoire de la pince de moustiques, et l'IHVC, légèrement en dessous du point médian entre le foie et la veine rénale droite (figure 10c). Placez la greffe de foie orthotopique.
- Pour l'anastomose de la SHVC par un surjet (Figure 11):
- Utilisez une pince courbe micro dans la main gauche lors de la procédure de suture pour saisir la paroi de la cuve ou de tenir l'aiguille de suture. Tout d'abord, placer la suture séjour sur le SHVC destinataire de l'intérieur vers l'extérieur en utilisant le joint 7-0 polypropylène dans le coin droit de la greffe suivie d'un nœud (ou vous pouvez l'attacher après que toutes les procédures de suture sont complets). Ensuite, placez la suture deuxième séjour de la même manière à la gauche de maïser, qui sera le point de départ d'un surjet. Pour élargir l'anastomose, saisir et maintenir les sutures en utilisant DeBakey clamps largables aux deux coins avec une légère traction superiolaterally (Figure 11a, b).
- Pierce la suture au coin gauche à travers la paroi du côté du greffon de l'extérieur vers l'intérieur vers l'extérieur en étroite collaboration noeud, et suturer la rangée postérieure de la SHVC intraluminale de 7 à 8 points de suture à l'angle droit (figure 11c). Faire les premiers points avec soin afin que les lumières intérieures sont face à face. Dans le coin droit, percer le polypropylène 7-0 dans le vaisseau sur le côté du greffon à l'extérieur.
- Ensuite, suturer la rangée antérieure de l'extérieur, de droite à gauche, avec environ 10 points (Figure 11d). Avant la fin de la rangée antérieure, rincer l'intérieur avec une solution de Ringer lactate pour éliminer les bulles d'air. Faire le dernier point à la ligne antérieure la plus prochepossible de la suture séjour dans le coin gauche, puis les attacher ensemble.
- Pour la reconstruction de la veine porte par une technique de manchette (figure 12):
- Rentrez les lobes médians et latéraux gauche vers le haut avec un tampon de gaze humide. Serrer la veine porte acquéreur à sa confluence avec la veine pylorique à l'aide d'une pince jetable micro navire de la droite. Fixer la pince de moustiques que les pinces de la veine porte dans l'argile, et tirez la pointe de la pince vers le hile du foie (Figure 12a, b).
- Inciser la paroi antérieure de la veine porte juste en dessous de la mâchoire de la pince de moustiques. Laver l'intérieur de la veine porte le destinataire et le brassard avec une solution de Ringer lactate. Maintenez la paroi antérieure de l'incision avec une pince droites micro dans la main gauche et une extension de la coiffe avec une pince courbe micro dans la main droite. Insérez le brassard dans la veine porte acquéreur profondément, et fixez-le avec une6-0 circonférentielle fil de soie (Figure 12c-f).
- Libérez les brides de la veine porte et SHVC, puis reperfuser le foie. Retirez la seringue de 5 ml à partir de l'arrière du rat, et augmenter la concentration d'isoflurane à 0,8% vol.
- Pour la reconstruction de l'artère hépatique par une technique de stent 16 (Figure 13):
- Tout d'abord, tenir le fil de l'artère hépatique bon destinataire par une pince mosquito du côté gauche et tirez-la vers le hile du foie, puis serrer les CHA bénéficiaires de la clôture côté droit du pancréas (figure 13a).
- Avec une pince micro droites, faire une petite incision dans la bifurcation de la structure en Y à la fin de l'ACH destinataire de faire une ouverture en forme d'entonnoir. Tenez le stent placé dans la LCS greffés avec une pince micro courbes. Après avoir lavé chaque lumière avec l'héparine Natrium solution (100 UI / ml), faites glisser le stent dans la réCHA nataire et le fixer avec un fil de soie 6-0. Attachez une extrémité de ce fil sur la LCS destinataire et le fil de 4 mm sur les CHA greffer ensemble de sorte que les deux ASC se rapprocher les uns aux autres avec une tension réduite du site anastomotique (figure 13b). Après cela, relâchez la pince.
- Pour l'anastomose de la IHVC par un surjet (Figure 14):
S'anastomosent de la même façon que pour le SHVC, mais utiliser plus de points avec morsure fine (figure 14a-d). Lier des sutures au dernier point peut être éliminée, ou la vente liée peut être accompli avec un facteur de croissance pour éviter la sténose anastomotique causée par attacher trop serré. Après desserrage, augmenter la concentration de l'anesthésie à 1,0% vol. Si l'anastomose semble sténose, dilater le site de l'anastomose en tirant les sutures de fixation bilatéraux ou l'élargissement de la rangée antérieure doucement pour élargir l'anastomose. - Administrer 0,5 ml de bicarbonate de sodium 8,4% solution avec 1,0 ml de solution de Ringer lactate par voie intraveineuse.
- Appliquer petits fragments de TachoSil pour sceller la surface du foie réséqué pour prévenir les saignements et les fuites biliaires.
- Pour la reconstruction de la voie biliaire par une technique de stent:
- Tenez le fil de la voie biliaire destinataire par une pince mosquito du côté gauche. Fixer la pince de moustiques dans l'argile, et tirez la pointe de la pince vers le hile du foie.
- Faire une petite incision dans le canal cholédoque au niveau approprié afin que la voie biliaire reconstruite ne serait pas trop long. Insérez le stent placé dans la voie biliaire du greffon dans le conduit destinataire avec une attention particulière pour éviter une torsion, et le fixer avec un fil de soie 6-0. Lier ce fil sur le canal destinataire et le fil 4-mm sur le conduit de greffe ensemble de telle sorte que les deux conduits se rapprocher de l'autre avec une tension réduite du site anastomotique.
- À la fin de la procédure de reconstruction, injecter 1 ml de solution de glucose à 5% par voie intraveineuse (figure 15).
- Confirmer hémostase adéquate, puis fermez l'incision abdominale par des sutures Vicryl 4-0 continus en deux couches.
6. Le traitement post-opératoire et suivi
Immédiatement après l'opération, traiter le rat receveur avec une injection sous-cutanée de céfuroxime sodique (16 mg / kg) et la buprénorphine (0,1 mg / kg) pour un total de 1,5 ml de solution saline normale. Laissez le rat de récupérer pendant 60 min dans une cage spéciale unité de soins intensifs de l'air réchauffé (30-35 ° C) et une alimentation en oxygène. Injecter la buprénorphine (0,1 mg / kg) par voie sous cutanée comme analgésique toutes les 12 heures pendant 3 jours. Ensuite déplacez le rat dans une cage normale, et de fournir un accès ad libitum à l'eau et de la nourriture.
Résultats
Toutes les rats destinataire (n = 20) ont survécu sans complications apparentes jusqu'à ce que l'euthanasie prévue pour le prélèvement sanguin à 1, 3, 24, et 168 heures (7 jours) après la reperfusion portale (n = 5 à chaque point dans le temps). Les échantillons de sang ont été prélevés dans la IHVC par une ponction directe avec une aiguille de calibre 27. Après la centrifugation à 5340 xg pendant 10 min, les échantillons de sérum ont été prélevés et analysés pour l'alanine aminotransférase (ALAT), qui reflètent le degré d'atteinte hépatocellulaire après la transplantation. L'évolution temporelle de l'évolution des taux sériques d'ALT est illustré à la figure 16. Les taux d'ALAT a atteint un pic à 24 h (moyenne ± écart type: 212,6 ± 67,9 UI / L), puis a diminué à l'intérieur des limites normales à 168 h (33,6 ± 6,8 UI / L).

Figure 1. Brassard pour la veine porte (PV) à partir d'un 14-jauge de cathéter, et les stents de l'artère hépatique (HA) et du canal cholédoque (BD) du 24-jauge cathéters.
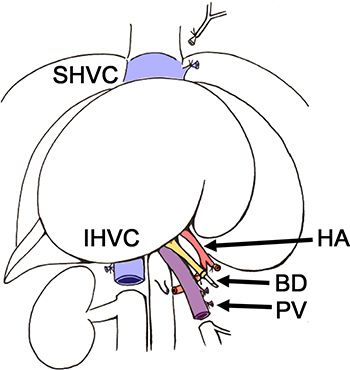
Figure 2. Schéma de la suppression du foie du rat donneur BD, des voies biliaires; artère hépatique. HA,; IHVC, infrahepatic la veine cave; PV, la veine porte; SHVC, la veine cave sus-hépatique.

Figure 3. Fonctionnement des bailleurs de fonds. a. Le rat est placé sur un coussin chauffant d'un système de rétraction fixateur magnétique. L'abdomen est ouvert par une incision médiane avec des extensions bilatérales. B. L'insertion de l'endoprothèse dans le canal cholédoque. C. Perfusion du foie par la veine porte. Les abréviations sont expliquered dans la figure 2.

Figure 4. La fixation d'une manchette de la veine porte. a, b. La pince DeBakey Bulldog qui saisit le tronc de la veine porte est placée au-dessus de la coupelle métallique. La coupe est monté dans le boîtier en plastique rempli de glace pilée. C. La veine porte est mis à travers le brassard. D. La paroi de la veine porte est retourné sur le brassard avec le moignon de la veine splénique l'extérieur de la manchette lors de la 7 heures de position et une extension de la manchette à la position 12 heures. e. La veine porte est sécurisé avec un fil de soie 6-0 circonférentielle sur le brassard. Les flèches noires indiquent le moignon de la veine splénique.
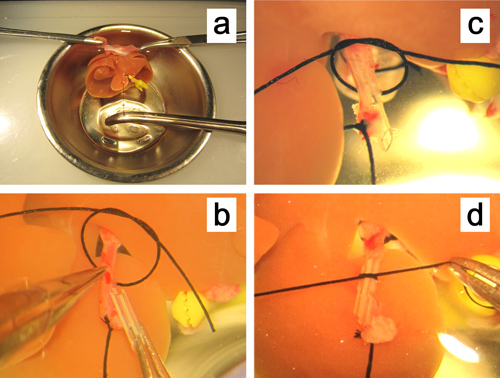
Figure 5. Ex vivol'insertion d'une endoprothèse dans l'artère hépatique. a. Le foie est fixé par serrage des deux bords de la membrane, et l'artère hépatique est tiré en ligne droite en maintenant le fil de ligature de l'artère. b. La paroi antérieure de la petite incision sur l'artère hépatique est maintenue par une pince droites micro . c, d. L'endoprothèse est introduite dans l'artère hépatique et fixé avec un fil de soie 6-0.

Figure 6. Le schéma de la résection hépatique ex vivo de 50%. Lobes de couleur grise sont supprimés. ACL, antérieure du lobe caudé; PCL, lobe caudé postérieure; LLL, à gauche lobe latéral; LML, la partie gauche du lobe médian; RML, partie droite du lobe médian; SRL, supérieur du lobe latéral droit; IRL, inférieure du lobe latéral droit.
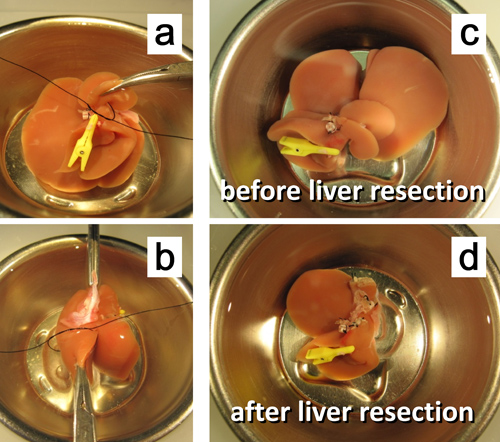
Figure 7. Ex vivo résection hépatique de 50%. une ligature. Ligature du pédicule du lobe caudé postérieure. b. du pédicule de la partie gauche du lobe médian. c. Le foie avant la résection de 50%. d. Le foie après résection de 50%.
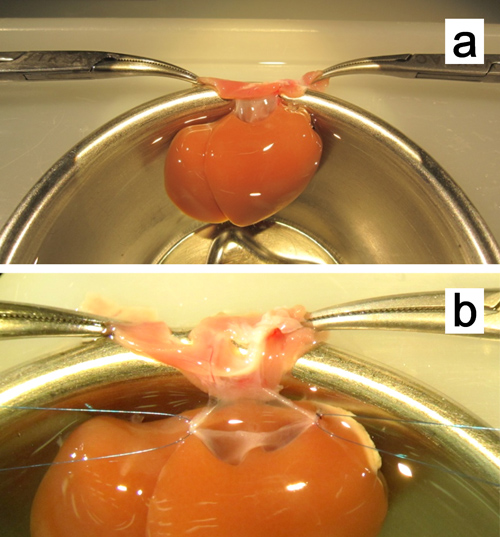
Figure 8. Ex vivo plastie de la veine cave sus-hépatique. a. Le foie est fixé par serrage des deux bords de la membrane avec la pince de moustiques. b. loger sutures avec 7-0 polypropylène sont fixés aux deux coins.

Figure 9. Schéma de l'implantation du greffon chez le rat. Destinataire Les procédures de reconstruction sont effectués pour le supra-et infrahepatic veine cave (SHVC et IHVC) avec une suture 7-0 continu, la veine porte (PV) par une technique de manchette, et l'hépatique artère (HA) et du canal cholédoque (BD) par une technique de stent.
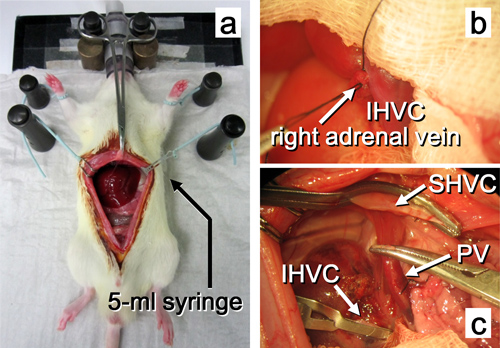
Figure 10. Destinataire opération jusqu'à ce que l'enlèvement du foie natif. une. L'abdomen est ouvert par une incision médiane. b. La veine surrénale droite est ligaturé. c. Le foie natif est excisé. Les abréviations sont expliquées dans la figure 2.
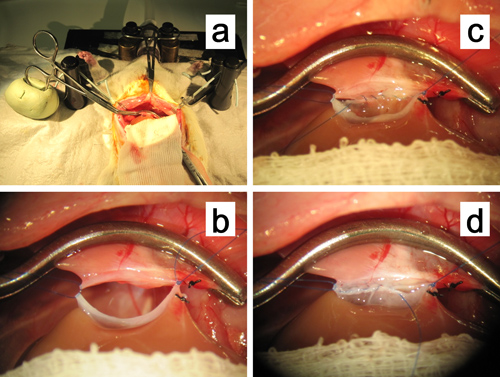
Figure 11. Anastomose de l'suprahepatic la veine cave. a, b. Pince vasculaire périphérique pour la veine cave sus-hépatique est fixé à un bloc de l'huile à base d'argile. Les sutures de fixation aux deux coins sont maintenus avec une légère traction superiolaterally d'élargir l'anastomose. C. Continu de suture intraluminale de la rangée postérieure en cours. D. Suture continue de la rangée antérieure en cours.
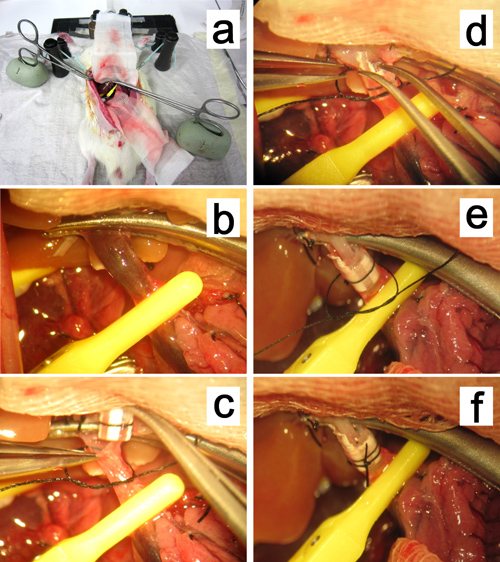
Figure 12. La reconstruction de la veine porte. a, b. La pince de serrage de moustiques de la veine porte est fixé dans l'argile à base d'huile et tiré vers le hile du foie. cf. l'insertion de la coiffe dans la veine porte.

Figure 13. Reconstruction de l'artère hépatique. a, b,. g Insertion> d'un stent dans l'artère hépatique commune bénéficiaire (CHA) à la bifurcation de l'artère hépatique propre (PHA) et l'artère gastro-duodénale (GDA).

Figure 14. Anastomose de la veine cave infrahepatic. une reperfusion. Les sutures de fixation à deux coins. b. suture continue de la rangée postérieure. c. suture continue de la rangée antérieure. d. du infrahepatic la veine cave. Les abréviations sont expliquées dans la figure 2.
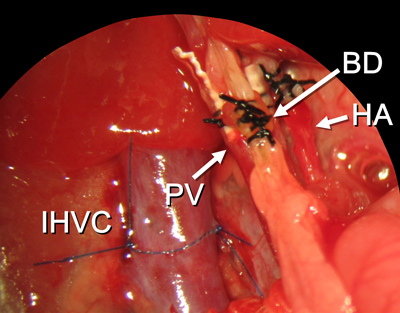
Figure 15. Toutes les procédures de reconstruction est terminée. Les abréviations sont expliquées dans la figure 2.
"Figure 16" src = "/ files/ftp_upload/4376/4376fig16.jpg" />
Figure 16 postopératoire évolution temporelle de l'évolution des taux sériques d'alanine aminotransférase (ALAT) (n = 20, n = 5 à chaque point dans le temps).. Les données sont exprimées en tant que moyen de barres d'erreur qui indiquent l'écart type. Les taux d'ALAT a atteint un pic à 24 h (212,6 ± 67,9 UI / L), puis a diminué à l'intérieur des limites normales à 168 h (33,6 ± 6,8 UI / L).
Discussion
Le premier modèle de rat BTA a été rapportée par Lee et al., En 1973 9, dans lequel tous les navires, y compris l'artère hépatique ont été reconstruits par une méthode cousu main et le shunt porto-systémique extracorporelle a été utilisée. Ce modèle est techniquement compliqué et difficile à réaliser. Le modèle suivant a été l'un sans reconstruction de l'artère hépatique et le shunt extracorporelle, développé par les auteurs mêmes 10 en 1975. Par la suite, en 1979, Kamada et al. Introduit la technique d'anastomose brassard pour le modèle sans 11 rearterialization hépatique. Avec ces modifications, le BTA chez le rat a été simplifiée avec un temps de anhépatique raccourci dans les opérations bénéficiaires et a été largement utilisé comme un modèle accepté expérimentale.
Cependant, il ya eu une controverse considérable depuis lors sur la signification de artérialisation hépatique chez le rat BTA 8 parce que la artérialisation était une tâche exigeante, mais diserais pas affecté la survie après la transplantation. De nombreuses études sur artérialisation hépatique en utilisant des techniques de reconstruction différents ont été rapportés 8, tel qu'un segment de l'aorte à l'aorte anastomose 3,9,17, une technique d'anastomose brassard 18,19,20, une technique télescopique 5, une technique de stent 13, 16, et une technique d'anastomose manchon 12,21-23. Bien que la technique de BTA rat n'est pas encore standardisé aujourd'hui, le modèle artérialisée a été de plus en plus favorisés en termes de sa supériorité physiologique 8,12,13,14. Parmi les techniques mentionnées ci-dessus, une technique de stent qui est simple et rapide à effectuer a été rapporté par Lehmann et al. 16 en 2005. L'étude a montré d'excellents résultats: pas de taux d'occlusion a été observée dans l'artère hépatique reconstruite à 8 h, 24 h et 6 mois après la reperfusion. Nous avons donc adopté cette technique pour artérialisation hépatique.
Nous performancema cousu main anastomose pour la reconstruction de la SHVC et IHVC. Cette méthode fournit le site anastomotique avec une condition physiologique optimale, ce qui conduit à la réduction de l'incidence de la thrombose 8, et est la meilleure simulation de microchirurgie et de la formation pour les chirurgiens. En outre, l'anastomose peut être possible même avec des souches de vaisseaux courts. En ce qui concerne l'anastomose de IHVC, cette méthode ne nécessite pas une longue IHVC sur le côté du greffon par rapport à la technique d'anastomose brassard. Par conséquent, lorsque la veine rénale est disséquée des bailleurs de fonds pour faire l'IHVC du greffon à long, cette méthode est applicable à la transplantation d'un greffon qui nécessite une petite IHVC longue, comme une greffe de 30% qui se compose de lobes latéraux droit et du noyau caudé avec une courte intrahépatique la veine cave sans SHVC 2.
En ce qui concerne les techniques de résection hépatique chez le rat, à ce jour, plusieurs méthodes ont été signalés, les deux principales techniques sont la technique de ligature de masse classiqueet la technique de bâtiment orienté 24. Nous effectuons la technique de ligature classique pour une résection hépatique 50% 15, mais sous un microscope chirurgical pour faire la fine procédure et d'éviter des dommages aux lobes restants et les structures.
Nous avons décrit les résultats représentatifs des rats receveurs dans notre modèle, les rats ont survécu pendant la période d'observation de 7 jours sans complications apparentes. Le modèle peut être modifié à des fins différentes des expériences en choisissant les différents paramètres, tels que le stockage froid prolongé, prolongée d'ischémie chaude qui inclut le don après la mort cardiaque, et l'utilisation de greffons hépatiques plus petites ou des greffes à partir de modèles expérimentaux de lésions du foie ou des maladies.
Dans notre expérience, il ya trois facteurs clés dans l'ensemble des procédures qui peuvent affecter la survie après la transplantation, le paramètre le plus fiable pour les résultats du BTA rat: le montant de la perte de sang, le temps de fonctionnement, espécialement serrage moment de la veine porte et IHVC et la pertinence de la reconstruction de chaque navire, ce qui pourrait entraîner une sténose, thrombose, ou des saignements. Dans une période de formation de ce modèle, la plupart des échecs pourrait probablement être liée à ces facteurs. Dans cet article, vidéo, nous vous présentons étape par étape les instructions pour les procédures chirurgicales pour notre modèle de rat de BTA à la reconstruction partielle de l'artère hépatique. Même si un modèle de rat de BTA est complexe et nécessite des compétences avancées de microchirurgie, cet article fournit une foule de renseignements pratiques, qui devrait servir comme un bon guide pour la formation et l'apprentissage de ce modèle. Apprendre efficacement ce modèle est particulièrement important pour la réduction de la période d'apprentissage, ce qui réduit le nombre d'animaux et les coûts nécessaires à la pratique, et plus tard la reproduction de résultats fiables dans les expériences. Ceci est en ligne avec le concept des 3R (remplacement, réduction et raffinement) de l'expérimentation animale, qui a été postulée par Russell et Burch en1959 25.
Déclarations de divulgation
Nous n'avons pas de conflits d'intérêts à déclarer. Les rats sont logés sous pathogènes spécifiques sans conditions, selon les directives de la Fédération des Associations de laboratoire Sciences de l'Animal (FELASA). Toutes les expériences ont été menées conformément à la loi fédérale allemande sur la protection des animaux et le «Guide pour le soin et l'utilisation des animaux de laboratoire» (National Institutes of Health publication n ° 86-23, révisée en 1985).
Remerciements
Les auteurs remercient Pascal Paschenda et Mareike Schulz pour leur assistance technique.
matériels
| Name | Company | Catalog Number | Comments |
| Nom | Entreprise | Numéro de catalogue | Commentaires |
| Microscope d'opération | Leica | M651 | |
| Source lumineuse | Schott | KL1500LCD | |
| Des cotons-tiges | NOBA Verbandmittel | 974202 | |
| Tampons de gaze (5x5 cm) | Fuhrmann | 10002 | |
| solution de polyvidone iodée | Mundipharma | 6108022.00.01 | |
| L'huile à base d'argile | Debika société | 090148 | |
| TachoSil | Takeda Pharmaceuticals International GmbH | EU/1/04/277/001-004 | Appliquée à la surface du foie réséqué |
| Scalpel lame n ° 11 | Pfm médical | 200130011 | Préparation de manchette et stents |
| Cathéter de calibre 14 | B. Braun | 4268210S | Brassard pour PV |
| Cathéter de calibre 18 | B. Braun | 4268130S | Perfusion par PV |
| Cathéter de calibre 24 | B. Braun | 4269071S | Stent pour les BD et HA |
| Suture soie 4-0 | Resorba | H3F | La résection hépatique |
| 6-0 suture de soie | Resorba | H1F | |
| 7-0 Prolene (polypropylène) de suture | Ethicon | 8701H | SHVC et IHVC |
| 4-0 suture Vicryl | Ethicon | V304H | Fermeture abdominale |
| 5 ml seringue | Terumo | SS + T05ES1 | Sauvegardez oreiller |
| Coussin chauffant | Thermo | 190 x 260 mm | |
| Magnetic système de rétraction fixateur | Fin Sciences Tools Inc | 18200-01 18200-02 18200-03 18200-12 | |
| Bain d'eau froide | Huber | 740.000X | La préservation du greffon |
| Pince bipolaire | Söring | MBC-200 | |
| Pince Mosquito | BONIMED | 451-476-03 | Deux paires utilisées |
| Adson micro pince | Dimeda | 10.176.12 | |
| Km courbecro pince | AESCULAP | FD281R | |
| Droites micropincettes | Bonimed | 451-476-03 | |
| Courbes Ciseaux micro | Medicon | 15/05/83 | |
| Droites Ciseaux micro | AESCULAP | FD12 | Fine incision |
| Ciseaux | AESCULAP | BC211W | |
| Porte-aiguille micro | AESCULAP | FD241R | Reconstruction |
| Porte-aiguille maire-Hegar | Mizuho Ikakogyo | 06-798-00 | Fermeture abdominale |
| DeBakey Bulldog pince (droite) | ULRICH | CV3054 | |
| DeBakey Bulldog pince (courbe) | CODMAN | 37-1062 | |
| Satinsky pince | Mizuhoika | 09-230-24 | |
| Pince vasculaire périphérique | Teleflex Medical | 353494 | Bénéficiaire SHVC |
| Pince micro navire (jetable) | AROSurgical Instruments Corporation | TKM-1-60 g | PV, IHVC greffe, et le destinataire HA |
| Pince micro navire (métal) | Fin Sciences Tools Inc | 18052-01 | Bénéficiaire IHVC |
| Solution de Ringer lactate | Fresenius Kabi | 6150917.00.00 | |
| Une solution saline normale | DeltaSelect | 1299.99.99 | |
| Solution HTK | Dr. Franz Köhler Chemie GmbH | 31268.00.00 | Solution de conservation |
| Héparine-Natrium | Ratiopharm | 5394.02.00 | 500 UI avant la perfusion du greffon |
| Bicarbonate de sodium 8,4% | Fresenius Kabi | 4399.97.99 | 0,5 ml après la reperfusion |
| Solution de glucose à 5% | B. Braun | 6714567.06.00 | 1,0 ml après la reperfusion |
| De sodium Cefuroxim | Fresenius Kabi | 38985.01.00 | Antibiotique, 16 mg / kg |
| La buprénorphine | Essex Pharma | 997.00.00 | Analgésique, 0,1 mg / kg |
| Intensive Care Unit Cage | Produits Brinsea Ltd | Vetario S10 | Les soins postopératoires |
Références
- Puhl, G., et al. Low viscosity histidine-tryptophan-ketoglutarate graft flush improves subsequent extended cold storage in University of Wisconsin solution in an extracorporeal rat liver perfusion and rat liver transplantation model. Liver Transpl. 12, 1841-1849 (2006).
- Yagi, S., et al. Improved Preservation and Microcirculation with POLYSOL After Partial Liver Transplantation in Rats. J Surg Res. 167, e375-e383 (2011).
- Engemann, R., Ulrichs, K., Thiede, A., Muller-Ruchholtz, W., Hamelmann, H. Value of a physiological liver transplant model in rats. Induction of specific graft tolerance in a fully allogeneic strain combination. Transplantation. 33, 566-568 (1982).
- Sumimoto, R., Shinomiya, T., Yamaguchi, A. Influence of hepatic arterial blood flow in rats with liver transplants. Examination of donor liver-derived serum class I MHC antigen in rats with liver transplants with or without hepatic arterial reconstruction. Transplantation. 51, 1138-1139 (1991).
- Chaland, P., et al. Orthotopic liver transplantation with hepatic artery anastomoses. Hemodynamics and response to hemorrhage in conscious rats. Transplantation. 49, 675-678 (1990).
- Imamura, H., Rocheleau, B., Cote, J., Huet, P. M. Long-term consequence of rat orthotopic liver transplantation with and without hepatic arterial reconstruction: a clinical, pathological, and hemodynamic study. Hepatology. 26, 198-205 (1997).
- Zhong, Z., Theruvath, T. P., Currin, R. T., Waldmeier, P. C., Lemasters, J. J. NIM811, a mitochondrial permeability transition inhibitor, prevents mitochondrial depolarization in small-for-size rat liver grafts. Am. J. Transplant. 7, 1103-1111 (2007).
- Spiegel, H. U., Palmes, D. Surgical techniques of orthotopic rat liver transplantation. J. Invest. Surg. 11, 83-96 (1998).
- Lee, S., Charters, A. C., Chandler, J. G., Orloff, M. J. A technique for orthotopic liver transplantation in the rat. Transplantation. 16, 664-669 (1973).
- Lee, S., Charters, A. C., Orloff, M. J. Simplified technic for orthotopic liver transplantation in the rat. Am. J. Surg. 130, 38-40 (1975).
- Kamada, N., Calne, R. Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 28, 47-50 (1979).
- Howden, B., Jablonski, P., Grossman, H., Marshall, V. C. The importance of the hepatic artery in rat liver transplantation. Transplantation. 47, 428-431 (1989).
- Gao, W., Lemasters, J. J., Thurman, R. G. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 56, 19-24 (1993).
- Zhao, D., Zimmermann, A., Wheatley, A. M. Morphometry of the liver after liver transplantation in the rat: significance of an intact arterial supply. Hepatology. 17, 310-317 (1993).
- Omura, T., Ascher, N. L., Emond, J. C. Fifty-percent partial liver transplantation in the rat. Transplantation. 62, 292-293 (1996).
- Lehmann, T. G., Bunzendahl, H., Langrehr, J. M., Neuhaus, P. Arterial reconstruction in rat liver transplantation--development of a new tubing technique of the common hepatic artery. Transpl. Int. 18, 56-64 (2005).
- Reck, T., et al. Impact of arterialization on hepatic oxygen supply, tissue energy phosphates, and outcome after liver transplantation in the rat. Transplantation. 62, 582-587 (1996).
- Hasuike, Y., et al. A simple method for orthotopic liver transplantation with arterial reconstruction in rats. Transplantation. 45, 830-832 (1988).
- Steffen, R., Ferguson, D. M., Krom, R. A. A new method for orthotopic rat liver transplantation with arterial cuff anastomosis to the recipient common hepatic artery. Transplantation. 48, 166-168 (1989).
- Knoop, M., Bachmann, S., Keck, H., Steffen, R., Neuhaus, P. Experience with cuff rearterialization in 600 orthotopic liver grafts in the rat. Am. J. Surg. 167, 360-363 (1994).
- Hickman, R., Engelbrecht, G. H., Duminy, F. J. A technique for liver transplantation in the rat. Transplantation. 48, 1080 (1989).
- Liu, T., Freise, C. E., Ferrell, L., Ascher, N. L., Roberts, J. P. A modified vascular "sleeve" anastomosis for rearterialization in orthotopic liver transplantation in rats. Transplantation. 54, 179-180 (1992).
- Li, J., et al. Modified sleeve anastomosis for reconstruction of the hepatic artery in rat liver transplantation. Microsurgery. 22, 62-68 (2002).
- Martins, P. N., Theruvath, T. P., Neuhaus, P. Rodent models of partial hepatectomies. Liver Int. 28, 3-11 (2008).
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1992).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon