Method Article
Procedimientos Quirúrgicos para un modelo de rata de trasplante hepático ortotópico parcial con reconstrucción arterial hepática
En este artículo
Resumen
Trasplante ortotópico de hígado en ratas es un modelo experimental indispensable para la investigación biomédica. A continuación les presentamos nuestros procedimientos quirúrgicos de trasplante ortotópico de hígado de rata con la reconstrucción arterial hepática mediante un injerto parcial del 50%.
Resumen
Trasplante hepático ortotópico (THO) en ratas utilizando un injerto total o parcial es un modelo indispensable para la investigación experimental del trasplante, tales como los estudios sobre la preservación del injerto y la isquemia-reperfusión 1,2 lesiones, reacciones inmunológicas 3,4, 5,6 hemodinámica y pequeños para su tamaño síndrome de 7. La OLT rata es uno de los modelos animales más difíciles de la cirugía experimental y requiere conocimientos avanzados de microcirugía que toman mucho tiempo para aprender. Por consiguiente, el uso de este modelo ha sido limitada. Puesto que la fiabilidad y reproducibilidad de los resultados son componentes clave de los experimentos en los que tales modelos animales se utilizan complejos, es esencial para los cirujanos que están involucrados en OLT rata para ser entrenado en procedimientos bien estandarizados y sofisticado para este modelo.
Si bien las técnicas y modificaciones de OLT en ratas se han reportado 8 desde el primer modelo estaba describiendoed por Lee et al. 9 en 1973, la eliminación de la reconstrucción arterial hepática 10 y la introducción de la técnica de anastomosis del manguito por Kamada et al. 11 fueron un gran avance en este modelo, ya que simplifica los procedimientos de reconstrucción a un gran grado . En el modelo por Kamada et al., El rearterialization hepática también fue eliminado. Dado que las ratas podían sobrevivir sin el flujo arterial hepática después del trasplante hepático, hubo una controversia considerable sobre el valor de arterialización hepática. Sin embargo, la superioridad fisiológica del modelo arterializada se ha reconocido cada vez más, especialmente en términos de preservar el sistema de conductos biliares 8,12 y la integridad hígado 8,13,14.
En este artículo, presentamos los detalles del procedimiento quirúrgico para un modelo de rata de la OLT con la reconstrucción arterial hepática utilizando un injerto parcial del 50% después de la resección del hígado ex vivoción. Los procedimientos de reconstrucción para cada recipiente y el conducto biliar se llevan a cabo mediante los siguientes métodos: una sutura de polipropileno 7-0 continuo para la supra-y la vena cava infradiafragmática; una técnica de manguito de la vena portal, y una técnica de stent para la arteria hepática y el conducto biliar.
Protocolo
1. Técnicas y procedimientos básicos comunes
- Todos los procedimientos se llevan a cabo en condiciones de limpieza, pero no estéril.
- Una vez que el abdomen de la rata se abre, todos los procedimientos se realizan bajo un microscopio quirúrgico con un aumento de 16x. Las excepciones son la resección del hígado ex vivo, que se realiza a 10 veces, y los procedimientos siguientes, que se realizan a 25x: la inserción de un stent en el conducto biliar y de la arteria hepática, y la reconstrucción de la arteria hepática, la vena cava infradiafragmática (IHVC), y el conducto biliar.
- Bastoncillos de algodón se utilizan para la manipulación suave de los órganos, la disección roma de los tejidos, hemostasia y compresión. Hisopos de gasa (5 x 5 cm) empapado con solución de Ringer lactato se utilizan para retraer el hígado o los intestinos, y para mantener a los órganos húmedo. La pinza de Satinsky se puede utilizar para la retracción de cubiertas de gasa-intestinos hacia la izquierda o hacia la cola de la rata para ampliar el campo quirúrgico alrededor de la IHVC.
- Todas las ligaciones se realizaron con un hilo de seda 6-0 excepto por los pedículos de los lóbulos del hígado durante la resección del hígado ex vivo, en hilos de seda 4-0 se utilizan. La ligadura puede ser arrastrado por una abrazadera DeBakey Bulldog o otros instrumentos para proporcionar la tensión adecuada para el punto de ligado de manera que la ligadura, puede efectuarse a una distancia a la primera, y la división entre los dos puntos ligados se puede hacer correctamente.
- Todas las inyecciones intravenosas se realiza a través de la vena del pene.
- Durante los procedimientos de reconstrucción de la vena cava suprahepática (SHVC), la vena porta, la arteria hepática y el conducto biliar, un pequeño bulto de arcilla a base de aceite se utiliza para sujetar un anillo de dedo de una pinza vascular periférica o una pinza mosquito para mantenerlos en una posición fija.
2. Preparación prequirúrgica
- Ratas Lewis macho que pesan entre 230 y 250 g se utilizan como el donante y el receptor de un trasplante hepático. Las ratas son todosadeudado libre acceso a agua y alimentos hasta que la inducción de la anestesia.
- Manguito para la vena portal (Figura 1): Preparar el manguito para el corte de la vena portal por un catéter de calibre 14-con una hoja de bisturí No. 11 bajo el microscopio. El manguito se compone de un cuerpo y una extensión, cada uno con una longitud de 2 mm. Hacer surcos circunferenciales en el manguito de sujeción por la pared del manguito de paso a paso circunferencialmente con una pinza mosquito de modo que un hilo puede ser sujetados firmemente en el manguito sin que se salga.
- Stents para el conducto biliar y de la arteria hepática (Figura 1): Corte 24-catéteres de calibre con un bisturí en el microscopio para producir biseles en ambos extremos de los catéteres con una longitud de 4 mm para la arteria hepática y 5 mm para el conducto biliar .
3. Donante de Operación
El esquema de la separación del hígado de la rata donante se muestra en la Figura 2. Este procedimiento requiere aproximadamentemadamente 30-35 min.
- Se anestesia la rata con la inhalación de 4% en volumen de isoflurano en oxígeno al 100% a un caudal de 4 l / min para la inducción de la anestesia, y 1,5% en volumen a 2 L / min para el mantenimiento. Inyectar buprenorfina (0,1 mg / kg) por vía subcutánea como analgésico. Coloque el ratón sobre una almohadilla de calefacción, y fijar los brazos utilizando el sistema magnético fijador retracción (Figura 3a). Shave la piel de toda la zona abdominal de la rata, y esterilizar la piel correspondiente con una solución de povidona-yodo.
- Abra el abdomen por una incisión de línea media con extensiones bilaterales. Colocar una jeringa de 5-ml bajo la parte posterior de la rata para que el SHVC se eleva ventralmente. Usando unas pinzas mosquito, pinza y tire de la apófisis xifoides hacia la cabeza, y aplicar los retractores subcostal para abrir el campo quirúrgico (Figura 3a).
- Disección del ligamento falciforme y el ligamento triangular izquierdo. A continuación, ligar y dividir la vena frénico izquierdo.
- Retractuar los lóbulos laterales y mediana izquierda hacia arriba con un hisopo de gasa húmeda. Con unas pinzas bipolares, coagular los vasos y se dividen para-esofágica entre el lóbulo caudado lateral izquierda y anterior.
- Mueva los intestinos fuera del abdomen en el lado izquierdo de la rata, y cubrirlos con una torunda de gasa húmeda. Retraer el lóbulo lateral derecho hacia arriba con un hisopo de gasa húmeda. Aislar el IHVC del tejido retroperitoneal, y ligar la vena suprarrenal derecha, que se divide más tarde justo antes de la eliminación del injerto.
- Para insertar un stent en el conducto biliar (Figura 3b):
- Se liga el conducto biliar en el nivel de la bifurcación de la arteria gastroduodenal. Los tejidos blandos que rodean el conducto biliar debe preservarse tanto como sea posible, y la separación de la vía biliar de la arteria hepática se debe evitar para asegurar el suministro suficiente de sangre arterial a la vía biliar.
- Con tijeras rectas micro, hacer una pequeña incisión en el anterio en la pared del conducto biliar proximal al punto de ligado. Mientras sostiene la pared anterior de la incisión con una pinza recta micro en la mano izquierda, insertar un stent en el conducto con una pinza de micro curvas en la mano derecha, y seguro que con un hilo de seda 6-0. Uno de los extremos del corte de la rosca en el conducto biliar se mantiene a una longitud de 4 mm, de manera que el hilo se hace durante la anastomosis posterior.
- Liberate de la vena porta de las venas esplénica pilórico y uniendo y dividiendo ellos.
- Ligar y dividir la arteria gastroduodenal, entonces aislar la arteria hepática común (CHA) de la cabeza del páncreas a su raíz. Girar el hígado a la derecha con hisopos de algodón, y diseccionar el ligamento alrededor de la parte posterior del hígado y el esófago.
- A la finalización de los preparativos para la escisión del hígado, quitar los retractores, fórceps los mosquitos para el proceso xifoides, y la jeringa de 5-ml debajo de la parte posterior de la rata. Devolver los intestinos al abdominal cavidad.
- Inyectar 500 UI de heparina-Natrium en 2 ml de solución salina normal a través de la vena del pene. Alrededor de 3 minutos después, reajustar la jeringa de 5 ml, las pinzas de mosquito, y los retractores. Ligar la CHA proximal a su raíz. Sigue uno de los extremos del corte de la rosca se ligaron durante la CHA largo.
- Después de fijar el cierre IHVC a la vena renal derecha con unas pinzas mosquito, sujetar la vena portal con una pinza vaso desechable micro debajo del tronco de la vena esplénica. Incisión en la pared anterior de la vena portal, e insertar un catéter de calibre 18-en la vena portal.
- Perfundir el hígado in situ con 60 ml de frío histidina-triptófano-cetoglutarato (HTK) solución a una presión hidrostática de 20 cm H 2 O. Inmediatamente después, cortar el diafragma y seccionar el intratorácica vena cava, y cortar la pared anterior de la IHVC abierta para permitir que la solución de perfusión que va a enjuagar fuera del hígado (Figura 3c).
- Fije el IHVC con un direcipiente de micro sposable abrazadera justo debajo del hígado. Escindir el hígado mediante la disección de la IHVC ligeramente por debajo del punto medio entre el hígado y la vena renal derecha, la vena portal por debajo del muñón de la vena esplénica, el diafragma, los ligamentos restantes en la parte posterior del hígado, la vena suprarrenal derecha, y la CHA en su raíz. Coloque el hígado extirpado en solución HTK frío en una taza de metal montado en una caja de plástico llena de hielo picado.
4. Ex vivo la preparación del injerto
Todos los procedimientos para el injerto de hígado se realizan en la copa de metal lleno de solución enfriada con hielo HTK. La preparación in vivo del injerto ex requiere aproximadamente 30 min.
- Para la fijación de un brazalete a la vena portal (Figura 4):
Sujetar el tronco venoso portal con una pinza DeBakey Bulldog. Coloque la abrazadera en una posición de puente encima de la taza (Figura 4a, b). Ponga la vena portal a través del manguito, y la abrazaderala vena portal de nuevo junto con la extensión del manguito en la posición de las 12 (Figura 4c). Evert la pared de la vena portal sobre el manguito para colocar el muñón de la vena esplénica exterior del manguito en la posición 7 horas (Figura 4d), y asegurar la vena porta con un hilo de seda 6-0 (Figura 4e) . - Para insertar un stent en la arteria hepática (Figura 5):
Fijar el hígado por la unión de ambos bordes del diafragma por el fórceps, y tire de los CHA recta sujetando el hilo ligado con la abrazadera DeBakey Bulldog (Figura 5a). Con tijeras rectas micro, hacer una pequeña incisión en la pared anterior de la CHA. Con la mano izquierda, sostenga la pared anterior de la incisión con una pinza de micro rectas, y con la mano derecha, insertar un stent en la CHA utilizando unas pinzas micro curvas. El stent está previamente lavada con solución de heparina-Natrium (100 UI / ml) (Figura 5b-d). Secure el stent con un hilo de seda 6-0, y mantener uno de los extremos del corte de la rosca en una longitud de 4 mm. Lavar el hígado a través del catéter arterial con 5 ml de solución HTK frío. - Para la resección hepática 50% (Figura 6):
- Fije el lóbulo caudado posterior con una pinza mosquito para arreglarlo en su lugar. Resecar el lóbulo después de la ligadura de su pedículo con un hilo de seda 4-0 (Figura 7a). De la misma manera, quitar el lóbulo caudado anterior.
- Gire la caja de plástico de 90 grados. Sujetar el borde derecho del diafragma y la parte izquierda del lóbulo medio. Hacer una pequeña incisión en el borde superior del borde de las porciones bilaterales del lóbulo medio, y luego retirar la porción izquierda después de la ligadura (Figura 7b). Retire el lóbulo lateral izquierdo después de la ligadura del pedículo con un hilo de seda 4-0. Cauterize la superficie del hígado resecado con cuidado con unas pinzas bipolares. Como resultado, la masa del hígado se reduce por unproximadamente 50% 15 (Figura 7c, d).
- Para plastia de la SHVC (Figura 8):
Fijar la posición del hígado por sujeción de ambos bordes de la membrana con una pinza mosquito (Figura 8a). Recorte la pared anterior de la SHVC mediante la eliminación de la membrana correspondiente. Acople dos suturas de polipropileno 7-0 desde el exterior hacia el interior en ambas esquinas permanecer como suturas para la anastomosis posterior (Figura 8b). Luego recortar la pared posterior de la SHVC. - Almacenar el injerto de hígado a 4 ° C en solución HTK en un baño de agua fría.
5. Receptor Operación
El esquema de la implantación del injerto en la rata receptora se muestra en la Figura 9. La operación requiere destinatario 60-70 min, que incluye 10-11 min de tiempo anhepática y aproximadamente 23-24 min de tiempo IHVC de sujeción.
- Realice los mismos procedimientos que en el doni operación (3,1 a 3,4), excepto para la apertura del abdomen por una incisión de línea media, sin extensiones bilaterales (Figura 10a).
- Coloque una torunda de gasa húmeda sobre el lado derecho del duodeno y de los intestinos enteros para obtener un campo quirúrgico alrededor de la IHVC. Poner los lóbulos laterales izquierdo y la mediana en la cavidad subfrénico izquierdo, y retraiga el lóbulo lateral derecho hacia arriba con un hisopo de gasa húmeda. Aislar el IHVC del tejido retroperitoneal. Ligar y dividir la vena suprarrenal derecha (Figura 10b). Con unos hisopos húmedos de gasa y algodón, gire el hígado a la izquierda, y diseccionar el ligamento alrededor de la parte posterior del hígado.
- Vuelva a colocar el lóbulo lateral derecha a la posición anatómica. Coloque una torunda de gasa húmeda para cubrir y retracción de los lóbulos laterales de la mediana y la izquierda hacia arriba. Seccionar el conducto biliar justo por debajo de la rama del lóbulo caudado. Los tejidos blandos que rodean el conducto biliar debe preservarse tanto como sea posible. Sigue uno de los extremos cortados de los siglosleer ligó para el conducto biliar en 4-mm de largo.
- Ligar y dividir la arteria gastroduodenal y la arteria hepática a una distancia de 3-mm a la ramificación de la CHA. Entonces, hacer un Y-estructura de la arteria en el extremo de la CHA. Sigue uno de los extremos del corte de la rosca se ligaron durante la arteria hepática en 4-mm de largo. Girar el hígado a la derecha con hisopos de algodón, y diseccionar el ligamento alrededor de la parte posterior del hígado desde el lado izquierdo.
- Después de la inyección intravenosa de 2 ml de solución de Ringer lactato, sujetar el IHVC con una abrazadera de metal recipiente de micro justo por encima de la vena renal derecha. Abrazadera de la vena portal a nivel de su bifurcación en el hígado hilo con una pinza de mosquitos de la parte izquierda de la rata. Sujetar el SHVC junto con el diafragma desde el lado derecho por una pinza vascular periférica, y fijar el anillo de dedo de la pinza en un trozo de arcilla a base de aceite.
- Reducir la anestesia con isoflurano al 0,4% vol durante el tiempo anhepática (la duraciónde pinzamiento de la vena porta). Impuestos Especiales del destinatario hígado nativo mediante la disección de la SHVC, la vena porta, y la IHVC en los siguientes niveles: la SHVC, en la frontera entre la SHVC y el hígado, y la vena portal, justo por encima de la mandíbula de la pinza de mosquito, y la IHVC, ligeramente por debajo del punto medio entre el hígado y la vena renal derecha (Figura 10c). Coloque el injerto hepático orthotopically.
- Para la anastomosis de la SHVC por una sutura continua (Figura 11):
- Use unas pinzas curvas micro en la mano izquierda durante el procedimiento de sutura para sujetar la pared del vaso o la celebración de la aguja de sutura. En primer lugar, coloque la sutura estancia en la SHVC destinatario desde el interior hacia el exterior mediante el anexo 7-0 polipropileno en la esquina derecha del injerto seguido de un nudo (o usted puede atar después de todos los procedimientos de sutura están completos). A continuación, colocar la sutura segunda estancia en la misma forma que en el maíz izquierdaer, que será la puntada de partida de una sutura continua. Para ampliar la anastomosis, agarrar y mantener las suturas utilizando DeBakey bulldogs en ambas esquinas con una suave tracción superiolaterally (Figura 11a, b).
- Pierce la sutura en la esquina izquierda a través de la pared en el lado del injerto desde el exterior hacia el interior cerca de la parte exterior del nudo, y suturar la línea posterior de la SHVC intraluminalmente con 7 a 8 puntos de sutura en la esquina derecha (Figura 11c). Hacer las primeras puntadas con cuidado para que las luces interiores se enfrentan entre sí. En la esquina derecha, perforar el polipropileno 7-0 a través del vaso de injerto en el lado hacia el exterior.
- A continuación, suturar la fila anterior desde el exterior, de derecha a izquierda, con aproximadamente 10 puntos de sutura (Figura 11d). Antes de la finalización de la fila anterior, limpiar el interior con solución de Ringer lactato para eliminar burbujas de aire. Hacer la última puntada a la fila anterior lo más cercaposible a la sutura estancia en la esquina izquierda, y luego atarlos juntos.
- Para la reconstrucción de la vena porta por una técnica de manguito (Figura 12):
- Retracción de los lóbulos laterales medias y la izquierda hacia arriba con un hisopo de gasa húmeda. Fije la vena porta receptor en su confluencia con la vena pilórica utilizando una pinza desechable buque micro desde la derecha. Fijar las pinzas de mosquito que se fija la vena porta en el barro, y tire de la punta de la pinza hacia el hilio hepático (Figura 12a, b).
- Incisión en la pared anterior de la vena portal justo debajo de la mandíbula de la pinza mosquito. Lavar el interior de la vena portal receptor y el manguito con solución de Ringer con lactato. Sostenga la pared anterior de la incisión con una pinza recta micro en la mano izquierda y una extensión de la banda con unas pinzas curvas micro en la mano derecha. Inserte el manguito en la vena porta recipiente hondo, y seguro que con uncircunferencial 6-0 hilo de seda (Figura 12c-f).
- Suelte las abrazaderas de la vena porta y SHVC y, a continuación reperfundir el hígado. Retire la jeringa de 5-ml de la parte posterior de la rata, y aumentar la concentración de isoflurano al 0,8% vol.
- Para la reconstrucción de la arteria hepática mediante una técnica de stent 16 (Figura 13):
- En primer lugar, mantener el hilo de la arteria hepática propia destinatario con una pinza mosquito del lado izquierdo y tire de él hacia el hilio del hígado, y luego fije los receptores CHA a partir del cierre del lado derecho al páncreas (Figura 13a).
- Con unas pinzas micro rectas, hacer una pequeña incisión en la bifurcación de la Y-estructura en el extremo de la CHA receptor para hacer una abertura en forma de embudo. Mantenga el stent colocado en las CHA injerto con una pinza de micro curvadas. Después de lavar cada lumen con solución de heparina-Natrium (100 UI / ml), deslice el stent dentro de la reCHA receptor y el seguro que con un hilo de seda 6-0. Ate un extremo de este hilo en el CHA destinatario y el hilo de 4-mm en los CHA injerto juntos para que ambos CHAs acercarse el uno al otro con tensión reducida de la anastomosis (Figura 13b). Después de eso, liberar la abrazadera.
- Para la anastomosis de la IHVC por una sutura continua (Figura 14):
Anastomosis de la misma manera que para la SHVC, pero el uso más puntadas con picadura fina (Figura 14a-d). La vinculación de las suturas en la última puntada se puede eliminar, o vinculación puede ser logrado con un factor de crecimiento para evitar la estenosis de la anastomosis causada por atar con demasiada fuerza. Después de desclampaje, aumentar la concentración de la anestesia a 1,0% vol. Si la anastomosis se ve estenótica, dilatar la anastomosis tirando de las suturas bilaterales o ampliación de la línea anterior con cuidado para ampliar la anastomosis. - Administrar 0,5 ml de 8,4% de bicarbonato de sodio solution con 1,0 ml de solución de Ringer lactato por vía intravenosa.
- Aplicar pequeños fragmentos de Tachosil para sellar la superficie del hígado resecado para evitar el sangrado y fuga biliar.
- Para la reconstrucción del conducto biliar mediante una técnica de stent:
- Sujete el hilo de la vía biliar destinatario con una pinza de mosquito desde el lado izquierdo. Fijar las pinzas de mosquitos en el barro, y tire de la punta de la pinza hacia el hilio hepático.
- Hacer una pequeña incisión en el conducto biliar en el nivel apropiado para que el conducto biliar reconstruida no sería demasiado largo. Inserte el stent colocado en el conducto biliar en el conducto de injerto destinatario con especial atención para evitar un giro, y seguro que con un hilo de seda 6-0. Tie este hilo en el conducto de destinatario y el hilo de 4-mm en el conducto de injerto juntas de modo que ambos conductos acercarse el uno al otro con tensión reducida de la anastomosis.
- A la finalización de los procedimientos de reconstrucción, inyectar 1 ml de solución de glucosa al 5% por vía intravenosa (Figura 15).
- Confirme hemostasia adecuada, y luego cierre la incisión abdominal por continuas suturas Vicryl 4-0 en dos capas.
6. Tratamiento postoperatorio y Seguimiento
Inmediatamente después de la operación, el tratamiento de la rata receptora con una inyección subcutánea de cefuroxima sódica (16 mg / kg) y buprenorfina (0,1 mg / kg) en un total de 1,5 ml de solución salina normal. Permitir la rata para recuperar durante 60 min en una jaula especial unidad de cuidados intensivos con aire caliente (30-35 ° C) y un suministro de oxígeno. Inyectar buprenorfina (0,1 mg / kg) por vía subcutánea como analgésico cada 12 horas durante 3 días. Después mover la rata en una jaula normal, y proporcionar acceso ad libitum a agua y comida.
Resultados
Todas las ratas receptoras (n = 20) sobrevivieron sin complicaciones aparentes hasta la eutanasia prevista para muestras de sangre a los 1, 3, 24, y 168 horas (7 días) después de la reperfusión portal (n = 5 en cada punto de tiempo). Las muestras de sangre se obtuvieron de la IHVC por una punción directa con una aguja de calibre 27. Después de la centrifugación a 5.340 xg durante 10 min, las muestras de suero se obtuvieron y se analizaron para la alanina aminotransferasa (ALT), que reflejan el grado de daño hepatocelular después del trasplante. El curso temporal de los cambios en los niveles de ALT en suero se muestra en la Figura 16. Los niveles de ALT alcanzó un máximo a las 24 horas (media ± desviación estándar: 212,6 ± 67,9 UI / L) y disminuyó dentro de los límites normales a 168 horas (33,6 ± 6,8 UI / L).

Figura 1. Un manguito para la vena portal (PV) de un 14-de medida catéter, y stents para la arteria hepática (HA) y el conducto biliar (BD) a partir de 24-catéteres de calibre.
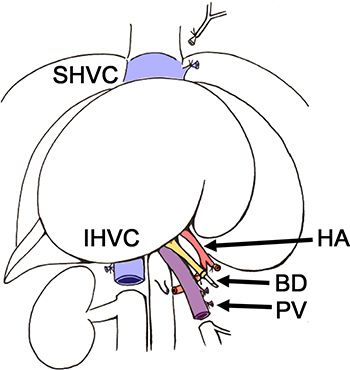
Figura 2. Esquema de la extracción del hígado de la rata donante BD, vías biliares,. HA, la arteria hepática; IHVC, infrahepática vena cava, PV, la vena porta; SHVC, vena cava suprahepática.

Figura 3. Donantes de operación. a. La rata se coloca en una almohadilla de calefacción con un sistema de retracción magnético fijador. Se abre el abdomen por una incisión de línea media con extensiones bilaterales. B. Inserción del stent en el conducto biliar. C. Perfusión del hígado por la vena portal. Las abreviaturas son explicared en la Figura 2.

Figura 4. La unión de un manguito a la vena portal. a, b. La pinza DeBakey Bulldog que agarra el tronco venoso portal se coloca sobre la taza de metal. La copa está montado en la caja de plástico llena de hielo triturado. C. La vena porta se pone a través del manguito. D. La pared de la vena porta se evierte sobre el manguito con el muñón de la vena esplénica fuera del manguito a la 7 en punto y una extensión de la banda en la posición de las 12. e. La vena porta se sujeta con un hilo de seda 6-0 circunferencial en el puño. Las flechas negras indican el muñón de la vena esplénica.
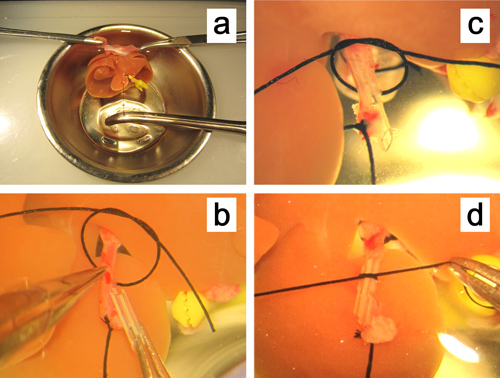
Figura 5. Ex vivola inserción de un stent en la arteria hepática. una. El hígado se fija por apriete ambos bordes del diafragma, y la arteria hepática se tira recta por sujeta el hilo se ligaron durante la arteria. b. La pared anterior de la pequeña incisión en la arteria hepática se lleva a cabo con una pinza de micro rectas . c, d. El stent se inserta en la arteria hepática y asegurados con un hilo de seda 6-0.

Figura 6. El esquema de la resección hepática ex vivo del 50%. Lóbulos de color gris se eliminan. ACL, anterior lóbulo caudado; PCL, lóbulo caudado posterior; LLL, lóbulo lateral izquierdo; LML, la porción izquierda del lóbulo medio; porción RML, a la derecha del lóbulo medio; SRL, superior lóbulo lateral derecho; IRL, inferior lóbulo lateral derecho.
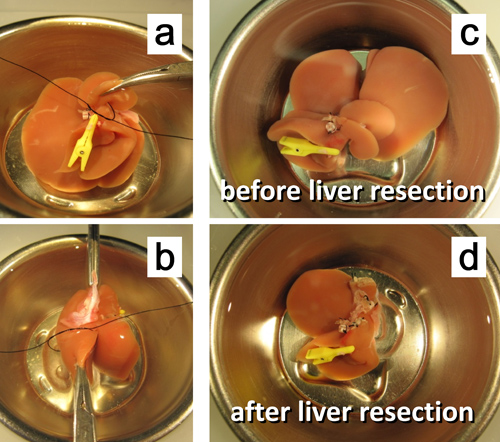
Figura 7. Ex vivo 50% resección hepática. una ligadura. ligadura del pedículo del lóbulo caudado posterior. b. del pedículo de la porción izquierda del lóbulo mediano. c. El hígado antes de la resección del 50%. d. El hígado después de la resección del 50%.
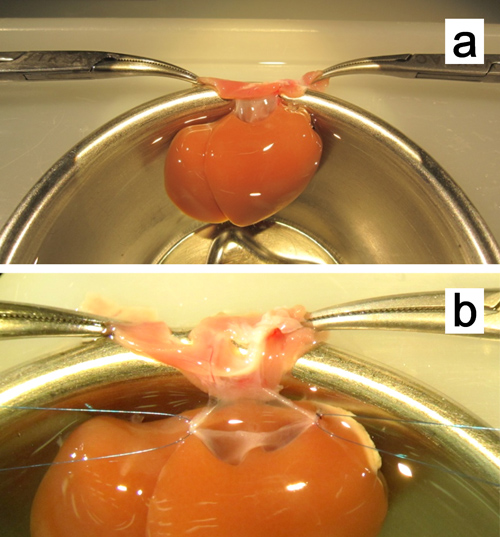
Figura 8. Ex vivo plastia de la vena cava suprahepática. una. El hígado se fija por apriete ambos bordes de la membrana con las pinzas mosquito. b. Quédate con suturas 7-0 polipropileno se adjuntan en las dos esquinas.

La Figura 9. Esquema de la implantación del injerto en la rata receptora. Los procedimientos de reconstrucción se llevan a cabo para la supra-y la vena cava infradiafragmática (SHVC y IHVC) con una sutura continua 7-0, la vena portal (PV) por una técnica de manguito, y la hepática arteria (HA) y del conducto biliar (BD) mediante una técnica de stent.
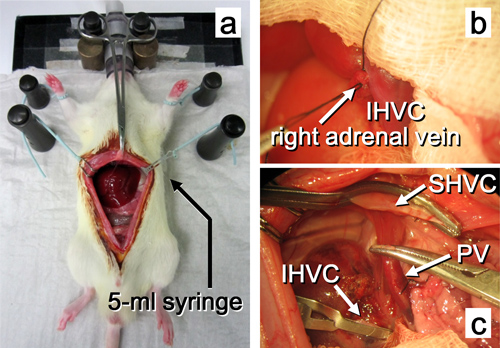
Figura 10. Receptor operación hasta que la separación del hígado nativo. a. se abre el abdomen por una incisión de línea media. b. La vena suprarrenal derecha se ligó. c. El hígado nativo se escinde. Las abreviaturas se explican en la Figura 2.
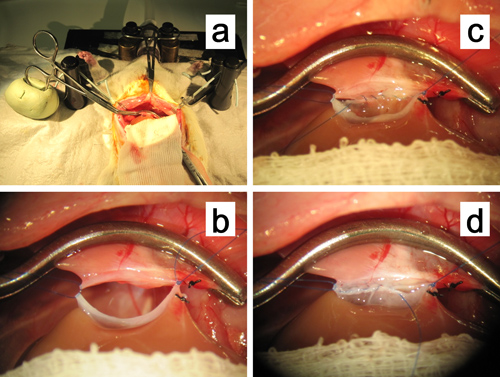
Figura 11. La anastomosis de la suprahehepático vena cava. a, b. La abrazadera vascular periférica de la vena cava suprahepática se fija en una masa de arcilla a base de aceite. Las suturas en ambas esquinas se mantienen con una tracción suave superiolaterally para ampliar la anastomosis. C. Sutura continua intraluminal de la fila posterior en curso. D. Sutura continua de la fila anterior en curso.
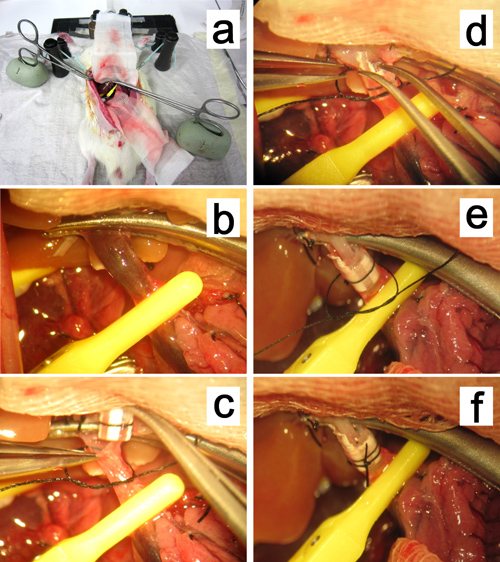
Figura 12. Reconstrucción de la vena portal. a, b. Las pinzas mosquito de sujeción de la vena porta se fija en la arcilla a base de aceite y tira hacia el hilio del hígado. cf. inserción del manguito en la vena portal.

Figura 13. Reconstrucción de la arteria hepática. a, b. g Inserción> de un stent en la arteria hepática común destinatario (CHA) en la bifurcación de la arteria hepática (PHA) y la arteria gastroduodenal (GDA).

Figura 14. La anastomosis de la vena cava infrahepática. una reperfusión. Las suturas en ambas esquinas. b. sutura continua de la fila posterior. c. sutura continua de la fila anterior. d. infrahepática de la vena cava. Las abreviaturas se explican en la Figura 2.
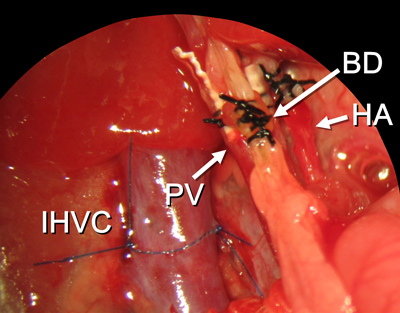
Figura 15. Todos los procedimientos de reconstrucción termine. Las abreviaturas se explican en la Figura 2.
"Figura 16" src = "/ files/ftp_upload/4376/4376fig16.jpg" />
Figura 16 postoperatoria curso de tiempo de los cambios en los niveles séricos de alanina aminotransferasa (ALT) (n = 20, n = 5 en cada punto de tiempo).. Los datos se expresan como media con barras de error que indican las desviaciones estándar. Los niveles de ALT alcanzó un pico a las 24 h (212,6 ± 67,9 UI / L) y disminuyó dentro de los límites normales a 168 horas (33,6 ± 6,8 UI / L).
Discusión
El primer modelo de rata OLT fue informado por Lee et al. En 1973 9, en el que todos los buques, incluidos la arteria hepática se reconstruyeron mediante un método de cosido a mano y la derivación portosistémica extracorpórea se utiliza. Este modelo era técnicamente complicado y difícil de realizar. El siguiente modelo fue uno sin reconstrucción arterial hepática y la derivación extracorpórea, desarrollado por los mismos autores 10 en 1975. Posteriormente, en 1979, Kamada et al. Introdujo la técnica de anastomosis manguito para el modelo sin rearterialization hepática 11. Con estas modificaciones, OLT en ratas se ha simplificado con un tiempo de anhepática acortado en las operaciones de receptores y ha sido ampliamente utilizado como un modelo experimental aceptada.
Sin embargo, ha habido una considerable controversia desde entonces sobre el significado de arterialización hepático en rata OLT 8 porque la arterialización era una tarea exigente, pero did no afecta a la supervivencia después del trasplante. Numerosos estudios sobre la arterialización hepática utilizando diversas técnicas de reconstrucción se han reportado 8, tal como un segmento de la aorta-a-aorta anastomosis 3,9,17, una técnica de anastomosis manguito 18,19,20, una técnica telescópica 5, una técnica de stent 13, 16, y una técnica de anastomosis manguito 12,21-23. Si bien la técnica para OLT rata no es todavía hoy estandarizado, el modelo arterializada ha sido cada vez más favorecida en cuanto a su superioridad fisiológica 8,12,13,14. Entre las técnicas antes mencionadas, una técnica de stent que era simple y rápido para realizar fue reportado por Lehmann et al. 16 en 2005. El estudio mostró resultados excelentes: no se observó incidencia de oclusión en la arteria hepática reconstruida a 8 h, 24 h, y 6 meses después de la reperfusión. Hemos adoptado esta técnica para arterialización hepática.
Nos PERFORma cosido a mano anastomosis para la reconstrucción de la SHVC y IHVC. Este método proporciona el sitio de la anastomosis con una condición fisiológica óptima, lo que conduce a la reducción en la incidencia de trombosis 8, y es la mejor simulación de la microcirugía y la formación para los cirujanos. Además, la anastomosis puede ser posible incluso con muñones vasculares bajo. Con respecto a la anastomosis de IHVC, este método no requiere un IHVC largo en el lado del injerto en comparación con la técnica de anastomosis del manguito. Por lo tanto, cuando la vena renal de donante es disecado para hacer el injerto a largo IHVC, este método es aplicable a trasplante de un injerto pequeño que necesita una IHVC largo, tal como un injerto 30% que consiste de lóbulos derecho lateral y caudado con un intrahepática corto la vena cava sin SHVC 2.
En cuanto a las técnicas de resección hepática en ratas, hasta la fecha, varios métodos han sido reportados, las dos técnicas principales son la técnica de ligadura en masa clásicay la técnica de recipiente orientado 24. Llevamos a cabo la técnica de ligadura clásica para la resección hepática 50% 15, pero bajo un microscopio quirúrgico para realizar el procedimiento más fina, y para evitar daños a los lóbulos restantes y estructuras.
Se describen los resultados representativos de las ratas receptoras en nuestro modelo, las ratas sobrevivieron durante el período de observación de 7 días sin complicaciones aparentes. El modelo puede ser modificado para distintos fines de experimentación mediante la elección de las diferentes opciones, tales como el almacenamiento prolongado en frío, caliente isquemia prolongada que incluye la donación después de muerte cardiaca, y el uso de injertos de hígado o injertos más pequeños a partir de modelos experimentales de lesión hepática o enfermedades.
En nuestra experiencia, hay tres factores clave a través de los procedimientos que pueden afectar la supervivencia después del trasplante, el parámetro más fiable para los resultados de la OLT rata: la cantidad de pérdida de sangre, el tiempo de operación, eespecialmente de sujeción momento de la vena porta y IHVC, y la adecuación de la reconstrucción de cada buque, lo que podría dar lugar a estenosis, trombosis o hemorragia. En un período de entrenamiento de este modelo, la mayor parte de los fracasos probablemente podría estar relacionada con esos factores. En este artículo, vídeo, se presenta paso a paso las instrucciones para los procedimientos quirúrgicos para nuestro modelo de rata de la OLT parcial con reconstrucción arterial hepática. Mientras que un modelo de rata de la OLT es complicada y requiere habilidades avanzadas de microcirugía, este artículo ofrece un montón de información práctica, que debería servir como una buena guía para la formación y el aprendizaje de este modelo. El aprendizaje de este modelo eficiente es particularmente importante para acortar el periodo de aprendizaje, lo que reduce el número de animales y los costos necesarios para la práctica, y después reproducir resultados fiables en los experimentos. Esto está en consonancia con el concepto de las 3R (reemplazo, reducción y refinamiento) de los experimentos con animales, que fue postulada por Russell y Burch en1959 25.
Divulgaciones
No tenemos conflicto de intereses a revelar. Las ratas se alojaron en patógenos específicos libre de condiciones de acuerdo con las directrices de la Federación de Asociaciones Laboratory Animal Science (FELASA). Todos los experimentos se llevaron a cabo de acuerdo con la ley federal alemana sobre protección de los animales y la "Guía para el Cuidado y Uso de Animales de Laboratorio" (National Institutes of Health publicación N º 86-23, revisado 1985).
Agradecimientos
Los autores agradecen a Pascal Paschenda y Mareike Schulz por su asistencia técnica.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre | Empresa | Número de catálogo | Comentarios |
| Microscopio quirúrgico | Leica | M651 | |
| Fuente de luz | Schott | KL1500LCD | |
| Esponjas de algodón | NOBA Verbandmittel | 974202 | |
| Torundas de gasa (5x5 cm) | Fuhrmann | 10002 | |
| solución de povidona yodada | Mundipharma | 6108022.00.01 | |
| A base de aceite de arcilla | Debika corporación | 090148 | |
| TachoSil | Takeda Pharmaceuticals International GmbH | EU/1/04/277/001-004 | Aplicado a la superficie del hígado resecado |
| Cuchilla de bisturí No. 11 | Pfm médica | 200130011 | Preparación de manguito y stents |
| 14-calibre catéter | B. Braun | 4268210S | Brazalete para PV |
| 18-calibre catéter | B. Braun | 4268130S | La perfusión a través de PV |
| 24-calibre catéter | B. Braun | 4269071S | Stent para BD y HA |
| Sutura de seda 4-0 | Resorba | H3F | Resección hepática |
| 6-0 sutura de seda | Resorba | H1F | |
| 7-0 Prolene (polipropileno) sutura | Ethicon | 8701H | SHVC y IHVC |
| Sutura Vicryl 4-0 | Ethicon | V304H | Cierre abdominal |
| 5-ml jeringa | Terumo | SS + T05ES1 | Realice una copia de almohada |
| Calefacción pad | Thermo | 190 x 260 mm | |
| Magnetic fijador sistema de retracción | Fine Ciencia Tools Inc. | 18200-01 18200-02 18200-03 18200-12 | |
| Baño de agua fría | Huber | 740.000X | Preservación del injerto |
| Fórceps bipolar | Soring | MBC-200 | |
| Pinzas de mosquito | BONIMED | 451-476-03 | Dos pares utilizados |
| Adson micro fórceps | Dimeda | 10.176.12 | |
| Mi Curvedcro fórceps | AESCULAP | FD281R | |
| Pinzas rectas micro | Bonimed | 451-476-03 | |
| Tijeras curvas micro | Medicon | 05.15.83 | |
| Tijeras rectas micro | AESCULAP | FD12 | Incisión fina |
| Tijeras | AESCULAP | BC211W | |
| Soporte de la aguja Micro | AESCULAP | FD241R | Reconstrucción |
| Alcalde-Hegar Needle titular | Mizuho Ikakogyo | 06-798-00 | Cierre abdominal |
| DeBakey Bulldog abrazadera (recto) | ULRICH | CV3054 | |
| DeBakey Bulldog abrazadera (curvada) | CODMAN | 37-1062 | |
| Satinsky abrazadera | Mizuhoika | 09-230-24 | |
| Pinza vascular periférica | Teleflex Medical | 353494 | Receptor SHVC |
| Micro pinza recipiente (desechable) | AROSurgical Instruments Corporation | TKM-1-60 g | PV, IHVC injerto y receptor de HA |
| Abrazadera buque Micro (metal) | Fine Ciencia Tools Inc. | 18052-01 | Receptor IHVC |
| Solución de Ringer lactato | Fresenius Kabi | 6150917.00.00 | |
| La solución salina normal | DeltaSelect | 1299.99.99 | |
| HTK solución | Dr. Franz Köhler Chemie GmbH | 31268.00.00 | Preservación solución |
| Heparin-Natrium | Ratiopharm | 5394.02.00 | 500 UI antes de la perfusión del injerto |
| 8,4% de bicarbonato de sodio | Fresenius Kabi | 4399.97.99 | 0,5 ml después de la reperfusión |
| Glucosa al 5% solución | B. Braun | 6714567.06.00 | 1,0 ml después de la reperfusión |
| Cefuroxima sodio | Fresenius Kabi | 38985.01.00 | Antibióticos, 16 mg / kg |
| La buprenorfina | Essex Pharma | 997.00.00 | Painkiller, 0,1 mg / kg |
| Jaula Unidad de Cuidados Intensivos | Brinsea Products Ltd. | Vetario S10 | Los cuidados postoperatorios |
Referencias
- Puhl, G., et al. Low viscosity histidine-tryptophan-ketoglutarate graft flush improves subsequent extended cold storage in University of Wisconsin solution in an extracorporeal rat liver perfusion and rat liver transplantation model. Liver Transpl. 12, 1841-1849 (2006).
- Yagi, S., et al. Improved Preservation and Microcirculation with POLYSOL After Partial Liver Transplantation in Rats. J Surg Res. 167, e375-e383 (2011).
- Engemann, R., Ulrichs, K., Thiede, A., Muller-Ruchholtz, W., Hamelmann, H. Value of a physiological liver transplant model in rats. Induction of specific graft tolerance in a fully allogeneic strain combination. Transplantation. 33, 566-568 (1982).
- Sumimoto, R., Shinomiya, T., Yamaguchi, A. Influence of hepatic arterial blood flow in rats with liver transplants. Examination of donor liver-derived serum class I MHC antigen in rats with liver transplants with or without hepatic arterial reconstruction. Transplantation. 51, 1138-1139 (1991).
- Chaland, P., et al. Orthotopic liver transplantation with hepatic artery anastomoses. Hemodynamics and response to hemorrhage in conscious rats. Transplantation. 49, 675-678 (1990).
- Imamura, H., Rocheleau, B., Cote, J., Huet, P. M. Long-term consequence of rat orthotopic liver transplantation with and without hepatic arterial reconstruction: a clinical, pathological, and hemodynamic study. Hepatology. 26, 198-205 (1997).
- Zhong, Z., Theruvath, T. P., Currin, R. T., Waldmeier, P. C., Lemasters, J. J. NIM811, a mitochondrial permeability transition inhibitor, prevents mitochondrial depolarization in small-for-size rat liver grafts. Am. J. Transplant. 7, 1103-1111 (2007).
- Spiegel, H. U., Palmes, D. Surgical techniques of orthotopic rat liver transplantation. J. Invest. Surg. 11, 83-96 (1998).
- Lee, S., Charters, A. C., Chandler, J. G., Orloff, M. J. A technique for orthotopic liver transplantation in the rat. Transplantation. 16, 664-669 (1973).
- Lee, S., Charters, A. C., Orloff, M. J. Simplified technic for orthotopic liver transplantation in the rat. Am. J. Surg. 130, 38-40 (1975).
- Kamada, N., Calne, R. Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 28, 47-50 (1979).
- Howden, B., Jablonski, P., Grossman, H., Marshall, V. C. The importance of the hepatic artery in rat liver transplantation. Transplantation. 47, 428-431 (1989).
- Gao, W., Lemasters, J. J., Thurman, R. G. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 56, 19-24 (1993).
- Zhao, D., Zimmermann, A., Wheatley, A. M. Morphometry of the liver after liver transplantation in the rat: significance of an intact arterial supply. Hepatology. 17, 310-317 (1993).
- Omura, T., Ascher, N. L., Emond, J. C. Fifty-percent partial liver transplantation in the rat. Transplantation. 62, 292-293 (1996).
- Lehmann, T. G., Bunzendahl, H., Langrehr, J. M., Neuhaus, P. Arterial reconstruction in rat liver transplantation--development of a new tubing technique of the common hepatic artery. Transpl. Int. 18, 56-64 (2005).
- Reck, T., et al. Impact of arterialization on hepatic oxygen supply, tissue energy phosphates, and outcome after liver transplantation in the rat. Transplantation. 62, 582-587 (1996).
- Hasuike, Y., et al. A simple method for orthotopic liver transplantation with arterial reconstruction in rats. Transplantation. 45, 830-832 (1988).
- Steffen, R., Ferguson, D. M., Krom, R. A. A new method for orthotopic rat liver transplantation with arterial cuff anastomosis to the recipient common hepatic artery. Transplantation. 48, 166-168 (1989).
- Knoop, M., Bachmann, S., Keck, H., Steffen, R., Neuhaus, P. Experience with cuff rearterialization in 600 orthotopic liver grafts in the rat. Am. J. Surg. 167, 360-363 (1994).
- Hickman, R., Engelbrecht, G. H., Duminy, F. J. A technique for liver transplantation in the rat. Transplantation. 48, 1080 (1989).
- Liu, T., Freise, C. E., Ferrell, L., Ascher, N. L., Roberts, J. P. A modified vascular "sleeve" anastomosis for rearterialization in orthotopic liver transplantation in rats. Transplantation. 54, 179-180 (1992).
- Li, J., et al. Modified sleeve anastomosis for reconstruction of the hepatic artery in rat liver transplantation. Microsurgery. 22, 62-68 (2002).
- Martins, P. N., Theruvath, T. P., Neuhaus, P. Rodent models of partial hepatectomies. Liver Int. 28, 3-11 (2008).
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1992).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados