Method Article
鼠神经母细胞核转染到研究神经细胞迁移
摘要
成神经细胞迁移是在出生后的神经发生了关键性的一步。在这里描述的协议可以被用于研究神经细胞迁移的候选调节器通过使用DNA /小发夹RNA(shRNA的)核转染,并与成神经细胞从啮齿动物出生后的头端迁移流中分离出来的三维迁移实验中的作用。
摘要
位于侧脑室外侧壁脑室下区(SVZ)中扮演成年神经发生了根本性的作用。在大脑中的这一禁区,神经干细胞增殖和不断产生的切向链,迁移沿喙迁移流(RMS)达到嗅球(OB)的神经母细胞。一旦在OB,神经母细胞切换到径向迁移和再分化成能够纳入已经存在的神经元网络的成熟神经元。适当的神经细胞迁移是在神经发生的基本步骤,确保新生神经元的正确功能成熟。鉴于SVZ来源的神经母细胞为目标的脑部受伤的地方,调查相关的运动细胞内机制的能力,不但可以提高神经的理解,而且可促进神经再生策略的发展。
此手稿描述了详细的协议主要啮齿动物的转染RMS产后神经母细胞和它们的蠕动使用3D 体外迁移实验扼要重述它们的迁移模式在体内观察到的分析。大鼠和小鼠的神经母细胞可以快速而有效地转经核转染与任何质粒DNA,小发夹(SH)RNA或短干扰(SI)的RNA寡核苷酸靶向目的基因。分析迁移,nucleofected细胞reaggregated在“悬滴”,并随后包埋在三维矩阵。核转染本身并不显著损害神经母细胞的迁移。也可进行药物治疗nucleofected和reaggregated成神经细胞的研究信令涉及成神经细胞迁移的途径的作用。
引言
在产后哺乳动物大脑,产生新的神经元(神经)发生在整个生命和被限定为两个神经源性龛:侧脑室的脑室下区(SVZ)和海马1的齿状回颗粒下层区域。最近的一些研究表明,成年神经发生的促进学习和记忆任务2,3的重要作用。此外,增殖脑损伤后4-7神经祖细胞和招聘的证据提出了神经发生的神经修复药理活性的可能性。
产后神经发生有严格的规定在其各个阶段,包括神经祖细胞的增殖,迁移,分化,存活和新生的神经元8的最终突触融合。在SVZ来源于干细胞的神经祖细胞(神经细胞)有很大的距离在迁移穿过喙迁徙流(RMS)对嗅球(OB),发育为功能性的神经元9。神经母细胞迁徙主要是单极的,有延伸的单个领先的流程细长的细胞体。这些细胞移动进行集体链,滑过彼此10。迁移是用于随后的成熟SVZ来源的祖细胞为功能性神经元11的一个关键步骤,是由多种因素和指导分子,包括控制:多唾液酸神经细胞黏附分子(PSA-NCAM)12,肝配蛋白13,整14,狭缝15,生长因子16和神经递质17,但保留该过程的分子机制尚不完全清楚。调查的细胞内信号途径调节神经细胞迁移不仅将提供一个更好地了解成人神经,也将有助于新的治疗发展方法促进大脑修复。
这个手稿描述了一个详细的协议使用核转染和三维迁移实验来研究神经细胞迁移的候选监管机构在体外的作用。核转染是基于电穿孔的改良方法的细胞转染技术。细胞类型特异性的电流和核转染溶液使聚阴离子大分子如DNA和shRNA的载体和siRNA寡核苷酸的转移直接进入细胞核并慢慢地分割或有丝分裂无活性细胞如胚胎和哺乳动物的神经元18允许转染。这种方法是快速的,相对易于执行和结果在广泛的细胞类型,包括原发性神经母细胞和神经元19-21的高度重复性的转染。
RMS组织的离解允许迁移性的神经母细胞的分离,从而可以成功地nucleofected与DNA /的shRNA载体或寡核苷酸的siRNA靶向目的基因。下面核转染,成神经细胞被reaggregated在悬滴,随后包埋在三维基质胶基质。这些条件允许的成神经细胞迁移出细胞聚集扼要体内观察到的迁移模式,从而提供了一个很好的模型系统来研究参与神经细胞迁移的信号通路,并评估药物治疗对这些细胞的运动的影响。
研究方案
这个程序是按照英国内政部规定(动物科学程序法,1986)。科学家应该遵循建立并获当地机构和国家动物监管机构的指引。
1。解剖和大鼠的RMS神经母细胞解离
- 准备所需的RMS解剖和分离的解决方案:
夹层介质 (100毫升)中
Hank平衡盐溶液(HBSS) - 98.5毫升
5个M HEPES pH值7.4 - 0.5毫升
青霉素,链霉素(10,000单位/ ml和10,000微克/毫升) - 1毫升
解离培养基(2ml)中
HBSS - 1.760毫升
10倍的胰蛋白酶(2.5%) - 200微升
DNAse1(1毫克/毫升) - 40μL
贝科改良Eagle培养基(DMEM)+ 10%胎牛血清(FCS)(40毫升)
DMEM -36毫升
FCS - 4毫升
完全培养基 (12毫升)中
Neurobasal培养基 - 11.46毫升
B27的补充 - 250微升
L-谷氨酰胺(200毫米) - 125微升
葡萄糖(45%) - 165微升
2。过滤灭菌的DMEM +10%FCS中,并在完全培养基中并preequilibrate它们在37℃/ 5%CO 2的培养箱中培养。
- 解剖
- 颈椎脱臼牺牲P6-P7鼠窝(约12幼崽),并斩首用剪刀。
- 使前后切口沿正中矢状缝线从鼻子到用手术刀刀片小脑皮肤。剥了一层皮,重复沿着头骨同一切口。
- 轻轻取下颅瓣用钳子,仔细用锅铲取出大脑,照顾到包括嗅球。
- 切断大脑的最尾端第三和丢弃它。
- 斩日Ë脑组织成使用组织菜刀1.4毫米厚的冠状切片。
- 将切片在含冷夹层介质的菜肴,仔细用针把它们分开。
- 有效值显示为一个三角形,半透明区域的OB部分的中心,作为一个小的,圆形的面积更尾大脑切片。切出的RMS每片用显微刀,同时注意避免包括周围组织。在P7的幼鼠,通常〜8最喙片(包括OB)包含有效值。
- 收集RMS片段用塑料巴斯德吸管,并将其放置在包含在冰冷的夹层介质一小碟。
- 当清扫结束后,转移RMS片段入15ml试管用塑料移液管。留下的碎片,收于管子的底部。
- 解离
- 用2毫升分离培养基更换夹层介质。
- 轻轻p磨碎的RMS片段ipetting片段悬挂上下左右10倍使用P1000的移液管。
- 离开该管的组织片段在37℃水浴中2分钟。
- 再次吸取溶液10倍,并确保片段已经分离(暂停应该变得浑浊)。
- 通过加入5ml预热的DMEM +10%FCS中的灭活胰蛋白酶。
- 离心细胞悬浮液在433×g离心5分钟。
- 在此期间等分试样所需的的siRNA / DNA的量成Eppendorf管中(通常是3-5微克DNA / shRNA的或每核转染5-9微克的siRNA寡核苷酸,然而DNA / siRNA的量,可能需要优化)。
- 去除多余的介质,并轻柔吹打在5毫升预热的DMEM +10%FCS的重悬细胞沉淀。
- 进行细胞计数。期望〜1×10 6每只大鼠幼鼠的脑细胞。最小2.5×10 6个细胞都需要为每个核转染,而最佳的结果是使用核转染每3-4×10 6细胞来实现。
- 离心细胞悬浮液在433×g离心5分钟。一定要去除尽可能多的媒介越好。
2。核转染
- 立即 (如果使用小鼠细胞或小鼠)先前在室温下培养神经元的核转染溶液重悬细胞沉淀在大鼠。使用核转染每100微升注 :通常为12幼仔大鼠垫料足以执行4 nucleofections和鼠标窝(12幼仔)足以执行2 nucleofections。
- 转移100微升的细胞悬液至含有的siRNA / DNA的每个Eppendorf管中,用P200移液管轻轻混匀2-3倍通过移液。
- 样品(cell-DNA/siRNA悬浮液)加入到nucleofectioncuvette的底部,注意避免气泡。
- 使用Nucleofect程序的G-013(用于大鼠细胞)或O-005(用于小鼠细胞)。一核转染大约需要5秒。
- 快速加入1 ml预热的DMEM +10%FCS中的nucleofected样品。
- 重复步骤2.4和2.5所有其他样本。注意:为达到最佳效果,在整个核转染过程应该持续时间不超过5分钟。
- 每个样品转移到15ml试管含有5ml预热的DMEM +10%FCS中的使用通过核转染试剂盒提供的塑料吸管。避免任何细胞碎片转移到管中。
- 离心样品在433×g离心5分钟。
- 小心地取出所有多余的介质,并使用P20吸管悬浮颗粒在25-30微升预热的DMEM +10%FCS的。不要使用超过30微升培养基。
- 移液器的悬浮液一滴到p35的培养皿盖的内侧。
- 逆转盖子以上含2ml完全培养基中的p35的培养皿(也参见图1)。
- 留在培养箱(37℃/ 5%CO 2)在至少5小时和最多7小时。较长的培育时间可以更好地再聚集的细胞簇。
- 从转移的盖子吊滴成使用P1000的吸管切尖这道菜的完全培养基。
- 在37℃/ 5%CO 2 24小时进行DNA nucleofections和48小时用于siRNA / shRNA的nucleofections。
3。嵌入
- 备的完全培养基(25毫升)中,并在37℃/ 5%CO 2的几个小时preequilibrate它。
- 取出基底膜基质的冷冻等分试样在-80℃下冷冻并在冷室中在冰上融化。
- 对于每个核转染制备含有多达813毫米无菌盖玻片一个6cm培养皿中。
- 将菜在冰盒盖上保鲜膜。重要的是要保持盖玻片凉爽重要的是要防止在嵌入过程中,基体凝固。
- 为了保持湿度,潮湿的地方组织的条15厘米的培养皿内,瓦特生病被用来撑起来包含嵌入神经母细胞36厘米菜肴。
- 加入完全培养基在1:3的比例解冻矩阵。例如,通过移液混合40微升完全培养基中以120μl的基质。这一数额矩阵是足够的八个12毫米盖玻片嵌入聚合。
- 转移reaggregated细胞簇到15毫升管中,离心 433×g离心5分钟。
- 删除多余的介质和悬浮颗粒于10微升完全培养基。
- 将2微升的细胞聚集体悬浮到每个无菌盖玻片,并加入18μl矩阵/完全培养基混合物。用枪头传播矩阵在整个盖玻片。
- 立即将含有盖玻片的6cm培养皿中的15cm培养皿,并在培养箱(37℃/ 5%CO 2)15-20分钟离开。当矩阵已经凝固,轻轻地加入5 ml完全培养基,以每6cm培养皿照顾,以推下任何浮动盖玻片用枪头。
- 孵育24小时后,在37℃/ 5%CO 2,让成神经细胞迁移出细胞聚集体。
4。 3D迁移实验
- 准备所需的免疫染色的解决方案。
- 准备块的解决方案:
山羊块溶液(50ml)中
磷酸盐缓冲盐水(PBS) - 5毫升
山羊血清 - 7.5毫升
10%的Triton X-100 - 1.5毫升
牛血清白蛋白 - 50毫克
H 2 O的- 36毫升 - 过滤器和储存在4°C。
- 准备固定的解决方案:
定影溶液(100毫升)中
多聚甲醛(PFA) - 4克注意:始终处理PFA一个引擎盖下
蔗糖 - 20克(可选)
PBS至100ml - 在热板上,并在不断搅拌下溶解PFA在80毫升PBS中保持在65℃。
- 一旦PFA溶解,加20克蔗糖。
- 调节pH值至7.4(通常通过添加〜60微升的1M NaOH每100毫升溶液)。
- 弹出至100ml,用PBS总体积。
- 准备块的解决方案:
- 免疫组化
- 放置盖玻片的24孔板。
- 冲洗盖玻片用PBS 2倍。
- 修复RMS成神经细胞聚集体在室温下45分钟固定液。
- 冲洗盖玻片用PBS 3X(5分钟/洗 - 摇摆平台上)。
- 阻断30-60分钟,山羊块的解决方案。
- 稀释一抗山羊块的解决方案,并孵育过夜,在4°C。 (如果需要的话,荧光鬼笔环肽(1:400)和Hoechst的染料(1:10,000)也可以加入到第一抗体溶液进行可视化的丝状肌动蛋白和核)。
- 冲洗盖玻片用PBS 3X(5分钟/清洗)。
- 稀释的二抗山羊块溶液孵育2小时,在室温下进行。
- 冲洗coversliPS用PBS 3X(5分钟/洗涤)
- 贴装盖玻片用荧光封固剂和离开干燥过夜室温。
- 迁移分析
- 捕捉固定有效值成神经细胞聚集的图像使用10X物镜的荧光显微镜。包括在样本图像中的比例尺。
- 要设置刻度量化,通过选择ImageJ的工具栏上的“直线”工具测量图像中的比例尺。
- 选择“分析”选项,并单击“设置比例”。
- 在规模窗口中设置了“已知的距离”,并勾选“全球”框保留为所有测量相同的设置。
- 使用ImageJ的工具栏上的“分段线”工具来测量距离从总的边缘,在整个集合( 图3B)周围6个不同行业的最远迁移成神经细胞。只考虑隔离AGgregates进行分析。
- 从计算每个聚合得到的6个值的平均移动距离。
- 测量10-20集料为每个条件中的至少三个独立实验的每个独立的实验和游泳池结果。总是包括一个核转染的控制( 例如 ,GFP或控制的sh /干扰)。
结果
神经母细胞可成功地分离自剖分RMS的组织( 图1A)和嵌入在三维矩阵。细胞无论从大鼠或小鼠出生后的RMS隔离免疫阳性是候鸟成神经细胞标志物,如doublecortin(DCX),βIII微管蛋白或PSA-NCAM( 图1B-C)。
离解成神经细胞可以有效地nucleofected与DNA( 例如 ,GFP的质粒编码,图2)或shRNA的质粒( 图4)来实现蛋白质消耗,这可以通过免疫印迹分析来评估( 图4B)或免疫荧光(未示出) 。
细胞nucleofected与绿色荧光蛋白编码质粒径向迁移出reaggregated成神经细胞群( 图3A)。相对迁移距离24小时后嵌入( 图3B)的量化显示了迁移的GFP-断定没有区别的ive细胞和GFP阴性,nonnucleofected细胞( 图3C),表明核转染本身不会中断迁移。也有在nucleofected神经母细胞和神经母细胞直接迁移出的RMS植(数据未显示)之间迁移的程度无显著差异。

图1。解剖有效值神经母细胞。有效值成神经细胞解剖(一)示意图。有关详细说明,请参阅文本。 (二)大鼠离体RMS细胞免疫阳性的成神经细胞迁徙者DCX和βlll微管蛋白。酒吧,20微米(C)细胞迁移出鼠标的RMS植表达迁徙神经细胞标志物DCX和PSA-NCAM。酒吧,20微米。0989/50989fig1highres.jpg“目标=”_blank“>点击这里查看大图。
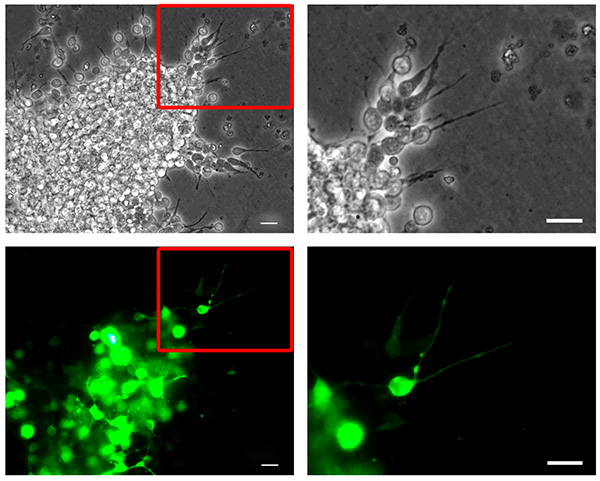
图2。小鼠成神经核转染。游离鼠标有效值 神经母细胞被nucleofected用PMAX-GFP,reaggregated,嵌入在一个三维矩阵和允许迁移6小时。神经母细胞迁移出reaggregated细胞簇(顶部,相衬图像)显示转染效率高(底,绿色荧光蛋白通道的图片)。右边一栏面板显示对应于左栏板突出的插图更高的放大倍率的照片。酒吧,20微米。 点击这里查看大图 。
ontent宽度=“6英寸”SRC =“/ files/ftp_upload/50989/50989fig3.jpg”宽度=“500px的”/>
图3。 3D迁移实验。 (A)大鼠成神经细胞被nucleofected用PMAX-GFP(绿色荧光蛋白)或pCAG-IRES-EGFP 22(EV),reaggregated,嵌在基质和左迁移24小时。然后将细胞固定并进行免疫染色的GFP(绿色)和βIII微管蛋白(红色)。酒吧,50微米(B)使用ImageJ测量迁移距离。该reaggregated细胞群被分成6等份。集群(虚线)和最远的迁移细胞的边缘之间的距离的测量是对每个扇区。的相对距离(C)的定量通过nucleofected细胞迁移(GFP阳性)和对照,nonnucleofected细胞(GFP阴性) 。 点击此处查看大图 。
“图4”FO:内容宽度=“6英寸”SRC =“/ files/ftp_upload/50989/50989fig4.jpg”宽度=“500px的”/>
图4。监测shRNA的核转染后的神经细胞迁移。 (一)大鼠神经母细胞进行nucleofected与对照shRNA表达载体(PCA-B-EGFPm5消音器3,这也表达了EGFP 23)或含有shRNA的中fascin目标,一个肌动蛋白束蛋白24相同的向量。细胞reaggregated超过48小时,嵌在基质和左迁移24小时。聚集体,然后固定和免疫染色的GFP(绿色)和βIII微管蛋白(红色)。酒吧,50微米(B)中fascin有效 损耗可以检测shRNA的核转染的Western blot分析后,50小时。肌动蛋白在此处显示为一个负载控制(C)相对迁移距离的显示,枯竭中fascin损害显著成神经细胞迁移的定量分析。(平均值±标准差; ** P <0.01,n = 3的独立实验)。 点击这里查看大图。
讨论
神经母细胞沿RMS在OB中的最终位置的迁移是在出生后的神经发生的一个基本步骤。然而,控制这个复杂的过程的分子机制还远远没有得到充分的理解。
这里描述的实验步骤,使得成神经细胞迁移的体外研究。我们已经适应了以前发表的协议,用于从出生后早期小鼠或大鼠25 RMS隔离神经细胞。以达到最佳效果,掌握剥离步骤是很重要的,因为它是非常重要的保持解剖和核转染到最低限度之间的时间间隔。核转染后,成神经细胞可以reaggregated,嵌入在一个三维矩阵和左迁移超过24小时的时期。另外,用于规定以外的迁移( 如免疫荧光或免疫印迹分析)等,电池可以立即核转染对polyornithine/laminin-镀后涂盖玻片,在那里他们存活长达4-5天。小鼠和大鼠的神经母细胞在基底膜迁移到类似的程度,但是小鼠细胞似乎具有更强的倾向链比大鼠细胞迁移。
根据不同的研究目的,神经母细胞可以nucleofected不同质粒编码的荧光蛋白质或野生型/突变体蛋白。为了获得最佳的蛋白表达质粒与CAG启动子(β-肌动蛋白启动子与CMV增强子和β-珠蛋白多聚A尾巴)26强烈推荐。此外,寡核苷酸的siRNA或shRNA质粒可以nucleofected拦截的利益目标。有效消耗的蛋白质可以通过免疫荧光或免疫印迹(通常裂解嵌入式聚集从1大鼠小狗与50微升标准裂解缓冲液)进行可视化。
核转染是一种比较简单的方法转染的主要成神经细胞,提供了一个更容易和更快的替代方案为vi拉尔载体介导的转染,并能达到高(〜70-80%)的转染效率。这是至关重要的核转染过程中快速地工作,因为留下的成神经细胞中的核转染溶液为延长的时间大大减少了细胞活力。
从RMS夹层的平均细胞产量是相对低的P7小鼠(〜5×10 5个细胞/脑)相比,P7大鼠(〜1×10 6个细胞/脑)和每核转染至少3×10 6个细胞是必需的实现转染〜50%的效率。此外,大鼠的神经母细胞出现抵抗更好核转染相比,小鼠成神经细胞。因此,出生后早期(P6-P7)幼鼠可能代表一个方便的成神经细胞源,也考虑到大鼠和小鼠的RMS的组织都显着西米拉尔27, 在体外大鼠和小鼠成神经细胞迁移的程度也不相上下。最好不要让nucleofected神经母细胞的reaggregated集群停牌超过48小时更长的时间来避免对细胞形态和迁移(我们未发表意见)异常的影响。
这里所描述的三维测定可用于在基体( 例如 ,24小时)后嵌入到量化成神经细胞迁移在固定的时间点。不同尺寸的聚集体可以在分析中使用,由于存在聚集体的大小和迁移距离(我们的未发表的观察结果)之间没有显著相关。可视化,并进一步探讨神经细胞迁移的动态,时间推移成像都可以使用。建议在执行迁移分析后嵌入一个24小时的时间间隔内,由于神经母细胞的速度出现大幅更长的时间点下降(我们未发表意见)。
有一些限制,以该协议。首先,核转染可到目前为止,用于产后早期啮齿类动物的神经母细胞,而感染病毒载体仍然是最有效的转染方法对成人神经母细胞28。其次, 在体外迁移测定不能完全重现体内观察到的RMS的复杂结构。事实上,虽然神经母细胞维持到,迁移以类似的方式,以它们的体内对应于这里描述它们缺乏与其它RMS的组分,如星形胶质细胞和血管,这也有助于调节其蠕动9,29相互作用的实验装置的能力, 30。这个问题可能在未来通过三维共培养模型系统的优化来解决。
总括来说,在一个3D迁移实验相结合的核转染代表一个有价值的工具,以便更好地了解潜在的分子机制成神经细胞迁移。此实验过程提供了一个初始,快速和相对简单的方法来评价成神经细胞迁移的候选调节剂,其可以通过其他方法,如在体内产后电穿孔和脑切片培养的延时成像进一步证实的作用28,31,32 。
披露声明
作者什么都没有透露。
致谢
这项工作是由威康信托计划资助授予PD和GL(089236/Z/09/Z)。 SG是由生物技术和生物科学研究理事会博士助学金支持。我们感谢马修Vermeren的shRNA表达载体和谢珍就成神经细胞核转染宝贵意见的一种恩赐。
材料
| Name | Company | Catalog Number | Comments |
| Hank’s Balanced Salt Solution (HBSS) | Invitrogen Life Technologies | 14175129 | |
| HEPES | Sigma-Aldrich | H3375-25G | |
| Penicillin-Streptomycin | Invitrogen Life Technologies | 15140-122 | |
| 2.5% Trypsin-EDTA (10x) | Gibco | 15090-046 | store 200 µl aliquots at -20 °C |
| DNAse I Vial (D2) | Worthington | LK003170 | ≥1,000 units per vial; store 50 µl aliquots at -20 °C |
| Dulbecco Modified Eagle's Medium (DMEM) | Gibco | 11960-044 | |
| Fetal Calf Serum (FCS) | Hyclone | SH3007902 | |
| Neurobasal medium | Gibco | 21103-049 | |
| B27 supplement | Invitrogen Life Technologies | 17504044 | |
| L-Glutamine (200 mM) | Invitrogen Life Technologies | 25030-081 | |
| D-(+)-Glucose solution (45%) | Sigma-Aldrich | G8769 | |
| Matrigel Basement Membrane Matrix, Growth Factor Reduced (GFR), Phenol Red-free, 10 ml, LDEV-Free | BD Biosciences | 356231 | prepare 120 µl aliquots at 4 °C, then store at -80 °C |
| PFA | Sigma-Aldrich | 441242 | |
| Sucrose | BDH | 102745C | |
| Goat serum | Sigma-Aldrich | 69023 | |
| Triton X-100 | VWR International Ltd. | 306324N | |
| BSA | Fisher Chemical | BPE9701-100 | |
| Dako fluorescence mounting medium | Dako | S3023 | |
| Rat neuron nucleofection kit | Lonza | VPG-1003 | |
| Mouse neuron nucleofection kit | Lonza | VPG-1001 | |
| Microsurgical knife | Angiotech | 7516 | |
| McIlwain tissue chopper | The Mickle Laboratory Engineering Company | ||
| Nucleofector II | Lonza |
参考文献
- Ming, G. L., Song, H. J. Adult Neurogenesis in the Mammalian Brain: Significant Answers and Significant Questions. Neuron. 70, 687-702 (2011).
- Alonso, M., et al. Activation of adult-born neurons facilitates learning and and memory. Nat. Neurosci. 15, 897-U127 (2012).
- Lazarini, F., Lledo, P. M. Is adult neurogenesis essential for olfaction?. Trends Neurosci. 34, 20-30 (2011).
- Arvidsson, A., Collin, T., Kirik, D., Kokaia, Z., Lindvall, O. Neuronal replacement from endogenous precursors in the adult brain after stroke. Nat. Med. 8, 963-970 (2002).
- Jin, K. L., et al. Evidence for stroke-induced neurogenesis in the human brain. Proc. Natl. Acad. Sci. U.S.A. 103, 13198-13202 (2006).
- Kim, Y., Szele, F. G. Activation of subventricular zone stem cells after neuronal injury. Cell Tissue Res. 331, 337-345 (2008).
- Massouh, M., Saghatelyan, A. De-routing neuronal precursors in the adult brain to sites of injury: Role of the vasculature. Neuropharmacology. 58, 877-883 (2010).
- Pathania, M., Yan, L. D., Bordey, A. A symphony of signals conducts early and late stages of adult neurogenesis. Neuropharmacology. 58, 865-876 (2010).
- Lois, C., Alvarez-Buylla, A. Long-Distance Neuronal Migration in the Adult Mammalian Brain. Science. 264, 1145-1148 (1994).
- Lois, C., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Chain migration of neuronal precursors. Science. 271, 978-981 (1996).
- Belvindrah, R., Nissant, A., Lledo, P. M. Abnormal Neuronal Migration Changes the Fate of Developing Neurons in the Postnatal Olfactory Bulb. J. Neurosci. 31, 7551-7562 (2011).
- Battista, D., Rutishauser, U. Removal of Polysialic Acid Triggers Dispersion of Subventricularly Derived Neuroblasts into Surrounding CNS Tissues. J .Neurosci. 30, 3995-4003 (2010).
- Conover, J. C., et al. Disruption of Eph/ephrin signaling affects migration and proliferation in the adult subventricular zone. Nat. Neurosci. 3, 1091-1097 (2000).
- Mobley, A. K., McCarty, J. H. beta 8 Integrin is Essential for Neuroblast Migration in the Rostral Migratory Stream. Glia. 59, 1579-1587 (2011).
- Nguyen-Ba-Charvet, K. T., et al. Multiple roles for slits in the control of cell migration in the rostral migratory stream. J. Neurosci. 24, 1497-1506 (2004).
- Garzotto, D., Giacobini, P., Crepaldi, T., Fasolo, A., De Marchis, S. Hepatocyte growth factor regulates migration of olfactory interneuron precursors in the rostral migratory stream through Met-Grb2 coupling. J. Neurosci. 28, 5901-5909 (2008).
- Platel, J. C., Stamboulian, S., Nguyen, I., Bordey, A. Neurotransmitter signaling in postnatal neurogenesis: The first leg. Brain Res. Rev. 63, 60-71 (2010).
- Dityateva, G., et al. Rapid and efficient electroporation-based gene transfer into primary dissociated neurons. J. Neurosci. Meth. 130, 65-73 (2003).
- Shieh, J. C., Schaar, B. T., Srinivasan, K., Brodsky, F. M., McConnell, S. K. Endocytosis Regulates Cell Soma Translocation and the Distribution of Adhesion Proteins in Migrating Neurons. PloS One. 6, (2011).
- Viesselmann, C., Ballweg, J., Lumbard, D., Dent, E. W. Nucleofection and Primary Culture of Embryonic Mouse Hippocampal and Cortical Neurons. J. Vis. Exp. , e2373 (2011).
- Gartner, A., Collin, L., Lalli, G. Nucleofection of primary neurons. Method Enzymol. 406 (06), 374-388 (2006).
- Causeret, F., et al. The p21-Activated Kinase Is Required for Neuronal Migration in the Cerebral Cortex. Cereb. Cortex. 19, 861-875 (2009).
- Bron, R., Eickholt, B. J., Vermeren, M., Fragale, N., Cohen, J. Functional knockdown of neuropilin-1 in the developing chick nervous system by siRNA hairpins phenocopies genetic ablation in the mouse. Dev. Dynam. 230, 299-308 (2004).
- Sonego, M., et al. Fascin regulates the migration of subventricular zone-derived neuroblasts in the postnatal brain. J. Neurosci. 33, 12171-12185 (2013).
- Ward, M., Rao, Y. Investigations of neuronal migration in the central nervous system. Methods Mol. Biol. 294, 137-156 (2005).
- Niwa, H., Yamamura, K., Miyazaki, J. Efficient Selection for High-Expression Transfectants with a Novel Eukaryotic Vector. Gene. 108, 193-199 (1991).
- Peretto, P., Giachino, C., Aimar, P., Fasolo, A., Bonfanti, L. Chain formation and glial tube assembly in the shift from neonatal to adult subventricular zone of the rodent forebrain. J. Comp. Neurol. 487, 407-427 (2005).
- Khlghatyan, J., Saghatelyan, A. Time-lapse Imaging of Neuroblast Migration in Acute Slices of the Adult Mouse Forebrain. J. Vis. Exp. , e4061 (2012).
- Bozoyan, L., Khlghatyan, J., Saghatelyan, A. Astrocytes Control the Development of the Migration-Promoting Vasculature Scaffold in the Postnatal Brain via VEGF Signaling. J. Neurosci. 32, 1687-1704 (2012).
- Whitman, M. C., Fan, W., Rela, L., Rodriguez-Gil, D. J., Greer, C. A. Blood Vessels Form a Migratory Scaffold in the Rostral Migratory Stream. J. Comp. Neurol. 516, 94-104 (2009).
- Sonego, M., Ya, Z., Oudin, M. J., Doherty, P., Lalli, G. In vivo Postnatal Electroporation and Time-lapse Imaging of Neuroblast Migration in Mouse Acute Brain. J. Vis. Exp. , (2013).
- Feliciano, D. M., Lafourcade, C. A., Bordey, A., lique, Neonatal Subventricular Zone Electroporation. J. Vis. Exp. , e50197 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。